HIF-1α对口腔癌裸鼠移植瘤生长及其CEACAM1及VEGF-C表达的影响
2017-11-11戴银花戴群邹文英杨琼刘子燕董耀玉
戴银花 戴群 邹文英 杨琼 刘子燕 董耀玉
HIF-1α对口腔癌裸鼠移植瘤生长及其CEACAM1及VEGF-C表达的影响
戴银花 戴群 邹文英 杨琼 刘子燕 董耀玉
目的建立口腔癌裸鼠移植瘤模型,探究HIF-1α对CEACAM1及VEGF-C表达的影响机制。方法分别将Tca8113细胞、siRNA阴性对照Tca8113细胞、HIF-1α 干扰的Tca8113细胞接种到裸鼠的右腋部皮下,建立口腔癌裸鼠移植瘤模型。观察各组裸鼠肿瘤生存情况和HIF-1α沉默对肿瘤的重量、体积抑制率的影响;采用ELISA方法检测移植瘤组织中HIF-1α干扰后其蛋白表达量的变化;分别利用实时荧光定量PCR、蛋白印迹法检测各组裸鼠移植瘤组织中HIF-1α、CEACAM1及VEGF-C mRNA和蛋白的表达水平。结果发现HIF-1α干扰组中裸鼠移植瘤的体积及重量均显著小于空白对照组,表明HIF-1α表达沉默显著抑制移植瘤的生长,同时明显下调CEACAM1及VEGF-C的表达。结论口腔癌中HIF-1α可能通过调节CEACAM1及VEGF-C的表达来影响肿瘤的生长。
口腔癌; 缺氧诱导因子-1α(HIF-1α); CEACAM1; VEGF-C
口腔癌是常发于头颈部的一种恶性肿瘤,分化程度较高,更倾向于近位淋巴转移,鲜有远位转移,同时其对放疗和化疗的敏感性较差,因此常伴有较高的死亡风险[1]。和所有实质性恶性肿瘤一样,肿瘤组织内局部多处于缺氧状态,缺氧是诱导肿瘤血管内皮生长因子表达的重要因素,恶性肿瘤导致患者死亡的主要原因是肿瘤的浸润和转移,在此过程中,血管的新生至关重要,只有新生血管为肿瘤提供足够能量,才有可能发生肿瘤细胞的浸润和转移[2]。缺氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α), 是一种广泛存在于高等动物体内的缺氧环境核转录因子,它调控一系列基因的表达。研究表明,HIF-1α在人体许多恶性肿瘤如口腔癌、胃癌、肺癌、胰腺癌等组织中均较正常组织呈现过度表达的状态,缺氧环境下HIF-1α水平上调促使肿瘤细胞能耐受缺氧的微环境,这与恶性肿瘤的不良预后存在密切关联[3]。
癌胚抗原相关黏附因子(CEACAM1)在肿瘤血管生成过程中具有重要作用,研究发现在慢性缺氧小鼠的微血管中,CEACAM1的表达明显上调,同时伴有HIF-1α与多种促血管生成因子表达的上调[4]。血管内皮生长因子(vascular endothelial growth factor,VEGF), 是一种在肿瘤血管新生的过程中发挥关键作用的细胞因子,能有效、特异地诱导血管的新生,它不仅具有促进内皮细胞分裂增殖和血管构建的功能,还能促进微血管通透性增加,加速肿瘤的生长和转移[5]。VEGF-C是新发现的VEGF家族成员,是内皮细胞功能调节及肿瘤转移相关因子之一[6]。形成肿瘤的同时会造成缺氧的微环境,缺氧的情况下会诱导肿瘤细胞形成新的血管并发生糖酵解[7],从而导致与之相关的某些生长因子及肿瘤侵袭相关的蛋白表达上调。而HIF-1α已被证实是VEGF基因上游的一种关键性的表达调控因子,它正相关地调控VEGF的转录,并且增加VEGF mRNA的稳定性,CEACAM1则在肿瘤发生的不同时期表达情况有所不同[8]。因此VEGF-C和CEACAM1成为新的潜在指标。本研究利用口腔癌细胞成功建立裸鼠移植瘤模型,以探究 HIF-1α对口腔癌生长的及其对CEACAM1及VEGF-C表达的影响。
1 材料与方法
1.1 舌癌Tca8113细胞系的培养与转染
人舌鳞状细胞癌细胞系Tca8113购自美国ATCC细胞库,培养于RPMI 1640培养液(内含10%胎牛血清),放置于37 ℃、5%CO2的细胞培养箱。细胞均匀地铺满瓶底时,使用0.25%胰蛋白酶消化,而后接种于6 孔板中,接种的细胞浓度为2×105个/孔,37 ℃、5%CO2条件下,孵育过夜。具有互补序列的能编码短发夹(shRNA)双链寡核苷酸由深圳华大基因研究所设计并合成。HIF-1α-siRNA靶序列:5'-AACCCACACATATCCACCTCT-3',阴性对照siRNA的靶序列:5'-AAGCTTCATAAGGCGCATAGC-3'。脂质体LipofectamineTM2000和siRNA 按2.5 μl∶1 μg的比例配置成混悬液,分别加入待转染细胞的6孔板中,轻晃摇匀后,置于孵箱中孵育,转染后换含10%胎牛血清的RPMI 1640培养基培养。
1.2 建立口腔癌裸鼠移植瘤模型
BALB/C(nu/nu)裸鼠,6~8 周龄,体重约为15~20 g,雌雄对半,共30 只,由中国医学科学院实验动物研究所提供,在SPF环境下的层流室中饲养。随机分为3 组,每组10 只。分别为空白对照组、siRNA阴性对照组以及HIF-1α干扰组即实验组。待细胞生长至对数期,用0.25%胰蛋白酶消化,制成细胞悬液,用PBS调整各组细胞密度至5×107/ml。之后分别将Tca8113细胞、阴性对照siRNA转染的Tca8113细胞、HIF-1α-siRNA转染的Tca8113细胞接种到各组裸鼠的右腋部皮下,接种的细胞浓度为 1×107个。给予饮用水和常规饲喂,在接种后3 周处死各组裸鼠。
1.3 观察移植瘤的生存状态
观察各组裸鼠移植口腔癌细胞后肿瘤每天的生存状态,在接种后的3 周处死各组裸鼠,利用游标卡尺测定分离出的移植瘤的长径和短径,用于计算肿瘤的体积,同时对肿瘤进行称重。用于计算肿瘤的体积公式为:体积(V)=1/2(长径×短径2);用于计算HIF-1α-siRNA对移植瘤重量抑制率的公式:重量抑制率=(对照组肿瘤重量-实验组肿瘤重量)/对照组肿瘤重量×100%;用于计算HIF-1α-siRNA对移植瘤对体积抑制率的公式,体积抑制率=(对照组肿瘤体积-实验组肿瘤体积)/对照组肿瘤体积×100%。
1.4 ELISA方法检测各组移植瘤中HIF-1α的含量
分离各组裸鼠的移植瘤,切碎分割成小块,取50 mg组织加入1 ml生理盐水于提前预冷的研钵中研磨至匀浆液,1 000 g下离心10 min收集上清液(放置于冰上)。HIF-1α含量的测定参照上海凯博生化试剂有限公司试剂说明书。最后使用酶标仪测定波长为450 nm处96孔板中各孔的A值,以计算各组移植瘤中HIF-1α的含量。
1.5 HIF-1α、CEACAM1及VEGF-C mRNA在各组裸鼠移植瘤中的表达
分离切割各组肿瘤组织,取其中的50 mg, Trizol法提取组织中的总mRNA。QPCR的方法检测各组移植瘤中HIF-1α、CEACAM1及VEGF-C mRNA的表达情况,以GAPDH为内参,HIF-1α、CEACAM1及VEGF-C的引物序列如表 1所示。反应体系中总体积为20 μl,其中包含有cDNA模板(终浓度:500 ng),正反向引物(终浓度为250 nmol/L)以及1 μl的10×SYBR Green染料(购自Takara,大连)。HIF-1α反应条件为:95 ℃ 3 min,94 ℃ 45 s,52 ℃ 1 min,72 ℃ 1 min,40 个循环,72 ℃ 5 min。CEACAM1的反应条件为:95 ℃ 3 min,94 ℃ 45 s,55 ℃ 1 min,72 ℃ 1 min,34 个循环,72 ℃ 5 min;VEGF-C的反应条件为:95 ℃ 3 min,94 ℃ 45 s,55 ℃ 1 min,72 ℃ 1 min,28 个循环,72 ℃ 5 min。荧光定量仪器为美国BIO-RAD公司CFX-96实时荧光定量PCR仪。
1.6 HIF-1α、CEACAM1及VEGF-C蛋白在各组裸鼠移植瘤中的表达
表 1 QPCR检测HIF-1α、CEACAM1及VEGF-C mRNA引物序列
Tab 1 The primers of HIF-1α, CEACAM1 and VEGF-C mRNA for QPCR

基因名称引物序列(5'-3')HIF-1α正向:GGAAGTGGCAACTGACAAGCTCATAA反向:ACACACTGTGTCCAGTTAGT-TCAAACTGAGCEACAM1正向:CAGTCACCTTGAATGTCACCTATG反向:GTTCCATTGATAAGCCAGGAGTACVEGF-C正向:CAGTTACGGTCTGTGTCCAGTGTAG反向:GGACACATGGAGGTTTAAAGAAGGAPDH正向:ACAGTCCATGCCATCACTGCC反向:GCCTGCTTCACCACCTTCTTG
Western blot法分析HIF-1α、CEACAM1及VEGF-C蛋白表达。分离切割各组裸鼠中获取的移植瘤组织,各取50 mg肿瘤组织加入匀浆器,加入1 ml的细胞裂解液,在冰上进行匀浆。匀浆后的液体在室温环境下静置1 h,而后离心(4 ℃、12 000 g,15 min),取上清液用于蛋白电泳。在SDS-PAGE中分离蛋白后,电转移至硝酸纤维素膜,用5%脱脂奶粉PBS-T封闭1 h,一抗稀释HIF-1α(1∶100),CEACAM1及VEGF-C(1∶50),在4 ℃环境下反应过夜。洗膜时采用PBS-T 10 min,重复操作3 次,二抗采用HRP标记的兔抗山羊二抗(1∶1 000稀释)、山羊抗鼠二抗(1∶1 000稀释),37 ℃恒温培养箱中培养1 h,之后进行DAB染色。
1.7 统计学方法
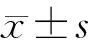
2 结 果
2.1 各组裸鼠移植瘤生存状态及HIF-1α干扰对肿瘤体积、重量的抑制率
整个实验过程中裸鼠的生长、饮食及活动情况均良好,无实验动物死亡。口腔癌裸鼠移植瘤模型建立后3周处死各组裸鼠。实验结束时,空白对照组肿瘤的体积为(280±37) mm3,阴性对照组为(285±40) mm3,HIF-1α干扰组为(180±30) mm3,阴性对照组与干扰组相比无显著差异,HIF-1α干扰组与对照组相比肿瘤体积抑制率为35.7%;空白对照组肿瘤的重量为(0.80±0.17) g,阴性对照组为(0.79±0.08) g,HIF-1α干扰组为(0.48±0.07) g,HIF-1α干扰组与对照组相比肿瘤重量抑制率为40.0%;HIF-1α干扰组的体积及重量均显著小于空白对照组(P<0.05)(表 2,图 1)。

表 2 各组裸鼠移植瘤的体积(mm3)、重量(g)及HIF-1α siRNA对移植瘤体积和重量的抑制率(%)
注: ①与空白对照组比较,P<0.05
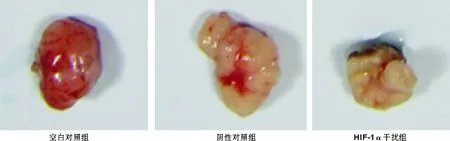
图 1 各组裸鼠剥离的移植瘤比对
2.2 ELISA方法测定HIF-1α含量
ELISA方法检测各组裸鼠移植瘤组织中HIF-1α蛋白含量,结果显示,HIF-1α蛋白在空白对照组和阴性对照组中的表达差异无统计学意义(P>0.05); HIF-1α干扰组与对照组相比,HIF-1α表达量显著下降(P<0.05),空白对照组与HIF-1α干扰组的差异具有统计学差异(P<0.05),说明HIF-1α siRNA显著抑制HIF-1α 蛋白表达(图 2)。

图 2 各组移植瘤组织中HIF-1α含量
Fig 2 The protein expression level of HIF-1α in the transplantated tumor
2.3 实时荧光定量PCR结果分析
采用实时荧光定量PCR的方法检测各组裸鼠移植瘤组织中HIF-1α、CEACAM1及VEGF-C mRNA表达,结果显示,HIF-1α、CEACAM1及VEGF-C mRNA在空白对照组和阴性对照组中的表达,差异无统计学意义(P>0.05); HIF-1α siRNA显著下调HIF-1α mRNA表达,空白对照组与HIF-1α干扰组的组间差异比较具有统计学差异(P<0.05),说明HIF-1α siRNA显著抑制HIF-1α mRNA的表达;同时,HIF-1α干扰组中CEACAM1及VEGF-C mRNA的表达与对照组相比,均显著下降,说明HIF-1α调控CEACAM1及VEGF-C表达,并与之呈正相关(图 3)。

图 3 HIF-1α、CEACAM1及VEGF-C mRNA在各组移植瘤中的表达
Fig 3 The mRNA expression level of HIF-1α, CEACAM1 and VEGF-C in the ransplantated tumor
2.4 Western blot结果分析
Western blot 检测裸鼠移植瘤组织中HIF-1α、CEACAM1及VEGF-C蛋白的表达,结果显示,HIF-1α、CEACAM1及VEGF-C蛋白在HIF-1α干扰组中的表达水平均显著低于空白对照组和阴性对照组,且在空白对照组和阴性对照组的表达差异无统计学意义(图 4),说明HIF-1α下调时,诱导CEACAM1及VEGF-C蛋白表达下调。

图 4 HIF-1α、CEACAM1及VEGF-C蛋白在各组移植瘤中的表达
Fig 4 The protein expression level of HIF-1α, CEACAM1 and VEGF-C in transplantated tumor
3 讨 论
本研究中分别将Tca8113细胞、阴性对照siRNA转染的Tca8113细胞、HIF-1α-siRNA转染的Tca8113细胞分别接种到裸鼠的右腋部皮下,建立口腔癌移植瘤裸鼠模型。结果发现HIF-1α干扰组裸鼠移植瘤的体积及重量均显著小于空白对照组,表明HIF-1α表达沉默能显著抑制移植瘤的生长,同时明显下调CEACAM1及VEGF-C的表达。发生恶性肿瘤时造成缺氧的微环境,缺氧会诱导肿瘤发生恶性转化,不仅增强肿瘤细胞对放射治疗或是药物治疗、甚至是放化疗联合治疗的耐受能力,而且能促进肿瘤的生长和侵袭,因此,肿瘤缺氧的微环境与肿瘤不良预后存在密切联系[9]。发生这些现象的根本原因在于一系列基因和蛋白的表达,HIF-1α是缺氧诱导基因表达的中心调节因子,与肿瘤的发生发展密切相关[10]。有研究表明,在多种恶性肿瘤组织中HIF-1α呈现过度表达,且它的表达受多种肿瘤基因及多种因子的调节,Alves等[11]发现HIF-1α在口腔癌中高表达,且增加口腔癌发生的风险。周沐青[12]等观察VEGF-C和CEACAM1在消化道癌组织和癌旁组织的表达情况,探究其表达和肿瘤分期的关系,结果发现胃肠道肿瘤中的VEGF-C和CEACAM1表达量与肿瘤分期有关,预示VEGF-C mRNA在癌组织中的表达水平可作为恶性肿瘤临床分子诊断的预测指标。
HIF-1α过度表达情况下能激活包括VEGF-C和CEACAM1等刺激血管生成的调控因子的转录和翻译[13],从而促进肿瘤生长、侵袭及转移。Zhang等[14]发现在食管鳞状细胞癌中HIF-1α与VEGF均呈现过度表达,且HIF-1α的表达与VEGF呈正相关,本研究中沉默HIF-1α表达后,VEGF-C表达亦受到抑制,与过去的研究结果相符。CEACAM1能抑制肿瘤生长和上皮细胞的增殖,诱导上皮细胞的凋亡,抑制T细胞的增殖和活化[15],促进血管生成[16]。最初的研究发现CEACAM1在一些上皮来源的恶性肿瘤中表达明显低于正常组织,因此被认为是一种肿瘤抑制因子,但随着研究的深入,发现CEACAM1的表达与癌症的分级相关。
本研究结果显示抑制HIF-1α可以下调血管生成因子CEACAM1和促血管内皮生成因子VEGF-C的表达,并抑制移植瘤的生长。发生这种现象的原因可能在于HIF-1α沉默抑制了肿瘤组织中过表达的HIF-1α对肿瘤血管生成的促进作用,减弱肿瘤增殖活力,形成了新的微环境从而抑制肿瘤组织缺氧环境下的恶性转化。我们推测在口腔癌中HIF-1α可能通过调节CEACAM1及VEGF-C表达影响肿瘤内的血管生成和成瘤过程。
[1] Kademani D. Oral cancer[J]. Mayo Clin Proc, 2007, 82(7): 878-887.
[2] Cvetkovic D, Movsas B, Dicker AP, et al. Increased hypoxia correlates with increased expression of the angiogenesis marker vascular endothelial growth factor in human prostate cancer[J]. Urology, 2001, 57(4): 821-825.
[3] Brennan PA, Mackenzie N, Quintero M. Hypoxia-inducible factor 1alpha in oral cancer[J]. J Oral Pathol Med, 2005, 34(7): 385-389.
[4] 鲍永霞, 吕福祯, 马迎军. 低氧对小鼠缺氧诱导因子-1α、P53和血管内皮生长因子表达的影响[J]. 中国康复医学杂志, 2006, 21(5): 408-411.
[5] 张庆元, 李金荣, 李武修, 等. 口腔鳞状细胞癌血管内皮细胞生长因子的表达[J]. 实用口腔医学杂志, 2003, 19(4): 362-365.
[6] Joukov V, Pajusola K, Kaipainen A, et al. A novel vascular endothelial growth factor, VEGF-C, is a ligand for the Flt4(VEGFR-3) and KDR(VEGFR-2) receptor tyrosine kinases[J]. EMBO J, 1996, 15(2): 290-298.
[7] 张伟锋.RNA干扰HIF-1α对食管鳞癌细胞Eca-109糖酵解相关基因表达的影响[D]. 江苏:南京医科大学, 2010.
[8] 邓锁琴, 靳元, 陈公琰. 癌胚抗原粘附分子1在肺癌组织中的表达及其临床意义[J]. 齐齐哈尔医学院学报, 2010, 31(15): 2357-2358.
[9] Marton I, Knezevic F, Ramic S, et al. Immunohistochemical expression and prognostic significance of HIF-1alpha and VEGF-C in neuroendocrine breast cancer[J]. Anticancer Res, 2012, 32(12): 5227-5232.
[10]Thairu, Munga N. Mechanisms of colorectal cancer pathogenesis: Role of hypoxia[D]. London: Imperial College London,2013.
[11]Alves LR, Fraga CA, Oliveira MV, et al. High HIF-1α expression genotypes increase odds ratio of oral cancer[J]. Head Neck Oncol, 2012, 4(5): 87.
[12]周沐青, 刘鷖雯, 王颖智, 等. 荧光定量PCR检测VEGF-C、CEACAM-1在胃肠肿瘤中的表达及意义[J]. 检验医学, 2011, 26(5): 299-305.
[13]Mohamed KM, Le A, Hai D, et al. Correlation between VEGF and HIF-1α expression in human oral squamous cell carcinoma[J]. Exp Mol Pathol, 2004, 76(2): 143-152.
[14]Zhang H, Wang Y, Xu N, et al. Expression and clinical significance of HIF-1α,VEGF and Survivin in esophageal squamous cell carcinoma[J]. Chinese-German J Clin Oncol, 2007, 6(4): 339-344.
[15]Nagaishi T, Iijima H, Nakajima A, et al. Role of CEACAM1 as a regulator of T cells[J]. Ann N Y Acad Sci, 2006, 1072: 155-175.
[16]Lu R, Kujawski M, Pan H, et al. Tumor angiogenesis mediated by myeloid cells is negatively regulated by CEACAM1[J]. Cancer Res, 2012, 72(9): 2239-2250.
TheeffectsofHIF-1αonthegrowthoftransplantedoralcancerinnudemiceandontheexpressionofCEACAM1andVEGF-Cinthetumor
DAIYinhua,DAIQun,ZOUWenying,YANGQiong,LIUZiyan,DONGYaoyu.
330006,DepartmentofGeneraldentistry,StomatologicalHospitalAffiliatedofNanchanguniversity;TheKeyLaboratoryofOralBiomedicine,JiangxiProvince
Objective: To explore the effects of HIF-1α on the growth of transplanted oral cancer and on the expression of CEACAM1 and VEGF-C in the tumor.MethodsNude mouse model of oral cancer was established by transplantation of Tca8113 cells respectively treated by HIF-1α siRNA and negative control siRNA subcutaneously into right axillary region of nude mice. 3 weeks after transplantation the mice were sacrificed, the tumor volum and weight were measured. The tumor tissue was examined by ELISA method for the detection HIF-1α protein expression, by real-time quantitative PCR and western blot for the detection of mRNA and protein expression of HIF-1α, CEACAM1 and VEGF-C respectively.ResultsThe volume and weight of the transplanted tumor in HIF-1α siRNA group were significantly less than those in the control group(P<0.05), CEACAM1 and VEGF-C mRNA and protein were down-regulate in HIF-1α siRNA group(P<0.05).ConclusionHIF-1α expression is positively related to the expression of CEACAM1 and VEGF-C in the regulation of oral tumor growth.
Oralcancer;Hypoxiainduciblefactor1α(HIF-1α);CEACAM1;VEGF-C
330006, 南昌大学附属口腔医院综合科·江西省口腔生物医学重点实验室
戴群 E-mail: 512968304@qq.com
R739.8
A
10.3969/j.issn.1001-3733.2017.04.007
(收稿: 2016-12-02 修回: 2017-03-26)
