草海自然保护区空心莲子草群落植物组成及多样性分析
2017-11-10彭雪梅钱长江杨允菲张兆军
彭雪梅, 钱长江, 杨允菲, 张兆军
1.贵州师范学院化学与生命科学学院, 贵阳 550018 2.东北师范大学草地研究所, 植被生态科学教育部重点实验室, 长春 130024
草海自然保护区空心莲子草群落植物组成及多样性分析
彭雪梅1,2, 钱长江1, 杨允菲2,*, 张兆军1
1.贵州师范学院化学与生命科学学院, 贵阳 550018 2.东北师范大学草地研究所, 植被生态科学教育部重点实验室, 长春 130024
湿地生态系统极易受外来入侵植物侵害, 为调查草海湿地生态系统空心莲子草不同入侵程度的群落物种组成及多样性的变化, 在夏季对草海自然保护区水陆生境的空心莲子草群落进行调查, 按空心莲子草盖度分为水Ⅰ(0—20%)、水Ⅱ(20%—50%)、水Ⅲ(50%—100%)、陆Ⅰ(0—20%)、陆Ⅲ(50%—100%)五种群落类型。结果表明: 在调查的25个样方中, 水生生境共有10科22种植物, 陆生生境共有13科29种植物, 随空心莲子草入侵程度的增加, 禾本科植物在两种生境中比例均上升; 地面芽植物种类减少; 根茎型植物种类增加; 水中丛生型植物种类增加, 陆地分枝型植物种类减少; 水中物种丰富度增加, 陆地物种丰富度降低; 两生境多样性和均匀度均呈一致的下降。
空心莲子草; 多样性; 生长型; 生活型; 生态类型
1 前言
外来种的引入和传播已经成为全球生态学和保护生物学的关键问题, 入侵种对陆地和水域环境生物群落的改变不断的增加, 成为了被入侵地生态系统的灾难[1]。入侵种对当地的生态和经济都带来严重的危害, 美国每年与外来入侵种直接相关的经济损失达 138亿美元[2], 而使新西兰植物种数降低的两个主要因素中, 外来植物的入侵占57%[3]。入侵种对入侵地植物多样性造成严重威胁[4], 导致生物多样性的降低[5]和本地种的消失[6], 致使生态系统退化,损害生态系统服务功能[7], 因此引起高度关注[8]。
空心莲子草(Alternanthera philoxeroides(Mart.)Griseb.)是起源于南美巴拉那河流域的多年生水陆两栖草本植物[9], 现已在澳大利亚、北美、新西兰、中国、印度和其他亚洲国家成为危害严重的入侵植物[10]。20世纪30年代被引入我国上海, 后传播到华东、华中、华南和西南等广大地区[11]。在入侵地空心莲子草不能进行有性生殖, 主要靠匍匐茎进行无性繁殖[12], 空心莲子草匍匐茎交织在一起, 易形成草毯覆盖水域或陆地, 造成土著种减少、群落物种单一化、水上交通堵塞、农作物减产、湖泊水域面积缩小、生物多样性减少、生态系统破坏等[13]。因为其具有入侵性、传播的潜力、对波动的环境的高忍耐力和宽的生态幅[14]及对经济和环境都有不利的影响, 因此被认为是世界上最有危害的入侵种之一。
草海是我国重要的生物多样性保护区域之一,为我国特有的黑颈鹤等珍稀鸟类及其他候鸟的重要越冬地, 同时也是一个完整、典型的高原喀斯特湿地生态系统。近年来草海生态面临 4大威胁中, 外来生物入侵(空心莲子草、黄黝鱼、彩石鲋)是其中之一, 在对草海的水生植物进行的调查中发现空心莲子草在草海水体的东部大量分布[15]。 本研究的目的是调查草海陆地和水域生态系统中空心莲子草分布的群落物种组成及多样性变化, 为全面正确评估空心莲子草的入侵对草海水域及陆地带来的生态环境的影响, 并为空心莲子草的防控提供理论依据。
2 材料与方法
2.1 研究区概况
自然地理环境: 草海湖位于贵州省西部威宁县城西南侧, 地理位置为北纬 26°49′—26°53′, 东经104°12′—104°18′。湖底平均海拔 2170 m, 湖盆面积约 47 km2, 区内属山地暖温带湿润季风气候, 年平均气温10.6 ℃, 7月份平均气温最高为17.7 ℃, 1月份最低为1.9 ℃, 冬季长, 无夏季[16]。年平均降雨量950.9 mm, 干湿季节明显, 5—10月份为雨季, 其降雨量837.8 mm, 占全年的88%, 11月份至次年4月份为旱季, 降雨量113.1 mm, 仅占全年的5%[17]。光能丰富, 多年平均太阳光能总辐射为466.3 kJ·cm-2[18]。
调查样地在威宁县草海村 8组湖边地带, 该地位于草海自然保护区东南侧, 此处是空心莲子草入侵最严重的地区之一, 海拔2171 m, 东经104°16′E,北纬 26°50′N。
2.2 研究方法
2.2.1 野外调查
于2015年6月22日调查空心莲子草分布的群落植物种类和分布情况。调查生境包括: 河道及岸边陆地。水生生境选取空心莲子草Ⅰ低盖度(AⅠ: 0—20%), Ⅱ中盖度(AⅡ: 20%—50%), Ⅲ高盖度(AⅢ:50%—100%)(共 3种群落类型), 陆生生境选取空心莲子草Ⅰ低盖度(TeⅠ: 0—20%), Ⅲ高盖度(TeⅢ:50%—100%)(共2种群落类型)。调查采用样方法, 每个群落选取有代表性的5个样方, 每个样方大小为1 m×1 m。调查样方中所有植物的种类、盖度和各种植物的株数等。由于没找到未被干扰的足够的空心莲子草零入侵的水陆两环境的群落, 因此空心莲子草零盖度未进入统计。
2.2.2 数据分析
依据《中国植物志》[19]及相关文献的划分方法把每种植物按株生长型、根生长型、Raunkiaer生活型、水分生态类型分类[20-23]。计算每种植物在各盖度等级中的相对频度。
用 Simpson’s Diversity Index (D)[24]来计算水生陆生两种生境低盖度和高盖度样方中物种多样性。
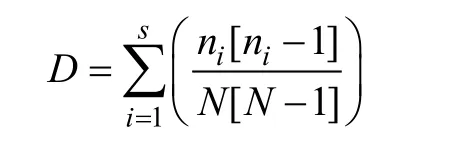
其中:S是物种总数,ni是第i种植物在样方中的数量,N是样方中所有植物数量总和。
用Evenness Index’ (E)[25]均匀度指数来计算两种生境高低两种空心莲子草盖度等级的均匀度
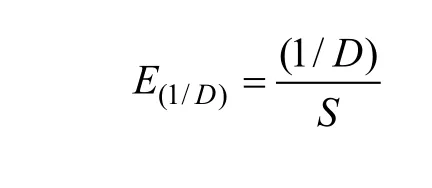
D是辛普森多样性指数,S是样方中的植物种数。
对同一生境的不同盖度的丰富度、多样性、均匀性、各生态学结构的不同类型进行单因素方差分析, 统计软件为SPSS 20。
3 结果与分析
3.1 植物组成的分类学结构
在调查的25个样方中, 水生生境共有10科22种植物, 陆生生境共有13科29种植物(表1)。在水生生境的三个空心莲子草盖度类型群落中, 水Ⅰ中莎草科(Cyperaceae)种类所占比例最多(31%), 其次是禾本科(Gramineae)(26%), 水Ⅱ、水Ⅲ中禾本科最多(AⅡ: 42%, AⅢ: 46%)。在陆生生境的两个盖度类型的群落中, 菊科(Compositae)植物种类所占比例最多(TeⅠ: 25%, TeⅢ: 29%), 其次是禾本科(TeⅠ:15%, TeⅢ: 21%)(图 1)。
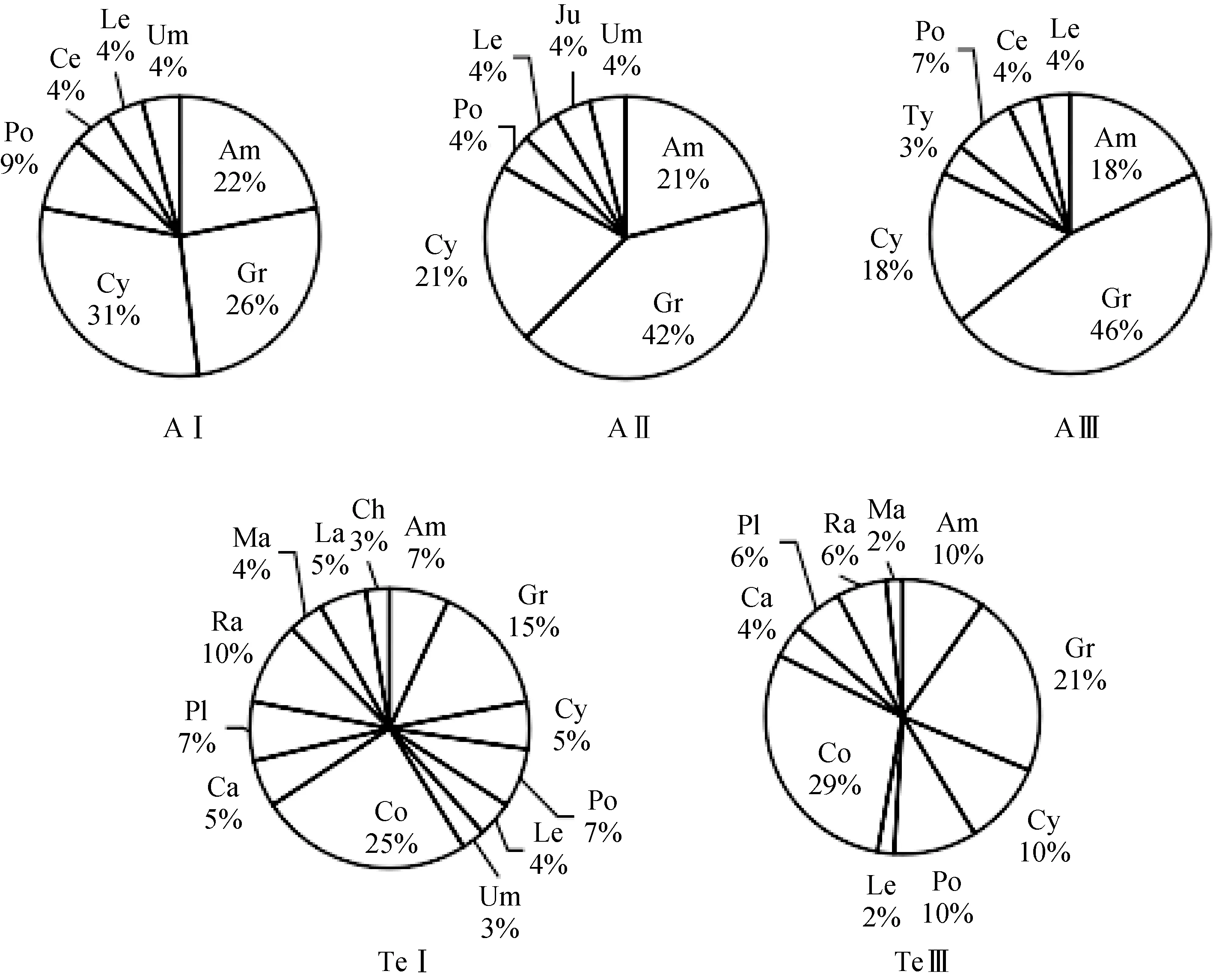
图1 水生和陆生生境不同盖度空心莲子草群落植物种类组成Fig.1 The plant species composition of different ‘coverage grade’ community of A.philoxeroides in aquatic and terrestrial habitats
除空心莲子草之外, 水生生境中相对频度最高的是水葱, 其次是拂子茅, 陆Ⅰ中相对频度最高的是水蓼(Polygonum hydropiperLinn.)、车前(PlantagoasiaticaL.)、石龙芮(Ranunculus sceleratusLinn.), 其次是水莎草(Juncellus serotinus(Rottb.) C.B.Clarke)、早熟禾(Poa annuaL)、钻形紫菀(Aster subulatusMichx.)、繁缕(Stellaria media(L.) Cyr.), 陆Ⅲ中相对频度最高的是水蓼、牛膝菊(Galinsoga parvifloraCav.), 其次是狗牙根(Cynodon dactylon(Linn.)Pers.)(表1)。
3.2 植物组成的生态学结构
生活型是生物对特定生境长期适应而在外貌上反映出来的类型, 根据Raunkiaer的生活型分类系统对草海两种生境的不同空心莲子草盖度的群落进行统计, 水域生态系统中地面–地下芽植物种类最多(AⅠ: 43.48%, AⅡ: 41.67%, AⅢ : 46.43%),地下芽植物次之(AⅠ: 34.78%, A Ⅱ: 25%, A Ⅲ: 32.14%),水Ⅱ中一年生植物种类数量(25.00%)与地下芽植物并排第二位, 地面、地上芽植物极少。陆生两种群落类型都是以一年生植物最多, 占所有种类的一半以上(TeⅠ: 57.53%, TeⅢ : 50.98%)(图2)。陆生生境植物群落随空心莲子草盖度增加, 地面芽植物种类显著减
少(P=0.014), 一年生植物种类显著减少(P= 0.0193)。
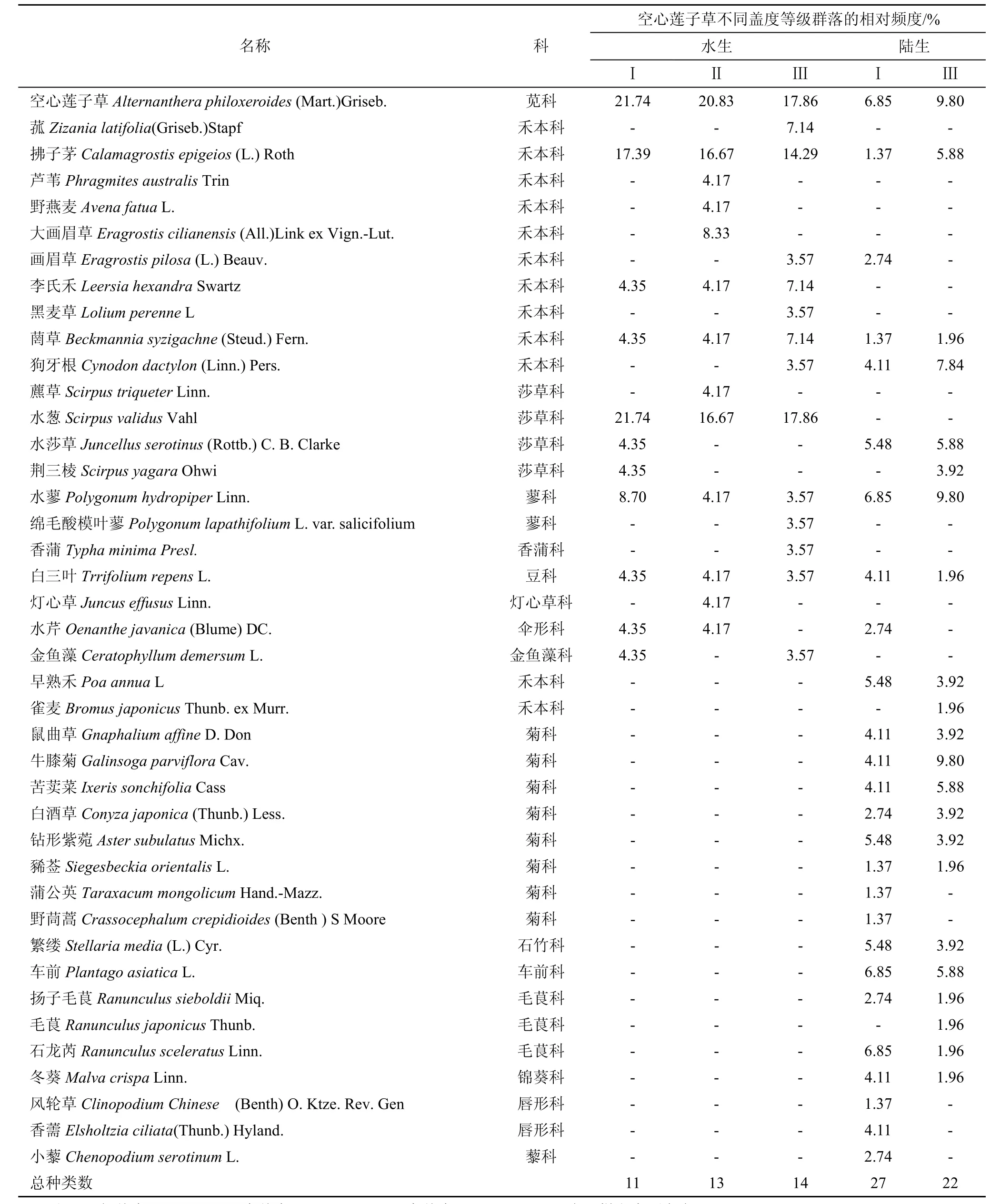
表1 水生和陆生生境不同盖度空心莲子草群落中植物种类科属组成及相对频度Tab.1 The family composition and the relative frequency of plant species in three ‘coverage grade’ community of A.philoxeroides
按植物地上部分株生长型分类, 水Ⅰ中以直立型最多, 占34.78%, 丛生、匍匐型次之, 均占26.09%;水Ⅱ、Ⅲ中以丛生型最多(AⅡ: 37.50%, AⅢ:35.71%), 直立型次之(AⅡ: 33.33%, AⅢ: 28.57%)。陆Ⅰ和陆Ⅲ中均以分枝型最多(TeⅠ: 49.32%, TeⅢ:43.14%)匍匐型次之(TeⅠ: 17.81%, TeⅢ: 21.57%),陆Ⅲ中直立型与匍匐型并列第二(图2)。按植物地下部分根生长型分类, 水生 3个盖度等级均是根茎型最多(AⅠ: 77.27%, AⅡ: 70.83%, AⅢ: 77.78%), 直根型最少(AⅠ: 4.55%, AⅡ: 4.17%, AⅢ: 0)。陆Ⅰ中直根型最多, 占 41.10%, 根茎型最少, 占 27.40%,陆Ⅲ中则是根茎型最多, 占 41.18%, 直根型最少,占 23.53%(图 2)。
在水生生境的三个盖度等级中, 湿生植物种类最多(AⅠ: 47.83%, AⅡ: 37.50%, A Ⅲ: 39.29%),挺水与中生种类数量相似, 沉水种类最少(AⅠ: 4.35%,AⅡ: 0, A Ⅲ:3.57%)。陆生生境的两个盖度等级中,中生植物种类最多(TeⅠ: 69.86%, TeⅢ: 66.67%),湿生植物次之(TeⅠ: 27.40%, TeⅢ: 33.33%)(图 2)。
3.3 植物多样性分析
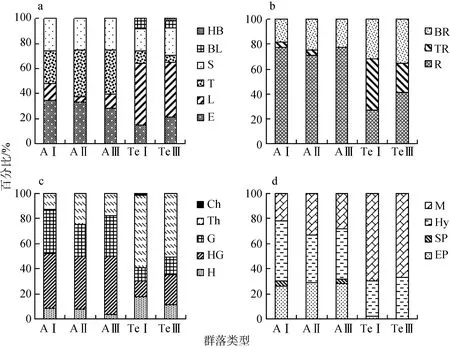
图2 水生和陆生生境不同盖度空心莲子草群落植物株生长型(a)、根生长型(b)、生活型(c)、水分生态类型(d)组成Fig.2 The plant composition of different ‘coverage grade’ community of A.philoxeroides in aquatic and terrestrial habitat
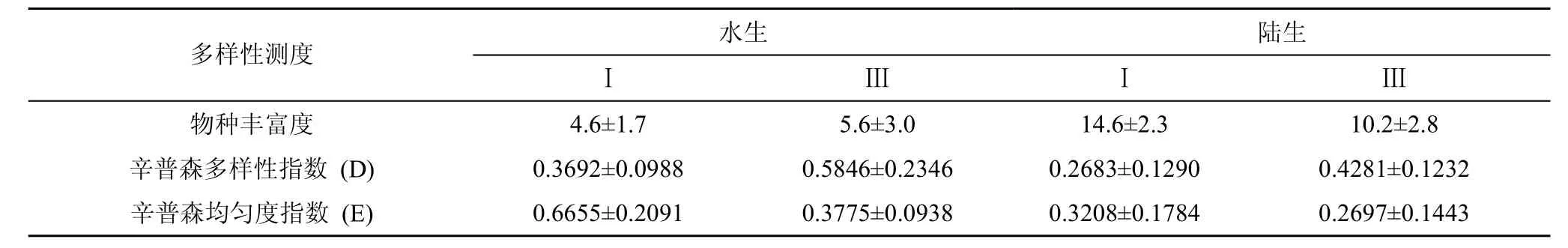
表2 水生和陆生生境最低和最高盖度等级空心莲子草群落的物种丰富度、多样性和均匀度Tab.2 Species richness (S), species diversity (Simpson’s Diversity Index), and evenness (Simpson’s Evenness Index) in‘coverage grade’ Ⅰ (cover 1-20%) and Ⅲ (cover 50%-100%) of A.philoxeroides communities (mean ± SD, n=5)
水生和陆生两种生境中空心莲子草最低(Ⅰ)和最高(Ⅲ)盖度等级中物种丰富度(S)、辛普森多样性指数(D)和均匀度指数(E)见表2。水Ⅰ中物种丰富度低于水Ⅲ中(P=0.526), 但没达到显著水平, 陆Ⅰ中物种丰富度显著高于陆Ⅲ(P=0.026); 水Ⅰ中辛普森多样性指数(D)高于水Ⅲ中的, 但并未达到显著水平(P=0.067), 陆Ⅰ中辛普森多样性指数(D)高于陆Ⅲ,但并未达到显著水平(P=0.08); 水Ⅰ中均匀度指数(E)高于水Ⅲ中的, 但并未达到显著水平(P=0.051), 陆Ⅰ中均匀度指数(E)高于陆Ⅲ, 但并未达到显著水平(P=0.632)。
4 结论与讨论
在水生生境中, 随着空心莲子草盖度的增加,禾本科物种数比例相应增加, 莎草科植物种数比例减少。在陆生生境中, 随着空心莲子草盖度的增加, 禾本科植物种数比例相应增加, 因此两种生境中禾本科所占比例与空心莲子草的盖度成正相关。水葱是样地中水生生境分布较均匀且盖度最大的植物, 因此在水生生境的三个盖度等级中相对频度较高。水蓼是陆生生境分布较多的植物, 因此在低盖度和高盖度中都是频度最高的植物, 车前和石龙芮在低盖度中频度较高, 而另一入侵种牛膝菊在高盖度等级中频度较高, 与空心莲子草有较大的竞争力。
本次调查样地是村庄与湖区的连接处, 周边有农田, 是土壤肥沃且经常被干扰的地带, 植物生活型与李安定等[26]调查的结果水生生境中 H: Cr: Th为 56: 38: 6, 湿生生境中, H: Cr: Th 为 43: 36: 21的差异在于: 水生生境的三个入侵盖度等级中地面芽植物均明显减少, 地面地下芽植物成为生活型谱的主要构成, 一年生植物的比例有所增加; 陆生生境的两个入侵盖度中地面芽植物减少, 一年生植物大幅度增加, 植物的生活型谱也证实了该地是被频繁扰动的地区。随着空心莲子草盖度的增加, 两生境的地面芽植物种类均减少, 说明随着空心莲子草入侵程度的增加, 地面芽植物定植更加不利。
水生三个空心莲子草盖度等级群落中直立型植物种类数量未发生变化, 在水Ⅱ、水Ⅲ中丛生型植物种类数量增加, 导致丛生型植物种类的比例上升, 直立型植物比例下降。陆生生境中, 分枝型植物种类减少, 百分比降低, 其他类型种类数量未发生变化, 而百分比因分枝型的减少而增加。地下部分根生长型随空心莲子草盖度增加的变化情况是:两种生境中根茎型植物种类均增加, 直根型植物种类极显著(P=0.0046)减少, 在水中根茎型最多, 陆地上空心莲子草低盖度群落中直根型最多, 高盖度群落中根茎型最多。六月是雨季, 沿岸的浅水区在旱季可能积水较少或无积水, 因此这里以湿生植物居多。而岸边陆地可能常年不会淹水, 所以主要生长中生型植物。
在新西兰北部湖泊, 空心莲子草与本地种盖度负相关与丰富度无关[27]。在印度, 空心莲子草入侵的吾勒湖[28]等多个湿地和水域生态系统中, 本地植物的数量、丰富度、多样性、均匀性随空心莲子草盖度的增加显著下降[13], 中国南京春季陆地生境中, 空心莲子草分布受土壤水分和干扰强度影响,入侵使物种多样性下降[11]。江西省上饶市郊区空心莲子草入侵达到一定阈值会导致乡土植物多样性下降[29]。在本次调查中, 陆生生境中高空心莲子草盖度的群落物种丰富度显著下降, 而水生生境中高空心莲子草盖度的群落物种丰富度却增加。植物群落物种多样性指数反应群落内各植物种类的多少及各植物种的数量在种间分布的均匀程度[30], 本调查中高空心莲子草盖度的多样性指数降低, 说明入侵严重的群落多样性下降。物种均匀度是衡量植物种类分布均匀程度的重要指标, 均匀度越大, 优势物种不占绝对优势, 反之均匀度越小, 优势物种的优势程度越突出[31,32]。本调查中高盖度空心莲子草群落均匀度降低, 空心莲子草占据优势的地位。两种生境中多样性与均匀度变化趋势基本一致, 说明由于空心莲子草对空间的占据, 两生境物种多样性有着不同程度的降低, 空心莲子草入侵严重的植物群落简单化。在水生生境中的高盖度空心莲子草群落中, 仍然有大量的水葱和拂子茅同时存在, 并在水下还有金鱼藻。在陆生的空心莲子草高盖度群落中, 有相同生态位的狗牙根、高度占优势的水蓼和另一入侵植物牛膝菊同时共存。本次调查中, 水陆生境都没找到空心莲子草盖度大于 90%的群落,所以这可能是导致比较分析中只有少数几个指标达到显著的主要原因。
本研究在夏季对草海的空心莲子草群落进行了调查, 空心莲子草是热带和亚热带地区多年生植物,在冬季往往盖度较低[13], 然而多雨高热的季节盖度显著增大。若揭示高原湿地空心莲子草四季的入侵情况和特征及建立合理的防治措施, 可进一步进行年度的季节动态监测。
外来物种到达一个新地点是人类活动直接或间接的结果, 其入侵生境通常是人类干扰比较强的区域[33]。种间竞争对不同生境的物种组成和群落的空间结构变化起着关键作用。通过对草海不同入侵程度的空心莲子草群落水陆两种生境植物分类学结构、生态学结构及多样性的研究, 结果表明它入侵程度的增加改变了群落的组成并进而改变了植物群落的空间结构。此研究为全面、正确评估该草不同的入侵程度对环境影响的差异, 并为外来入侵杂草的安全性评价和为采取有效控制措施提供更充足的理论依据。
[1]MCNEELY J.Invasive species: a costly catastrophe for native biodiversity[J].Land use and water resources research, 2001, 1 (2): 1–10.
[2]PIMENTEL D, LACH L, ZUNIGA R, et al.Environmental and economic costs of nonindigenous species in the United States[J].BioScience, 2000, 50 (1): 53–65.
[3]DOPSON S R, DE LANGE P J, OGLE C C, et al.The conservation requirements of New Zealand’s nationally threatened vascular plants[M].Threatened species occasional publication 13.Wellington: Department of Conservation, 1999: 194.
[4]KOLAR C S, LODGE D M.Progress in invasion biology:predicting invaders[J].Trends in Ecology and Evolution,2001, 16: 199–204.
[5]POWELL K I, CHASE J M, KNIGHT T M.A synthesis of plant invasion effects on biodiversity across spatial scales[J].American Journal of Botany, 2011, 98: 539–548.
[6]BUTCHART S H M, WALPOLE M, COLLEN B, et al.Global biodiversity: indicators of recent declines[J].Science, 2010, 328: 1164–1168.
[7]PYSEK P, RICHARDSON D M.Invasive species,environmental change and management, and health[J].Annual Review of Environment and Resources, 2010, 35:25–55.
[8]WILCOVE D S, ROTHSTEIN D, DUBOW J, et al.Quantifying threats to imperiled species in the United States[J].Science, 1998, 48 (8): 607–615.
[9]MADDOX D M.Bionomics of an alligator weed flea beetle,Agasiclessp.in Argentina[J].Annals of the Entomological Society of America, 1968, 61: 1299–1305.
[10]SAINTY G, MCCORKELLE G, JULIEN M.Control and spread of alligator weedAlternanthera philoxeroides(Mart.)Griseb., in Australia: lessons for other regions[J].Wetlands Ecology and Management, 1998, 5: 195–201.
[11]林金成, 强胜.空心莲子草对南京春季杂草群落组成和物种多样性的影响[J].植物生态学报, 2006, 30 (4): 585–592.
[12]JULIEN M, BOURNE A, LOW V.Growth of the weedAlternanthera philoxeroides(Martius) Grisebach, (alligator weed) in aquatic and terrestrial habitats in Australia[J].Plant Protection Quarterly, 1992, 7: 102–108.
[13]ANINDITA C, ANJANA D.Effect of varyingAlternanthera philoxeroides(alligator weed) cover on the macrophyte species diversity of pond ecosystem: a quadrat-based study[J].Aquatic Invasions, 2014, 9 (3):343–355.
[14]CHATTERJEE A, DEWANJI A.Peroxidase as a metric of stress tolerance and invasive potential of alligator weed(Alternantheraphiloxeroides) growing in aquatic habitats[J].Management of Biological Invasions, 2012, 3:65–76.
[15]唐金刚, 李苇洁, 周传艳.高原湿地草海水生植物多样性变化研究[J].广西植物, 2014, 34 (5): 601–607.
[16]罗伦.贵州地区气温时空分布特征初探[J].贵州科学,1984, 1: 65–73.
[17]贵州环境保护局编.自然保护与社区发展—草海的战略和实践[M].贵阳: 贵州民族出版社, 1999.
[18]刘家庄.贵州生理辐射与光合生产潜力在农业发展上的意义[J].贵州师范大学学报(自然科学版), 1986, 1: 1–9.
[19]中国科学院中国植物志编辑委员会.中国植物志[M].北京: 科学出版社, 1959–2004.
[20]谢尼科夫.植物与环境、生态型和生活型—苏联的草甸植被(张绅译)[M].北京: 科学出版社, 1958.
[21]李建东.东北草原草本植物基本生活型的探讨[J].吉林师范大学报(自然科学版), 1979, 2: 143–155.
[22]李建东, 杨允菲.松嫩平原贝加尔针茅草甸草原植物组成的结构分析[J].草地学报, 2003, 11(1): 15–22.
[23]陈世鐄, 张昊, 王立群, 等.中国北方草地植物根系[M].长春: 吉林大学出版社, 2001.
[24]SIMPSON E H.Measurement of diversity[J].Nature, 1949,163: 688.
[25]KENT M.Vegetation description and data analysis: a practical approach, 2ndedn [M].UK: Wiley-Blackwell,2012: 414.
[26]李安定, 谢元贵, 张建利, 等.异质生境空心莲子草植物群落组成及物种多样性研究[J].生态环境学报, 2013, 22(8): 1322–1328.
[27]IMOGEN B, QUENTIN P, ROBIN H, et al.Characterising alligator weed (Alternathera philoxeroides; Amaranthaceae)invasion at a northern New Zealand lake[J].New Zealand Journal of Ecology, 2012, 36 (2): 216–222.
[28]ATHER M, FAREED A K.Invasion of alligator weed(Alternanthera philoxeroides) in Wular Lake, Kashmir,India[J].Aquatic Invasions, 2012, 7 (1): 143–146.
[29]郭连金, 徐卫红, 孙海玲, 等.空心莲子草入侵对乡土植物群落组成及植物多样性的影响[J].草业科学, 2009, 26(7): 137–142.
[30]CADOTTE M W, CARSCADDEN K, MIROTCHNICK N.Beyond species: Functional diversity and the maintenance of ecological processes and services[J].Journal of Applied Ecology, 2011, 48: 1079–1087.
[31]邓红兵, 王青春, 王庆礼, 等.河岸植被缓冲带与河岸带管理[J].应用生态学报, 2001, 12 (1): 951–954.
[32]赵清贺, 马丽娇, 刘倩, 等.黄河中下游典型河岸带植物物种多样性及其对环境的影响[J].生态学杂志, 2015,34(5): 1325–1331.
[33]BINGGELI P.A taxonomic, biogeographical and ecological overview of invasive woody plants.Journal of Vegetation Science, 1996, 7: 121–124.
Botanical composition and diversity analysis of Alternanthera philoxeroides(alligator weed) community in Caohai Nature Reserve
PENG Xuemei1,2, QIAN Changjiang1, YANG Yunfei2,*, ZHANG Zhaojun1
1.School of Chemistry and Life Sciences,Guizhou Education University,Guiyang550018,China2.Institute of Grassland Science,Northeast Normal University,and Key laboratory for Vegetation Ecology,Ministry of Education, Changchun130024,China
Wetland ecosystems are easily invaded by alien invasive plants.There was infestation fromAlternanthera philoxeroides(alligator weed) in Caohai Nature Reserve.In order to investigate the species composition and the change of diversity of different‘coverage grade’ community ofA.philoxeroides,the research was conducted in summer.The study focused on enumerating the effect of varying coverage ofA.philoxeroideson the botanical composition and diversity of aquatic and terrestrial region of natural plateau wet-land habitat.A.philoxeroidescommunity was categorized into 3 coverage grades in aquatic habitat (AI: 0%-20%, AⅡ: 20%-50%,AⅢ: 50%-100%) and 2 coverage grades in terrestrial habitat (Te I: 0-20%, TeⅢ: 50%-100%).In total 25 quadrates, 22 species belonging to 10 families in aquatic habitat and 29 species belonging to 13 families in terrestrial habitat were found to be present.With the increase ofA.philoxeroidesinvasion, the percentage of Gramineae raised in two habitats; the number of hemicryptophyte decreased; the number of rhizome type increased; the number of tuft type increased in aquatic habitat; the number of limb type decreased in terrestrial habitat.Species richness increased in aquatic habitat, but decreased in terrestrial habitat.Diversity and evenness both decreased in two habitats.
Alternanthera philoxeroide; diversity; growth form; life form; ecological type
10.14108/j.cnki.1008-8873.2017.05.016
Q948.1
A
1008-8873(2017)05-121-08
彭雪梅, 钱长江, 杨允菲, 等.草海自然保护区空心莲子草群落植物组成及多样性分析[J].生态科学, 2017, 36(5): 121-128.
PENG Xuemei, QIAN Changjiang, YANG Yunfei, et al.Botanical composition and diversity analysis ofAlternanthera philoxeroides(alligator weed) community in Caohai Nature Reserve[J].Ecological Science, 2017, 36(5): 121-128.
2016-08-26;
2016-11-03
贵州省青年科技成长项目(黔教合KY字[2016]213) ; 国家自然科学基金项目(31672471, 31472134, 31670427); 贵州省科技厅基金项目(黔科合J字[2013]2249号)
彭雪梅(1978—), 女, 辽宁铁岭人, 博士研究生, 主要从事植物种群生态学研究, E-mail: pengxm215@163.com
*通信作者:杨允菲, 女, 硕士, 教授, 主要从事植物种群生态学研究, E-mail: yangyf@nenu.edu.cn
