天然及人工红树林土壤微生物群落结构分析
2017-11-10殷萌清冯建祥黄小芳蔡中华林光辉周进
殷萌清, 冯建祥, 黄小芳, 蔡中华, 林光辉,*, 周进,*
1.清华大学, 地球系统科学研究中心, 北京100084 2.清华大学深圳研究生院, 海洋科学与技术学部, 深圳518055
天然及人工红树林土壤微生物群落结构分析
殷萌清1,2, 冯建祥2, 黄小芳2, 蔡中华2, 林光辉1,2,*, 周进2,*
1.清华大学, 地球系统科学研究中心, 北京100084 2.清华大学深圳研究生院, 海洋科学与技术学部, 深圳518055
应用高通量测序和OTU分析法比较了红树植物人工修复区(Transplant-, TP)与天然区(Natural-, NA)土壤微生物的群落结构差异。结果显示: 从群落组成来看, 细菌在天然林和人工林主要由27个门类的菌群组成, 优势菌群包括变形杆菌(Proteobacteria)、拟杆菌(Bacteroidetes)、绿弯菌(Chloroflexi)、酸杆菌(Acidobacteria)、浮霉菌(Planctomycetales)。古菌的组成在纲的水平上主要以盐杆菌(Halobacteria)、热原体(Thermoplasmata)和甲烷菌(甲烷微菌Methanomicrobia、甲烷杆菌 Methanobacteria、甲烷球菌 Methanococci)为主, 其中盐杆菌占的比重最大(约 19%—37%)。从结构来看, 多样性指数(H)和丰富度指数(Schao)表明: 天然林和人工林细菌的多样性和丰度均高于古菌, 天然林多样性及丰度均高于人工林(NA>TP)。此外, 对采集的样本进行主成分分析(PCA)显示细菌聚成两大类: 源自外周土壤的菌群聚成一类, 源自根际土壤的菌群聚成另一类; 古菌则按生境聚成三类: 分别是天然林、人工林和采自非红树区的基围鱼塘。对细菌来说, 经长时间修复的人工林与天然林的外周土壤群落结构差异不大, 显示出了趋同性; 但同一环境下的根际与外周土壤群落结构差异较大, 体现了明显的根际效应。古菌结构受根际效应的影响较小, 受环境因素影响较大。
天然林; 人工林; 土壤微生物; 群落结构; 根际效应; 秋茄
1 前言
红树林是生长在热带、亚热带潮间带的木本植物群落, 拥有五倍于热带雨林的生态服务价值, 与珊瑚礁、上升流、盐沼湿地组成了海洋四大高生产力生态系统[1]。然而, 随着经济的发展, 人为活动的频繁和环境的恶化造成了红树植被的大面积退化。过去的50年中已有三分之一的红树林消失, 2015年的最新统计数据表明, 全球红树林面积仅为4.0万hm2[2]。我国拥有有限的红树林资源, 其总面积不到1.5万 hm2,95%以上分布在北部湾沿岸和海南岛。基于红树林在滨海生态系统中的调节能力和全球变化中的重要作用, 近年来红树林的保护和资源修复越来越受到重视, 世界各国纷纷开展了相应的保护措施[3], 我国也启动了红树林湿地行动计划, 将人工种植作为资源修复的重要方式[4]。
植物的移栽和修复效果受多种因素的影响, 包括温度、盐度、营养以及土壤介质等。其中, 土壤环境是红树植物存活和成功移栽的一大关键[5]。而对于土壤环境的量化评价除了传统的理化指标以外,土壤中微生物的组成和群落结构也是影响土壤质量的重要因子。已有的研究表明, 红树植物与其土壤微生物之间存在密切的互作关系。一方面, 微生物通过能量循环和物质转化(氮、碳、磷、硫、铁)促进植物生长, 从而为生态系统中的其它生物提供生态位和营养来源[6]; 另一方面, 红树林的健康状况也影响微生物的多样性和群落结构。“植物-微生物”的相互关系在探明物质平衡、阐述气候变化以及揭示红树湿地起源上具有重要意义[7-8]。在探讨红树修复过程中微生物的变化方面也有过诸多尝试。Gomes等[8]利用短期的胚轴实验(3-6个月), 验证了根际微生物在植物健康移栽中的作用, 推荐将微生物组成作为评估红树保育效果的参照指标。此外, 一些作者证实了湿地环境下不同植物的根际微生物群落各异[10], 且不同修复林龄的植株根际微生物的组成也存在明显的差异[11]; 这些差异的产生与土壤营养状况、pH、土壤呼吸强度、以及土壤有机质的多寡等有关[11]。本实验室前期的工作也发现修复林的微生物组成与时间(4-8年)呈现一定的正相关, 即林龄越长微生物组成越趋同[12]。然而, 更长时间尺度上(25年以上)的微生物差异还未见报道。
为此, 本次工作以雷州红树林保护区秋茄的天然林和人工林为研究对象(移栽时间大于 25年), 通过 16S高通量测序和 OTU(Operational Taxonomic Units, 操作分类单元)分析法对这两种生境下的根际及外周土壤中的细菌和古菌群落结构进行了比较,旨在认识不同红树林土壤微环境下的微生物群落组成, 为评估修复效果、认识植物根际群落的自然演化进程提供科学认识。
2 材料与方法
2.1 样地介绍
采样地点位于中国广东省雷州市附城镇海岸带芙蓉村东北部(110°09′46″E, 20°56′26″N)(图 1), 该样地年平均气温为22.9 ℃, 最高气温出现在7月(28.4 ℃),最低气温出现在1月(15.5 ℃), 年降雨量为1711 mm。作为广东省红树林面积最大的区域, 雷州半岛自1991年以来成立了红树林保护区, 该区一方面进行野外现有资源的保护, 另一方面也进行红树林人工修复和增植, 形成了自然林和人工林共存的自然景观[13]。
本次研究的红树植物为秋茄(Kandelia obovata)。采集的样品为秋茄林的外周土壤和根际土壤。采样点的环境参数为: 盐度20.84‰—24.89‰, 温度23.4—24.1 ℃, pH 6.71—6.86。

图1 样地地理位置及采样点分布图(a为总览图, b、c为放大图)Fig.1 The map of the sampling sites (Picture a is the overview map; picture b & care the enlarged view)
2.2 样品采集
根据采样区红树林的分布情况, 2015年1月7日, 选择秋茄天然林(Natural-, NA)和人工林(Transplant-, TP)进行根际土壤和外周土壤的采集。根际土壤(Rhizosphere, 简称 R)的采集利用灭菌铲小心挖取 3段同株植物根系, 抖落根表面的多余土壤, 小心装入无菌样品袋中。外周土壤(Surrounding-,简称S)的获取则利用无菌采集器在同株植物周围多点采样混合装入无菌样品袋。每份样品设三个重复,置于冰盒于当天带回实验室进行预处理。实验中将无红树生长区的基围鱼塘(Fish Pond, 简称 FP)土壤样品作为非红树区的对照。所有采样位点及标记如图1c所示。
2.3 样品预处理
根际土壤的处理: 将天然林和人工林的秋茄根样等量称取后装入灭菌的、预装有无菌水的50 mL离心管中, 充分震荡1 min, 超声45 s, 交替三次, 使根际的土壤充分悬浮在无菌水中。随后13000 r⋅ min–1离心 20 min, 将悬浮的微生物通过离心力沉降, 收集沉淀用于后续的实验。外周土壤的处理: 外周土壤于冰浴环境带回实验室保存于–80℃冰箱, 用于环境DNA的提取和微生物多样性分析。
2.4 环境DNA的提取
分别称取等量(0.25 g)离心得到的根际土壤和外周土壤, 采用土壤专用 DNA提取试剂盒(MOBIO PowerSoil DNA Isolation Kit, USA)提取土壤样品DNA, 提取过程参照试剂盒说明书进行。
2.5 PCR扩增与Miseq文库制备
根据 Illumina Miseq高通量测序要求, 在 16S V4-V5区设计引物。细菌扩增引物为: 515F和926R (正向引物序列 5’-TCCCTACACGACGCTCTTCCG ATCT-GTGCCAGCMGCCGCGGTAA-3’, 反向引物序列(5’-GAGTTCCTTGGCACCCGAGAATTCCA- CCGTCAATTCMTTTGAGTTT-3’), 古菌扩增引物为:Arch519F 和 Arch915R(正向引物序列 5’-CAGC CGCCGCGGTAA-3’, 反 向 引物序列 5’-GTGCTCC CCCGCCAATTCCT-3’)。PCR 扩增反应体系为50 μL,其中 5×Buffer(10 μL), dNTP(10 mmol·L-1, 1 μL),Phusion 超保真 DNA 聚合酶(1 μL), 引物 1 μL(10 μmol·L-1), 模板(20—50 ng), ddH2O 补至 50 μL。反应体系为94 ℃ 2.5 min; 94 ℃ 30 s, 56 ℃ 1.5 min, 72 ℃ 30 s,72 ℃ 2 min, 25个循环; 10 ℃延伸。所用设备为: 扩增用晶格T960智能梯度PCR仪, 胶回收使用AXYGEN公司的 AxyPrepDNA 凝胶回收试剂盒, PCR 产物浓度检测采用微量荧光核酸定量仪Qubit 2.0进行。
2.6 Miseq第二代测序及数据分析
高通量测序数据通过NGS Illumina MiSeq 2 ×300 bp平台进行(上海微基生物科技有限公司)。对得到的序列数据进行优化和序列比对之后再按照97%的相似度进行 OTU的划分、α多样性分析、PCA分析及系统进化树构建。分析软件包括mothur V.1.33.3、PC-ORD、MEGAN、Excel、shannon-ace-table.pl及BioLinker的自编程序。进化树用Neighbor-joining的方法进行构建, 用Bootstrap(1000次重复)进行检验。
OTU分析作为本次测序数据的分析基础, 其反应的生物学意义在于: 研究系统发生学或群体遗传学时, 为了便于分析而给某一个分类单元(品系、种、属等)设置的同一标志。在生物信息分析中, 测序得到的每一条序列来自一个物种或一个菌株。在本研究的分析中, 取序列相似度97%进行 OTU归类, 其中细菌得到的OTU总数为5865个, 古菌为1193个。
3 结果
3.1 各样点细菌及古菌群落丰度及多样性
本实验构建了秋茄天然林、人工林的根际、外周土壤和基围鱼塘土壤的细菌及古菌 16S-rRNA基因文库。经去重复和去冗余获得了30000条以上的有效序列, 保证了数据分析的有效性。根据OTU归类的结果计算了多样性指数(H)和物种丰富度指数(Schao)。结果表明: 各样点细菌的多样性和丰度均高于古菌; 天然林微生物多样性指数和丰度均高于人工林, 非红树区的基围鱼塘两项指标都最低; 采自同一环境下的外周土壤的细菌多样性高于根际, 丰度则是根际略高于外周(表1)。
3.2 天然林与人工林细菌、古菌的组成与结构特征
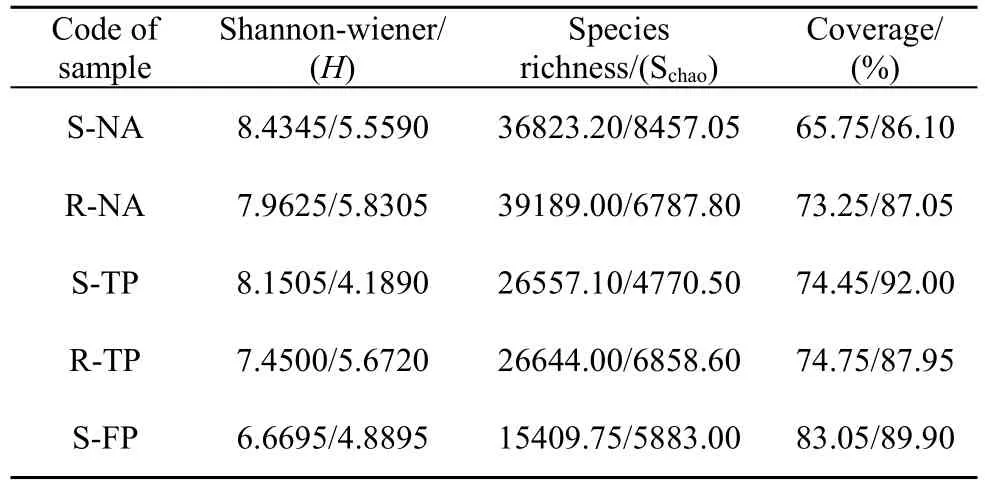
表1 不同样点土壤细菌/古菌16S rRNA基因文库的多样性指数Tab.1 Bacterial and archaea diversity index in rhizosphere soil and surrounding soil of different sample sites
从总体上看细菌在天然林和人工林主要由 27个门类的物种组成, 居前 5位的优势菌群为变形杆菌(Proteobacteria)、拟杆菌(Bacteroidetes)、绿弯菌(Chloroflexi)、酸杆菌(Acidobacteria)、浮霉菌(Planctomycetales), 其中变形杆菌(Proteobacteria)占绝对优势, 在所有样点中所占比例均超过 50%, 最高达到70.4%(出现在人工林根际R-TP)(图2A)。其它主要菌群如黏胶球形菌(Lentisphaerae)、梭杆菌(Fusobacteria)、硝化螺旋菌(Nitrospira)、芽单胞菌(Gemmatimonadetes)、蓝细菌(Cyanobacteria)、脱铁杆菌(Deferribacteres)、绿硫菌(Chlorobi)、放线菌(Actinobacteria)、螺旋体(Spirochaetae)、疣微菌(Verrucomicrobia)、厚壁菌(Firmicutes)、纤维杆菌(Fibrobacteres)、软壁菌(Tenericutes)、异常-栖热菌(Deinococcus-Thermus)和互养菌(Synergistetes)也在各样点中检出, 约占OTU总数的15%—5%。此外,一些低丰度物种(OTU tags<1%)亦存在于红树土壤细菌家族中, 包括待分类的候选家族(Candidate division)OD1、OP3、OP8、OP10、OP11、WS3、TM7和 Elusimicrobia(Termite Group 1)等(图 2B)。分析不同生境的细菌组成可以看出, 虽然小的波动存在于天然林和人工林, 但两者在总体的菌群组成上没有显著差异。值得注意的是, 占比最多的变形杆菌(Proteobacteria)在两种环境下都是根际比外周丰富(图 2A); 非红树区的基围鱼塘中的螺旋体(Spirochaetae)高于红树环境(图2B)。
相比于细菌, 古菌的多样性明显偏低。所检测到的古菌在门的水平上主要包括两大门类—奇古菌门(Thaumarchaeota)和广域古菌门(Euryarchaeota)。在纲的水平上如图 3, 主要包括盐杆菌(Halobacteria)、热原体菌(Thermoplasmata)、甲烷微菌(Methanomicrobia)、甲烷杆菌(Methanobacteria)以及甲烷球菌(Methanococci)。其中, 盐杆菌为绝对优势菌,占比 19%—37%, 其次为热原体菌(1.2%—8.5%),再次为甲烷菌(0.1%—2.1%), 未鉴定出的物种约50%以上。样点间的比较发现, 天然林与人工林的古菌群落组成趋同; 同一采样环境中外周土壤与根际土壤的比较发现盐杆菌偏爱于根际环境; 非红树区热原体菌和甲烷微菌占更高比例, 与红树区样品有较大差异(图3)。
3.3 样品中细菌和古菌群落组成的主成分分析
利用软件mothur、PC-ORD进行计算分别得到不同样点细菌(图 4)和古菌(图 5)群落组成的主成分分析图(PCA)。细菌群落组成的PCA图(两个主坐标解释 91.0%)显示, 所有样品大体归为两个群集, 第一个群集为根际土壤(R-)样品(蓝色圈), 第二个群集为外周土壤(S-)样品(红色圈)。同时该结果也可看到经过长时间的修复, 外周(S-, 林区内)土壤的细菌群落结构趋同, 根际样点(R-)相对分散, 而非红树区(FP)的鱼塘样点则偏离其它两个环境。
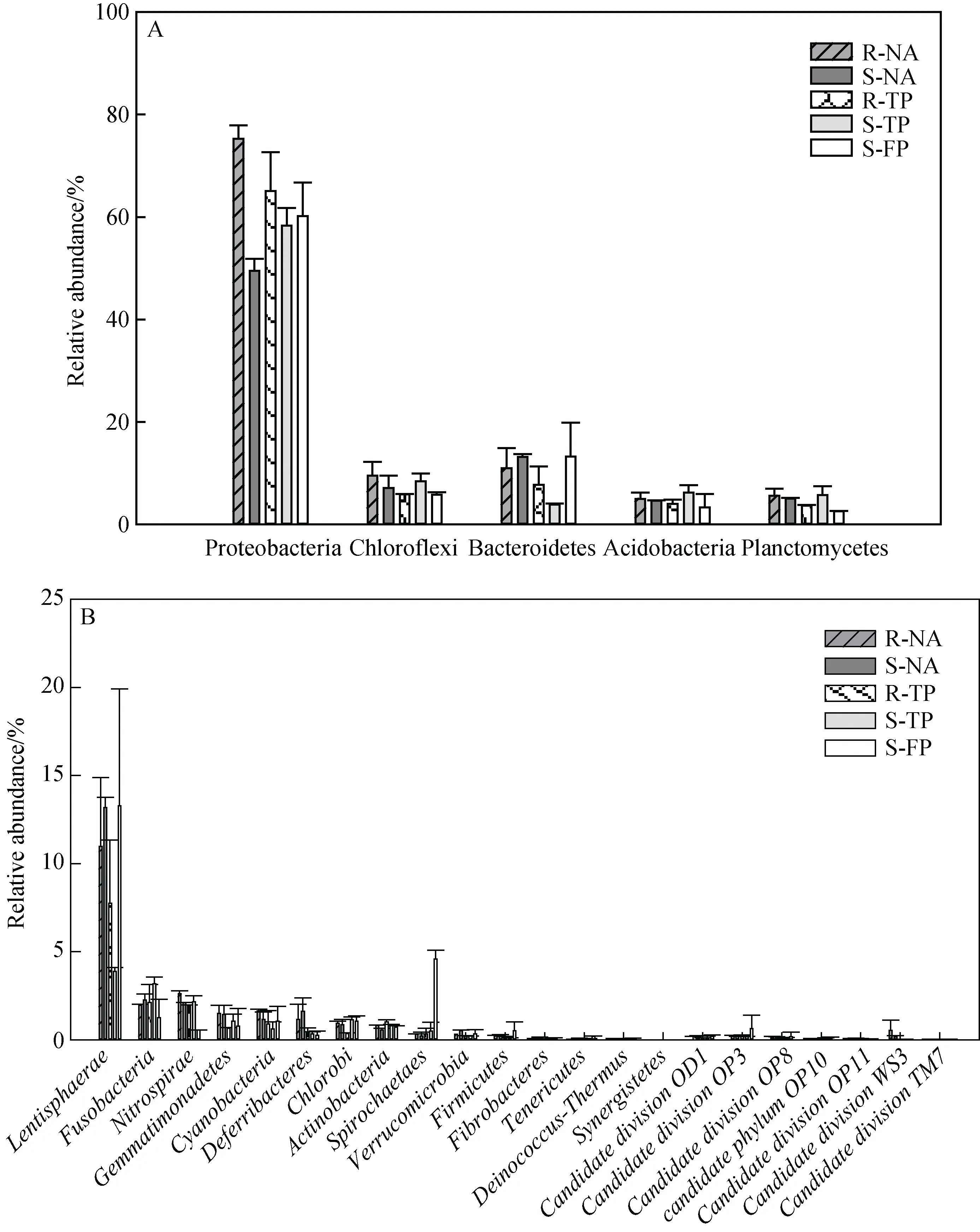
图2 门水平不同样点主导细菌相对数量。图A示占主导的前5类菌株, 图B示其它类菌株。S表示外周菌, R表示根际菌, NA为天然林, TP为人工林, FP为基围鱼塘.Fig.2 The relative abundance of the dominant bacterial phylum in different samples.A: top five dominated bacteria, B:other species.S-: surrounding, R-: rhizosphere, NA: natural, TP: transplant, FP: fish pond
古菌群落的PCA图(图5)显示(两个主坐标解释70.5%), 所分析的样品可聚为三个群集, 第一个群集为基围鱼塘(FP)土壤样品(蓝色圈), 第二个群集为天然林(NA)根际和外周土壤样品(红色圈), 第三个群集为人工林(TP)根际和外周土壤样品(绿圈)。该结果表明古菌群落结构受不同的土壤环境(NA, TP, FP)影响较大, 而同一环境下根际(R-)和外周(S-)样品的古菌群落组成较为接近。
3.4 细菌及古菌系统发育分析
为进一步了解样品中微生物的系统发育学地位, 绘制了主要细菌(图6)和古菌(图7)的系统进化树。从进化树的结果可以看出, 细菌和古菌分属17个门和 3个门类, 细菌中占主导地位的变形杆菌(Proteobacteria)构成第一大分支, 包括 α-, β-, γ-,δ-和 ε-亚族。其次拟杆菌(Bacteroidetes)和酸杆菌(Actinobacteria)作为相对优势菌构成第二和第三大分支。古菌在进化关系上则主要分成两支, 即盐杆菌(Halobacteria)家族和甲烷菌家族—甲烷微菌(Methanomicrobia)、甲烷杆菌(Methanobacteria)、甲烷球菌(Methanococci), 这两大类群在古菌中占主导可能与红树植物的泌盐特性和土壤中甲烷富集能力有关。

图3 不同样点古菌群落(纲分类水平)的结构组成。R-根际菌, S-外周菌, NA-天然林, TP-人工林, FP-基围鱼塘。Fig.3 The relative abundance of the dominant archaea in different samples at class level.R-: rhizosphere, S-:surrounding, NA: natural, TP: transplant, FP: fish pond

图4 不同样点细菌群落组成的主成分分析。R-根际菌, S-外周菌, NA-天然林, TP-人工林, FP-基围鱼塘。Fig.4 PCA plot for bacterial community structure of all samples.R-: rhizosphere, S-: surrounding, NA: natural, TP:transplant, FP: fish pond; 1, 2 are two repeated samples.

图5 不同样点古菌群落组成的主成分分析。R-根际菌, S-外周菌, NA-天然林, TP-人工林, FP-基围鱼塘。Fig.5 PCA plot for archaea community structure in all samples.R-: rhizosphere, S-: surrounding, NA: natural, TP:transplant, FP: fish pond; 1, 2 are two repeated samples.
4 讨论
4.1 根际和非根际土壤中微生物组成差异及原因
根际的概念最先由德国微生物学家 Lorenz Hiltne提出, 是指在根系周围受根系生长影响的土体范围,包括根际土壤和外周土壤[14]。在植物中针对根际微生物和外周微生物的组成差异进行了不少研究, 包括芦苇[10]、湿地红树[15]以及小麦(野生植株与种植植株)[16]等。这些实验证实了根际的细菌有较高的多样性, 体现明显的根际效应。形成这一特征的原因可能有: 一是植物光合作用产生的氧通过植物组织输送到根部, 使得根际周围的氧气比外周土壤的丰富,增加了根部环境对一些细菌(尤其是好氧菌)的选择性; 二是根际分泌物为微生物提供了营养和能量来源, 从而增加了微生物类群对根的趋向性[17]。此外,Srensen[18]从生态位(Niche)的角度也给出了解释,他认为植物的根际创造了一个有别于其它土壤的微生境(microhabitat), 该环境为部分微生物提供了生态位平台, 使得它们具有了竞争优势而得以大量繁殖, 成为优势类群, 从而使得物种的组成多样性减少。本次实验验证了Srensen的观点, 表1中, 同样的环境条件下, 土壤的细菌多样性高于根际(S-NA:8.4345>R-NA: 7.9625; S-TP: 8.1505>R-TP: 7.45)。从PCA的分布上(图4)可以看出, 外周土壤微生物的分布相对集中, 而根际微生物的分布则相对分散, 这说明根际环境的种群结构受到植物的影响较大, 体现了根际效应[19]。除了结构的多样性, 对丰度的探讨也是关注的热点。Tang等[20]通过16S rRNA技术发现红树植物老鼠簕(Acanthus ilicifolius)根际微生物具有更高的丰度指数, 与外周土壤相比体现明显差异(P<0.05)。本次实验中我们发现根际土壤的微生物量(Biomass)略高于外周土壤, 但未达到显著水平(表1), 造成这一差异的原因相对多样, 可能与植株个体、根系分泌物成分以及土壤类别有关[21]。最近Nature发文深入证实了根系微生物受土壤类型和植物基因型的影响, 且为根系微生物的定植找到了新的线索[22], 该研究进一步验证了植物种类能影响根际微生物的数量和种类, 而且从分子层面验证了“植物-土壤-细菌”交互选择、交互影响的复杂关系。

图6 红树土壤主要细菌类群的系统发育树。R-根际菌, S-外周菌, NA-天然林, TP-人工林, FP-基围鱼塘。Fig.6 Phylogenetic tree of bacterial at mangrove plant.R-: rhizosphere, S-: surrounding, NA: natural, TP: transplant, FP:fish pond

图7 红树土壤古菌系统发育树。R-根际菌, S-外周菌, NA-天然林, TP-人工林, FP-基围鱼塘Fig.7 Phylogenetic tree of archaeal at mangrove plant.R : rhizosphere, S-: surrounding, NA: natural, TP: transplant, FP:fish pond
对于一些主导性微生物, 其在根际高于外周土壤的原因可能是基于生态功能的需要。植物基于存活、抗逆以及对营养的需求会使特征性的菌群在根际富集, 如根瘤菌、伯克霍尔德氏菌、厚壁菌、硝化细菌等, 以满足植物对氮、碳、病原抵抗和纤维素降解等的需要[23]。本次结果中我们发现绿硫菌(Chlorochromatium、脱铁菌(Deferribacteraceae)、纤维杆菌(Fibrobacter)的OTU片段数在根际部分要高于土壤。依据《伯杰氏细菌鉴定手册(第八版)》的注解[24], 这些菌群的功能主要是氧化硫(提供电子供体进行厌氧条件下的光合作用)、化能异养利用碳源、以及降解纤维素等。这些特性对帮助秋茄根系获取能量有重要意义, 同时也进一步印证了根系对微生物具有选择性的理论[25]。Tarafdar等[26]用数学模型模拟了根系分泌物与根际微生物群落的关系, 证实根际主要微生物的数量和种类与可溶性碳的分布距离有关。因此, 根际和非根际主导性微生物的组成差异, 其驱动力除了源自微生物个体的自身功能,根系分泌物也有一定的介导作用。
值得注意的是, 与细菌相比, 古菌的多样性有些许不同。本次实验仅发现除了在外周土壤中的 OTU数量比根际高外, 其它古菌成员在根际和非根际区差别不大, 未体现明显的根际效应, 这或许与古菌的生态功能、环境响应力、以及种群基数有关[27]。
4.2 天然林与人工林土壤微生物的组成差异
从总体的微生物组成来看, 本次研究中发现两种林地中占优势地位的细菌主要包括变形杆菌(Proteobacteria)、拟杆菌(Bacteroidetes)、酸杆菌(Acidobacteria)、绿弯菌(Chloroflexi)、脱铁杆菌(Deferribacteres)、浮霉菌(Planctomycetales)、放线菌(Actinobacteria)、厚壁菌(Firmicutes)、疣微菌(Verrucomicrobia)以及硝化螺旋菌(Nitrospira)(图 1),这与以往研究结果类似[28]。比较天然林与人工林的细菌差异发现, 优势菌群未见显著差异。值得注意的是, 天然林根际硝化螺旋菌(Nitrospira)的比例(0.66%—0.80%)约为人工林(0.31%—0.39%)的两倍,其原因可能是天然林积累了更多的凋落物, 需要更多的硝化菌行使N源转化功能。Thoms等[29]也指出凋落物的差异使得输入到土壤中的有机质存在差异, 进而影响微生物的组成, 其中影响最大的就包括具有分解有机物能力的硝化细菌(杆菌、球菌和螺旋菌)。对于非红树区的基围鱼塘(图2、3)存在一些与红树区的些许差异, 包括: 拥有更高比例的蓝细菌(Cyanobacteria)和甲烷微菌(Methanomicrobium); 以及特征性的出现两类革兰氏阴性菌—互养菌(Synergistetes)和梭杆菌(Fusobacteria)。形成这一差异的原因可能是源自鱼塘的底泥特征(NH4+的富余和偏厌氧环境), 氨是甲烷微菌的唯一氮源, 致使甲烷微菌在这一环境中的数量居多[30]; 而互养菌(Synergistetes)和梭杆菌(Fusobacteria)是低氧环境中的典型代表, 因而两者在鱼塘环境中常见。此外, 鱼塘环境受人类活动影响较大, 外界因素的扰动也是驱动微生物组成发生改变的原因之一[29]。
另一个值得我们注意的是, 植株根际微生物的组成与修复林龄有关。杨琼等[11]证实人工修复林在1年林龄与天然林有显著差异, 当年份延长至7年时两者差异最小; 而随着时间的进一步推演, 至14年时又可观察到较大差异。造成这一现象的原因是种植初期由于红树进入新环境, 微生物的适应、演变和稳定需要一个过程; 而随着时间的进一步延伸,植株叶片的生长阻挡了阳光对土壤的照射, 影响了土壤对光照的吸收; 此外, 叶片凋落物的增加和有机养分的积累也成为了导致细菌种群结构变化的推手[29]。这一生态过程受多个参数影响, 包括微生物生物量碳的多寡、呼吸强度的强弱、土壤有机质的丰度等。本实验室前期也通过分析不同修复年限(4年、8年和 10年)根际微生物的小片段重复序列(Short Tandem Repeat, STR), 发现三个不同修复时间的红树林修复区和天然林存在差异, 10年修复林更加接近原生红树林。这些结果表明修复区红树林的根际微生物群落会逐步朝着原生红树林根际微生物群落结构演替, 但这一过程并非简单的加和式线性变化, 而是存在复杂性和年份突变性的可能[12]。本次实验中人工林的种植时间在25年以上, 未呈现人工林与天然林的显著差异, 证明在更长的时间尺度上微生物的组成具有趋同效应, 这或许是共生系统在经历自然选择过程中(营养获取、生态位竞争、自身生存), 应对环境变化、维持生态系统稳定性的适应性表现。如果能获得更长时间的数据, 则有望根据微生物的区系组成评估移栽的效果。当然, 以微生物组成作为 Biomarker来评判移植的效果还需要结合植被种类、气候变化、林地环境等多种因素做综合考虑, 这些系统数据的获得还有待进一步的实验研究和信息收集。
5 结论
基于群落的结构多样性和功能多样性, 微生物在与环境交互的历程中经历了“适应-发展-成熟”的过程, 会逐渐朝着稳定的方向发展。本次实验证实了经长期修复(25林龄)的人工林, 其根部微生物的组成会沿时间尺度与自然林趋同, 但存在少量特异性和差异性的物种。这种差异与“植物-微生物”共生体应对全球变化和区域环境的改变有关, 同时也是适应环境和协同进化的需要。总结本次实验和已有文献的报道, 显示出红树植物在修复条件下其微生物种群差异抑或呈现一个原则: 即“中心明确、边缘模糊”。
[1]COSTANZA R, D'ARGE R, DE GROOT R, et al.The value of the world's ecosystem services and natural capital[J].Ecological Economics, 1998, 1(25): 3–15.
[2]GODOY M D P, LACERDA L D D, GODOY M D P, et al.Mangroves response to climate change: a review of recent findings on mangrove extension and distribution[J].Anais da Academia Brasileira de Ciências, 2015, 87(2): 651–667.
[3]GEDAN K B, SILLIMAN B R.Using facilitation theory to enhance mangrove restoration[J].AMBIO: A Journal of the Human Environment, 2009, 38(2): 109–109.
[4]胡宏友, 陈顺洋, 王文卿, 等.中国红树植物种质资源现状与苗木繁育关键技术[J].应用生态学报, 2012, 23(4):939–946.
[5]KAIRO J G, DAHDOUH-GUEBAS F, BOSIRE J, et al.Restoration and management of mangrove systems-a lesson for and from the East African region[J].South African Journal of Botany, 2001, 67(3): 383–389.
[6]BHARATHKUMAR S, PAUL D, NAIR S.Microbial diversity of culturable heterotrophs in the rhizosphere of salt marsh grass,Porteresia coarctata(Tateoka) in a mangrove ecosystem[J].Journal of Basic Microbiology,2008, 48(1): 10–15.
[7]GOMES N C, CLEARY D F, PINTO F N, et al.Taking root:enduring effect of rhizosphere bacterial colonization in mangroves[J].2010, PloS One, 5(11): e14065.
[8]曹启民, 郑康振, 陈耿, 等.红树林生态系统微生物学研究进展[J].生态环境, 2008, 2: 839–845.
[9]刘玉, 温翠屏, 李艳萍, 等.六种红树植物群落中根际和非根际真菌生态比较研究[J].生态学报, 2015, 35(8):2473–2480.
[10]武钰坤, 刘永军, 司英明, 等.人工湿地不同植物根际微生物群落多样性比较研究[J].生态科学, 2012, 31(3):318–323.
[11]杨琼, 谭凤仪, 吴苑玲, 等.不同林龄海桑林和无瓣海桑林根际微生物特征[J].生态学杂志, 2014, 33(2):296–302.
[12]李庆赟, 殷萌清, 陈淑文, 等.红树林人工修复区根际微生物群落结构分析[J].现代生物医学进展, 2016, 16(8):1401–1405.
[13]郑运.附城红树林生态恢复对土壤主要理化性质与细菌群落结构的影响[D].广东: 广东海洋大学, 2014.
[14]HARTMANN A, SCHMID M, VAN TUINEN D, et al.Plant-driven selection of microbes[J].Plant and Soil, 2009,321(1–2): 235–257.
[15]JIANG X T, PENG X, DENG G H, et al.Illumina sequencing of 16S rRNA tag revealed spatial variations of bacterial communities in a mangrove wetland[J].Microbial Ecology, 2013, 66(1): 96–104.
[16]BULGARELLI D, GARRIDO-OTER R, M NCH P C, et al.Structure and function of the bacterial root microbiota in wild and domesticated barley[J].Cell Host & Microbe,2015, 17(3): 392–403.
[17]尤朝阳, 万玉龙, 刘汤勋.黄菖蒲人工湿地微生物分布特点研究[J].安徽农业科学, 2011, 35: 20233–20235.
[18]SRENSEN J, VAN ELSAS J, TREVORS J, et al.The rhizosphere as a habitat for soil microorganisms[J].Modern Soil Microbiology: 1997, 21–45.
[19]GOMES N C, CLEARY D F, CALADO R, et al.Mangrove bacterial richness[J].Communicative & Integrative Biology,2011, 4(4): 419–423.
[20]TANG Y L, LIN H P, XIE Q Y, et al.Actinoallomurusacanthiterraesp.nov., an actinomycete isolated from rhizosphere soil of the mangrove plantAcanthus ilicifolius[J].International Journal of Systematic and Evolutionary Microbiology, 2013, 63(5): 1874–1879.
[21]项学敏, 宋春霞, 李彦生, 等.湿地植物芦苇和香蒲根际微生物特性研究[J].环境保护科学, 2004, 30(124):35–38.
[22]BULGARELLI D, ROTT M, SCHLAEPPI K, et al.Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota[J].Nature, 2012, 488(7409):91–95.
[23]HOLGUIN G, VAZQUEZ P, BASHAN Y.The role of sediment microorganisms in the productivity, conservation,and rehabilitation of mangrove ecosystems: an overview[J].Biology and Fertility of Soils, 2001, 33(4): 265–278.
[24]BREED R E, GIBANS N E, 伯杰氏细菌鉴定手册[M].1984, 第八版.北京: 科学出版社.
[25]JUNKER R R, THOLL D.Volatile organic compound mediated interactions at the plant-microbe interface[J].Journal of Chemical Ecology, 2013, 39(7): 810–825.
[26]TARAFDAR J,JUNGK A.Phosphatase activity in the rhizosphere and its relation to the depletion of soil organic phosphorus[J].Biology and Fertility of Soils, 1987, 3(4):199–204.
[27]LI M, CAO H, HONG Y, et al.Spatial distribution and abundances of ammonia-oxidizing archaea (AOA) and ammonia-oxidizing bacteria (AOB) in mangrove sediments[J].Applied Microbiology and Biotechnology, 2011, 89(4):1243–1254.
[28]林鹏, 张瑜斌, 邓爱英, 等.九龙江口红树林土壤微生物的类群及抗菌活性[J].海洋学报(中文版), 2005, 3:133–141.
[29]THOMS C, GATTINGER A, JACOB M, et al.Direct and indirect effects of tree diversity drive soil microbial diversity in temperate deciduous forest[J].Soil Biology &Biochemistry, 2010, 42: 1558–1565.
[30]FOTIDIS I A, KARAKASHEV D, ANGELIDAKI I.Bioaugmentation with an acetate-oxidising consortium as a tool to tackle ammonia inhibition of anaerobic digestion[J].Bioresource Technology, 2013, 146(10): 57–62.
Soil microbial community structure in natural and transplanted mangrove(Kandelia obovata) forests
YIN Mengqing1,2, FENG Jianxiang2, HUANG Xiaofang2, CAI Zhonghua2, LIN Guanghui1,2*, ZHOU Jin2,*
1.Center for Earth System Science,Tsinghua University,Beijing100084,China2.Division of Ocean Science and Technology,Graduate School at Shenzhen,Tsinghua University,Shenzhen518055,China
In order to understand the potential ecological adaptation of mangrove plants, the soil and rhizosphere microbial communities were characterized from different mangrove habitats.Samples were collected from mangrove wetlands on the East-Coast of the Leizhou Peninsula, Guangdong Province, China.Environmental genomics approaches, including highthroughput sequencing and OTU analysis, were used to assess the composition and structure of bacteria and archaea in the rhizosphere and surrounding soil of transplanted and native (non-transplanted) plants.The results showed that 27 different bacterial phyla were identified in the soil of transplants and native plants.The dominant bacterial groups were Proteobacteria,Chloroflexi, Acidobacteria, Bacteroidetes, and Deferribacteres.And the dominant archaeal groups were Halobacteria,Thermoplasmata, Methanomicrobia, Methanobacteria, and Methanococci.The largest proportion of the archaeal community was comprised of Halobacteria (70%-90%).The Shannon–Wiener (H) and richness indices (Schao) indicated that the diversity of bacteria was higher than that of archaea and that the biodiversity of the natural samples was larger than that of transplants.Principal component analysis (PCA) showed that the bacteria clustered into two categories: surrounding soil and rhizosphere samples, while the archaea were divided into three groups according their habitats: natural, transplant, and non-mangrove soil samples (from fishponds).This work showed that after several years of ecological restoration, the bacterial communities of the transplanted mangrove samples were similar to those of natural plants.For the rhizosphere microbes, the bacterial community structure was related to the rhizosphere environment and exhibited the rhizosphere-effect to some extent.However, the archaeal community structure appeared to be significantly regulated and shaped by environmental parameters, such as pH, temperature and salinity, etc.
natural forest; transplanted forest; microbial community structure; rhizosphere-effect; archaea;Kandelia obovata
10.14108/j.cnki.1008-8873.2017.05.001
Q938.1
A
1008-8873(2017)05-001-10
殷萌清, 冯建祥, 黄小芳, 等.天然及人工红树林土壤微生物群落结构分析[J].生态科学, 2017, 36(5): 1-10.
YIN Mengqing, FENG Jianxiang, HUANG Xiaofang, et al.Soil microbial community structure in natural and transplanted mangrove(Kandelia obovata) forests[J].Ecological Science, 2017, 36(5): 1-10.
2015-12-23;
2016-01-27
国家海洋局公益性行业科研专项(201305021); 广东省海洋渔业科技与产业发展专项计划(A201503D07); 深圳市科技创新委员会基础研究计划(JCYJ20150529164918736)
殷萌清(1992—), 女, 陕西人, 硕士研究生, 研究方向红树林微生物生态学, E-mail: ymq13@mails.tsinghua.edu.cn
*通信作者:周进(1977—), 男, 副教授, 博士, 从事微生物生态学研究, E-mail: zhou.jin@sz.tsinghua.edu.cn林光辉(1962—), 男, 教授, 博导, 从事湿地生态学研究, E-mail: lingh@mail.tsinghua.edu.cn
