强酸胁迫下大叶相思幼苗抗性生理机制研究
2017-11-10杨舒贻李俊成惠文凯陈晓阳马玲
杨舒贻, 李俊成, 惠文凯, 陈晓阳,*, 马玲,*
1.华南农业大学林学与风景园林学院/亚热带农业生物资源保护与利用国家重点实验室, 广东省森林植物种质创新与利用重点实验室, 广东省木本饲料工程技术研究中心, 农业部能源植物资源与利用重点实验室, 广州 510642 2.北京林业大学生物科学与技术学院/林木育种国家工程实验室, 北京 100083
强酸胁迫下大叶相思幼苗抗性生理机制研究
杨舒贻1, 李俊成1, 惠文凯2, 陈晓阳1,*, 马玲1,*
1.华南农业大学林学与风景园林学院/亚热带农业生物资源保护与利用国家重点实验室, 广东省森林植物种质创新与利用重点实验室, 广东省木本饲料工程技术研究中心, 农业部能源植物资源与利用重点实验室, 广州 510642 2.北京林业大学生物科学与技术学院/林木育种国家工程实验室, 北京 100083
为探讨大叶相思幼苗耐强酸胁迫的生理机制, 试验采用水培法, 设置了pH 3.0、pH 2.0 和pH 5.8 (CK)酸胁迫梯度和3天、9天两个持续胁迫时间, 观测了大叶相思幼苗在不同强度酸胁迫下叶片丙二醛(MDA)含量, 脯氨酸(Pro)含量以及抗氧化酶如过氧化物酶(POD)、谷胱甘肽-S-转移酶(GST)、谷胱甘肽过氧化物酶(GPX)和谷胱甘肽还原酶(GR)等活性的响应特征。结果表明: (1)酸胁迫加重过程中, PSⅡ 最大光化学效率(Fv/Fm)表现出下降趋势; (2)与CK比较, 在pH 3.0胁迫下, Pro无显著变化, 但在pH 2.0持续胁迫下显著上升, 表明当pH 值低至2.0时, 大叶相思幼苗受到严重胁迫; (3)与CK比较, 在pH值为 3.0和 2.0持续3天、9天的胁迫下, MDA含量无显著变化, 表明大叶相思幼苗在极强酸胁迫下膜脂过氧化程度并未显著提高; (4)与CK比较, 在pH 3.0胁迫下GST和GPX活性显著上升, 但在pH 2.0胁迫下无显著变化; 与CK比较, 在pH 3.0胁迫下GR和POD活性无显著差异, 但在pH 2.0胁迫下有所下降, 表明大叶相思幼苗体内不同抗氧化酶在应对不同程度强酸胁迫时表现不同, 其中 GST对强酸胁迫响应最为敏感。综合分析各指标在不同梯度酸胁迫下的变化, 认为大叶相思幼苗耐强酸胁迫的生理调节阈值可能在pH 3.0左右.
大叶相思; 酸胁迫; 抗氧化酶
1 材料与方法
含硫矿采后由于硫的氧化使土壤呈强酸性, 许多植物难以存活, 给矿山修复带来巨大阻力, 因此,筛选和利用耐强酸植物作为修复植物具有重要意义。大叶相思(Acacia auriculiformis)系豆科金合欢属速生乔木树种, 能在多种土质下生长, 是改良土壤的优良树种[1]。前期研究发现, 大叶相思幼苗可在废弃硫铁矿土(pH 3.0)中存活, 存活率≥70%, 通过控制试验发现大叶相思幼苗在pH 2.0基质中表观生长受到严重抑制, 但仍能存活, 并结根瘤, 说明大叶相思幼苗可能具有一套高效缓解由酸胁迫产生的伤害的防御体系, 可用于强酸性矿土修复[2]。
多篇研究指出抗氧化酶活性的高低与植物对环境胁迫的抗性有密切的关系[3,4]。目前国内外对酸胁迫研究多关注的是酸雨胁迫[5,6], 且相对于其他非生物胁迫, 研究基础还比较薄弱, 作用机制仍未明朗。抗氧化酶系统在保护植物免受酸雨伤害中起到了重要的作用也倍受关注, 包括过氧化物酶(Peroxidase,POD)[7]、谷胱甘肽-S-转移酶(Glutathione S- transferases, GST)[8]、谷胱甘肽过氧化物酶(Glutathione Peroxidase, GPX)[9]及谷胱甘肽还原酶(Glutathione Reductase, GR)[10]。Gabara等人的研究指出模拟酸雨胁迫(pH 1.8)诱导番茄GST活性在胁迫3天时达到最大值, 随后大幅降低[11]; Wyrwicka等人的研究表明,pH 3.0酸雨胁迫诱导黄瓜GST活性在胁迫5天时达到最大值, 胁迫7天时下降[12], 可见植物对酸雨胁迫的生理响应存在一定的阈值。王应军等发现木芙蓉对酸雨胁迫的生理响应阈值大致在pH 2.0—pH 3.0[13]。另外, 植物对强酸胁迫及其它非生物胁迫的生理响应是整个机体抗氧化防御体系的综合反应, 除抗氧化酶体系外, 丙二醛(Malondialdehyde, MDA)含量、脯氨酸(Proline, Pro)含量、PSⅡ最大光化学效率(Fv/Fm)等的变化也常用于分析植物对逆境胁迫的生理响应方式。
本研究以大叶相思幼苗为试验材料, 设置不同酸度的胁迫试验, 旨在揭示大叶相思幼苗抗氧化酶系统对不同程度强酸胁迫的响应特征; 探讨不同胁迫时间梯度对大叶相思幼苗响应酸胁迫的相关抗氧化酶变化的影响, 为进一步研究大叶相思幼苗耐强酸胁迫的生理机制提供依据。
2 材料与方法
2.1 试验材料
供试的大叶相思实生苗木为8个月龄苗, 苗高约30 cm。完全洗根后每株独立置于装有Hoagland营养液的塑料杯中, 并固定茎秆使其保持直立, 稳定生长一周后进行试验处理。于2015年5月在广州(全年日照时数1770—1940小时左右)华南农业大学校内通风玻璃温室内自然光下进行试验, 试验期间环境温度10 ℃ —32 ℃, 湿度50%—95%。
2.2 实验处理
以Hoagland营养液原液(pH 5.8)为对照(CK, 不加酸), 另设pH 2.0、pH 3.0两个酸度梯度, 使用H2SO4调节溶液pH; 设3d、9d两个持续处理时间梯度,每个处理3个重复。
2.3 试验方法
应用FluorPen FP100测定不同pH强度和不同胁迫时间下叶绿素荧光参数。于晴天上午9—11点用仪器自带叶夹使叶片暗适应15分钟后测定OJIP曲线,自动输出 PSⅡ的最大光化学效率Fv/Fm值。
于晴朗天上午9点左右取顶端第3或4片完全展开叶, 快速称重后用锡纸包裹放入液氮中保存, 并及时放入-80 ℃超低温冰箱, 待9d样品取样后, 即进行提取实验。
叶片内MDA、Pro含量以及POD、GST、GPX和GR等生理指标使用试剂盒(南京建成生物有限公司, 南京)提取。取-80 ℃冷藏后叶片样品, 加入预冷0.01 mol·LPBS溶液(pH 7.4)研磨(Pro含量测定需加入试剂盒中特定试剂), 制备10%匀浆液。在4 ℃下5000转·分离心20min后取上清液备用。使用紫外分光光度计(PerkinElmer Lambda 25, 美国)测定相应波长下的OD值。MDA含量测定使用TBA法, 测定波长为532 nm[14]; Pro含量测定使用茚三酮法[15]; POD活性测定是利用POD催化过氧化氢反应的原理, 通过测定420 nm处吸光度的变化计算其活性[14]; GST活性的测定是利用GST催化还原型谷胱甘肽(GSH)与1-氯-2, 4-二硝基苯(CDNB)反应的原理, 通过检测GSH的浓度来反映活性(GSH与二硫二代硝基甲苯(DTNB)作用生成稳定的黄色底物,412 nm下测定吸光度值计算GSH的量); GPX活性测定是利用GPX促进H2O2与GSH反应行程H20和GSSG,通过测定酶促反应中GSH的消耗求出GPX活性[16]; GR活性测定利用氧化型谷胱甘肽GSSG在GR催化下, 由NADPH供氢, 使GSSG还原生成GSH, 在340 nm处检测NADPH吸光度值的下降, 通过检测NADPH的改变,计算GR活性。Pro以鲜重质量计算含量, 其他生理指标均以样品蛋白浓度计算。
2.4 数据处理与分析
采用SAS9.0分析统计软件进行显著性检验(t-test); 采用SPSS 9.0分析统计软件进行双因素方差分析; 采用EXCEL绘制相关图表。
3 试验结果
3.1 酸胁迫对大叶相思幼苗叶片 PSⅡ的最大光化学效率(Fv/Fm)的影响
由图1可知, 经持续3天和9天处理后, Fv/Fm均随着酸胁迫强度的增加呈持续下降趋势, 与对照相比, 差异达极显著水平(p<0.01)。

图1 酸胁迫对大叶相思幼苗叶片Fv/Fm的影响Fig.1 Fv/Fm in phylloid of Acacia auriculiformis under strong acid stress
3.2 酸胁迫对大叶相思幼苗叶片MDA含量的影响
由图2可知, 经持续3天和9天处理后, 大叶相思幼苗叶片中MDA含量均随着酸胁迫强度的增加呈先升高后降低趋势, 但差异不显著。双因素方差分析结果显示, 持续胁迫时间对MDA含量影响不显著,酸度与时间尺度交互作用不显著(表1)。
3.3 酸胁迫对大叶相思幼苗叶片pro含量的影响
由图3可以看出, 与CK相比较, 经pH 3.0 胁迫3天和9天后, 大叶相思幼苗叶片中Pro含量均无变化, 而经pH 2.0胁迫后, Pro含量显著增加(p<0.01)。经双因素方差分析, 这两种胁迫时间尺度对Pro含量影响极显著, 酸度与时间尺度的交互作用达到显著水平(表1)。
3.4 酸胁迫对大叶相思幼苗叶片GST活性的影响
由图4可知, 经3天和9天胁迫后, 大叶相思幼苗叶片中GST活性随酸度增加均呈现先升后降趋势,在pH 3.0胁迫下, GST活性最高, 与对照相比, 分别提高了511.76%和673.46%, 差异达到极显著水平(p<0.01); 而在pH 2.0胁迫下, GST活性与对照则无显著差异。经双因素方差分析, 胁迫3天、9天均对GST活性有极显著影响, 酸度与时间尺度交互作用达到显著水平(表1)。
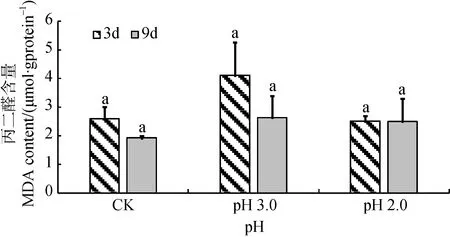
图2 酸胁迫对大叶相思幼苗叶片丙二醛含量的影响Fig.2 MDA content in phylloid of Acacia auriculiformis under strong acid stress

图3 酸胁迫对大叶相思幼苗叶片脯氨酸含量的影响Fig.3 Pro content in phylloid of Acacia auriculiformis under strong acid stress
3.5 酸胁迫对大叶相思幼苗叶片GPX活性的影响
由图5可知, 经3天和9天胁迫处理后, 大叶相思幼苗叶片中GPX活性也随酸度增加均呈现先上升后下降趋势, 但只有9天处理的pH 3.0胁迫强度与CK的差异达到显著水平(p<0.05), 而pH 2.0胁迫强度下与CK 无显著差异。经双因素方差分析, 胁迫3天、9天这两个胁迫时间尺度对GPX活性影响没有达到显著水平, 酸度与时间尺度交互作用也不显著(表1)。
3.6 酸胁迫对大叶相思幼苗叶片GR活性的影响
由图6可知, 经3天和9天胁迫处理后, 大叶相思幼苗在pH 3.0和pH 2.0酸度强度下叶片中GR活性与对照的差异没有达到显著水平。在pH 3.0和pH 2.0酸度胁迫下, 分别达到显著(p<0.05)和极显著差异水平(p<0.01), 9天的处理GR活性明显比3天的高。经方差分析, 胁迫3天、9天这两个胁迫时间尺度对GR活性影响达到极显著水平, 酸度与时间尺度交互作用不显著(表1)。
3.7 酸胁迫对大叶相思幼苗叶片POD活性的影响
根据图7显示, 在胁迫3天时间尺度上, pH 3.0胁迫时大叶相思幼苗叶片中POD活性相与CK无明显差异, 而pH 2.0胁迫时大叶相思幼苗叶片中POD活性明显比CK低; 经 pH 3.0和pH 2.0酸度 9天胁迫处理后, 叶片中POD活性与CK均无显著差异。双因素方差分析显示, 经3天、9天胁迫处理对POD活性影响不显著, 酸度与时间尺度交互作用也不显著(表1)。

图4 酸胁迫对大叶相思幼苗叶片谷胱甘肽-S-转移酶活性的影响Fig.4 GST activity in phylloid of Acacia auriculiformis under strong acid stress
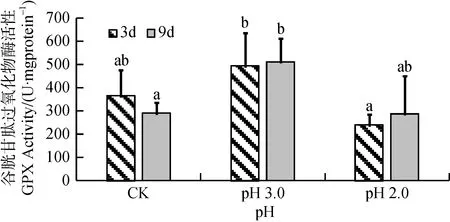
图5 酸胁迫对大叶相思幼苗叶片谷胱甘肽过氧化物酶活性的影响Fig.5 GPX activity in phylloid of Acacia auriculiformis under strong acid stress
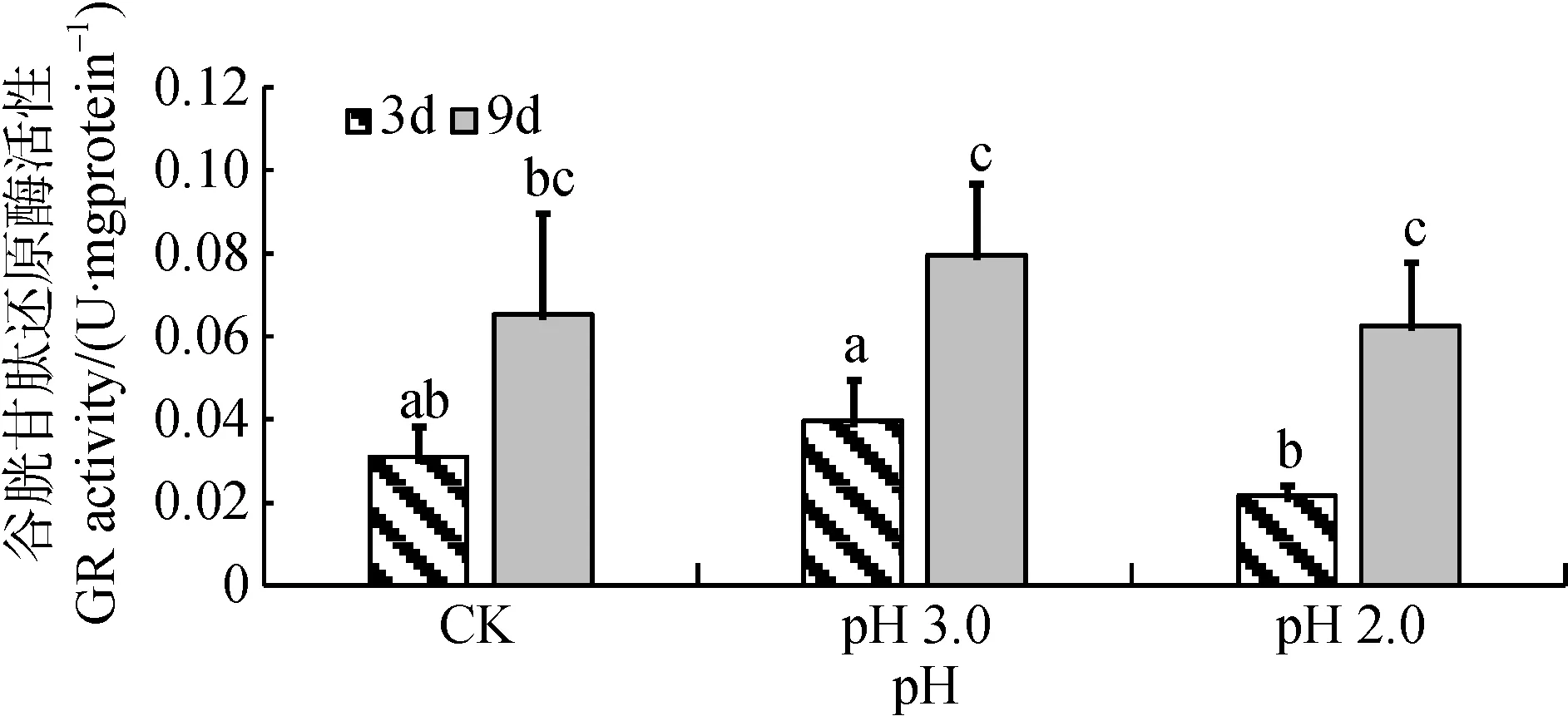
图6 酸胁迫对大叶相思幼苗叶片谷胱甘肽还原酶活性的影响Fig.6 GR activity in phylloid of Acacia auriculiformis under strong acid stress
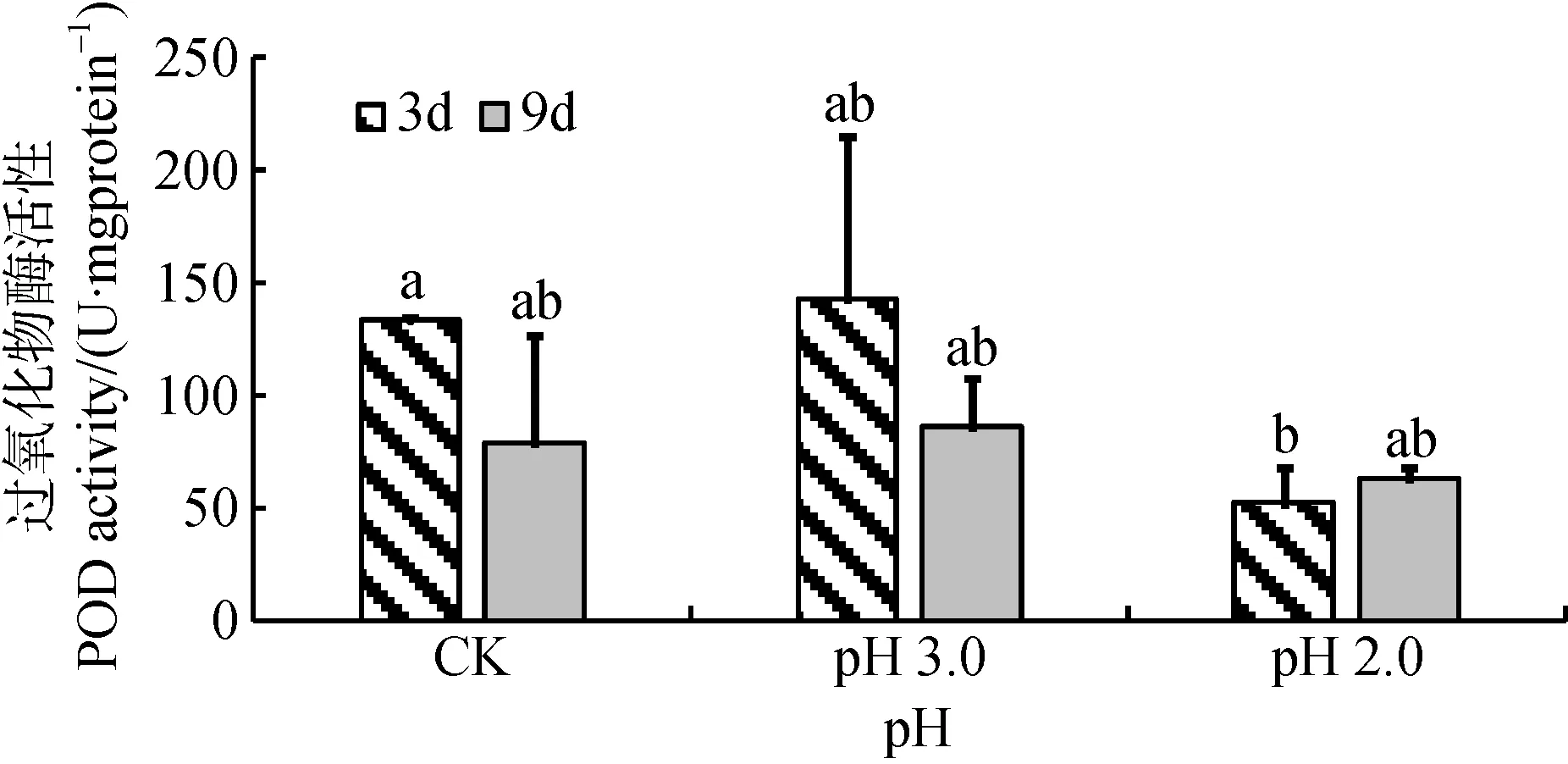
图7 酸胁迫对大叶相思幼苗叶片过氧化物酶活性的影响Fig.7 POD activity in phylloid of Acacia auriculiformis under strong acid stress
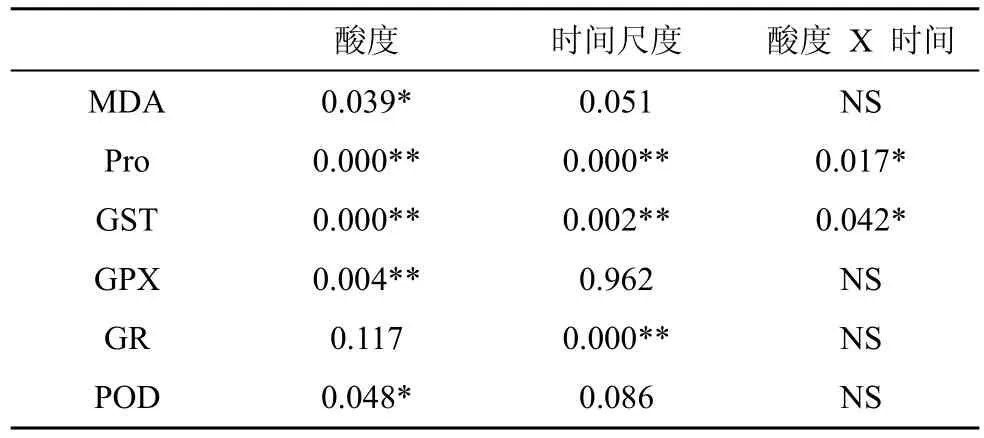
表1 酸度、时间尺度双因素显著性分析表Tab.1 Two-factor analysis between pH and time
4 讨论
大叶相思幼苗受酸毒害的一个重要原因可能是酸胁迫引起体内的氧化胁迫, 胁迫会破坏植物细胞内的稳态环境, 使植物细胞内ROS含量增加。ROS被认为是有氧代谢有毒的副产品[17], 包括单线态氧、超氧阴离子(O2-)、过氧化氢(H2O2)、氢氧根离子(HO-)等。大叶相思幼苗在酸胁迫下, Pro含量以及GST、GPX、GR等抗氧化酶活性发生了变化, 类似的结果也出现在低温[18]、干旱[19]、盐[20]以及高浓度铜[21]等环境胁迫中。说明大叶相思幼苗在酸胁迫下积极启动抗氧化酶防御系统, 通过调节酶活性等方式来阻止、降低、修复因酸胁迫造成的机体损伤, 保证植物可以正常进行生理活动。
叶绿素荧光参数在测定植物光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用[22]。叶绿素荧光分析技术现较多的被应用于探测温度胁迫、干旱胁迫等环境胁迫对植物光合作用的影响过程以及机制研究中[23][24]。Fv/Fm是光合系统II(PSII)的最大光能转换效率, 反映PSII反映中心内禀光能转换效率[25]。本研究中, 经3天和9天胁迫后,Fv/Fm随酸胁迫强度地增强呈逐渐下降趋势, 且与对照相比, 存在极显著差异, 表明在酸胁迫下大叶相思幼苗叶片PSⅡ系统受到了一定程度的损伤。Fv/Fm也是表征健康植物叶片的指标, 植物受到胁迫时, 这一效率值(0.8)就明显下降[26]。本研究中, 经pH 3.0、pH 2.0胁迫后, 该效率值在0.8之下,表明两种酸强度对大叶相思幼苗造成了胁迫。
Pro是水溶性最大的氨基酸(溶解度162.3 g, 25℃), 具有较强水合能力, 生理pH范围内带静电荷,是理想的有机渗透调节物质[27], 逆境胁迫下植株可通过增加Pro含量提高渗透势以缓解胁迫引起的伤害[28]。本试验中, 在 pH 3.0下, 经3天和9天胁迫处理后, Pro含量与对照差异较小; 经pH 2.0处理后,Pro含量大幅增加, 表明大叶相思幼苗在pH 3.0时所受害较轻, 而在pH 2.0时才受害严重 , 且Pro在大叶相思幼苗受到酸胁迫时起了重要的渗透调节作用。此外, 也从生理水平上证明大叶相思幼苗对强酸有较大的耐受性。MDA是细胞脂质过氧化最重要的产物之一。MDA的增加表明质膜损坏的出现。本研究中, 在pH 3.0和pH 2.0酸度下经3天和9天处理后,MDA含量与CK相比均无显著变化。其他环境胁迫,如低温胁迫处理后, 玉米MDA含量也出现了类似变化, 抗冷能力较强的玉米品种(东农250)遭受8 ℃和9℃处理时, MDA含量与对照相比, 差异并不明显,且在胁迫第9天含量仅比对照增加6.53%和4.26%[29]。因此我们推测pH 2.0的强酸对大叶相思幼苗所形成的胁迫可能体现在其他细胞结构或生物大分子受损而非质膜损坏, 但该推断需要在今后进行进一步研究验证。
GPX、GST、GR是与谷胱甘肽密切相关的酶类。有研究指出, GPX活性的提高可以反映植物体高效清除脂质过氧化产物[12]。本试验中, 经pH 3.0胁迫后,大叶相思幼苗叶片中GST和GPX相对于CK均显著升高。可能由于pH 3.0对大叶相思幼苗产生一定程度的氧化胁迫, 进而刺激植物体内ROS大量积累,ROS作为信号因子诱导抗氧化酶活性增强, 以尽量降低氧化胁迫对植物产生的伤害。其中GST活性在pH 3.0胁迫时相对于CK升高幅度最大, 推测GST活性的提高可能对大叶相思幼苗耐酸胁迫具有重要作用。Wyrwicka等研究指出GST对清除由酸雨诱导的黄瓜体内有毒产物具有重要作用, 这与本研究结果相符[12]。经pH 2.0处理后, 大叶相思幼苗GST、GPX、GR活性并未被高效激活, 甚至受到抑制, 可能原因是如此强的酸胁迫已对大叶相思幼苗产生了严重伤害, 破坏植物组织, 造成植物机体代谢紊乱, 使GST、GPX、GR活性无法被激活; 也可能是由于Pro的大量积累, 在降解过程中产生有毒物质, 使植物体内酶活性降低或完全丧失[30,31]。
POD作为活性较高的适应性酶, 能够反映植物生长发育的特点、体内代谢状况以及对外界环境的适应性。在本研究中, 在pH 3.0酸度下经3天和9天胁迫后, 大叶相思幼苗POD活性与对照相比有增强趋势, 但差异不显著; 经pH 2.0处理后POD活性反而受到抑制, 邓红平等人的研究报导了类似结果: 入侵物种土荆芥POD活性随模拟酸雨胁迫的增强呈现先升高后降低的趋势, 在pH 3.5处理后活性达到最高值[32]。说明POD可能并未高效地参与大叶相思幼苗植物体内ROS的清除过程, 对缓解强酸胁迫引起的氧化损伤可能并不是必需的。
大叶相思幼苗GST、GPX、GR、POD等抗氧化酶活性随胁迫强度增强总体呈现先升高后下降趋势,特别是GST活性, 相比对照显著升高, 而脂质过氧化程度并未显著提高, 表明大叶相思幼苗在pH 3.0时能较好的调节自身防御机制以抵抗酸胁迫带来的伤害。综合各生理指标对不同梯度酸胁迫的响应的分析, 同时借鉴肖艳、姜静等人对模拟酸雨胁迫下荔枝、龙眼、芒果、美人蕉等植物生理伤害阈值的确定方法[33,34], 可以推测, 大叶相思幼苗耐强酸胁迫的生理调节阈值在pH 3.0左右。
两个胁迫时间尺度对GST、GR活性和Pro含量影响显著, 而对Fv/Fm、MDA含量、GPX和POD活性的影响较小。胁迫9天时, GST活性相对于胁迫3天显著降低, 而GR活性和Pro含量相对于胁迫3天显著升高。由于本实验是在水培条件下进行, 推测9天时间尺度对大叶相思幼苗生理活动造成轻微水淹胁迫,而GST、GR和Pro对水淹胁迫可能较敏感。有研究发现水淹胁迫会提高无花果幼苗Pro含量[35], 牡丹受到淹水胁迫时GR也表现出类似的响应: 牡丹体内GR活性随着水淹胁迫时间的延长呈现先上升后下降趋势[36]。关于大叶相思幼苗对水淹胁迫的响应有待今后进一步深入研究, 但总体来说本试验中轻微水淹胁迫并未对酸胁迫结果造成不利影响。
5 结论
(1) pH 2.0时大叶相思幼苗受到严重胁迫, pH 3.0时仅受到轻微胁迫。
(2) 大叶相思幼苗体内不同抗氧化酶在应对不同程度强酸胁迫时表现不同, 其中GST对强酸胁迫响应最为敏感。
(3) 大叶相思幼苗耐强酸胁迫的生理调节阈值可能在pH 3.0左右。
本研究的数据为进一步研究酸胁迫下大叶相思幼苗抗氧化酶保护系统的活化以及酸胁迫的作用机理提供了基础框架。
[1]林秀兰.大叶相思人工林木材理化特性及利用方式的研究[J].林业科学, 2002, 38(5): 121–127.
[2]MA Ling, RAO Xingquan, LU Ping, et al.Acid-tolerant plant species screened for rehabilitating acid mine drainage sites[J].Journal of Soils and Sediments, 2015, 15:1104–1112.
[3]SÁNCHEZ RODRÍGUEZ E, RUBIO WILHELMI M D M,BLASCO B, et al.Antioxidant response resides in the shoot in reciprocal grafts of drought-tolerant and droughtsensitive cultivars in tomato under water stress[J].Plant Science, 2012, 188-189(3): 89–96.
[4]HU Longxing, LI Huiying, PANG Huangcheng, et al.Responses of antioxidant gene, protein and enzymes to salinity stress in two genotypes of perennial ryegrass(Lolium perenne) differing in salt tolerance[J].Journal of Plant Physiology, 2012, 169(2): 146–156.
[5]LIU Jixi, ZHOU Guoyi, YANG Chengwei, et al.Responses of chlorophyll fluorescence and xanthophyll cycle in leaves ofSchima superbGardn.&Pinus massonianaLamb.to simulated acid rain at Dinghushan Biosphere Reserve[J].Acta Physiologiae Plantarum, 2007, 29(1): 33–38.
[6]麦博儒.模拟酸雨对农作物生长发育、产量及营养品质的影响[D].南京: 南京信息工程大学, 2008.
[7]郭慧媛, 马元丹, 王丹, 等.模拟酸雨对毛竹叶片抗氧化酶活性及释放绿叶挥发物的影响[J].植物生态学报,2014, 38(8): 896–903.
[8]CHEN Juan, WANG Wenhua, LIU Tingwu, et al.Photosynthetic and antioxidant responses ofLiquidambar formosanaandSchima superbaseedlings to sulfuric-rich and nitric-rich simulated acid rain[J].Plant Physiology and Biochemistry, 2013, 64: 41–51.
[9]WYRWICKA A, SKŁODOWSKA M.Intercompartmental differences between cytosol and mitochondria in their respective antioxidative responses and lipid peroxidation levels in acid rain stress[J].Acta Physiologiae Plantarum,2014, 36(4): 837–848.
[10]LIU Enu, LIU Chiungpin.Effects of simulated acid rain on the antioxidative System inCinnamomum philippinenseSeedlings[J].Water, Air, & Soil Pollution, 2011, 215(1–4):127–135.
[11]GABARA, B, SKŁODOWSKA M, WYRWICKA A, et al.Changes in the ultrastructure of chloroplasts and mitochondria and antioxidant enzyme activity inLycopersicon esculentumMill.leaves sprayed with acid rain[J].Plant Science, 2003, 164(4): 507–516.
[12]WYRWICKA A, SKŁODOWSKA M.Influence of repeated acid rain treatment on antioxidative enzyme activities and on lipid peroxidation in cucumber leaves[J].Environmental and Experimental Botany, 2006, 56(2):198–204.
[13]王应军, 邓仕槐, 姜静, 等.酸雨对木芙蓉幼苗光合作用及抗氧化酶活性的影响[J].核农学报, 2011, 25(3):588–593.
[14]LI Hongxia, XIAO Yu, CAO Lingling, et al.Cerebroside C Increases Tolerance to Chilling Injury and Alters Lipid Composition in Wheat Roots[J].Plos ONE, 2013, 8(9):e73380.
[15]赵世杰, 史国安, 董新纯.植物生理学实验指导[M].北京: 中国农业科学技术出版社, 2002
[16]LEI Liu, YANG Liu, JIE Cui, et al.Oxidative stress induces gastric submucosal arteriolar dysfunction in the elderly[J].World Journal of Gastroenterology, 2013, 19 (48):9439–9446
[17]MITTLER R.Oxidative stress, antioxidants and stress tolerance[J].Trends in Plant Science, 2002, 7(9): 405–410.
[18]王小华, 庄南生.脯氨酸与植物抗寒性的研究进展[J].中国农学通报, 2008, 124(11): 398–402.
[19]UZILDAY B, TURKAN I, SEKMEN A H, et al.Comparison of ROS formation and antioxidant enzymes inCleome gynandra(C4) andCleome spinosa(C3) under drought stress[J].Plant Science, 2012, 182: 59–70.
[20]SEKMEN A H, TURKAN I, TANYOLACZ O, et al.Different antioxidant defense responses to salt stress during germination and vegetative stages of endemic halophyteGypsophila oblanceolataBark[J].Environmental and Experimental Botany, 2012, 77: 63–76.
[21]THOUNAOJAM T C, PANDA P, MAZUMDAR P, et al.Excess copper induced oxidative stress and response of antioxidants in rice[J].Plant Physiology and Biochemistry,2012, 53: 33–39.
[22]裴斌, 张光灿, 张淑勇, 等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报, 2013, 33(5):1386–1396
[23]郭延平, 张良诚, 红双宋, 等.温州蜜柑叶片气体交换和叶绿素荧光对低温的响应[J].植物生理学报, 2000, 26(2):88–94
[24]杨甲定, 赵哈林, 张铜会.黄柳和垂柳的耐热性和耐寒性比较研究[J].植物生态报, 2005, 91(1): 42–47
[25]温国胜, 田海涛, 张明如.叶绿素荧光分析技术在林木培养中的应用[J].2006, 17, (10): 1973–1977
[26]BJÖRKMAN O, DEMMIG B.Photon yield of O2evolution and chlorophyll fluorescence characteristics at 77K among vascular plants of diverse origins[J].Planta,1987, 170 (4): 489–504
[27]DELAUNEY A J, VENNA D S P.Proline biosynthesis and osmoregulation in plants[J].The Plant Journal, 1993, 4(2):215–223.
[28]全先庆, 张渝洁, 单雷, 等.高等植物脯氨酸代谢研究进展[J].生物技术通报, 2007, (1): 14–18.
[29]王瑞, 马凤鸣, 李彩凤, 等.低温胁迫对玉米幼苗脯氨酸、丙二醛及电导率的影响[J].东北农业大学学报, 2008,39(5): 20–23
[30]HELLMANN H, FUNCK D, RENTSCH D, et al.Hypersensitivity of an Arabidopsis sugar signaling mutant toward exogenous proline application[J].Plant Physiology,2000, 123(2): 779–790.
[31]DEUSCHLE K, FUNCK D, HELLMANN H, et al.A nuclear gene encoding Mitochondrial△1-pyrroline-5-carboxylate dehydrogenase and its potential role in protection from proline toxicity[J].The Plant Journal, 2001,27(4): 345–356.
[32]邓红平, 尹灿, 王馨, 等.模拟酸雨对土荆芥生长和抗氧化酶活性的影响[J].西南师范大学学报(自然科学版),36(1): 113–117
[33]肖艳, 黄建昌.13种果树对酸雨抗性的研究[J].果树学报, 2004, 21(3): 191–195
[34]姜静.酸雨胁迫对美人蕉生理生化特性的影响[D].四川:四川农业大学, 2011
[35]齐琳, 马娜, 吴雯雯, 等.无花果品种幼苗淹水胁迫的生理响应与耐涝性评估[J].园艺学报, 2015, 42(7):1273–1284.
[36]王娟.淹水对牡丹生理特性的影响[J].生态学杂志,2015, 34(12): 3341–3347
Study on the physiological mechanism for seedling resistance to strong acid stress in Acacia auriculiformis
YANG Shuyi1, LI Juncheng1, HUI Wenkai2, CHEN Xiaoyang1,*, MA Ling1,*
1.College of Forestry and Landscape Architecture, South China Agricultural University /State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Guangdong Key Laboratory for Innovative Development and Utilization of Forest Plant Germplasm,Guangdong Province Research Center of Woody Forage Engineering Technology,Guangzhou510642,China2.College of Biological Sciences and Technology,Beijing Forestry University/National Engineering Laboratory for Forest Tree Breeding,Beijing100083,China
A hydroponics experiment was set up to investigate the physiological response ofAcacia auriculiformisseedlings to acid stress.The experiment was designed with two levels of acid stresses (pH 2.0 and 3.0), contrast to the control (CK) pH 5.8, and two periods of times in acid stress (3 and 9 days after any treatment).Effects of the acid stress on metabolic products were assessed by measuring the contents of malondialdehyde (MDA) and proline (Pro) and the activities of different antioxidant enzymes in seedling leaves, including the peroxidase (POD), glutathione S-transferases (GST), glutathione peroxidase (GPX) and glutathione reductase(GR).The results showed that the proline content exhibited an insignificant difference under pH 3.0, but a significant increase under pH 2.0 in comparison with the results under control, indicating that the seedling stress was severe under pH 2.0.The MDA content didn’t show any significant difference from that in CK under the stress of either pH 3.0 or pH 2.0, suggesting that membrane lipid was not severely peroxidated under a strong acid stress.Compared with the results in CK, the activities of enzymes GST and GPX significantly increased under pH 3.0, but did not significantly change under pH 2.0.On the contrary, the activities of enzymes GR and POD showed no significant differences under pH 3.0, but significantly decreased under pH 2.0, suggesting distinct responses to the two levels of acid stresses among different antioxidant enzymes.The GST enzyme was most sensitive to a strong acid stress.In general, our observed patterns suggested that the strength of acid stress under pH 3.0 could be a threshold below which the seedlings ofA.auriculiformiswere difficult to adapt in physiological metabolism.
Acacia auriculiformis; acid stress; antioxidant enzymes
10.14108/j.cnki.1008-8873.2017.05.002
Q948.1
A
1008-8873(2017)05-011-07
杨舒贻, 李俊成, 惠文凯, 等.强酸胁迫下大叶相思幼苗抗性生理机制研究[J].生态科学, 2017, 36(5): 11-17.
YANG Shuyi, LI Juncheng, HUI Wenkai, et al.Study on the physiological mechanism for seedling resistance to strong acid stress inAcacia auriculiformis[J].Ecological Science, 2017, 36(5): 11-17.
2016-10-21;
2016-11-22
国家自然科学基金(31600307); 广东省科技计划项目(2015A020209139, 2015B020207002); 中央财政林业示范推广项目[(2015)GDTK-08].
杨舒贻(1991—), 女, 在读硕士, E-mail: zjtzysy@126.com
*通信作者:陈晓阳(1958—), 男, 博士, 教授, 主要从事遗传育种工作, E-mail: xychen@scau.edu.cn马玲(1979—), 女, 博士, 助理研究员, 主要从事植物生理生态学研究, E-mail: maling@scau.edu.cn
