水华初期蓝藻颗粒有机物在不同菌群作用下分解释放营养盐的过程研究
2017-11-10黄亚新张小倩孔繁翔卢亚萍施丽梅
黄亚新, 张小倩 杨 燕 孔繁翔, 卢亚萍 , 施丽梅,
1.南京农业大学生命科学学院, 南京 210095 2.中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008
水华初期蓝藻颗粒有机物在不同菌群作用下分解释放营养盐的过程研究
黄亚新1,2, 张小倩1, 杨 燕1, 孔繁翔2, 卢亚萍1,*, 施丽梅2,*
1.南京农业大学生命科学学院, 南京 210095 2.中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008
蓝藻水华为富营养化湖泊制造了大量有机物,这些藻源有机物的分解影响了水体中的营养盐循环。通过室内模拟附生细菌(A),附生细菌与游离细菌 (AF),及附生细菌与底泥细菌(AS)三个实验组作用下蓝藻颗粒有机物(POM)在黑暗条件下长期(132天)分解过程,监测颗粒态有机碳(POC)、氮(PON)、磷(POP)、硝酸盐(NO3–)、磷酸盐(PO43–)、溶解性有机碳(DOC)等浓度的变化,揭示蓝藻颗粒有机物的分解和营养盐释放规律。结果表明,在整个降解过程中,叶绿素a(Chla)浓度在培养第28天时降低至最低水平,在三个实验组中Chla分解速率随时间的变化而增大,平均分解速率为:(0.15±0.06) mg/(L·d)。而POC,PON,POP的分解大致分为两个阶段,快速分解大都在28天以内,而后为缓慢降解,且分解速率明显低于Chla,平均分解速率分别为(0.03±0.03) mg/(L·d),(0.04±0.05) mg/(L·d),(0.03±0.02) mg/(L·d),且呈现随着时间变化而降低的趋势。三者之间及其在三个实验组之间的分解速率并无显著性差异。A、AF、AS三个实验组中,POC的最大分解量分别为82.30%、81.90%、63.14%;PON的最大分解量分别为92.85%、91.68%、73.27%;POP的最大分解量分别为93.50%、91.25%、70.11%,表明了POC的转化量小于PON和POP,AS实验组中POM的分解量最低,说明了底泥微生物对藻源有机物具有较低的分解量。此外,随着藻源有机物的降解,水体中NO3–、PO43–、DOC的最大值出现在Chla完全降解之后,分别是初始值的2.36倍、2.13倍、2.64倍,说明了藻源颗粒有机物的分解将显著增加水体中的营养盐。
蓝藻水华; 微生物; 分解; 营养盐; 太湖
1 前言
在富营养化水体中,频繁发生的蓝藻水华,成为水体中初级生产力的主要来源,吸收无机营养,制造出大量颗粒有机物,改变了湖泊的营养盐含量和物质循环[1-3]。同时,蓝藻水华堆积腐烂分解会释放大量的可溶性营养盐[4-5],进而显著改变水体中营养盐的形态组成以及含量[6],为细菌、附着生物、大型植物以及浮游植物等提供大量营养[7]。
有研究表明,蓝藻向水体中释放营养盐量会随着蓝藻浓度的升高而升高[8],而在此过程中,微生物起了关键作用。陈伟民[1]等对太湖微囊藻的耗氧降解中发现,微生物能够促进水体中营养盐的循环。对水体中的蓝藻颗粒来说,微生物在水体中主要以附生和游离两种形式存在。蓝藻的胞外产物富含多糖和蛋白质,是细菌聚集的热点[9],能够形成特殊的藻际微生物群落,即附生细菌;另一部分细菌则是在水体中游离存在,藻产生的胞外产物释放到水体中,是游离细菌的主要的碳源之一[10]。除此之外,在浅水湖泊中,由于水体扰动,底泥经常悬浮,因而蓝藻还受到来自底泥微生物的作用[11]。不同的细菌群落组成不同[12-14],影响了对有机物的利用程度和效率,因而藻源有机物在不同的细菌群落作用下的分解过程可能不同。
许多关于蓝藻分解的研究报道表明蓝藻分解释放了大量的营养盐,但是大多数研究是短期的,一般都在30天以内,在叶绿素降为0之前[3,15-17],或者着重于单一来源微生物对蓝藻水华的分解[18],然而,我们观察到在蓝藻叶绿素a降解为0时,仍然有大量的藻碎屑存在于培养体系中。有研究报道有机物的分解是一个长期的过程,一般分为三个阶段,即:快速分解、缓慢降解、不再降解[19]。为了充分探讨藻源颗粒有机物的降解过程,本研究通过室内模拟不同来源菌群对蓝藻水华颗粒有机物的长期分解过程,并分析碳、氮、磷等不同营养物质的动态释放过程,从而深入了解蓝藻分解过程中营养盐的释放规律,为进一步研究蓝藻水华的分解对湖泊营养盐循环的影响奠定基础。
2 材料与方法
2.1 研究区域概况
梅梁湾位于太湖北部,南北长12—17 km,东西宽7—10 km,面积约123.8 km2,紧邻无锡市区,周围有多条污染严重的入湖河流,受到人类活动影响相当明显,是太湖富营养化程度最为严重的区域之一[20],几乎每年都发生严重的蓝藻水华堆积[21-22]。
2.2 材料
2.2.1 样品采集
2014年6月在太湖梅梁湾(31°28'16″N,120°10′20″E)使用25号浮游生物网收集水华发生初期的蓝藻。采用多次漂浮静置的方法去除浮游动物和其他杂质颗粒,用无菌水进行冲洗后作为藻源颗粒有机物。经显微镜检,样品中的蓝藻基本上都是微囊藻,并且以水华微囊藻为优势种。同时使用采水器采集整个水柱,分别用3 μm和0.2 μm滤膜对采集的湖水进行过滤,分别获得含游离细菌的湖水及无菌湖水,用作室内实验培养用水。用柱状采泥器(HYDROBIOS,德国)采集底泥,刮取表层2 cm底泥,作为底泥微生物来源。
2.2.2 实验设计
实验设计如表1,将等量均匀的蓝藻颗粒有机物(POM)分别培养在500 mL的三角烧瓶中,以无菌湖水作为附生菌群(A)实验组、含水体中游离细菌的3 μm过滤湖水作为附生菌和游离菌群(AF)共同作用实验组,以及添加表层底泥的无菌湖水作为附生和底泥菌群(AS)共同作用实验组,三个实验组中分别加入湿重为5 g的蓝藻颗粒作为藻源有机物,A和AS组中分别加入300 mL 0.2 μm过滤湖水,AF实验组中加入300 mL 3 μm过滤湖水,并在AS实验组中加入2 g表层底泥作为底泥菌群的来源。每个实验组设置三个平行,26 ℃避光培养。在培养的第1、7、14、21、28、35、42、72、102、132天进行取样,取样之前将培养体系摇匀,分别过滤在一张GF/C、两张GF/F滤膜(使用前在马弗炉中450 ℃灼烧4 h,并用十万分之一的天平称定质量),每次各取5 mL。其中,GF/C滤膜用于Chla浓度的测定,一张GF/F滤膜用于颗粒态有机磷(POP),另一张GF/F膜用于颗粒态有机氮(PON)和颗粒态有机碳(POC)的测定,所得到的GF/F滤膜滤液稀释一定倍数后用于硝酸盐氮(NO3–)、正磷酸盐(PO4–)、总溶解性有机碳(DOC)的测定。
2.2.3 分析测定的参数
POP使用电感耦合等离子光谱仪(ICP-AES)进行测定(Agilent,美国),而PON和POC经过盐酸熏蒸后将GF/F膜研磨至粉状,使用CN元素分析仪(ALLIANCE,法国)进行测定,硝酸盐氮(NO3-)、正磷酸盐(PO43–)采用SKALAR连续流动分析仪(荷兰)测定。叶绿素a(Chl a) 采用丙酮提取以后,使用日本岛津公司RF-5301型荧光分光光度计进行测定[23]。DOC采用Shimadzu公司DOC-5000A型自动分析仪进行测定。
2.2.4 颗粒态有机物的分解速率和分解量的计算
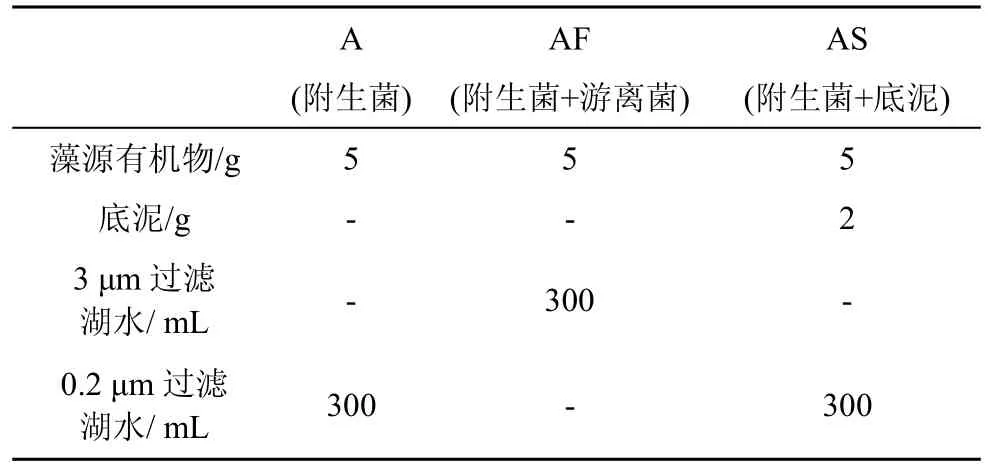
表1 实验设计Tab.1 Experimental design
Chla、POC、PON、POP的分解速率采用Olson指数衰减模型,其公式为:Ct/C0=e-kt[24]。
分解量的计算为:(1-Ct/C0)·100%。其中各式中Ct为分解t时间后剩余的POM中的碳、氮、磷含量,C0为POM中的碳、氮、磷初始含量,t为分解时间,k即为分解速率[17]。
2.2.5 数据处理
数据处理使用Excel和Origin 8.5完成,相关性分析采用SPSS 16.0统计软件完成。
3 结果与分析
3.1 Chla和颗粒态有机物含量的变化过程
图1a中Chla的含量检测结果显示,三个实验组A、AF、AS中Chla的初始浓度均在1700 μg·L-1左右。Chla浓度从加入藻源有机物后呈现一直下降的趋势,在培养第28天时浓度达到最低,此时三个实验组A,AF,AS中叶绿素a分解量分别为99.67%、99.97%和99.67%,之后降为0。
各实验组中POC含量的变化如图1b所示。其中A实验组POC的快速分解主要发生在藻源有机物加入后的前7天,此时的分解量为70.41%,之后一直到实验结束为缓慢分解,分解量为9.85%。AF实验组中POC的含量在整个实验过程中都处于一直下降的状态,到实验结束时,分解量为81.89%。而AS实验组POC的快速分解主要在前28天,分解量为63.14%,之后处于波动状态。在整个实验过程中A,AF,AS三个实验组中POC的最大分解量分别为82.25%、81.89%和63.14%。
各实验组中PON的含量变化如图1c所示,A实验组中PON含量的变化趋势和POC的大致相同,PON的快速分解主要在前7天,此时分解量为82.41%,之后一直到实验结束为缓慢分解,分解量为10.44%。而AF实验组中PON的快速分解主要发生在前28天,分解量为66.79%,之后为缓慢分解,分解量为24.68%。而AS组PON的快速分解主要发生在前28天,分解量为72.75%,之后为缓慢分解,分解量为0.56%。在整个实验过程A,AF,AS三个实验组中PON的最大分解量分别为92.85%、91.68%和73.27%。
各实验组中POP的含量变化如图1d所示,A实验组的POP的快速分解主要发生在前14天,此时分解量为66.88%,之后处于波动下降的状态,分解量为26.62%。而AF和AS实验组POP的快速分解主要发生在前21天,分解量分别为66.29%和70.11%。之后AF实验组波动下降,此期间分解量为26.62%,而AS实验组则波动增加的趋势。在整个实验过程A,AF,AS,三个实验组中POP的最大分解量分别为93.50%、91.25%和70.11%。

图1 实验组A、AF、AS中Chl a和颗粒态有机C、N、P的浓度变化Fig.1 Changes in concentration of Chla, POC, PON and POP in the experimental group A, AF and AS
综上所述,三个实验组中POC的分解量明显小于PON和POP (p<0.05)。而且AS组中POC、PON、POP的分解量
组中POC与PON的比值变化范围为:6.34—17.50,且比值都随着时间的增加逐渐增大。
3.2 有机物分解速率的变化
三个实验组中Chla分解速率的变化与POM的分解速率呈现相反的变化趋势(图2a-d),其中Chla的分解速率呈现逐渐增大的趋势,而POC、PON、PP都呈现波动下降的趋势。总体来说,Chla分解速率的范围在0.057—0.285 mg/(L·d) (图2a),平均为(0.15±0.06) mg/(L·d)(图2e),而POC、PON、POP的分解速率变化范围分别为0.010—0.174 mg/(L·d);0.018—0.248 mg/(L·d);0.008—0.093 mg/(L·d),平均分解速率分别为(0.03±0.03) mg/(L·d),(0.04±0.05) mg/(L·d),(0.03±0.02)mg/(L·d)。表明Chla的分解速率明显高于POC、PON、POP(p<0.05),而POC、PON、PP的分解速率之间无显著性差异(p>0.05)(图2e)。此外,对于Chla和POP的分解速率三个实验组无明显差异(图2a,2d)。但是对于POC,PON,A实验组分别在前21天和前72天具有比其他两组更高的分解速率(图2b,2c)。
3.3 各实验组中NO3–、PO43–和 DOC含量的变化
在实验体系中刚加入蓝藻,就有NO3-的释放产生(图3a),并且在Chla降为0之后,仍然有营养盐的释放。A实验组和AF实验组的NO3-的含量在蓝藻颗粒加入的前28天之内增长缓慢,在第35天增加到最大,分别是初始值的2.27倍和2.36倍,平均增长速率分别为0.707 mg/(L·d)和0.564 mg/(L·d);AS实验组NO3–的释放最大值在实验初始时,然后一直呈现下降的趋势。
PO43–的变化趋势与NO3-相似,A实验组和AF实验组都经过了先增加后减少的过程,并且在加入蓝藻的第35天后达到最大值,分别是初始值的1.32倍和2.13倍,平均增长速率分别为0.018 mg/(L·d)和0.068 mg/(L·d)(图3b),AS组则是缓慢下降的过程。

图2 有机物分解速率的变化及差异Fig.2 Changes and differences in the decomposition rate of organic matter
水体中DOC的变化过程如图3c所示,可以看出,蓝藻颗粒有机物的分解释放有机碳,使得水体中DOC增加,在Chla分解为0的一周后(即第35天)达到峰值,A和AF实验组的分解量显著大于AS实验组(P<0.05)。A和AF实验组的DOC的变化趋势是先增加然后波动减少,并且在第35天时达到最大,分别是初始值的2.64倍、2.60倍,且平均增长速率分别为0.669 mg/(L·d)和、0.677 mg/(L·d),AS实验组的DOC在前35天是缓慢增加,且最大值是初始值的1.64倍,其平均增长速率为0.284 mg/(L·d),而35天后AS实验组DOC含量迅速减少到低于仪器检测限。
综上所述,在实验结束时,A、AF实验组的营养盐和DOC含量仍然较高,而AS实验组的营养盐和DOC呈现一直下降的趋势。
4 讨论
4.1 有机物含量的变化
本实验模拟了在黑暗条件下湖泊中蓝藻降解的过程。在湖泊中,蓝藻是颗粒有机物的主要来源。大量的蓝藻堆积对湖泊中有机物做出重要贡献,同时它的降解影响了湖泊中C、N、P元素的循环。在黑暗降解过程中Chla的含量不断减少,说明藻细胞逐渐裂解死亡[25-26]。随着培养时间的增加,藻类会死亡裂解成大量的颗粒态物质和碎屑,其中有机物会在微生物的作用下被分解形成有机碳和营养盐物质进入水体中[1]。但是在Chla分解为0之后,仍然有大量的蓝藻碎屑存在于培养体系中,说明蓝藻残体对水体中颗粒有机物仍然有很大的贡献。
实验表明三个实验组中POC的分解量均小于PON和POP,同时随着降解进行,有机物的C/N比值升高。实验初始时,各实验组中C/N为6.5左右,说明蛋白含量较高[17],而蛋白质是PON的主要组成部分;P元素主要存在于生物活性物质中[27],二者都易分解,同时在分解前期,易分解部分会迅速降解[28],在对海洋中颗粒态有机物的降解过程的研究中发现易降解有机物所占比例会随着降解时间的增加而逐渐降低[29]。C元素是蓝藻细胞壁所含纤维素的主要组成元素[25],有研究表明,纤维素较难分解[30],所以导致C/N值升高。植物残体的分解量受到C/N等因素的影响[31],当C/N比值越高,分解量越低[32]。A,AF实验组中的POM的分解量无明显差异,而AS实验组中POM的分解量低于其他两组,一方面可能由于所添加的底泥自身惰性有机物的存在,另一方面由于加入底泥菌群高效的吸收利用了溶解态营养盐以及DOC转化成了颗粒有机物,从而使得颗粒有机物的分解量减少。

图3 实验组A、AF、AS中硝酸盐、正磷酸盐和总溶解态碳的含量变化Fig.3 Changes in the concentration of NO3-, PO43- and DOC in the experimental group of A, AF, AS
总起来讲,藻源颗粒有机物的分解如同其他有机物一样,分为快速降解和慢速降解阶段[19],即蓝藻在短期快速降解之后,随后存在一个缓慢降解阶段。前者蓝藻的分解量占75%左右,与前人报道相似[18],后者蓝藻的分解量占15%左右。同时实验结果也表明了藻源有机物并不能完全被降解,尤其在底泥中存在时,会有部分藻源有机物的残留,从而影响了湖泊中有机物的存储。
4.2 有机物降解速率的变化
在本实验中,在Chla的降解过程中速率变化发现,随着时间的变化,Chla的分解速率是逐渐增大的,且不同实验组中具有相似的分解速率,有研究表明,Chla在有氧条件的分解会逐渐加快[34]。本文研究结果表明POM的分解速率都在0.008—0.248 mg/(L·d)之间,与前人报道相似[35-36]。水生高等植物的分解通常需要半个月到一年的时间,蓝藻来源颗粒有机物的循环速率与之相比较高[35-36],一方面,浮游藻类与高等水生植物相比有着更小的体积,增加了微生物与之接触面积;另一方面浮游藻类的化学组成有关,有研究表明有机物中N元素含量越高,分解速率越快[28,37]。实际上在蓝藻避光培养的同时,细菌对蓝藻颗粒有机物的分解随即开始。有研究表明,在相差显微镜下连续观察裂解过程,细菌和藻的密切接触是裂解所必须的[38]。在藻源有机物刚加入时,由于微囊藻伪空泡作用,藻源有机物悬浮于水体表层,所以蓝藻最先受到蓝藻附生菌群的作用,对于分解程度的不同可能是由于细菌对于藻体的接触程度不同造成的。另外,附生菌群具有比其他菌群更强的利用能力和活力[39],因而在实验刚开始时,POC、PON在A实验组具有较高的分解速率。随着分解的继续进行,各实验组之间的分解速率趋于相似。可能是由于附生菌与其他菌群之间存在相互转换[40],因而无差异。
4.3 有机物降解过程中营养盐的释放
在藻型湖泊中,浮游藻类是初级生产力的主要来源,并且能够利用水体中的营养盐,同时,在浮游藻类大量堆积过程中发生降解,并向水体中释放大量的营养盐,参与水体中营养盐的循环,藻细胞在微生物的作用下裂解,蓝藻来源有机物中PON分解形成NO3-[21,41-42],POP转化成溶解态磷[22],同时POC的分解引起了DOC的显著升高[43-44],表明了蓝藻颗粒有机物对NO3-、PO43-、DOC的贡献。另外在实验后期,AS组中营养盐和DOC出现了明显的下降,表明了底泥菌群对营养盐的利用和吸附[33,45-46],与该组中的蓝藻颗粒有机物仍然具有较高水平相对应,说明了AS实验组中添加的底泥影响了有机物的转化,从而为底泥中颗粒有机物的埋藏提供了一定的支撑。
5 结论
在蓝藻来源有机物中的降解过程中,Chla相对于POM具有较快的分解速率,并可以完全降解至0。POC、PON与POP三者间的分解速率无明显差异,而且三个实验组中C/N值会随着降解进行而升高。经过快速和缓慢降解之后体系中会残留10%左右的有机物不能被降解。同时各实验组中POC的分解量明显低于PON和POP,而且加入底泥的实验组中,POM的分解量明显低于其他只有附生细菌和附生细菌游离细菌共同作用的两个实验组,说明了相对于PON、POP来说,会有较多的POC留存在了体系中,而底泥的存在会影响了颗粒有机物的分解。
在整个降解过程中蓝藻颗粒有机物释放的NO3-,PO43-和DOC都在第35天即Chla降为0之后达到最大值,远高于初始湖水水平,而后维持与初始值相似的水平,说明蓝藻颗粒有机物降解可以很快释放氮磷营养盐和DOC,并随着降解的进行逐渐升高,从而显著增加水体中的营养盐含量。
致谢:周建协助样品采集及预处理,特此致谢!
[1]陈伟民, 蔡后建.微生物对太湖微囊藻的好氧降解研究[J].湖泊科学, 1996, 8(3): 248–252.
[2]史红星, 刘会娟, 曲久辉, 等.富营养化水体中微囊藻细胞碎屑对氨氮的吸附特性.环境化学[J], 2005,24(3): 241–244.
[3]孙小静, 秦伯强, 朱广伟.蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放[J].中国环境科学, 2007 ,27(3): 341–345.
[4]KRIVTSON V, BELLINGER E G, SIGGE D C.Elemental composition ofMicrocystis aeruginosaunder conditions of lake nutrient depletion[J].Aquatic Ecology, 2005, 39(2):123–134.
[5]姜霞, 钟立香, 王书航, 等.巢湖水华暴发期水沉积物界面溶解性氮形态的变化[J].中国环境科学, 2009, 29(11):1158–1163.
[6]NAKAMURA Y, WATANABE M M, Growth characteristics ofChattonella antique.Part 2.Effects of Nutrients on Growth[J].Journal of the Oceanographical Society of Japan, 1983, 39(4): 151–155.
[7]马喆, 王勤, 肖琳, 等.附生细菌在微囊藻(Microcystis)藻华颗粒上的定殖和生长[J].农业环境科学学报, 2007,26(5): 1894–1897.
[8]陈丙法, 冯慕华, 尚丽霞, 等.秋季聚积蓝藻打捞对蓝藻生长及水质影响的原位实验[J].湖泊科学, 2016, 28(2):253–262.
[9]SHI L, CAI Y, KONG F, et al.Specific association between bacteria and buoyantMicrocystiscolonies compared with other bulk bacterial communities in the eutrophic Lake Taihu, China[J].Environmental Microbiology Reports,2012, 4(6): 669–678.
[10]WORM J, SONDERGAADRD M.Dynamics of heterotrophic bacteria attached toMicrocystisspp.(Cyanobacteria)[J].Aquatic Microbial Ecology, 1998,14(1): 19–28.
[11]孙芳, 郑忠明, 陆开宏, 等.底泥微生物活性对蓝藻水华水柱及沉积物间隙水氮磷分布的影响[J].生态科学,2011, 30(3): 217–222.
[12]BRUNBERG A K.Contribution of bacteria in the mucilage of Microcystis spp.(Cyanobacteria) to benthic and pelagic bacterial production in a hypereutrophic lake[J].FEMS Microbiology Ecology, 1999, 29(1): 13–22.
[13]SHI L, CAI Y, WANG X, et al.Community structure of bacteria associated with Microcystis colonies from cyanobacterial blooms[J].Journal of Freshwater Ecology,2010, 25(2): 193–203.
[14]叶文瑾.太湖营养化水体和底泥中微生物群落的分子生态学研究[D].上海: 上海交通大学, 2009.
[15]冯胜, 刘义, 余广彬.微生物作用下的微囊藻降解试验研究[J].现代农业科技, 2009, 1(1): 253–255.
[16]朱梦圆, 朱广伟, 王永平.太湖蓝藻水华衰亡对沉积物氮、磷释放的影响[J].环境科学, 2011, 32(2): 409–415.
[17]李柯, 关保华, 刘正文.蓝藻碎屑分解速率及氮磷释放形态的实验分析[J].湖泊科学, 2011, 23(6): 919–925.
[18]孙远军.淀山湖蓝藻碎屑的好氧降解和营养盐释放规律研究[J].中国环境科学, 2013, 33(11): 2047–2052.
[19]JIAO L, ZHANG L, WANG X, et al.Narrow graphene nanoribbons from carbon nanotubes[J].Nature, 2009,458(7240): 877–880.
[20]QIN B Q, HU W P, CHEN W M.Process and mechanism of environmental changes of the Taihu Lake[M].Beijing:Science Press, 2004.
[21]高香玉, 崔益斌, 胡长伟, 等.太湖梅梁湾 2008年有机污染物检测及环境影响度[J].中国环境科学, 2009,29(12): 1296–1300.
[22]陈鸣, 陆卫鲜, 郁建桥, 等.太湖梅梁湾水污染及蓝藻分析计算[J].河海大学学报(自然科学版), 2010, 38(6):634–638.
[23]刘霞.太湖蓝藻水华中长期动态及其与相关环境因子的研究[D].武汉:华中科技大学, 2012.
[24]OLSON J S.Energy storage and the balance of producers and decomposers in ecological systems[J].Ecology, 1963,44(2): 322–331.
[25]ZHANG Y, VAN Dijk M A, LIU M, et al.The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: field and experimental evidence[J].Water Research, 2009,43(18): 4685–4697.
[26]翟中和, 王喜忠, 丁明孝.细胞生物学[M].北京:高等教育出版社, 2000.
[27]李文朝, 陈开宁, 吴庆龙, 等.东太湖水生植物生物质腐烂分解实验[J].湖泊科学, 2001, 13(4): 331–336.
[28]BATTLE J M, MIHUC T B.Decomposition dynamics of aquatic macrophytes in the lower Atchafalaya, a large flood plain river[J].Hydrobiologia, 2000, 418: 123–136.
[29]MAGEN C, CHAILLOU G L, Crowe S A, et al.Origin and fate of particulate organic matter in the southern Beaufort Sea–Amundsen Gulf region, Canadian Arctic [J].Estuarine Coastal & Shelf Science, 2010, 86(1): 31–41.
[30]代静玉, 秦淑平, 周江敏.水杉凋落物分解过程中溶解性有机质的分组组成变化[J].生态环境, 2004, 13(2):207–210.
[31]BARGALI S S, SHUKLA K, SINGH L, et al.Leaf litter decomposition and nutrient dynamics in four tree species of dry deciduous forest[J].Tropical Ecology, 2015, 56(2):191–200.
[32]陈书秀, 江明喜.三峡地区香溪河流域不同树种叶片凋落物的分解[J].生态学报, 2006, 26(9): 2905–2912.
[33]FISCHER H, SACHSE A, STEINBERG C E W, et al.Differential retention and utilization of dissolved organic carbon by bacteria in river sediments[J].Limnology and Oceanography, 2002, 47(6): 1702–1711 .
[34]FALLON R D, BROCK T D.Decomposition of blue-green algal (cyanobacterial) blooms in Lake Mendota,Wisconsin[J].Applied and Environmental Microbiology,1979, 37(5): 820–830.
[35]潘慧云, 徐小花, 高士祥.沉水植物衰亡过程中营养盐的释放过程及规律[J].环境科学研究, 2008, 21(1):64–68.
[36]MENÉNDEZ M, MARTINEZ M, HERNÁNDEZ O et al.Comparison of leaf decomposition in two mediterranean rivers: a large eutrophic river and an oligotrophic stream( S Catalonia, NE Spain)[J].International Review of Hydrobiology, 2001, 86(4/5): 475–486.
[37]ANDERSON J T, SMITH L M.The effects of flooding regimes on decomposition of Polygonum pensylvanicum in the playa wetlands(Southern Great Plains, USA)[J].Aquatic Botany, 2002, 74: 97–108.
[38]王君洁.溶藻细菌和溶藻粘细菌的分离及溶藻效果研究[D].武汉: 华中师范大学, 2007.
[39]CASAMATTA D A, WICKSTROM C E.Sensitivity of two disjunct bacterioplankton communities to exudates from the cyanobacteriumMicrocystisaeruginosaKützing[J].Microbial Ecology, 2000, 40(1): 64–73.
[40]TANG X, Li L, SHAO K, et al.Pyrosequencing analysis of free-living and attached bacterial communities in Meiliang Bay, Lake Taihu, a large eutrophic shallow lake in China[J].Canadian Journal of Microbiology, 2014, 61(1): 22–31.
[41]曾巾, 杨柳燕, 肖琳, 等.湖泊氮素生物地球化学循环及微生物的作用[J].湖泊科学, 2007, 19(4): 382–389.
[42]贺纪正, 张丽梅.氨氧化微生物生态学与氮循环研究进展[J].生态学报, 2009, 29(1): 406–415.
[43]GHIGLIONE J F, MEVEL G, PUJO–PAY M, et al.Diel and seasonal variations in abundance, activity, and community structure of particle-attached and free-living bacteria in NW Mediterranean Sea[J].Microbial Ecology,2007, 54(2): 217–231.
[44]UNCLES R J, FRICKERS P E, EASTON A E, et al.Concentrations of suspended particulate organic carbon in the tidal Yorkshire Ouse River and Humber Estuary[J].Science of the Total Environment, 2000, 251(2000):233–242.
[45]朱永青.淀山湖底泥氮磷营养盐释放及其影响因素研究[J].环境污染与防治, 2014, 36(5): 70–77.
[46]汪家权, 孙亚敏, 钱家忠, 等.巢湖底泥磷的释放模拟实验研究[J].环境科学学报, 2002, 22(6): 738–742.
Processes of nutrients release from particulate organic matter derived from cyanobacterial blooms in early stage by different microflora
HUANG Yaxin1,2, ZHANG Xiaoqian1, YANG Yan1, KONG Fanxiang2, LU Yaping1,*, SHI Limei2,*
1.College of Life Sciences,Nanjing Agricultural University,Nanjing210095,China2.State Key Laboratory of Lake Science and Environment,Nanjing Institute of Geography and Limnology,Chinese Academy of Sciences,Nanjing210008,China
Cyanobacterial blooms introduce plenty of organic matters to eutrophic lakes, and degradation of these organic matters greatly affects the circulation of nutrients in the water body.In this study, a long-term (132 days) degradation process of particulate organic matter (POM) derived from bloom-forming cyanobacteria was simulated under dark conditions in laboratory.The contribution of three bacterial communities to the processes, including cyanobacteria attached bacteria (A), combined effect of attached bacteria and free living bacteria (AF), and combined effect of attached bacteria and sediment bacteria (AS), were investigated.Changes in concentrations of particulate organic carbon (POC), particulate organic nitrogen (PON), particulate organic phosphorus (POP), nitrate(NO3-), phosphate (PO43-) and dissolved organic carbon (DOC) were monitored to reveal the pattern of POM decomposition and nutrient release.The results showed that during the entire degradation process, the concentration of Chla reduced below detection at the 28thday.Decomposition rate of Chla increased with time in all the three experimental groups, with an average of (0.15±0.06)mg/(L·d).However, the decomposition of POC, PON and POP roughly divided into two phases including the rapid decomposition stage mostly within 28 days, and then the slow decomposition phase.The average decomposition rate of POC, PON and POP decreased during the entire process, and was (0.03±0.03) mg/(L·d), (0.04±0.05) mg/(L·d) and (0.03±0.02) mg/(L·d), respectively.They were not significantly different from each treatment, and also not different among the three experimental groups.The maximum release amount of POC in the three experimental groups A, AF, AS was 82.30%, 81.90% and 63.14%; that of PON was 92.85%,91.68% and 73.27%; and that of PP was: 93.50%, 91.25% and 70.11% respectively.It indicated that the AS experimental group had the lowest POM release, and the amount of POC release was less than PON and POP.These results illustrated that sediment bacteria might contribute more to POM degradation.In addition, along with degradation of the organic matter, the maximum value of NO3-,PO43-, DOC in water was 2.36, 2.13 and 2.64 times of their initial value, respectively.It indicated the algal derived POM could be quickly converted into nutrients, which could be resupplied for the growth of cyanobacteria.
cyanobacterial blooms; microflora; biodegradation; nutrient recycle; Lake Taihu
10.14108/j.cnki.1008-8873.2017.05.008
X524
A
1008-8873(2017)05-055-09
黄亚新, 张小倩, 杨燕, 等.水华初期蓝藻颗粒有机物在不同菌群作用下分解释放营养盐的过程研究[J].生态科学, 2017,36(5): 55-63.
HUANG Yaxin, ZHANG Xiaoqian, YANG Yan, et al.Processes of nutrients release from particulate organic matter derived from cyanobacterial blooms in early stage by different microflora[J].Ecological Science, 2017, 36(5): 55-63.
2016-04-19;
2016-05-21
江苏省自然科学基金项目(BK20131466), 国家自然科学基金项目(31370509)
黄亚新 (1989–), 男, 硕士研究生, E-mail:15150565871@163.com
*通信作者:E-mail: lyphwq@njau.edu.cn; lmshi@niglas.ac.cn
