自由基催化炔酸酯环化制备香豆素类化合物的研究进展
2017-11-10陈露露王彦波陈丹云付记亚朱俊彦
陈露露,陈 沛,王彦波,陈丹云,付记亚,朱俊彦
(河南大学 化学化工学院,河南 开封 475004)
自由基催化炔酸酯环化制备香豆素类化合物的研究进展
陈露露,陈 沛,王彦波*,陈丹云,付记亚,朱俊彦
(河南大学 化学化工学院,河南 开封 475004)
香豆素及其衍生物是一类重要的含氧杂环化合物,在香料、食品、医药、农药、光电材料及超分子识别等诸多领域应用广泛,因此香豆素类化合物的合成研究已引起人们的极大关注,本文基于近几年报道的自由基促进炔酸酯环化合成香豆素类化合物的研究进展进行了简要综述.
香豆素;自由基;炔酸酯;环化反应
苯并吡喃酮构建的香豆素类化合物是一类重要芳香氧杂环化合物,该类化合物因其独特的结构而广泛应用于食品、医药、农药、材料科学、香料及超分子识别等领域[1],特别是在抗癌、抗菌、抗炎、抗HIV及抗凝血等方面具有重要作用(图1). 目前香豆素类化合物的合成方法集中于邻羟基苯醛类化合物的环化反应[2-3]、苯酚类化合物的环化反应[4]、炔酸酯类化合物的环化反应[5]以及香豆素母体与活性分子偶联反应[6]. 值得注意的是,近几年不同课题组分别报道了通过自由基引发合成香豆素类化合物的研究,该类方法具有操作简单、高活性、高适用性和区域选择性等诸多优势,为目标分子的制备提供了一种高效实用的方法,已成为目前制备该类化合物的研究热点. 本文依据自由基引发该反应的类型不同,以碳自由基、硫自由基及其他自由基(膦自由基、卤素自由基和硒基自由基等)作为自由基来源,简要综述与讨论以上自由基促进炔酸酯环化制备香豆素类化合物的研究进展,并对反应机理进行了归纳与总结.
众所周知,引发产生自由基方法众多:如可见光诱导法、过氧化物诱导法,热诱导法和辐射诱导法等,本文主要讨论前两种诱导产生自由基的方法. 此外,由于自由基参与的反应具有较高反应活性,常被人们用于有机合成中. 自由基对底物炔酸酯的三键进行加成而产生相应的烯基自由基,该烯基自由基能和苯环的π电子体系发生环化反应以制备不同功能化香豆素类化合物.
1 碳自由基催化合成香豆素类化合物
1.1 可见光引发碳自由基
由二氟亚甲基结构单元构建的化合物广泛应用于医药和材料科学领域,如何有效地向分子中引人-CF2-结构单元成为科研工作者重要研究课题之一[7]. 2015年,FU课题组[8]报道了一种向香豆素类化合物3位引入二氟亚甲基的新方法:在过渡金属配合物fac-Ir(ppy)3、可见光和无机碱碳酸钾作用下二氟溴乙酸乙酯转化为二氟乙酸乙酯自由基,该自由基能够催化不同功能化炔酸酯环化以制备相应的香豆素类化合物(图2). 此外,作者尝试使用一氟溴乙酸乙酯和二氟溴磷酸酯作为底物时,该环化反应不能进行.
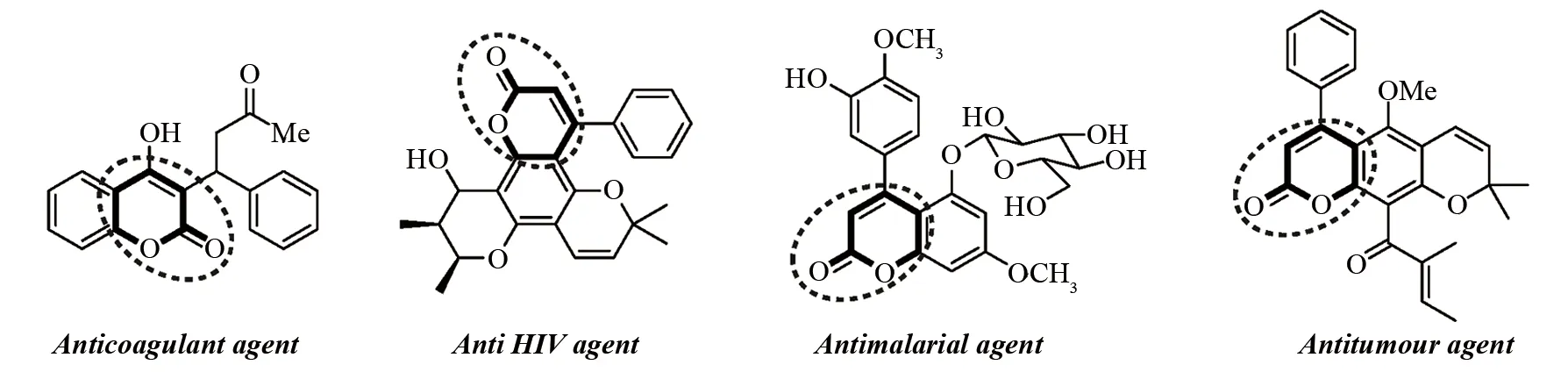
图1 几种含有香豆素结构片段具有生理活性的药物代表Fig.1 Some representative bioactive agents containing the coumarin motif
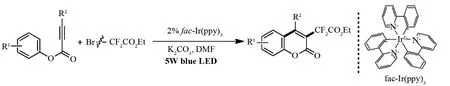
图2 可见光引发二氟溴乙酸乙酯与炔酸酯反应制备3-二氟乙酸乙酯功能化香豆素类化合物Fig.2 Visible-light-mediated cyclization of alkynoates with ethyl bromodifluoroacetate for the synthesis of 3-difluoroacetylated coumarins
氧邻位sp3杂化的C-H键通常需要过渡金属在高温(110~120 ℃)条件下才能产生相应的碳自由基[9-10],然而2016年XIE课题组报道了在温和条件下得到邻氧碳自由基:通过金属配合物Ru(bpy)3Cl2、t-BuOOH和可见光作用,使醚类产生邻氧碳自由基,该自由基可以中到高产率引发不同炔酸酯转化为相应的香豆素类化合物[11](图3). 研究表明:当醚类氧原子邻位含有两个化学环境不同sp3杂化的C-H键时,该产物的选择性较差.

图3 可见光促进醚与炔酸酯的环化反应Fig.3 Cyclization reaction of ether with alkynoates promoted by visible-light
1.2 过氧化物引发碳自由基
将三氟甲基官能团引入有机分子中通常可以改善该分子的物理、化学和生物性能[12],特别是三氟甲基功能化的香豆素类化合物可以用于抗癌剂,荧光标记物,光学分子传感器和聚合物波长调节剂等方面[13]. 之前文献报道的三氟甲基功能化香豆素类化合物主要集中在4位,而3位三氟甲基功能化还未有报道. 基于此,2014年,DING课题组[14]考察了铜盐在温和条件下催化不同三氟甲基试剂与炔酸酯的环化反应. 研究结果表明:一代Togni试剂的活性高于二代Togni试剂和Umemoto试剂,在一代Togni试剂作用下可以顺利制备3-三氟甲基功能化香豆素类化合物(图 4).

图4 铜催化炔酸酯的三氟甲基化以构建三氟甲基功能化的香豆素类化合物Fig.4 Copper-catalyzed trifluoromethylation of alkynoates for construction of trifluoromethylated coumarins
3-酰基香豆素类化合物具有重要的生物活性[15-16],如:抗氧化剂、单胺氧化酶(MAO)抑制剂,抗疟药,抗肿瘤药和抗炎药. 基于该类化合物的重要性,通过酰基自由基引发炔酸酯环化反应以制备3-酰基香豆素类化合物得到了较大应用. WU课题组[17]在2014年使用四丁基溴化铵和过硫酸钾引发芳香醛或脂肪醛产生酰基自由基,该酰基自由基可以催化不同功能化炔酸酯的环化以制备3-酰基香豆素类化合物(图5). 随后,2015年YANG和DING课题组[18-19]分别报道了银盐在过硫酸钾作用下催化α-酮酸与炔酸酯的脱羧与环化串联反应制备3-酰基功能化香豆素类化合物 (图6).
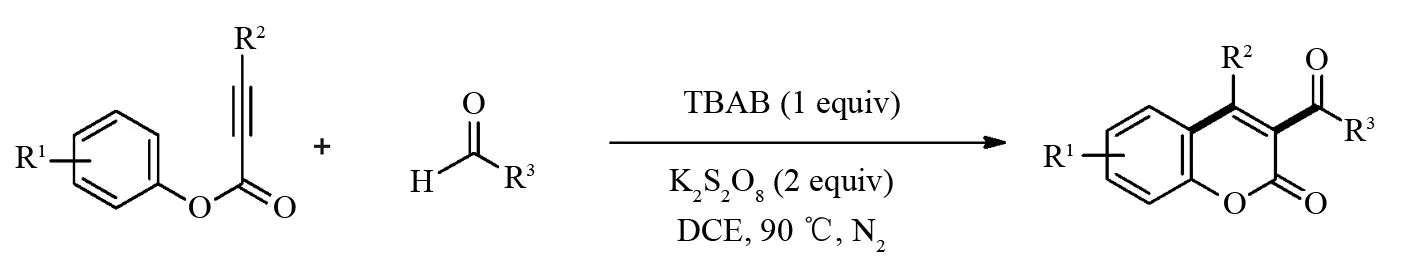
图5 无金属催化炔酸酯与醛的酰化与环化串联氧化反应Fig.5 Metal-free-catalyzed tandem oxidative acylation/cyclization between alkynoates with aldehydes
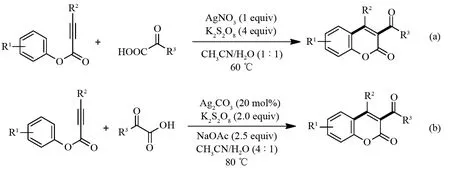
图6 银催化α-酮酸与炔酸酯的脱酸环化反应制备3-酰基香豆素类化合物Fig.6 Silver-promoted decarboxylative annulation of alkynoates with α-ketoacid
氰基是一类重要的官能团,一方面广泛存在于天然产物和医药分子[20];另一方面可以进一步功能化转化制备羧酸及其衍生物,胺和醛酮类化合物等[21-22]. 通过廉价易得的乙腈作为氰基来源已引起人们的广泛关注[23-24],2016年,SUN课题组[25]报道了过苯甲酸特丁酯(TBPB)和碳酸钠催化乙腈与炔酸酯反应制备相应的3-乙腈基功能化香豆素类化合物. 研究表明:3-乙腈基功能化香豆素类化合物可以进一步高效地转化为酯基和酰胺基修饰的香豆素类化合物. 此外,作者考察丙酮与炔酸酯的环化反应,可以顺利得到相应的2-氧丙基香豆素类化合物(图7).
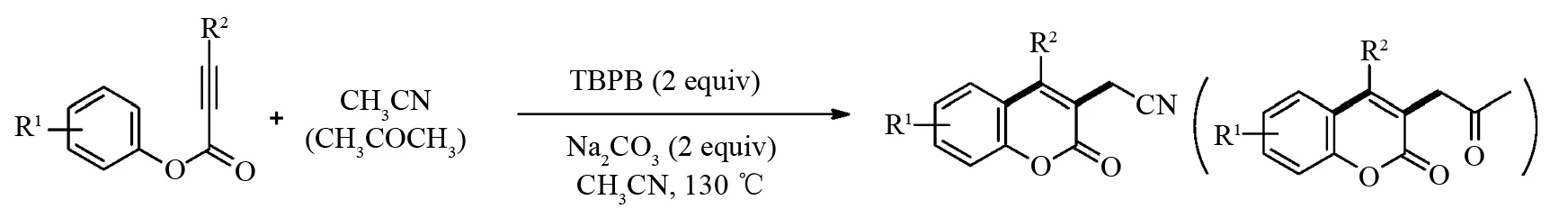
图7 无金属催化炔酸酯与乙腈或丙酮的环化反应Fig.7 Metal-free-catalyzed cyclization of various alkynoates with acetonitrile or acetone
2016年,DING课题组[26]使用1,2-二氯乙烷和水作为混合溶剂,在四丁基溴化铵和过硫酸钾作用下使得2,4-二酮化合物转化为相应的碳自由基,该自由基促使炔酸酯的环化以制备3-功能化香豆素类化合物,其最高分离产率为73%(图8).

图8 无金属催化炔酸酯与2,4-二酮氧化环化串联反应Fig.8 Metal-free catalyzed tandem oxidative cyclization of alkynoates with 2,4-diones
2 硫自由基催化合成香豆素类化合物
2.1 磺酰基自由基
砜类化合物作为一类具有较强活性的抗菌剂广泛应用于医药和农药领域[27-29],如何有效合成砜类修饰的香豆素化合物已引起人们广泛关注. 不同课题组相继报道了磺酰基自由基催化炔酸酯的环化反应以制备3-砜基香豆素类化合物. 2015年,WANG课题组[30]报道了四丁基碘化铵(TBAI)和叔丁基过氧化氢(TBHP)诱导磺酰肼脱氢而释放氮气以产生相应的磺酰基自由基,该自由基进一步催化炔酸酯的环化而得到3-磺酰基香豆素类化合物(图9a),该反应具有无过渡金属参与和良好的官能团容忍性等优势. 随后, WANG课题组[31]报道了在室温条件下可见光诱导有机染料伊红Y和叔丁基过氧化氢参与的炔酸酯与亚磺酸的氧化环化反应(图9b). 反应过程同样是通过多步自由基引发产生关键的磺酰基自由基中间体. 该反应具有反应条件温和,无金属参与、高活性高区域选择性和较好的底物适用性等诸多优点. 此外,2016年,WU课题组[32]报道了一种新颖磺酰基自由基制备方法. 在无金属和氧化剂作用下,使用DABCO固定二氧化硫作为磺酰基来源,与苯基重氮四氟硼酸盐反应而生成相应的磺酰基自由基. 该催化体系在温和反应条件下可以高活性实现不同炔酸酯的环化反应(图9c).
2.2 三氟甲硫基和硫氰基自由基
2015年,WANG课题组[33]在温和条件下分别以三氟甲烷硫醇银(AgSCF3)和硫氰化银(AgSCN)作为三氟硫甲基化和硫氰基化的来源,研究了在过硫酸钾作用下炔酸酯的三氟硫甲基化和硫氰基化反应(图10). 该反应具有反应条件温和及良好的底物适用性等优点.

图9 磺酰基自由基引发炔酸酯的环化反应Fig.9 Sulfonyl radical-initiated annulation of alkynoates
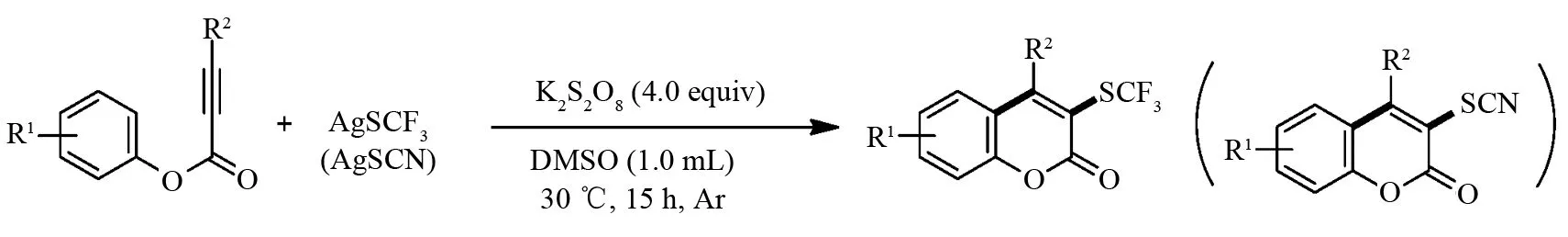
图10 炔酸酯的三氟硫甲基化和硫氰基化反应Fig.10 Trifluoromethylthiolation and thiocyanation of alkynoate
3 其他自由基催化合成香豆素类化合物
3.1 膦自由基
芳基膦化合物广泛存在于天然产物,药品,材料科学和合成中间体中[34-35],基于有机磷化合物的重要性,HUANG课题组[36]在2014年报道了碳酸银与硝酸镁促使亚磷酸二酯脱氢产生有机磷自由基,该自由基与不同炔酸酯反应,中到高产率得到相应的3-亚磷酸酯修饰的香豆素类化合物(图11).

图11 银盐催化亚磷酸酯与炔酸酯的环化反应Fig.11 Silver-catalyzed phosphorus carbocyclization of alkynoates
3.2 溴自由基
含溴基化合物是一类重要的有机合成原料,通过对其亲核取代和金属催化偶联反应可以进一步构建各种功能化有机化合物. 2016年,DING课题组[37]开发了四丁基溴化铵(TBAB)与炔酸酯的溴代氧化偶联以构建3-溴香豆素类化合物,该方法具有易于操作,溴源廉价易得等优点. 此外, 3-溴香豆素类化合物在金属钯催化下可以分别与端炔和亚磷酸酯进行偶联反应(图12).
3.3 硒自由基
硒是人类身体必需的微量元素,而有机硒化合物广泛用于抗肿瘤、抗病毒、心血管保护、免疫调节、抗菌及神经保护药物[38-40],因此如何将有机硒基团引入具有生物活性药物分子中已成为一个重要的研究课题. 2014年,ZENI课题组[41]报道了三氯化铁与二硒化合物催化炔酸酯的环化反应以制备3-硒基香豆素类化合物(图13). 在此基础上研究表明:该催化体系同样适用于炔酰胺与二硒化合物的环化反应.
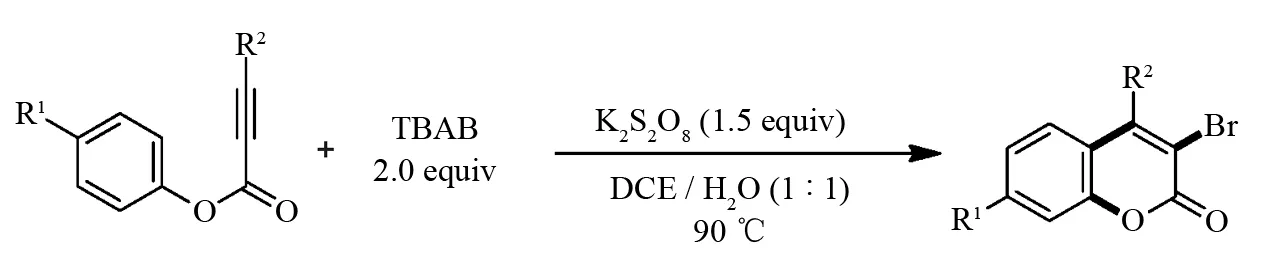
图12 无金属催化炔酸酯与四丁基溴化铵的环化反应Fig.12 Metal free-catalyzed cyclization of alkynoates and tetrabutylammonium bromide (TBAB)

图13 三氯化铁催化炔酸酯与二硒化合物的环化反应Fig.13 Iron(III) chloride-mediated cyclization of alkynoates and diorganyl diselenides
4 反应机理
基于同位素标记和产物区域选择性不同,目前引发自由基催化炔酸酯环化反应的机理主要有两种:一种自由基引发5-exo环化;另一种是自由基引发6-endo 环化. 前者反应机理如Path a所示:在外界条件(光引发或氧化剂)作用下,促使一个反应底物产生自由基R·(碳自由基、硫自由基、膦自由基、溴自由基和硒自由基等),然后该自由基与炔酸酯三键加成生成中间体A,中间体A经过5-exo 环化得到中间体B. 在氧化剂作用下,中间体B失去一个电子而转化相应的阳离子中间体C,紧接着中间体C经过酯基氧迁移而生成中间体D,该中间体失去一分子质子而得到目标产物香豆素类化合物. 后者反应机理如Path b所示:第一步产生中间体A与Path a第一步相似,接着中间体A经过6-endo 环化产生中间体E,在氧化剂存在下,中间体E失去一个电子而得到中间体F,然后该中间体失去一分子质子而转化为目标产物香豆素类化合物. 当底物炔酸酯中与酯基相连苯环上有取代基R1(R1≠H)时,两种机理最大的区别在于产物存在区域选择性,也即是取代基R1在产物苯环的位置不同,如图14所示.
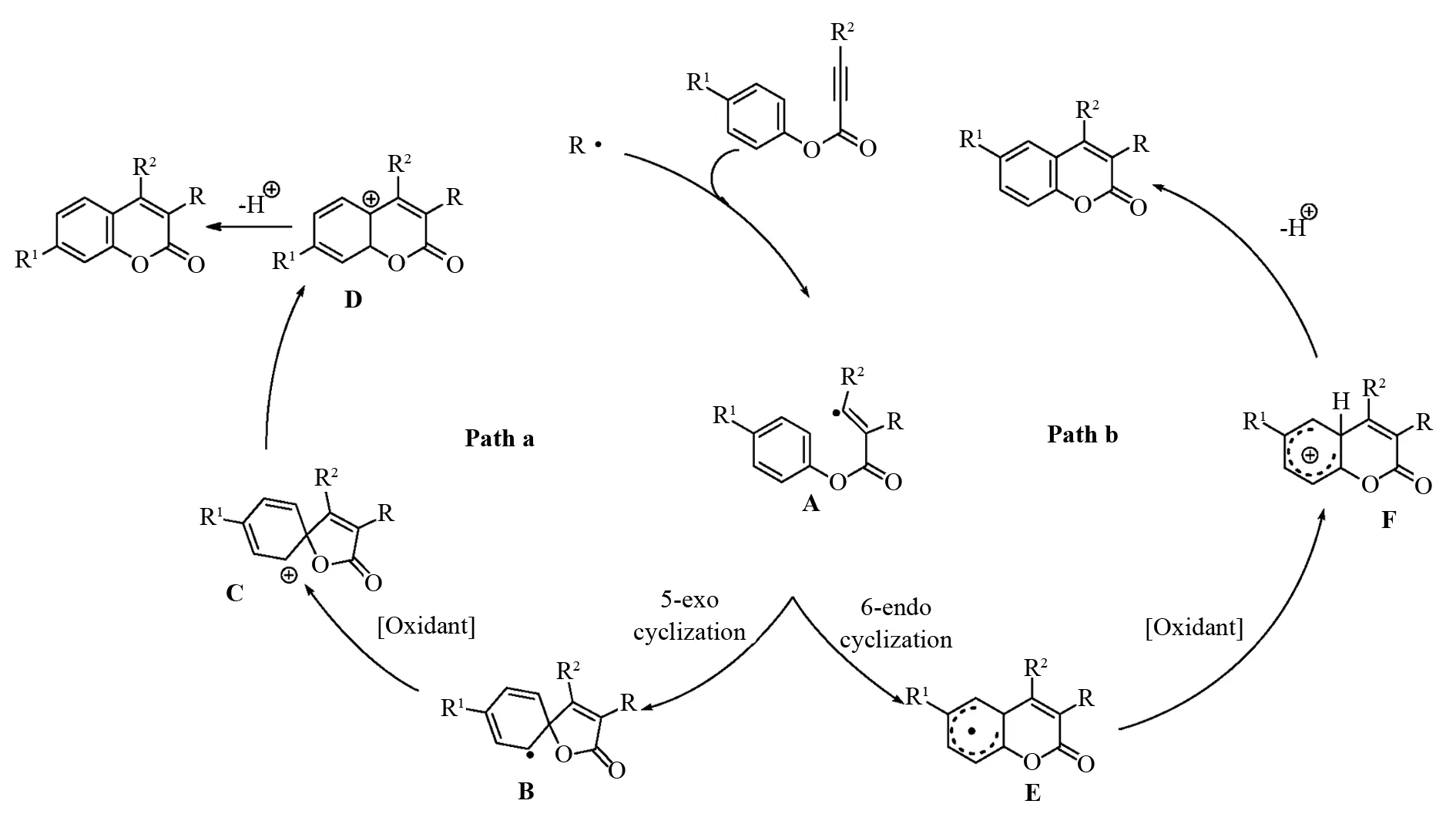
图14 通过炔酸酯环化反应合成香豆素类化合物的可能反应机理Fig.14 Proposed mechanism for the synthesis of coumarins vis cyclization of alkynoates
5 结语与展望
本文简要地介绍了不同类型自由基参与催化炔酸酯的环化反应以制备功能化香豆素类化合物的研究. 与传统构建香豆素类化合物方法相比,该自由基引发方法具有易于操作、反应活性和区域选择性较高等众多优点. 如何在温和反应条件下开发新型自由基催化体系高效催化炔酸酯制备香豆素类化合物以及进一步探索自由基引发炔酸酯环化反应机理将是该领域的重点研究方向.
[1] PENG X M, DAMU G, ZHOU C H, et al. Current deve-lopments of coumarin compounds in medicinal chemistry [J]. Current Pharmaceutical Design, 2013, 19(21): 3884-3930.
[2] SURYA P R H, SIVAKUMAR S. Condensation ofα-aroylketene dithioacetals and 2-hydroxyarylaldehydes results in facile synthesis of a combinatorial library of 3-aroylcoumarins [J]. Journal of Organic Chemistry, 2006, 71(23): 8715-8723
[3] YUAN H, WANG M, LIU Y, et al. Unexpected hydrobromic acid-catalyzed C-C bond-forming reactions and facile synthesis of coumarins and benzofurans based on ketene dithioacetals [J]. Chemistry-A European Journal, 2010, 16(45): 13450-13457.
[4] FAUSTA U, MARCHETTI M, PICCOLO O. Enantioselective synthesis of (S)- and (R)-tolterodine by asymmetric hydrogenation of a coumarin derivative obtained by a heck reaction [J]. Journal of Organic Chemistry, 2007, 72 (16): 6056-6059.
[5] MANTOVANI A C, GOULART T A C, BACK D F, et al. Iron(III) chloride and diorganyl diselenides-mediated 6-endo-dig cyclization of arylpropiolates and arylpropiolamides leading to 3-organoselenyl-2H-coumarins and 3-organoselenyl-quinolinones [J]. Journal of Organic Chemistry, 2014, 79(21): 10526-10536.
[6] LI Y, QI Z, WANG H, et al. Palladium-catalyzed oxidative heck coupling reaction for direct synthesis of 4-arylcoumarins using coumarins and rrylboronic acids [J]. Journal of Organic Chemistry, 2012, 77 (4): 2053-2057.
[7] ROMANENKO V D, KUKHAR V P. Fluorinated phosphonates: synthesis and biomedical application [J]. Chemical Reviews, 2006, 106(9): 3868-3935.
[8] PENG J J, DENG Y Q, FU W, et al. Visible-light-mediated radical aryldifluoroacetylation of alkynes with ethyl bromodifluoroacetate for the synthesis of 3-difluoroacetylated coumarins [J]. Journal of Organic Chemistry, 2015, 80(9): 4766-4770.
[9] WEI W, SONG R, OUYANG X, et al. Copper-catalyzed oxidativeipso-carboalkylation of activated alkynes with ethers leading to 3-etherified azaspiro[4,5]trienonescarbo-nate [J]. Organic Chemistry Frontiers, 2014, 1(5): 484-489.
[10] PAN C, ZHANG H, ZHU C. Oxidative difunctionalization of alkynoates via cascade radical addition, aryl migration, and decarboxylation [J]. Tetrahedron Letters, 2016, 57(5): 595-598.
[11] FENG S, XIE X, ZHANG W. et al. Visible-light-promoted dual C-C bond formations of alkynoates via a domino radical addition/cyclization reaction: a synthesis of coumarins [J]. Organic Letters, 2016, 18(15): 3846-3849.
[12] SCHLOSSER M. CF3-Bearing aromatic and heterocyclic building blocks [J]. Angewandte Chemie International Edition, 2006, 45(33): 5432-5446.
[13] SCHILL H, NIZAMOV S, BOTTANELLI F. 4-Trifluoromethyl-substituted coumarins with large stokes shifts: synthesis, bioconjugates, and their use in super-resolution fluorescence microscopy [J]. Chemistry-A European Journal, 2013, 19(49): 16556-16565.
[14] LI Y, LU Y, DING Q, et al. Copper-catalyzed direct tri-fluoromethylation of propiolates: construction of trifluoromethylated coumarinsbene [J]. Organic Letters, 2014, 16(16): 4240-4243.
[15] SANDHU S, BANSAL Y, SILAKARI O, et al. Coumarin hybrids as novel therapeutic agents [J]. Bioorganic & Medicinal Chemistry, 2014, 22(15): 3806-3814.
[16] BORGES F, ROLEIRA F, MILHAZES N, et al. Simple coumarins and analogues in medicinal chemistry: occurrence, synthesis and biological activity [J]. Current Medicinal Chemistry, 2005, 12(8): 887-916.
[17] MI X, WANG C, HUANG M, et al. Preparation of 3-acyl-4-arylcoumarins via metal-free tandem oxidative acylation/cyclization between alkynoates with aldehydeslic [J]. Journal of Organic Chemistry, 2015, 80(1): 148-155.
[18] YAN K, YANG D, WEI W, et al. Silver-mediated radical cyclization of alkynoates andα-keto acids leading to coumarins via cascade double C-C bond formation [J]. Journal of Organic Chemistry, 2015, 80(3): 1550-1556
[19] LIU T, DING Q, ZONG Q, et al. Radical 5-exo cyclization of alkynoates with 2-oxoacetic acids for synthesis of 3-acylcoumarins [J]. Organic Chemistry Frontiers, 2015, 2(6): 670-673.
[20] FLEMING F F, YAO L, RAVIKUMAR P C, et al. Nitrile-containing pharmaceuticals: efficacious roles of the nitrile pharmacophore [J]. Journal of Medicinal Chemistry, 2010, 53(22): 7902-7917.
[21] ANBARASAN P, SCHAREINA T, BELLER M. Recent developments and perspectives in palladium-catalyzed cyanation of aryl halides: synthesis of benzonitriles [J]. Chemical Society Reviews, 2011, 40(10): 5049-5067.
[22] WANG M X. Enantioselective biotransformations of nitriles in organic synthesis [J]. Accounts of Chemical Research, 2015, 48(3): 602-611.
[23] BUNESCU A, WANG Q, ZHU J. Copper-catalyzed cyanomethylation of allylic alcohols with concomitant 1,2-aryl migration: efficient synthesis of functionalized ketones containing anα-quaternary center [J]. Angewandte Chemie International Edition, 2015, 54(10): 3132-3135.
[24] CHATALOVA-SAZEPIN C, WANG Q, SAMMIS G M, et al. Copper-catalyzed intermolecular carboetherification of unactivated alkenes by alkyl nitriles and alcohols [J]. Angewandte Chemie International Edition, 2015, 54(18): 5443-5446.
[25] YU Y, ZHUANG S, SUN P, et al. Cyanomethylation and cyclization of aryl alkynoates with acetonitrile under transition-metal-free conditions: synthesis of 3-cyanomethylated coumarins [J]. Journal of Organic Chemistry, 2016, 81 (22): 11489-11495.
[26] LIU T, DING Q, QIU G, et al. Tandem metal-free oxidative radical 5-exo dearomative spirocyclization and ester migration: generation of 3-functionalized coumarins from alkynoates [J]. Tetrahedron, 2016, 72(2): 279-284.
[27] HARRAK Y, CASULA G, BASSET J, et al. Synthesis, anti-inflammatory activity, and in vitro antitumor effect of a novel class of cyclooxygenase inhibitors: 4-(aryloyl)phenyl methyl sulfones [J]. Journal of Medicinal Chemistry, 2010, 53(18): 6560-6571.
[28] AZIZ J, MESSAOUDI S, ALAMI M, et al. Sulfinate derivatives: dual and versatile partners in organic synthesis [J]. Organic & Biomolecular Chemistry, 2014, 12(48): 9743-9759.
[29] LIU N W, LIANG S, MANOLIKAKES G, et al. Recent advances in the synthesis of sulfones [J]. Synthesis, 2016, 48(13): 1939-1973.
[30] WEI W, WEN J, WANG H, et al. Direct and metal-free arylsulfonylation of alkynes with sulfonylhydrazides for the construction of 3-sulfonated coumarins [J]. Chemical Communications, 2015, 51(4): 768-771.
[31] YANG W, YANG S, WANG L, et al. Visible-light initiated oxidative cyclization of phenyl propiolates with sulfinic acids to coumarin derivatives under metal-free conditions [J]. Chemical Communications, 2015, 51(35): 7520-7523.
[32] ZHENG D, YU J, WU J. Generation of sulfonyl radicals from aryldiazonium tetrafluoroborates and sulfur dioxide: the synthesis of 3-sulfonated coumarins [J]. Angewandte Chemie International Edition, 2016, 55(39): 11925-11929
[33] ZENG Y F, TAN D H, WANG H, et al. Direct radical trifluoromethylthiolation and thiocyanation of aryl alkynoate esters: mild and facile synthesis of 3-trifluoromethylthiolated and 3-thiocyanated coumarins [J]. Organic Chemistry Frontiers, 2015, 2(11): 1511-1515.
[34] GEORGE A, VEIS A. Phosphorylated proteins and control over apatite nucleation, crystal growth, and inhibition [J]. Chemical Reviews, 2008, 108 (11): 4670-4693.
[35] QUEFFELEC C, PETIT M, BUJOLI B, et al. Surface modification using phosphonic acids and esters [J]. Chemical Reviews, 2012, 112 (7): 3777-3807.
[36] MI X, WANG C, HUANG M, et al. Silver-catalyzed synthesis of 3-phosphorated coumarins via radical cyclization of alkynoates and dialkyl H-phosphonates [J]. Organic Letters, 2014, 16 (12): 3356-3359.
[37] QIU G, LIU T, DING Q. Tandem oxidative radical brominative addition of activated alkynes and spirocyclization: switchable synthesis of 3-bromocoumarins and 3-bromo spiro-[4,5] trienone [J]. Organic Chemistry Frontiers, 2016, 3(4): 510-515.
[38] PERIN G, LENARDAO E J, JACOB R G, et al. Synthesis of vinyl selenides [J]. Chemical Reviews, 2009, 109(3): 1277-1301.
[39] SANTI C, SANTORO S, BATTISTELLI B. Organoselenium compounds as catalysts in nature and laboratory [J]. Current Organic Chemistry, 2010, 14(20): 2442-2462.
[40] NOGUEIRA C W, ZENI G, ROCHA J B T. Organoselenium and organotellurium compounds: toxicology and pharmacology [J]. Chemical Reviews, 2004, 104 (12): 6255-6286.
[41] MANTOVANI A C, GOULART T A C, ZENI G, et al. Iron(III) chloride and diorganyl diselenides-mediated 6-endo-dig cyclization of arylpropiolates and arylpropiolamides leading to 3-organoselenyl-2H-coumarins and 3-organoselenyl-quinolinones [J]. Journal of Organic Che-mistry, 2014, 79(21): 10526-10536.
Researchprogressinthesynthesisofcoumarinsviaradical-catalyzedcyclizationofalkynoates
CHEN Lulu, CHEN Pei, WANG Yanbo*, CHEN Danyun, FU Jiya, ZHU Junyan
(CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China)
As a class of important aromatous oxygen-containing heterocyclic compounds coumarin and its derivatives are widely used in spice, food, medicine, pesticide, photolectric materials and supramolecular recognition. Therefore, the synthesis of coumarin derivatives has attracted much interest. In this paper, the recent research progress in synthesis of coumarin derivatives promoted by radical has been briefly reviewed.
coumarin; radical; alkynoates; cyclization reaction
O626
A
1008-1011(2017)05-0645-08
2017-07-05.
国家自然科学基金(U1504205);河南省高等学校重点科研项目计划(17A150002).
陈露露(1996-), 女, 硕士生, 研究方向为有机合成.*
, E-mail:wangyanbokf@henu.edu.cn.
[责任编辑:张普玉]
