水曲柳FmABI5基因非生物胁迫及信号诱导的表达模式分析
2017-11-10赵兴堂梁楠松刘春浩覃俊祺詹亚光
孙 爽 赵兴堂,2 梁楠松,2 刘 颖,2 于 磊,2 刘春浩 覃俊祺 詹亚光,2*
(1.东北林业大学生命科学学院,哈尔滨 150040; 2.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
* 通信作者
* Corresponding author
水曲柳FmABI5基因非生物胁迫及信号诱导的表达模式分析
孙 爽1赵兴堂1,2梁楠松1,2刘 颖1,2于 磊1,2刘春浩1覃俊祺1詹亚光1,2*
(1.东北林业大学生命科学学院,哈尔滨 150040;2.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
ABI5(abscisic acid-insensitive 5)蛋白是一个响应ABA信号的碱性亮氨酸拉链类(basic leucine zipper,bZIP)转录因子。揭示了水曲柳FmABI5在非生物胁迫下的表达特征,为该基因在水曲柳中代谢调控功能的研究奠定基础。获得了水曲柳ABI5基因的全长,命名为FmABI5,应用生物信息学软件分析了水曲柳FmABI5基因的分子结构特征,利用PEG、低温(4℃)及盐(NaCl)进行非生物胁迫处理,利用脱落酸(ABA)和赤霉素(GA3)进行信号诱导,分析FmABI5的表达特征。生物信息学分析表明该基因全长1 455 bp,含有完整的开放阅读框,编码484个氨基酸。FmABI5为不稳定类亲水性蛋白,不存在信号肽,具有跨膜能力,α-螺旋、延伸链、无规则卷曲分布于整个蛋白。分子进化分析结果表明,水曲柳FmABI5基因与芝麻的遗传距离较近,说明其亲缘关系较近;与马铃薯、潘那利番茄、水茄与甜椒的遗传距离较远,说明其亲缘关系较远。非生物胁迫结果表明,FmABI5基因表达水平随非生物胁迫处理时间不同而上下波动,但在处理6、48和72 h后,FmABI5基因对3种非生物胁迫处理都上调表达,说明FmABI5基因对非生物胁迫具有响应。信号诱导结果表明,外源的ABA与GA共同调节了FmABI5基因的表达。
水曲柳;FmABI5;生物信息学分析;非生物胁迫
植物在其生长发育过程中会经历各种生物、非生物胁迫,各种转录因子介导的基因表达调控网络在植物抵御外界胁迫过程中起着重要的作用。目前已鉴定的碱性域亮氨酸拉链(basic domain leucine zipper,bZIP)家族是一类与植物抗胁迫有关的转录因子[1],这些转录因子与特定的顺式作用元件结合,特异地调控植物在遭受外界胁迫反应中相关功能基因和调节基因表达,最终使植物对环境胁迫的适应能力提高,能够正常生长发育。ABI5属于bZIP家族中A亚家族成员之一[2],在拟南芥(Arabdopsisthaliana)幼苗中,ABI5对ABA信号转导和胁迫反应起着至关重要的调控作用,ABA诱导ABI5表达[3]。研究表明在小麦(TriticumaestivumL.)[4]、玉米(ZeamaysL.)[5]与水稻(OryzasativaL.)[6]的研究中,ABI5也参与ABA信号转导及其介导的胁迫相关信号转导。此外,ABI5参与植物对高盐、干旱、低温、水杨酸与甘露醇的响应,以及胚胎发育和种子的萌发。脱落酸(abscisic acid,ABA)作为一种重要的植物激素调节着植物生长发育过程中的诸多环节,如种子和芽的休眠[7]、气孔关闭、生物与非生物性胁迫的响应[8~9]、以及拮抗其他植物生长调节物质的作用。赤霉素(GA)是植物主要激素之一,也是一种信号物质[10~11],与ABA在叶片的衰老、种子形成与休眠过程中共同发挥调节作用[12]。
水曲柳(Fraxinusmandshurica)系木犀科(Oleaceae)梣属(Fraxinus)乔木,是东北林区珍贵的3大硬阔叶树种之一,也是红松混交主要树种。水曲柳材质优良,纹理秀美,是建筑、家具、室内装修、造船、制造军工器械及胶合板等的优良用材[13]。本文分析水曲柳FmABI5的基因序列,研究在低温(4℃)、盐(NaCl)、PEG的非生物胁迫下该基因的表达模式,利用脱落酸(ABA)、赤霉素(GA)对FmABI5处理,观察信号诱导下FmABI5的表达模式,以揭示FmABI5在非生物胁迫和信号诱导下的表达特征。
1 材料与方法
1.1 材料
取水曲柳15 d幼苗,分别用4℃低温、NaCl(200 mmol·L-1)[14~16]、干旱(20% w/V PEG6000)[15~16]、ABA(100 μmol·L-1)和GA3(100 μmol·L-1)处理,对照组不做任何处理,然后在正常条件下继续培养,分别于处理后0、6、12、24、48和72 h取样,平行3次重复。样品于-80℃冰箱保存。
1.2 方法
利用在线分析软件Protparam分析FmABI5氨基酸序列的理化性质。利用在线分析软件ProtScale的Kyte and Doolittle算法分析FmABI5蛋白亲水/疏水性。利用在线分析工具Signa-P的神经网络算法对FmABI5蛋白进行预测并分析FmABI5蛋白的信号肽。利用在线工具TMPred预测和分析FmABI5蛋白的跨膜结构。应用GOR4分析FmABI5蛋白的二级结构。利用NCBI数据库对FmABI5基因序列以及推测的编码蛋白进行同源序列比对。应用PRALINE在线多序列比对软件分析对FmABI5推测的编码蛋白以及上述物种中的同源蛋白,进行同源序列比对分析。利用MEGA5.0软件,应用Neighbor-Joining算法构建系统进化树[17~18]。
应用CTAB法提取水曲柳RNA,将检测可用的RNA反转录成cDNA进行RT-PCR,产物长度在150~250 bp模板为稀释10倍的cDNA。荧光定量使用Takara(SYBR Green)试剂盒,PCR体系(20 μL):灭菌蒸馏水6.8 μL,SYBR Premix EX Taq 10 μL,上下游引物各0.4 μL,50×ROX reference dye Ⅱ 0.4 μL,cDNA模板2 μL。利用Applied Biosystems 7500荧光定量PCR仪进行扩增,反应程序:95℃、30 s→95℃、5 s→60℃、34 s(共40个循环)→95℃、15 s→60℃、1 min→95℃、15 s。每份样品重复3次[19]。以水曲柳a-Tubulin基因作为内参[20],计算FmABI5基因的相对表达水平2-ΔΔCT。其中ΔΔCT=(CT靶基因-CT内参)处理组-(CT靶基因-CT内参)对照组。
2 结果与分析
2.1 氨基酸理化性质分析
我们克隆了水曲柳FmABI5全长基因1 455 bp,编码484个氨基酸,含有完整的开放阅读码框。分析FmABI5理化性质,其蛋白等电点(PI)为9.14;不稳定系数为52.46,为不稳定的蛋白(不稳定系数大于40时,预测蛋白质为不稳定蛋白,反之则为稳定蛋白);总平均疏水性为-0.615,说明该蛋白为亲水性蛋白。蛋白质亲疏水性氨基酸的组成是蛋白质折叠的主要驱动力,通过亲水性预测可以反映蛋白质的折叠情况(>0.5区域为疏水区,<-0.5区域为亲水区,+0.5~-0.5为两性区域)。结果表明,FmABI5蛋白共有26个疏水区,38个亲水区域。
2.2 信号肽及跨膜结构域的预测和分析
信号肽是N端的一段氨基酸序列,一般由16~26个氨基酸残基组成,指导分泌性蛋白到内质网膜上合成,在蛋白质合成结束之前被切除,其中包括疏水核心区、信号肽的C端和N端。结果表明,FmABI5不存在信号肽。
跨膜结构是一段氨基酸片段,一般由20个左右的疏水性氨基酸残基组成,主要形成α-螺旋。利用在线工具TMPred对FmABI5蛋白进行跨膜结构分析。图1表明,FmABI5蛋白可能存在一个显著的跨膜螺旋,但是这个结构的方向有两种可能:第一种可能为跨膜螺旋位于第342个氨基酸(亮氨酸)和第360个氨基酸(丙氨酸)之间,共包括19个氨基酸,如果N末端定为外侧(o),C末端为内侧(i),则这个跨膜螺旋的方向为o→I;第二种可能为跨膜螺旋位于第341个氨基酸(甘氨酸)和第362个氨基酸(甘氨酸)之间,共含有22个氨基酸,方向为i→o.表明FmABI5蛋白具有跨膜能力,其方向可能是从外到内,也可能是从内到外,但是两种方向不可能同时存在。

图1 水曲柳FmABI5蛋白跨膜结构域预测和分析Fig.1 Prediction and analysis of FmABI5 protein transmembrane domain in F.mandshurica
2.3 蛋白质二级结构域的预测与分析
FmABI5蛋白是由44.42%的α螺旋(Alpha helix)、8.47%的延伸链(Extandedstrand)和47.11%的无规则卷曲(Random coil)所组成的,并且分布于整个蛋白。由此可知,FmABI5蛋白较不稳定,为不稳定蛋白。
2.4 氨基酸序列比对及系统进化树构建
对FmABI5氨基酸序列进行同源序列比对并构建系统进化树(图2)。获得的FmABI5蛋白序列,与毛果杨(Populustrichocarpa)、芝麻(Sesamumindicum)、烟草(Nicotianatabacum)、茶树(Camelliasinensis)、马铃薯(Solanumtuberosum)、棉花(Gossypiumhirsutum)和巨桉(Eucalyptusgrandis)等物种中的同源蛋白序列相比具有很高的保守性。
系统进化树是物种的进化史,通过构建系统进化树可以根据这些物种的祖先描述它们的进化关系。结果表明(图2),16条蛋白序列大致分为2个大类:其中巨桉、棉花、甜橙(Citrussinensis)、毛果杨、蓖麻(Ricinuscommunis)聚成一个大类,锦鸡儿(Caraganakorshinskii)、葡萄(Vitisvinifera)、美花烟草(Nicotianasylvestris)、马铃薯、潘那利番茄(Solanumpennellii)、茶树、水茄(Solanumtorvum)、甜椒(Capsicumannuum)、芝麻和水曲柳聚成一个大类。水曲柳FmABI5蛋白与芝麻的遗传距离较近说明有着较近的亲缘关系;与马铃薯、潘那利番茄、水茄与甜椒的遗传距离较远,说明亲缘关系较远。
2.5 FmABI5在水曲柳中的表达模式
2.5.1 非生物胁迫下FmABI5在水曲柳中的表达
非生物胁迫下FmABI5基因的表达水平随处理时间的不同而上下波动,但在处理6、48和72 h后,FmABI5基因对3种非生物胁迫处理都上调表达,说明FmABI5基因对非生物胁迫具有响应(图3)。低温处理结果表明在处理6、48和72 h时上调表达,在处理12和24 h时下调表达。PEG与NaCl处理在6、12、24、48和72 h时,FmABI5基因都上调表达(图3)。此外,FmABI5基因分别在低温处理12 h、NaCl处理12 h与PEG处理72 h时表达量最高。说明FmABI5对非生物胁迫有响应,而对不同胁迫方式的响应模式不同。
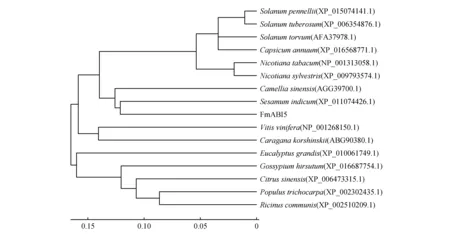
图2 水曲柳FmABI5基因系统发育进化树Fig.2 Phylogenetic tree of FmABI5 gene
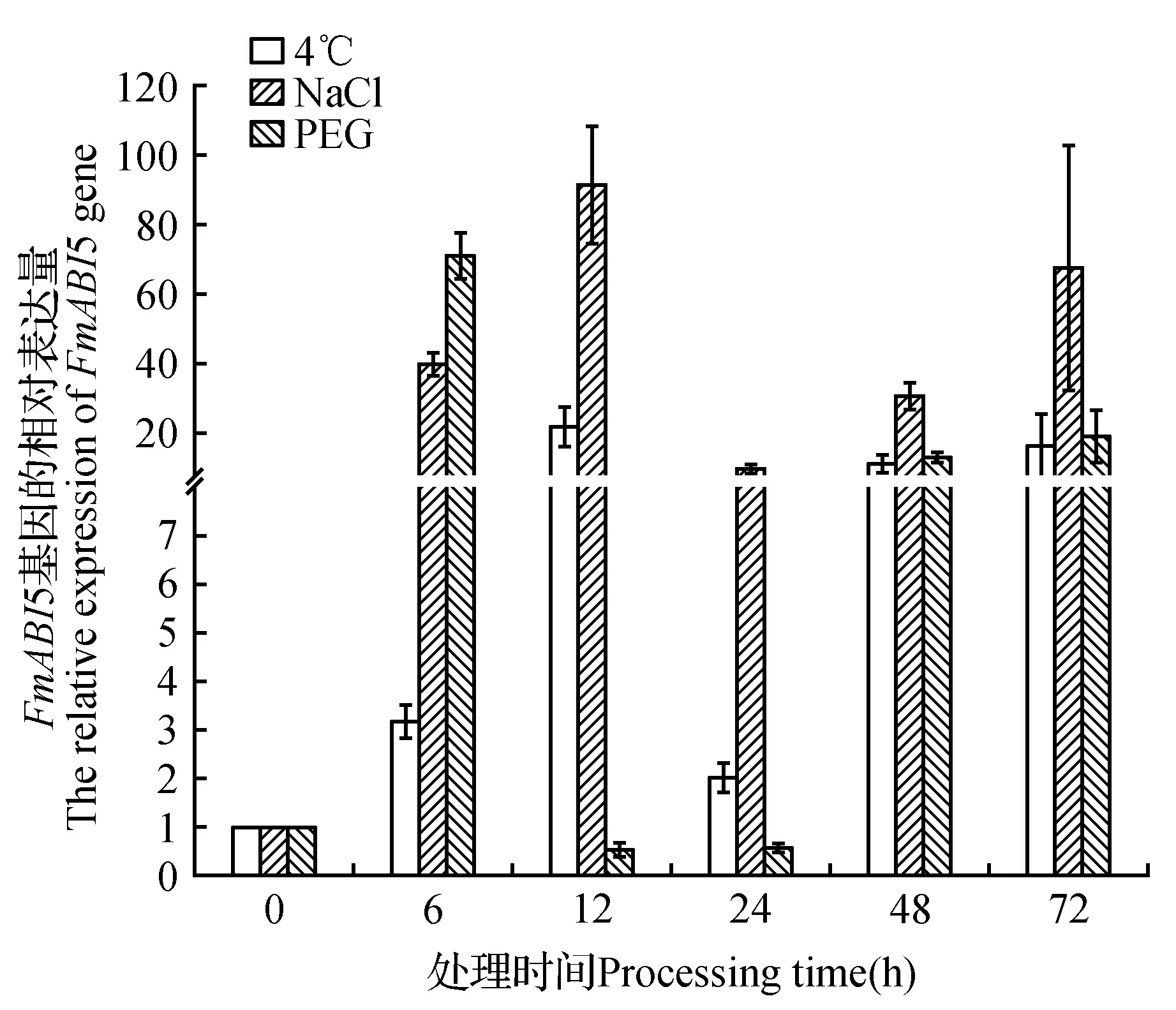
图3 水曲柳FmABI5基因在非生物胁迫下的相对表达Fig.3 The relative expression of FmABI5 under abiotic stress in F.mandshurica
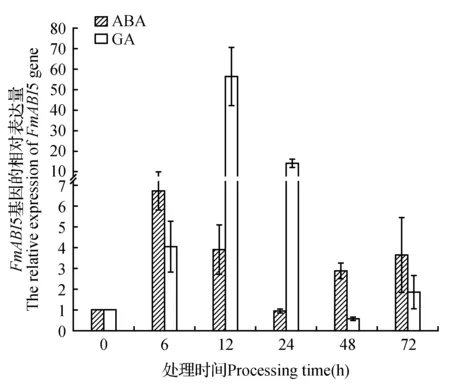
图4 水曲柳FmABI5基因在ABA、GA处理后的相对表达Fig.4 The relative expression of FmABI5 after ABA and GA
2.5.2 信号诱导下FmABI5在水曲柳中的表达
ABA处理6 h后,FmABI5的表达量达到最大值,约为最低值24 h的7倍;12 h的表达量较6 h有所降低,但仍高于24 h,约为24 h的4倍;48 h表达量较12 h有所降低,但仍高于24 h,约为24 h的3倍;72 h处理材料中的FmABI5表达量与12 h基本相同(图4)。与对照相比,除24 h外,其他时间点FmABI5的表达量均有所提高。因此,ABA能够影响水曲柳FmABI5基因的表达。
赤霉素(GA)作为植物主要的激素之一,参与植物体内多种发育过程与代谢产物的调控[21]。我们对水曲柳进行赤霉素处理,用来确定赤霉素对水曲柳FmABI5表达的影响。由结果可以看出,处理6 h的材料,表达量明显升高,约为对照的4倍,在处理12 h后表达量急剧增加,为对照的56倍,在处理24 h后表达量有所降低,但仍为对照的13.8倍,在处理48 h后表达量最低,为对照的58%,在处理72 h后,表达量又有所升高,为对照的1.8倍(图4)。综上可知,GA参与了FmABI5基因的信号调控。
3 讨论
在拟南芥幼苗中,ABI5对ABA信号转导和胁迫反应起着至关重要的作用,在植物的调控网络中,通过磷酸化来调控ABI5的活性[22]。为了鉴定FmABI5蛋白的功能,通过在线工具对FmABI5蛋白进行了预测和生物信息学分析。结果表明FmABI5蛋白为亲水性蛋白,不存在信号肽,含有一个跨膜结构域;二级结构分析表明,FmABI5蛋白是由α-螺旋、延伸链、无规则卷曲组成;对FmABI5的氨基酸序列与NCBI数据库中的BLASTP比对分析表明,FmABI5蛋白与毛果杨、芝麻、烟草、茶树、马铃薯、棉花和巨桉等物种对应蛋白的同源性较高;同时应用比对结果构建了系统进化树,结果表明FmABI5蛋白与锦鸡儿、葡萄、美花烟草、马铃薯、潘那利番茄、茶树、水茄、甜椒、芝麻等对应的蛋白聚成一大类,说明它们在进化上亲缘关系较近。
非生物胁迫是限制植物生长及产量的全球性问题。经过长期的自然选择,植物逐渐进化出一套完整的适应非生物胁迫的能力。例如盐是一种主要的非生物胁迫因子[23],在盐条件下,钠离子通过非选择性离子通道和高亲和力K+转运进入根部表皮细胞[24]。这样的带电Na+离子能够使质膜去极化,导致K+立即通过去极化活化的外向整流的K+(KOR)通道泄露。这耗尽细胞内K+,损害细胞的新陈代谢并可能导致盐水条件下细胞程序性死亡[25]。因此,离子平衡的维护是植物抵御盐胁迫的重要因素[26]。已有多种证据表明,在植物中,ABI5的表达是由多种应激诱导的刺激,包括NaCl、渗透压、ABA、GA等[27]。Zou等发现水稻中的ABI5(OsABI5)在ABA和高盐条件下被诱导表达;在干旱和低温条件下表达被下调;OsABI5作为一个转录因子可以调控逆境胁迫且调控水稻的发育力[28]。本文对FmABI5在NaCl胁迫下的表达进行了测定,研究结果表明NaCl提高了FmABI5的表达。ABI5可与顺式元件ABRE相结合,从而调节下游大量抗旱、耐盐碱等相关功能基因的表达,是在依赖ABA的逆境信号传导过程中的关键因子,具有提高植物抗逆性的能力[29]。而且ABI5家族成员在响应ABA、寒冷、干旱以及渗透胁迫时表现出不同的可诱导性[30~32]。Choi等对生长2~3周的拟南芥ABI5进行Northern Bloting分析,发现ABI5对ABA、干旱与NaCl有微弱的响应[24]。此外,ABI5参与ABA信号并对晚期胚胎发育起正调控作用[33~34]。
ABA与GA是调节植物生长发育与逆境的两种主要激素,在多种过程中发挥作用[35]。如ABA与GA共同调节种子的萌发[36]。GA刺激萌发,并且GA的合成是休眠中种子的萌发发生必不可缺的[37~38]。在研究高粱种子休眠时,发现ABI5与ABI4的相互作用会导致GA的降解,从而防止休眠中的种子萌发[39]。Rodrlguez等研究发现ABI5蛋白含量在外源ABA处理24 h时有所降低,在96 h时瞬时达到峰值,在144 h时恢复到原来正常水平。与ABA处理相类似,外源GA处理96 h时,ABI5蛋白的含量也瞬时增大到峰值,而不是像预期的那样,外源GA会使ABI5蛋白含量降低[40]。本文对FmABI5在外源ABA和GA信号诱导下的表达进行了测定,发现外源ABA在6 h时使得FmABI5表达达到了峰值,然后在12 h时有所降低,在24 h时回复到原来的水平;相对于ABA,外源GA对FmABI5的表达诱导效果更明显(图4),FmABI5表达在GA处理12 h时达到峰值,在24 h时有所降低,在48 h表达量比对照还要小;而且,FmABI5对外源ABA的响应要比GA早,但是FmABI5对外源GA的响应强度要大于对外源ABA的响应强度。因此,FmABI5的表达是受到ABA与GA共同调节的,这与Rodrlguez等的研究结果相类似。
综上所述,本研究证实了PEG、低温、盐胁迫等非生物胁迫可以诱导FmABI5基因表达,初步说明FmABI5蛋白参与植物耐受非生物胁迫。外源信号ABA、GA均能引起FmABI5基因表达量的升高说明了ABA与GA共同调节FmABI5的表达。本研究为进一步研究ABI5在木本植物中的表达和生物学功能提供了依据,同时为深入研究FmABI5基因响应非生物胁迫和信号诱导奠定了基础。
1.刘宝玲,张莉,孙岩,等.谷子bZIP转录因子的全基因组鉴定及其在干旱和盐胁迫下的表达分析[J].植物学报,2016,51(4):473-487.
Liu B L,Zhang L,Sun Y,et al.Genome-wide characterization of bZIP transcription factors in foxtail millet and their expression profiles in response to drought and salt stresses[J].Chinese Bulletin of Botany,2016,51(4):473-487.
2.赵菲佚,焦成瑾,陈荃,等.拟南芥PKS5激酶磷酸化ABI5参与植物ABA响应[J].植物生理学报,2015,51(10):1719-1728.
Zhao F Y,Jiao C J,Chen Q,et al.PKS5 kinase is involved in ABA response through phosphorylating ABI5 inArabidopsis[J].Plant Physiology Journal,2015,51(10):1719-1728.
3.Zhao W M,Guan C M,Feng J,et al.TheArabidopsisCROWDED NUCLEI genes regulate seed germination by modulating degradation of ABI5 protein[J].Journal of Integrative Plant Biology,2016,58(7):669-678.
4.孙晓燕.ABI5基因在不同休眠特性小麦中的鉴定和表达特异性研究[D].呼和浩特:内蒙古农业大学,2016.
Sun X Y.Isolation and Characterization ofABI5 in Chinese wheats with different depth of Dormancy[D].Hohhot:Inner Mongolia Agricultural University,2016.
5.燕芳.玉米ABA-insensitive(ABI) 5基因在非生物逆境胁迫下的功能研究[D].重庆:重庆大学,2012.
Yan F.The functional studies of maize ABA-insensitive(ABI) 5 gene in abiotic stresses[D].Chongqing:Chongqing University,2012.
6.Zou M J,Guan Y H,Ren H B,et al.A bZIP transcription factor,OsABI5,is involved in rice fertility and stress tolerance[J].Plant Molecular Biology,2008,66(6):675-683.
7.张萍.‘凤丹’种子发育过程中脱落酸表达机制的初步研究[D].北京:中国农业科学院,2014.
Zhang P.Preliminary study on the mechanisms of abscisic acid regulation inPaeoniaostii‘Fengdan’ seed development[D].Beijing:Chinese Academy of Agricultural Sciences,2014.
8.汪孟窈.甘蓝Open Stomata 1(BolOST1)基因调节植物干旱胁迫应答反应分子机制的初步解析[D].杨凌:西北农林科技大学,2014.
Wang M Y.Functional analysis of BolOST1,an Ortholog of open stomata 1 involved in plant drought responses in brassica oleraceal[D].Yangling:Northwest A&F University,2014.
9.孟莹.脱落酸在24-表油菜素内酯缓解葡萄幼苗水分胁迫下生理效应中的作用研究[D].杨凌:西北农林科技大学,2016.
Meng Y.Study of Abscisic Acid’s Role in the Ameliorative effects of 24-epibrassinolide On Grape Seedlings Under Water Stress[D].Yangling:Northwest A&F University,2016.
10.Ueguchi-tanaka M,Ashikari M,Nakajima M,et al.Gibberellin insensitiveDWARF1 encodes a soluble receptor for gibberellin[J].Nature,2005,437(7059):693-698.
11.高琼.赤霉素在非生物胁迫响应中的作用研究[D].北京:北京林业大学,2014.
Gao Q.The role of gibberellin metabolism in response to abiotic stress[D].Beijing:Beijing Forestry University,2014.
12.Riechmann J L,Heard J,Martin G,et al.Arabidopsistranscription factors:genome-wide comparative analysis among eukaryotes[J].Science,2000,290(5499):2105-2110.
13.赵兴堂,夏德安,曾凡锁,等.水曲柳生长性状种源与地点互作及优良种源选择[J].林业科学,2015,51(3):140-147.
Zhao X T,Xia D A,Zeng F S,et al.Provenances by sites interaction of growth traits and provenance selection ofFraxinusmandshurica[J].Scientia Silvae Sinicae,2015,51(3):140-147.
14.李月,许朋斐,刘超,等.陆地棉bZIP转录因子响应非生物胁迫表达谱分析[J].植物遗传资源学报,2016,17(3):562-569.
Li Y,Xu P F,Liu C,et al.Expression profiling of cotton(GossypiumhirsutumL.) bZIP genes responsive to abiotic stresses[J].Journal of Plant Genetic Resources,2016,17(3):562-569.
15.姚晓华,吴昆仑.青稞脂质转运蛋白基因blt4.9的克隆及其对非生物胁迫的响应[J].作物学报,2016,42(3):399-406.
Yao X H,Wu K L.Isolation ofblt4.9 gene encoding LTP protein in Hulless barley and its response to abiotic stresses[J].Acta Agronomica Sinica,2016,42(3):399-406.
16.张秋博,何之龙,詹亚光,等.水曲柳SnRK2B基因和启动子的克隆及分析[J].核农学报,2016,30(6):1074-1082.
Zhang Q B,He Z L,Zhan Y G,et al.Cloning and analysis ofSnRK2Bgene and promoter inFraxinusmandshurica[J].Journal of Nuclear Agricultural Sciences,2016,30(6):1074-1082.
17.周姗,李思达,董恒,等.白桦BpHO基因非生物胁迫及信号诱导的表达模式分析[J].北京林业大学学报,2015,37(11):69-75.
Zhou S,Li S D,Dong H,et al.Analysis of the expression patterns ofBpHOgene induced by abiotic stress and signal in birch[J].Journal of Beijing Forestry University,2015,37(11):69-75.
18.梁楠松,周姗,李蕾蕾,等.小黑杨bHLH转录因子基因和启动子的克隆与分析[J].经济林研究,2013,31(4):58-66.
Liang N S,Zhou S,Li L L,et al.Cloning and analysis of bHLH transcription factor genes and promoters inPopulus×XiaoheiT.S.Hwang et Liang[J].Nonwood Forest Research,2013,31(4):58-66.
19.周姗,孙丰坤,姜涛,等.白桦BpNOS基因的生物信息及表达模式分析[J].中草药,2015,46(8):1203-1208.
Zhou S,Sun F K,Jiang T,et al.Bioinformatics and expression pattern analysis ofBpNOSgene inBetulaplatyphylla[J].Chinese Traditional and Herbal Drugs,2015,46(8):1203-1208.
20.He Z L,Zhan Y G,Zeng F S,et al.Drought physiology and gene expression characteristics ofFraxinusinterspecific hybrids[J].Plant Growth Regulation,2016,78(2):179-193.
21.欧阳芳群,蒋明,王军辉,等.补光对欧洲云杉苗木生长的生理影响研究[J].北京林业大学学报,2016,38(1):50-58.
Ouyang F Q,Jiang M,Wang J H,et al.Effects of supplemental lighting on growth and physiological responses of Norway spruce(Piceaabies(L.) H.Karst) from different provenances[J].Journal of Beijing Forestry University,2016,38(1):50-58.
22.白益利.ABA反应关键下游转录因子ABI5 Ser-42残基磷酸化修饰及生物学功能研究[D].杨凌:西北农林科技大学,2016.
Bai Y L.Biological determination of Phosphorylation of ABI5 at Ser-42,a Key Transcription Factor Involved in Plant ABA Responses[D].Yangling:Northwest A&F University,2016.
23.倪建伟.唐古特白刺悬浮细胞体系的构建及耐盐代谢机制研究[D].北京:中国林业科学研究院,2015.
Ni J W.Studies on the Establishment of Suspension Cell Lines and Salt-tolerance Metabolic Mechanisms ofNitrariatangutorumBobr[D].Beijing:Chinese Academy of Forestry,2015.
24.张彦桃,王欣,祁智,等.拟南芥高亲和性钾转运体AtHAK5参与植物根对盐胁迫及ABA的反应[J].华北农学报,2014,29(6):214-219.
Zhang Y T,Wang X,Qi Z,et al.Arabidopsisthalianahigh-affinity potassium transporter at HAK5 participated in the response to salt stress and ABA in the plant root[J].Acta Agriculturae Boreali-Sinica,2014,29(6):214-219.
25.刘建新,王金成,王瑞娟,等.KCl对NaCl胁迫下燕麦幼苗活性氧代谢和渗透溶质积累的影响[J].植物研究,2015,35(2):233-239.
Liu J X,Wang J C,Wang R J,et al.Effects of KCl on active oxygen metabolism and osmotica accumulation inAvenanudeL. seedlings under NaCl stress[J].Bulletin of Botanical Research,2015,35(2):233-239.
26.陈静波,牛佳伟,田海燕,等.NaCl胁迫对杂交狗牙根品种‘苏植2号’和‘Tifgreen’生长及Na+和K+积累的影响[J].植物资源与环境学报,2014,23(3):45-51.
Chen J B,Niu J W,Tian H Y,et al.Effect of NaCl stress on growth and Na+and K+accumulation of cultivars ‘Suzhi No.2’ and ‘Tifgreen’ of hybrid bermudagrass(Cynodondactylon×C.transvaalensis)[J].Journal of Plant Resources and Environment,2014,23(3):45-51.
27.党智笙.拟南芥ABI5基因启动子的克隆与遗传转化载体构建[D].兰州:兰州理工大学,2014.
Dang Z S.The cloning and expression analysis ofABI5 gene promter fromArabidopsisthaliana[D].Lanzhou:Lanzhou University of Technology,2014.
28.Zeng D E,Hou P,Xiao F M,et al.Overexpression ofArabidopsisXERICO gene confers enhanced drought and salt stress tolerance in rice(OryzaSativaL.)[J].Journal of Plant Biochemistry and Biotechnology,2015,24(1):56-64.
29.曹如星.拟南芥abi5基因的分子克隆及其在原核细胞中的表达[D].兰州:兰州理工大学,2012.
Cao R X.Cloning and Expression of theabi5 gene from theArabidopsisthalianainE.coliBL21[D].Lanzhou:Lanzhou University of Technology,2012.
30.Choi H I,Hong J H,Ha J K,et al.ABFs,a family of ABA-responsive element binding factors[J].Journal of Biological Chemistry,2000,275(3):1723-1730.
31.Uno Y,Furihata T,Abe H,et al.Arabidopsisbasic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(21):11632-11637.
32.Bensmihen S,Rippa S,Lambert G,et al.The homologous ABI5 and EEL transcription factors function antagonistically to fine-tune gene expression during late embryogenesis[J].The Plant Cell,2002,14(6):1391-1403.
33.Carles C,Bies-etheve N,Aspart L,et al.Regulation ofArabidopsisthalianaEm genes:role of ABI5[J].The Plant Journal,2002,30(3):373-383.
34.Garcia M E,Lynch T,Peeters J,et al.A small plant-specific protein family of ABI five binding proteins(AFPs) regulates stress response in germinatingArabidopsisseeds and seedlings[J].Plant Molecular Biology,2008,67(6):643-658.
35.杨柳,王乐,谢忠奎,等.内源IAA、GA3调控对百合试管苗生长的影响研究[J].植物研究,2016,36(5):760-767.
Yang L,Wang L,Xie Z K,et al.Influence of endogenous IAA and GA3on in vitro lily seedling growth[J].Bulletin of Botanical Research,2016,36(5):760-767.
36.刘宁.种子的休眠与萌发[J].生物学通报,2014,49(10):11-14.
Liu N.Seed dormancy and germination[J].Bulletin of Biology,2014,49(10):11-14.
37.Piskurewicz U,Lopez-molina L.The GA-signaling repressor RGL3 represses testa rupture in response to changes in GA and ABA levels[J].Plant Signaling & Behavior,2009,4(1):63-65.
38.陈志飞,宋书红,张晓娜,等.赤霉素对干旱胁迫下高羊茅萌发及幼苗生长的缓解效应[J].草业学报,2016,25(6):51-61.
Chen Z F,Song S H,Zhang X N,et al.Effects of gibberellin on seed germination and seedling growth of tall fescue under drought stress[J].Acta Prataculturae Sinica,2016,25(6):51-61.
39.Cantoro R,Crocco C D,Benech-arnold R L,et al.Invitrobinding ofSorghumbicolortranscription factors ABI4 and ABI5 to a conserved region of aGA2-OXIDASEpromoter:possible role of this interaction in the expression of seed dormancy[J].Journal of Experimental Botany,2013,64(18):5721-5735.
40.Rodríguez M V,Mendiondo G M,Maskin L,et al.Expression of ABA signalling genes and ABI5 protein levels in imbibedSorghumbicolorcaryopses with contrasting dormancy and at different developmental stages[J].Annals of Botany,2009,104(5):975-985.
National Natural Science Foundation of China(31270697);National Key Technology Support Program(2012BAD21B020106);Innovation and entrepreneurship training program of Northeast Forestry University(201610225233)
introduction:SUN Shuang(1994—),female,mainly engaged in biotechnology research.
date:2017-01-03
ExpressionPatternsofFmABI5GeneInducedbyAbioticStressandSignalinFraxinusmandshurica
SUN Shuang1ZHAO Xing-Tang1,2LIANG Nan-Song1,2LIU Ying1,2YU Lei1,2LIU Chun-Hao1QIN Jun-Qi1ZHAN Ya-Guang1,2*
(1.College of Life Science,Northeast Forestry University,Harbin 150040;2.State Key of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
Abscisic acid-insensitive 5(ABI5) protein was a basic leucine zipper(bZIP) transcription factor containing a basic DNA-binding domain linked to a leucine zipper domain andABI5 protein response abscisic acid. We studied theFmABI5 expression pattern in signal induction and regulation, and analyzed gene function in metabolic regulation ofFraxinusmandshurica. TheABI5 gene was cloned fromF.mandshurica, namedFmABI5. The molecular structure ofFmABI5 was analyzed by bioinformatics software. Abiotic stress by polyethylene glycol(PEG), salt(NaCl) and low temperature(4℃), and signal induced by abscisic acid(ABA) and gibberellin(GA) were used in the study. The expression patterns ofFmABI5 induced by abiotic and signal induction were analyzed. By bioinformatics analysis,FmABI5 is 1 455 bp, and contains the complete ORF, encoding 484 amino acids.FmABI5 is a hydrophobic protein without signal peptide but with one transmembrane ability. The alpha helix, extension chain and random coil are distributed throughout the protein. By molecular evolution analysis, the genetic distance ofFmABI5 gene betweenF.mandshuricaandSesamumis relative close. The gene heredity distance is farther withSolanumtuberosum,S.pennellii,S.torvumandCapsicumannuum, explaining the far genetic relationship with them. After abiotic stress,FmABI5 gene expression levels varied with abiotic stress time with fluctuations, but after 6, 48 and 72 h treatment,FmABI5 gene for three abiotic stress treatments were up-regulated, indicatingFmABI5 genes are responsive to abiotic stresses. Therefore, the signal induced by exogenous ABA and GA regulate transcription expression ofFmABI5 together.
Fraxinusmandshurica;FmABI5;bioinformatics analysis;abiotic stress
国家自然科学基金面上项目(31270697);国家科技支撑项目(2012BAD21B020106);东北林业大学大学生创新创业训练计划项目(201610225233)
孙爽(1994—),女,本科生,主要从事生物技术研究。
2017-01-03
Q949.776.2
A
10.7525/j.issn.1673-5102.2017.03.017
