脱落酸和己糖激酶抑制剂对高表达C4-PEPC转基因稻苗耐旱性的影响
2017-11-10吴敏怡何亚飞
吴敏怡 李 霞 何亚飞 张 琛 严 婷
(1.江苏省农业科学院粮食作物研究所,江苏省优质水稻工程技术研究中心,南京 210014; 2.南京师范大学生命科学学院,江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心,南京 210023; 3.南京农业大学生命科学学院,南京 210095; 4.南京林业大学生物与环境学院,南京 210037)
脱落酸和己糖激酶抑制剂对高表达C4-PEPC转基因稻苗耐旱性的影响
吴敏怡1,2李 霞1*何亚飞1,4张 琛1,3严 婷1,3
(1.江苏省农业科学院粮食作物研究所,江苏省优质水稻工程技术研究中心,南京 210014;2.南京师范大学生命科学学院,江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心,南京 210023;3.南京农业大学生命科学学院,南京 210095;4.南京林业大学生物与环境学院,南京 210037)
为了研究高表达转玉米C4-磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)基因水稻(PC)的耐旱性机制,本研究以PC和未转基因野生型原种kitaake为材料,分别在光照和黑暗预处理24 h,其中光照处理中光强为600 μmol·m-2·s-1,预处理后稻苗再在15%聚乙二醇-6000模拟干旱胁迫下,同时使用药理学的方法,通过加入脱落酸和己糖激酶的专一性抑制剂100 μmol·L-1去甲二氢愈创木酸和10 mmol·L-1葡萄糖胺,观察两种水稻4~5叶期稻苗耐旱表现。结果发现,与WT水稻相比,在PEG-6000处理后,经过光预处理的PC水稻叶片相对含水量下降较少,始终比WT的高,而且丙二醛含量则较少,脯氨酸诱导增加,表现耐旱;而经过暗预处理后PC植株显著降低这个优势,表明光预处理有利于PC耐旱性的表现;黑暗预处理均显著下调了2供试材料植株叶片中可溶性糖的含量,而对可溶性蛋白的含量影响不显著;而光预处理后PC水稻叶片内可溶性糖含量比WT增加,而在黑暗预处理则PC的显著低于WT的,其中葡萄糖胺对光预处理下PC的可溶性糖含量的下调作用最显著;暗预处理逆转或消除了NO,H2O2和钙离子含量变化趋势,这些变化与暗预处理减少了两材料叶片蔗糖和葡萄糖含量变化同步;光暗预处理对两材料的PEPC酶活性的差异影响不大,表明外源玉米C4-PEPC在水稻中是组成型表达。可见PC叶片可部分通过糖组分,参与内源糖介导ABA和HXK信号途径,缓解干旱处理对叶片的伤害,稳定光合能力。
水稻;磷酸烯醇式丙酮酸羧化酶;干旱;糖;脱落酸;己糖激酶
水稻是世界上超过一半人口的主食,是最重要的粮食作物之一,而干旱制约着作物,尤其是水稻的生长和发育,降低其产量[1]。近年来全球干旱呈加重趋势,因此,从多角度解析水稻的耐旱机理成为现代农业生物学研究的热点之一。而C4植物如玉米在干旱等逆境条件下表现较高的光合效率和水分利用率,进而表现一定的抗逆性,维持作物产量[2]。因此,科学家们一直希望将C4植物中的关键基因转入C3植物水稻中,增强水稻光合效率和耐逆性,提高产量,保证世界粮食安全[3]。玉米磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC,EC.1.1.31)是C4植物光合途径的关键酶。PEPC不仅在提高C4光合效率中起到关键作用,并且在耐旱性方面也扮演着重要的角色[4]。现已通过基因工程技术获得高表达转玉米C4-PEPC基因(基因登陆号:Zm09g542372)水稻(PC)[5~6]。不少研究表明高表达转玉米C4-PEPC基因植株不仅表现出较强的光合能力和较高产量[7~10],而且表现耐旱和耐低氮的特性[11~14]。
当植物遇到干旱胁迫时,利用自身细胞合成可溶性糖,降低细胞的渗透势,增加细胞吸水,使得细胞保持一定的膨压,从而维持植物体原来的生理生化活动[15]。相同干旱程度,相同的生长时期,同一物种中可溶性糖的增加量愈显著,其渗透调节能力愈强,植物的抗旱性与渗透调节能力呈正相关[16]。植物中的糖也可以直接作为抗氧化剂淬灭氧化物质[17],调节植物生长发育,并应对不良环境[18]。近年来,糖信号作为植物科学研究的前沿问题之一,吸引了大量的科学家的兴趣[19]。之前的研究工作已经发现,在正常条件下,高表达的转C4-pepc基因水稻(PC)在生育后期不同组织(包括叶片,茎秆和籽粒)中碳氮代谢酶活性显著高于未转基因的野生型原种(WT),且可溶性糖含量也显著高于WT[20~21],而且表现耐旱的优势[22],那么在干旱条件下,高表达转PEPC基因水稻体内的糖是否作为信号分子参与干旱的响应,是一个值得深入研究的问题。
脱落酸(abscisic acid,ABA)是调控植物发育及其对外界环境适应的重要信号分子[23]。而己糖激酶(Hexokinase,HXK)是一种多功能蛋白,既能催化糖酵解的第一步,又参与植物糖感知和转导过程,在糖信号的调节中发挥重要作用[24]。HXK能磷酸化的底物有葡萄糖、果糖、甘露糖和半乳糖等,它还是联系植物糖和植物激素的关键元件[25]。通过分析拟南芥糖信号转导突变体与激素信号转导突变体在表型、遗传、生理和分子生物学等中关系的研究证实,糖与ABA、乙烯(Ethylene)、吲哚-3-乙酸(indole-3-acetic acid,IAA)、细胞分裂素(cytokinin,CTK)以及赤霉素(game archives,GA)等主要激素之间均有联系[26],并提出植物可能通过调节葡萄糖水平,参与ABA介导并依赖己糖激酶的糖途径,实现从响应逆境到抵御逆境的跨越[27],但相关的实验证据尚不多见。本研究选取干旱耐性和糖含量差异的高表达转玉米C4-磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)基因水稻(PC)和未转基因的野生型原种(WT)为研究材料,在供试材料的4~5叶期,通过设置光、暗两种预处理处理,然后再采用15%聚乙二醇6000(polyethylene glycol-6000,PEG-6000)处理稻苗进行模拟干旱处理,并设置100 μmol·L-1ABA抑制剂去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA)和10 mmol/L的HXK抑制剂葡萄糖胺(glucosamine,Gluc)根吸入实验,分析供试水稻糖水平与两个重要信号途径在植株干旱响应中的表现,期望了解内源可溶性糖在PC水稻缓解干旱胁迫的生理功能,为“C4稻”在干旱中的应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 供试材料的培养
本研究使用的材料为高表达转玉米转C4-pepc基因(基因登陆号:Zm09g542372)水稻(PC)和原种(WT)[28]。水稻种子首先使用50%次氯酸钠溶液浸种消毒15 min,然后用75%的乙醇洗涤浸泡5 min,随后使用蒸馏水反复冲洗数次直至无乙醇残留。将消毒后的种子放在培养皿中,使用纯净水浸没,置于30℃黑暗条件2 d浸种,然后催芽2 d,待长出均一的芽之后,随后转到培养板上,使用改良后的国际水稻培养液进行培养[29]。置于30℃/25℃(昼/夜)、14 h/10 h(光/暗)光照培养箱中培养。待水稻材料长到4~5叶期时,取长势相一致稻苗进行相关处理,测定相同叶位的叶片(第二片完全展开的叶)的各项生理指标。
1.1.2 干旱处理以及抑制剂引入方法
采用15%(w/v)PEG-6000对水稻植株进行模拟干旱处理,将4~5叶期水稻分别在光照和黑暗条件预处理24 h。然后再分别加入营养液、100 μmol·L-1ABA抑制剂去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA)+营养液、10 mmol·L-1的HXK抑制剂葡萄糖胺(glucosamine,Gluc)+营养液、100 μmol·L-1NDGA+10 mmol·L-1Gluc+营养液,使植株根吸入上述试剂,在暗中处理60 min,然后再加入15% PEG-6000处理4 h,每个处理20株,处理完毕的材料迅速用液氮冷冻,然后置于-80℃储存,处理完毕后统一测定各项生理指标[30]。
1.2 实验方法
1.2.1净光合速率(Netphotosyntheticrate,Pn)、气孔导度(Stomatalconductance,Gs)和蒸腾速率(transpirationrate,Tr)的测定
采用Li等[31]方法,LI-6400便携式光合测定仪(LI-COR,美国),使用红蓝光源开放式系统测定,设定PPED为1 000 μmol·m-2·s-1,流速为500 μmol·s-1。选取4~5叶期稻苗的倒二叶进行,测定供试材料的Pn、Gs和Tr。每个处理测定3~5个重复。
1.2.2叶片相对含水量(relativewatercontent,RWC)的测定
剪取材料倒二叶的中间部位叶片,称鲜重(Fresh weight,Fw)。将叶片悬浮于放有蒸馏水的三角瓶中黑暗处理24 h,之后称其饱和鲜重(Turgid fresh weight,Tw)。最后将叶片105℃杀青20 min,然后置于75℃下烘至衡重,使用千分之一的天平称其干重(Dry weight,Dw)。RWC按照如下公式计算:
RWC%=(Fw-Dw)/(Tw-Dw)×100%[32]
(1)
1.2.3丙二醛(Malondialdehyde,MDA)含量的测定
丙二醛含量的测定使用硫代巴比妥酸法。称取植物叶片0.2 g,剪碎后加入10%三氯乙酸(Trichloroacetic acid,TCA)2 mL和少量石英砂,研磨至匀浆再加入4 mL TCA进一步研磨(即体积为6 mL),将匀浆液4 000 g离心10 min,随后吸取上清液2 mL(对照为2 mL蒸馏水),加入2 mL 0.6%硫代巴比妥酸溶液,混匀后于沸水浴中反应15 min,迅速冷却再离心,取上清测定在532、600和450 nm波长下的吸光度[33]。
1.2.4 脯氨酸(proline,pro)含量的测定方法
准确称取0.3 g样品,用磺基水杨酸溶液研磨提取,磺基水杨酸的最终体积为10 mL。匀浆液转入玻璃离心管中,在沸水浴浸提10 min。冷却后,以5 000 g离心10 min,取上清液待测。吸取上清液2 mL于具塞试管中(对照加入2 mL水)、2 mL冰醋酸和3 mL酸性茚三酮试剂,摇匀后沸水浴中加热显色40 min,冷却至室温加人10 mL甲苯萃取红色产物,完全分层后,取甲苯层用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国)在波长520 nm下比色。同样以相同条件制定标准曲线。脯氨酸含量计算公式:
脯氨酸含量(pg/g)=[XxV1/V2]/样重(g)
(2)
式中:X为测定液中脯氨酸含量;Vl为提取液体积(mL);V2为反应液体积(mL)[34]。
1.2.5 可溶性蛋白含量的测定
称取0.5叶片加3 mL预冷的丙酮研磨,将匀浆液转移至离心管中4℃ 10 000 g离心10 min,吸取上清液,即为粗蛋白提取液。在3 mL考马斯亮兰G-250蛋白试剂(100 mg考马斯亮蓝G-250溶于50 mL 95%乙醇中,加入100 mL 85%的正磷酸,用蒸馏水定溶到1 L,搅拌下放置过夜,过滤后贮于棕色瓶中备用)中加入粗蛋白提取液50 μL,使用UV-1200紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),在595 nm下测定OD值。以标准牛血清蛋白浓度作标准曲线,计算粗提液的可溶性蛋白含量[35]。
1.2.6 一氧化氮(Nitric oxide,NO)含量的测定
称取0.1 g样品,加入1 mL磷酸缓冲液提取(pH7.4)研磨,将匀浆液转移至离心管中4℃ 10 000 g离心10 min,收集上清液。取50 μL上清液,用100 units的超氧化物歧化酶和100 units的过氧化氢酶反应5 min后,以去除内源性活性氧(reactive oxygen species,ROS),然后向其中加入5 mL氧合血红蛋白(5 mmol·L-1),并孵育2 min,在NO被氧合血红蛋白转化为高铁血红蛋白的基础上,使用UV-1200紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国)。在550 nm处测定吸光值,最后计算一氧化氮含量[36]。
1.2.7过氧化氢(hydrogenperoxide,H2O2)和钙离子(Calcium,Ca2+)含量测定
根据Patterson[37]的方法测定H2O2含量。称取0.3 g叶片加3 mL预冷的丙酮研磨,将匀浆液转移至离心管中4℃ 10 000 g离心10 min,吸取上清液并加入0.2 mL浓氨水和0.1 mL 20%的四氯化钛盐酸溶液,25℃条件下反应10 min,再将反应混合物4℃下8 000 g离心10 min,离心后用冷丙酮洗涤两次,并加入3 mL的1 mol·L-1H2SO4。使用UV-1200紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),在410 nm处测定吸收值,使用已知浓度的H2O2作标准曲线,最后根据标准曲线计算H2O2含量。
根据杨彩琴等[38]方法测定Ca2+含量。称取0.1 g样品,加入1 mL磷酸缓冲液提取(pH7.4)研磨,将匀浆液转移至离心管中4℃ 10 000 g离心10 min,收集上清液。取50 μL上清液,加入1 mL甲基麝香草酚兰(Methyl thymol blue complexon,MTB)试剂,0.6%聚乙烯吡咯烷酮(Polyvinylpyrrolidone,PVP),0.25 mol·L-1MTB,0.1 mol·L-1HCl),2 mL碱性溶液(0.1%甘氨酸,0.2 mol·L-1Na2SO3,0.23 mol·L-1NaOH),以2.5 mmol·L-1钙代替试液做标准液,以去双蒸水做空白对照,静止5 min后,使用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),在610 nm测定吸光值,最后计算Ca2+含量。
1.2.8 可溶性糖含量的测定
采用蒽酮比色法进行,糖在浓硫酸作用下,可经脱水反应生成糖糠或羟甲基糠醛可与蒽酮反应生成有色物质,用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),在630 nm处测定吸光值[39]。
1.2.9 蔗糖(Sucrose,Suc)含量的测定
蔗糖在水解液中经过沸水浴,用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),产物在290 nm处有最大吸收峰,测定其OD值,计算出蔗糖含量。方法根据南京建成生物工程研究所生产的试剂盒(货号:F006)说明书进行。
1.2.10 葡萄糖(Glucose,Glu)含量的测定
葡萄糖经过葡萄糖氧化酶作用生成葡萄糖酸和过氧化氢,后者在过氧化物酶的作用下,将还原性4-氨基安替比林与酚偶联缩合成可被分光光度计测定的醌类化合物。用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),在290 nm处测定吸光值,其过程参照南京建成生物工程研究所生产的试剂盒(货号:F006)说明书进行。
1.2.11 果糖(Fructose,Fru)含量的测定
果糖与基质液作用,其产物用用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),产物在285 nm处有最大吸收峰,可通过紫外分光光度比色测定其含量,具体步骤根据南京建成生物工程研究所生产的试剂盒(货号:F006)说明书进行。
1.2.12磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvatecarboxylase,PEPC)活性的测定
参照Giglioli-Guivarc’h等[40]的方法,将0.15 g叶片置于研钵中冰浴研磨,加入1.5 mL粗酶提取缓冲液(50 mmol·L-1Tris-HCI(三(羟甲基)氨基甲烷)(pH7.8),5 mmol·L-1二硫苏糖醇(dithiothreitol,DTT),1 mmol·L-1氯化镁,2% PVP),在4℃下13 000 g离心10 min,收集上清液,即为粗酶液。酶活性测定反应体系(1 mL):50 mmol·L-14-羟乙基哌嗪乙磺酸(4-2-hydroxyethyl)-1-piperazineethanesulfonic acid,Hepes)-KOH(pH8.0),10 mmol·L-1碳酸氢钠,5 mmol·L-1氯化镁,0.2 mmol·L-1还原型辅酶I二钠,1.5 U苹果酸脱氢酶,50 μL粗酶液,用蒸馏水定容至1 mL,混匀后加入5 mmol·L-1磷酸烯醇式丙酮酸,用紫外分光光度计(UV-1200型,上海美谱达仪器有限公司,上海,中国),记录90 s内340 nm下光密度的下降值(每15 s记录一次),计算酶活性。
2 结果与分析
2.1PEG-6000处理对PC和WT叶片相对含水量(RWC)、丙二醛和脯氨酸含量的影响
由图1可知,与暗预处理后的植株相比,光预处理PC植株在PEG处理后其体内的RWC始终高于WT(图1:A,B),而暗预处理的WT与PC植株在干旱处理下体内的RWC含量没有显著性差异(图1:B),说明光促进PC水稻维持更强的保水能力。此外,在光处理下,单独加入ABA抑制剂NDGA和HXK抑制剂葡萄糖胺,光预处理后两材料在PEG处理下体内RWC含量进一步显著降低(图1:A),而联合加入NDGA和葡萄糖胺时,两材料体内RWC含量下降最大,提示ABA和己糖激酶途径参与对干旱的响应。丙二醛含量是植株膜质过氧化程度的指标,由图1C,D可知,与暗预处理后的植株相比,光预处理PC植株体内的MDA显著低于WT(图1:C),暗预处理PC体内的MDA含量则显著高于WT的(图1:D),说明在光预处理产物的积累有利于PC水稻膜质过氧化产物的清除。而单独或者联合加入NDGA和葡萄糖胺则对两材料的MDA含量没有影响,表明MDA的产生与两信号途径关系不大。由图1E,F可知,与暗预处理的植株相比,光预处理的脯氨酸含量显著小于暗的,而且对WT植株而言,经过暗处理的植株对ABA和HXK的响应更强烈,可通过依赖2途径加强氮代谢,表明暗预处理加强了通过ABA或者HXK途径负调节氨基酸的代谢以补偿光合产物可溶性糖的不足。在植株形态上,与光预处理植株相比,单独加入NDGA后植株再PEG6000处理后表现出一定的叶片卷曲,叶尖发黄,部分叶片萎蔫死亡的现象,而单独加葡萄糖胺后植株叶片发黄不太明显,而联合加入2种抑制剂则植株萎蔫最严重。而暗预处理,单独或者联合加入抑制剂对植株形态没有明显影响,其中PC的萎蔫程度低于同样处理WT的,表现出耐旱的特征。
2.2PEG-6000处理对PC和WT叶片可溶性蛋白和可溶性糖的含量的影响
由图2(A,B)可知,光暗预处理植株后,经PEG6000处理两植株叶片可溶性蛋白含量均诱导增加,除光预处理后PC的可溶性蛋白含量在单独PEG处理显著高于同样处理的WT的,其他处理两材料变化不大,ABA和HXK抑制剂对其的作用也不大,提示氮代谢在参与干旱响应的作用有限。而经黑暗预处理,则显著地降低了两材料可溶性糖的含量,而且PC糖的降低显著大于WT的,两材料原来在光预处理下含量的差异明显的缩小,显然ABA和HXK途径参与这个糖代谢的过程(图2D)。其中经光预处理的植株,PEG6000处理则进一步显著提高PC体内可溶性糖含量(图2C),但单独加入NDGA和葡萄糖胺均抑制这种增加趋势,且葡萄糖胺的抑制作用更明显,此时PC的可溶性糖含量反而显著低于WT的,而NDGA和葡萄糖胺共处理,则可显著增加两材料叶片可溶性糖含量,而且PC此处理的含量显著高于WT的。由此可以见,在干旱条件下,光预处理有利于光合产物可溶性糖的积累,它的调控与ABA和HXK途径正调节均有关,其中PC的可溶性糖的调节更依赖于HXK途径。
2.3PEG-6000处理对PC和WT叶片NO、H2O2和Ca2+含量的影响
第二信使分子如NO,H2O2以及钙离子均是植物耐性反应中重要的信号分子[41]。有研究表明:干旱胁迫显著提高NO含量,其增加能够提高耐旱性[42]。由图3可知,PEG6000处理显著诱导两材料叶片内NO含量的增加(图3:A~B),其中光暗预处理下对2植株叶片内NO含量的影响则不同,光预处理的PC植株在PEG6000处理后其含量显著高于WT的,而暗预处理则相反。ABA和HXK正调节光预处理PC的NO的含量,而WT则只有HXK的抑制剂显著降低其含量。暗预处理的PC体内NO在不同抑制剂单独处理和联合处理的变化趋势均与单独PEG6000处理的无明显变化(图3:A~B)。而ABA抑制剂处理则显著诱导增加了暗处理WT叶内NO的含量,表明在黑暗下,ABA负调节WT的NO含量。干旱胁迫能提高
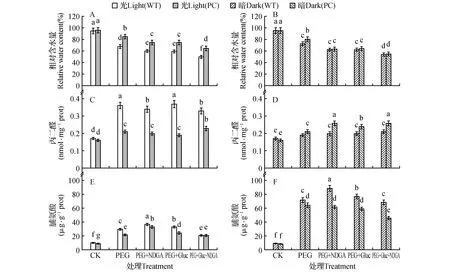
图1 高表达转玉米C4-pepc基因水稻(PC)和未转基因供体(WT)在光(600 μmol·m-2·s-1)暗预处理后不同抑制剂和15% PEG处理4 h后叶片RWC的变化 MDA和脯氨酸含量的变化(A,C,E.光预处理;B,D,F.暗预处理) ABA专一性的抑制剂:100 μmol·L-1去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA);HXK专一性的抑制剂:10 mmol·L-1葡萄糖胺(glucosamine, Gluc) 不同字母表示数据间的差异显著(P<0.05),下同。Fig.1 RWC,MDA and pro contents of leaves in PC and WT lines pretreated by light (600 μmol·m-2·s-1) or dark for 24 h under 15% PEG treatment with different inhibitors for 4 h A,C,E. Pre-light treatment; B,D,F. Pre-dark treatment NDGA(nordihydroguaiaretic acid):a specific inhibitor of Abscisic acid,100 μmol·L-1; Gluc(glucosamine):a specific inhibitor of hexokinase(HXK),10 mmol·L-1 Different letters mean different significant of data(P<0.05),the same as below.
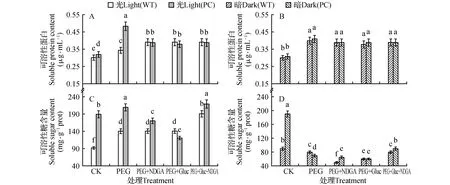
图2 高表达转玉米C4-pepc基因水稻和未转基因供体(WT)在光(600 μmol·m-2·s-1) 暗预处理后不同抑制剂和15% PEG处理4 h后叶片可溶性蛋白的变化和可溶性糖的含量的变化 A,C.光预处理;B,D.暗预处理 ABA专一性的抑制剂:100 μmol·L-1去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA);HXK专一性的抑制剂:10 mmol·L-1葡萄糖胺(glucosamine,Gluc)Fig.2 Contents of soluble protein and soluble sugar of WT and PC lines pretreated by light(600 μmol·m-2·s-1) or dark for 24 h under 15% PEG treatment with different inhibitors for 4 h A,C.Pre-light treatment; B,D.Pre-dark treatment NDGA(nordihydroguaiaretic acid):a specific inhibitor of Abscisic acid,100 μmol·L-1; Gluc(glucosamine):a specific inhibitor of hexokinase(HXK),10 mmol·L-1

图3 高表达转玉米C4-pepc基因水稻和未转基因供体(WT)在光暗预处理24 h后植株在不同抑制剂和15% PEG处理下叶片NO、H2O2和Ca2+含量的变化 A,C,E.光预处理;B,D,F.暗预处理 ABA专一性的抑制剂:100 μmol·L-1去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA);HXK专一性的抑制剂:10 mmol·L-1葡萄糖胺(glucosamine,Gluc)Fig.3 Contents of NO,H2O2 and Ca2+ of WT and PC lines pretreated by light or dark for 24 h under 15% PEG treatment with different inhibitors for 4 h A,C,E. Pre-light treatment;B,D,F. Pre-dark treatment NDGA(nordihydroguaiaretic acid):a specific inhibitor of Abscisic acid,100 μmol·L-1; Gluc(glucosamine):a specific inhibitor of hexokinase(HXK),10 mmol·L-1

图4 高表达转玉米C4-pepc基因水稻和未转基因供体(WT)在光暗预处理24 h后植株在不同抑制剂和15% PEG处理4 h后叶片蔗糖、葡萄糖和果糖的含量的变化 A,C,E.光;B,D,F.暗 ABA专一性的抑制剂:100 μmol·L-1去甲二氢愈创木酸(nordihydroguaiaretic acid,NDGA);HXK专一性的抑制剂:10 mmol·L-1葡萄糖胺(glucosamine,Gluc)Fig.4 Contents of sucrose,glucose and fructose of WT and PC lines pretreated by light or dark for 24 h under 15% PEG treatment with different inhibitors for 4 h A,C,E. Pre-light treatment;B,D,F. Pre-dark treatment NDGA(nordihydroguaiaretic acid):a specific inhibitor of Abscisic acid,100 μmol·L-1; Gluc(glucosamine):a specific inhibitor of hexokinase(HXK),10 mmol·L-1
植株叶片H2O2含量[43],适量增加H2O2有利于提高PC水稻光合作用[10],从而增强耐旱性。由图3(C~D)可知,PEG处理同样诱导了光暗预处理后两材料植株的H2O2含量,其中,光预处理的PC在PEG6000单独处理下的H2O2含量显著地低于同处理的WT的(图3C);而经暗预处理两材料的H2O2含量均被ABA和HXK正调节,其中PC的更依赖HXK,而WT则依赖ABA途径(图3D)。Ca2+参与干旱信号ABA的传递,诱导胁迫相关基因的表达,调节气孔的开闭程度,从而增强植物对干旱的耐受能力[44]。由图3E可知,与处理前相比,在光下PEG6000处理显著诱导了WT叶片中钙离子含量的增加,而PC则在同样条件下没有显著变化。单独或者联合加入ABA和HXK的抑制剂则进一步诱导了叶片钙离子含量的增加,表明体内钙离子合成有不依赖ABA和HXK的途径。而暗预处理后(图3F),WT和PC植株叶片体内的Ca2+含量变化无差异,且总含量显著低于经过光预处理的植株的,表明光是正调节植株体内钙离子的合成。值得关注的是,当联合加入ABA和HXK的抑制剂时,植株体内的钙离子则显著增加,不仅高于单独抑制剂处理水平,而且高于单独PEG6000处理水平。结合图2C~D中相同处理可溶性糖的变化,可以看出信号分子在两个抑制剂联合处理的显著诱导增加与该处理下可溶性糖含量的增加是同步,暗示糖在参与水稻植株对干旱的响应中发挥了重要的作用。
2.4PEG-6000处理对PC和WT叶片糖组分(蔗糖、葡萄糖和果糖)含量的影响
可溶性糖是植物在胁迫环境中所诱导产生的小分子溶质之一,主要包括葡萄糖、果糖和蔗糖等,它是植物中最重要的能源物质。在植物中,蔗糖不仅是光合作用同化产物以及体内能量运输和贮藏形式,也可以在环境胁迫中,通过玻璃化叶绿体周围的细胞液,从而降低细胞水势,增加细胞抗性[45]。其中葡萄糖是HXK的底物,磷酸化为6-磷酸葡萄糖(Glucose-6-phosphate(G-6-P)参与糖信号的调节,参与逆境响应基因和蛋白响应[17]。由图4A可知,经光预处理均显著增加了两材料叶片内蔗糖含量,而且PC体内的水平始终显著高于WT的水平。但是单独加入ABA抑制剂以及联合加入ABA和HXK抑制剂,则消除了PC和WT体内含量的差异,表明,PC体内糖的降解与ABA和HXK途径关系不大,而WT可以通过ABA途径进一步降低蔗糖的含量;显然,暗预处理后显著降低了两材料体内蔗糖的含量(图4B),其中在单独PEG6000处理以及PEG6000H和ABA抑制剂联合处理后,PC的仍显著高于WT的,而加入HXK抑制剂则相反,提示己糖激酶途径参与低水平蔗糖的调节。葡糖糖和果糖作为蔗糖分解的单糖产物,可以作为小分子溶质调节植物面对环境胁迫中的渗透压力或者转化为葡萄糖-6-磷酸(G-6-P)作为信号传导分子发挥作用[46]。从图4E可知,与没有PEG6000处理的对照相比,光预处理的2植株在单独PEG6000处理后均显著提高了其体内葡萄糖含量,其中PC的增加水平显著高于WT的。而单独或者联合加入ABA和HXK抑制剂,则消除了PC体内葡萄糖的增量,表明两材料对ABA和HXK途径敏感性差异是其葡萄糖含量差异的重要原因。其中对WT而言,单独加入HXK抑制剂则进一步诱导了其体内葡萄糖含量的增加,而联合加入ABA和HXK抑制剂则显著降低了其葡萄糖含量,可见,WT体内葡萄糖含量的调节是更依赖与ABA途径。经暗预处理后(图4D),两材料各处理的葡萄糖水平也显著降低,显著低于光预处理的植株的,其中单独PEG6000处理下,PC体内的水平始终显著高于WT的,而单独或联合加入2种抑制剂均进一步显著降低PC体内葡萄糖的含量,表明:PC内源糖含量是需要ABA和HXK途径正调节,而对于WT,经暗处理的植株只有单独或者联合加入HXK的抑制才显著降低其活性,而单独加入ABA的抑制剂,则显著诱导增加其含量,提示,ABA负调节而HXK以正调节参与低水平葡萄糖含量的代谢。从图4E进一步看出,两材料体内果糖含量的变化与葡萄糖的类似。
2.5光暗预处理对PEG-6000处理WT和PC水稻体内PEPC酶活性以及光合参数的影响
从图5可以看出,无论是光还是暗预处理后,PC的PEPC酶活性都是始终高于WT的,PC是组成型表达模式。在本研究的不同处理条件下,ABA和HXK均负调节PEPC酶活性。而且在两途径抑制之后,无论是光还是暗预处理,PC的PEPC酶活性仍显著高于单独PEG6000处理的水平,提示PC还存在不依赖于ABA和己糖激酶途径的补偿途径,上调PEPC酶活性;而WT植株的PEPC酶活性很低,且变化不明显。图6植株干旱处理前后光合参数的表现,也显示了PC在正常和干旱条件具有的较高的光合能力,也是其抵御干旱逆境的重要生理基础。
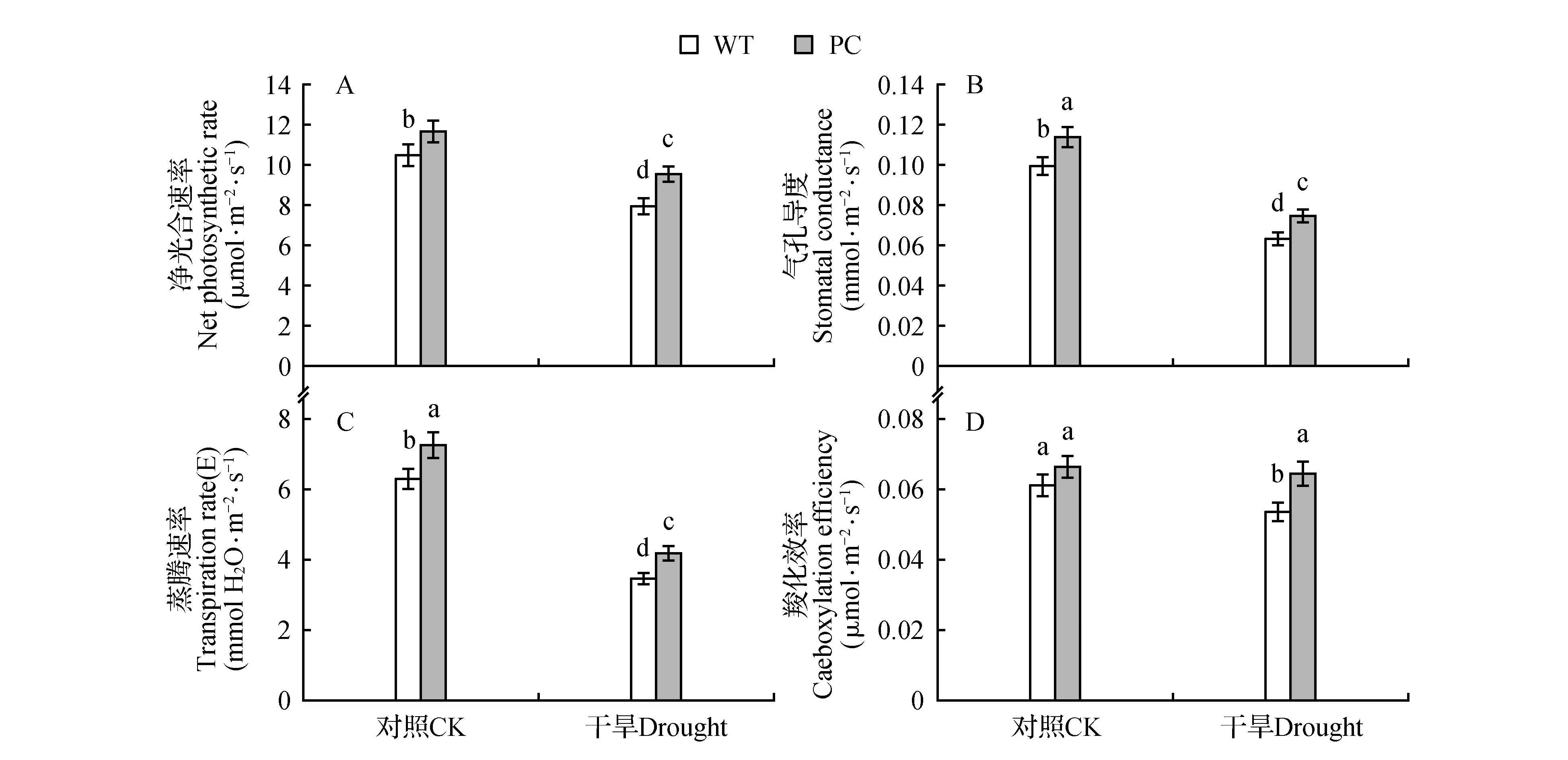
图6 15% PEG6000处理4 h前后,2水稻材料4叶期功能叶片的净光合速率、气孔导度、蒸腾速率和羧化效率的变化A.净光合速率;B.气孔导度;C.蒸腾速率;D.羧化效率 不同字母表示0.05水平上的差异显著。Fig.6 Net photosynthetic rate,stomatal conductance,transpiration rate and carboxylation efficiency in two rice lines before and after 15% PEG 6000 treatment for 4 h A.Net photosynthetic rate;B.Stomatal conductance;C.Transpiration rate;D.Caeboxylation efficiency The different letters are significant different at 0.05 level.
3 讨论
C4植物拥有一个“CO2”浓缩机制,通过固定环境中较低浓度的CO2,提高Rubisco羧化效率,抑制其加氧活性,从而提高植物的光合效率。PEPC是C4光合途径的关键酶之一,此酶基因已在很多C4植物如玉米[47]、高粱[48]等被克隆,并在部分C3植物中实现了高表达,包括烟草[49],小麦[50]以及拟南芥[51]等。Ku等首先将包含启动子、终止子以及全部外显子和内含子的完整玉米C4-PEPC,采用农杆菌介导方法转入粳稻品种Kitaake中,且成功地获得了高水平表达的转基因水稻植株,其中部分转基因株系的PEPC酶活性比未转基因植株增加高达110倍,且植株中的PEPC蛋白表达量也显著增加,约占总可溶性蛋白的12%,这些高表达的转基因植株不仅表现光合能力增强,且氧抑光合作用下降[4],从此激发了科学家通过基因工程改良水稻C4光合特性的研究热潮。之后玉米C4-PEPC全序列基因也成功转入籼稻中,使转基因植株耐高温[8]。转基因植株也报道耐高光强逆境,这与其维持稳定的光合机构密切相关[20];转Zmppc基因水稻在干旱胁迫下还可通过提高玉米黄质含量,进而提高对过剩光能耗散能力,同时增强了叶片超氧化物岐化酶(Superoxide Dismutase,EC1.15.1.1,SOD)、过氧化物酶(Peroxidase,EC1.11.1.7,POD)和过氧化氢酶(Catalase,EC1.11.1.6,CAT)活性,提高了氧化防护能力[11],表现耐旱和籽粒产量的增加[9,22,52~53]。在干旱胁迫条件下,玉米C4-PEPC在水稻中的高表达能够使水稻植株维持较高的ATP含量[13]、稳定的钙离子浓度[32]以及与ABA、NO等之间的相互作用来响应干旱,维持较高的PSⅡ光化学效率[22]。前期已通过同位素14C观察到,转基因水稻植株增加的碳可合成C4酸-草酰乙酸和天冬氨酸[7],并且观察到转基因植株的碳氮代谢酶活性诱导增加和光合产物可溶性糖的大量积累[21]。最近的研究表明:糖是植物生长发育和基因表达的重要调节因子,它不仅是能量来源和结构来源,而且在信号转导中具有类似激素的初级信使作用[16]。本研究通过设置2个与干旱响应相关信号途径的抑制剂引入,观察具有内源糖含量和耐旱表现差异植株的生理表现,有利于找到糖与干旱响应之间的有机联系。
相对含水量(RWC)是描述植物保水能力的重要指标之一,干旱胁迫可以降低植株叶片的RWC[54]。本研究观察到,通过光和暗不同预处理,均造成了两材料植株体内可溶性糖含量显著降低,但是PC体内的始终高于WT的,而且PC对干旱逆境较强的保水能力,无论是光还是暗预处理均具有优势,其中ABA和HXK途径均参与了这个干旱响应过程。但是在暗预处理之后则显著缩小了两材料的差距,相对含水量则不再表现显著差异,提示了内源糖含量水平与植株保水能力的关联,而且光参与了PC的ABA和HXK途径对干旱的响应。丙二醛(MDA)是植物细胞膜脂过氧化作用的主要产物之一,其含量可作为参考植物细胞遭受逆境伤害程度的依据。本研究中,光照预处理的PC水稻MDA含量明显低于WT,而在黑暗预处理PC体内MDA含量则高于WT的,表明PC在干旱条件对MDA的清除是需要光的参与的。植物体内可溶性糖对ROS有双重作用,即同时作为促进氧化的分子和抗氧化剂,它们既可以参与ROS的产生途径,也可以参与NADPH的产生途径如氧化戊糖磷酸途径,从而促进ROS的清除[55~56]。结合本研究中黑暗预处理后PC体内可溶性糖的含量和MDA含量的相反变化趋势,进一步反证了内源可溶性糖通过增强ROS的清除能力而参与干旱的耐性。值得关注的是,黑暗预处理则显著增强了两材料脯氨酸的含量,而且无论是光还是暗预处理,WT中脯氨酸含量始终高于PC的,但是脯氨酸的表现并没有逆转两材料对干旱逆境的表现,表明内源糖对植株的干旱耐性更重要,推测暗预处理表现的植株脯氨酸的积累可能与蛋白质的分解有关,而对PC耐旱的响应机制关系不大。
植物可溶性糖也可参与渗透调节并在维持植物中蛋白稳定方面其重要作用[15]。已有实验证明在干旱和盐等环境胁迫下,可溶性糖参与植物中渗透调节以及复水后植物体内的生理和生化恢复和修复过程[57~58]。本研究观察到PC在单独PEG6000处理下,其叶内可溶性糖含量则显著低于WT的。值得关注的是,PC中蔗糖、葡萄糖和果糖等其他糖组分,无论是光还是暗预处理仍高于WT的,表明PC体内糖动员能力始终高于WT的,提示PC中可溶性糖除了用于糖的分解代谢,还可能以低浓度参与信号传导途径。
第二信使分子均可快速响应干旱逆境信号,如NO,H2O2和钙离子。本研究表明:NO在ABA和己糖激酶信号途径下游参与干旱响应。而H2O2则诱导增加在ABA和己糖激酶信号上游发挥作用。H2O2作为ROS和信号分子的双重身份,其含量水平对于其作用的发挥去向至关重要。适当浓度的外源H2O2可促进PC光合能力的发挥[59]。本研究的结果也观察到虽然两材料在PEG6000单独处理后均诱导了其体内H2O2含量的增加,但是PC的H2O2含量始终维持在显著低于WT的水平。与此同时,在作为生物膜的稳定剂,Ca2+在维护植物细胞膜的稳定性方面具有重要作用,细胞内含有一定量的Ca2+有利于提高植物抗旱能力[58]。在这篇研究中,也观察到PC在单独PEG6000处理下,其叶内钙离子含量保持稳定。看来,PC首先利用现有内源的糖转化,调节糖的水平,然后通过ABA或己糖激酶信号途径来感受干旱逆境,之后再通过如上这些第二信使分子参与下游靶基因的响应或适应机制。
先前有研究表明干旱、盐和冷害等逆境可以诱导植物PEPC活性的增强[22,60],并且C4酸的激活对于植物的糖代谢是至关重要的[61]。PC的早期研究已经发现玉米C4-PEPC基因在水稻的高表达观察到转基因植株内C4酸积累的增加[7],因此,外源C4-PEPC是导致水稻光合产物如碳水化合物(可溶性糖)含量增加的重要分子基础。在本研究的结果也证实在干旱条件下,ABA途径和HXK途径均可负调节PEPC酶活性,有利于糖的分解和动员,促进其以低水平作为信号分子参与干旱响应,并且这个诱导过程分别在光和暗预处理后仍然显现。值得注意的是,在两途径同时抑制的条件下,仍然可以诱导PEPC酶活性的增加,显示,PEPC酶活性存在多条激活机制,如已报道的磷脂酸途径或细胞外ATP等[62~64]。PC的多条适应机制有助于其灵活地响应干旱逆境。
4 结论
PC水稻的内源糖参与其对干旱的响应,其中包括ABA途径和HXK信号途径,但更依赖于HXK途径,这些调节过程是依赖于光的介导。本研究提示了HXK在PC植株中整合干旱胁迫和代谢信号中具有重要功能,今后以HXK途径为中心,研究PC体内与信号传导相关的激酶级联放大途径,将加深植物对干旱胁迫耐性机理的认识。
1.Chaves M M,Flexas J,Pinheiro C.Photosynthesis under drought and salt stress:regulation mechanisms from whole plant to cell[J].Annals of Botany,2009,103(4):551-560.
2.Zhu X G,Long S P,Ort D R.Improving photosynthetic efficiency for greater yield[J].Annual Review of Plant Biology,2010,61(1):235-261.
3.Karki S,Rizal G,Quick W P.Improvement of photosynthesis in rice(OryzasativaL.) by inserting the C4pathway[J].Rice,2013,6:28.
4.O’leary B,Park J,Plaxton W C.The remarkable diversity of plant PEPC(phosphoenolpyruvate carboxylase):recent insights into the physiological functions and post-translational controls of non-photosynthetic PEPCs[J].Biochemical Journal,2011,436(1):15-34.
5.Ku M S B,Agarie S,Nomura M,et al.High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plants[J].Nature Biotechnology,1999,17(1):76-80.
6.Jeanneau M,Gerentes D,Foueillassar X,et al.Improvement of drought tolerance in maize:towards the functional validation of theZm-Asr1 gene and increase of water use efficiency by over-expressing C4-PEPC[J].Biochimie,2002,84(11):1127-1135.
7.Jiao D M,Kuang T Y,Li X,et al.Physiological characteristics of the primitive CO2concentrating mechanism in PEPC transgenic rice[J].Science in China Series C:Life Sciences,2003,46(4):438-446.
8.Bandyopadhyay A,Datta K,Zhang J,et al.Enhanced photosynthesis rate in genetically engineered indica rice expressingpepcgene cloned from maize[J].Plant Science,2007,172(6):1204-1209.
9.Lian L,Wang X W,Zhu Y S,et al.Physiological and photosynthetic characteristics of indica Hang2 expressing the sugarcanePEPCgene[J].Molecular Biology Reports,2014,41(4):2189-2197.
10.Ren C G,Li X,Liu X L,et al.Hydrogen peroxide regulated photosynthesis in C4-pepc transgenic rice[J].Plant Physiology and Biochemistry,2014,74:218-229.
11.Ding Z S,Sun X F,Huang S H,et al.Response of photosynthesis to short-term drought stress in rice seedlings overexpressing C4phosphoenolpyruvate carboxylase from maize and millet[J].Photosynthetica,2015,53(4):481-488.
12.钱宝云,刘小龙,李霞.钙肥对不同内源钙含量水稻品种光合作用的影响[J].江苏农业学报,2014,30(3):467-473.
Qian B Y,Liu X L,Li X.Photosynthesis of rice cultivars with various endogenous calcium contents in response to calcium fertilizer application[J].Jiangsu Journal of Agricultural Sciences,2014,30(3):467-473.
13.霍垲,陆巍,李霞.干旱胁迫下调节ATP的含量对提高转玉米C4型pepc水稻光合速率的影响[J].中国生态农业学报,2015,23(5):605-613.
Huo K,Lu W,Li X.Effect of regulating ATP on improving photosynthetic rate of transgenic rice with overexpressing maizeC4pepcunder drought stress[J].Chinese Journal of Eco-Agriculture,2015,23(5):605-613.
14.唐玉婷,李霞,陆巍,等.高表达转C4型PEPC基因水稻在低氮下诱导碳氮酶稳定光合作用[J].华北农学报,2015,30(4):95-100.
Tang Y T,Li X,Lu W,et al.Transgenic rice with high expression of C4-PEPCgenes induced higher carbon and nitrogen key enzyme to maintain photosynthesis under low nitrogen condition[J].Acta Agriculturae Boreali-Sinica,2015,30(4):95-100.
15.Wingler A,Roitsch T.Metabolic regulation of leaf senescence:interactions of sugar signalling with biotic and abiotic stress responses[J].Plant Biology,2008,10(S1):50-62.
16.Ruan Y L,Jin Y,Yang Y J,et al.Sugar input,metabolism,and signaling mediated by invertase:roles in development,yield potential,and response to drought and heat[J].Molecular Plant,2010,3(6):942-955.
17.Keunen E,Peshev D,Vangronsveld J,et al.Plant sugars are crucial players in the oxidative challenge during abiotic stress:extending the traditional concept[J].Plant,Cell &Environment,2013,36(7):1242-1255.
18.Kunz S,Pesquet E,Kleczkowski L A.Functional dissection of sugar signals affecting gene expression inArabidopsisthaliana[J].PLoS One,2014,9(6):e100312.
19.Lastdrager J,Hanson J,Smeekens S.Sugar signals and the control of plant growth and development[J].Journal of Experimental Botany,2014,65(3):799-807.
20.李霞,王超,任承钢,等.正丁醇和高光强下转玉米pepc基因水稻叶片超微结构的变化[J].西北植物学报,2010,30(8):1614-1621.
Li X,Wang C,Ren C G,et al.Change of micro-structure in transgenic rice ofpepcgene from maize with high photo-efficiency under the strong light with 1-Butanol treatment[J].Acta Botanica Boreali-Occidentalia Sinica,2010,30(8):1614-1621.
21.Li X,Wang C.Physiological and metabolic enzymes activity changes in transgenic rice plants with increased phosphoenolpyruvate carboxylase activity during the flowering stage[J].Acta Physiologiae Plantarum,2013,35(5):1503-1512.
22.Liu X L,Li X,Zhang C,et al.Phosphoenolpyruvate carboxylase regulation inC4-PEPCexpressing transgenic rice during early responses to drought stress[J].Physiologia Plantarum,2017,159(2):178-200,doi:10.1111/ppl.12506.2016.
23.Tuteja N.Abscisic acid and abiotic stress signaling[J].Plant Signaling & Behavior,2007,2(3):135-138.
24.Granot D,David-schwartz R,Kelly G.Hexose kinases and their role in sugar-sensing and plant development[J].Frontiers in Plant Science,2013,4:44.
25.Cho J I,Ryoo N,Eom J S,et al.Role of the rice hexokinasesOsHXK5 andOsHXK6 as glucose sensors[J].Plant Physiology,2009,149(2):745-759.
26.Albacete A A,Martínez-andújar C,Pérez-alfocea F.Hormonal and metabolic regulation of source-sink relations under salinity and drought:from plant survival to crop yield stability[J].Biotechnology Advances,2014,32(1):12-30,doi:10.1016/j.biotechadv.2013.10.005.
27.Cho Y H,Sheen J,Yoo S D.Low glucose uncouples hexokinase1-dependent sugar signaling from stress and defense hormone abscisic acid and C2H4responses inArabidopsis[J].Plant Physiology,2010,152(3):1180-1182.
28.Chen P B,Li X,Huo K,et al.Promotion of photosynthesis in transgenic rice over-expressing of maize C4phosphoenolpyruvate carboxylase gene by nitric oxide donors[J].Journal of Plant Physiology,2014,171(6):458-466.
29.Yoshida S,Fomo D A,Cock J H,et al.Laboratory manual for physiological studies of rice[M].Los Baos:IRRI,1972:61-64.
30.Qian B Y,Li X,Liu X L,et al.Enhanced drought tolerance in transgenic rice over-expressing of maize C4phosphoenolpyruvate carboxylase gene via NO and Ca2+[J].Journal of Plant Physiology,2015,175:9-20.
31.Li X,Wang C,Ren C G.Effects of 1-butanol,neomycin,and calcium on the photosynthetic characteristics of pepc transgenic rice[J].Africa Journal Biotechnology,2011,10:17466-17476.
32.刘小龙,李霞,钱宝云.外源Ca2+对PEG处理下转C4型PEPC基因水稻光合生理的调节[J].植物学报,2015,50(2):206-216.
Liu X L,Li X,Qian B Y.Photosynthetic and physiological regulation of C4phosphoenolpyruvate carboxylase transgenic Rice(Oryzasativa) by exogenous Ca2+under polyethylene glycol stress[J].Chinese Bulletin of Botany,2015,50(2):206-216.
33.Dhindsa R S,Matowe W.Drought tolerance in two mosses:correlated with enzymatic defence against lipid peroxidation[J].Journal of Experimental Botany,1981,32(1):79-91.
34.Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies[J].Plant and Soil,1973,39(1):205-207.
35.Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
36.Murphy M E,Noack E.Nitric oxide assay using hemoglobin method[J].Methods in Enzymology,1994,233:240-250.
37.Patterson B D,Macrac E A,Ferguson I B.Estimation of hydrogen peroxide in plant extracts using titanium(IV)[J].Analytical Biochemistry,1984,139(2):487-492.
38.杨彩琴,刘伟娜,赵志弘,等.血清钙的甲基百里香酚蓝测定法[J].光谱学与光谱分析,1998,18(4):485-487.
Yang C Q,Liu W N,Zhao Z H,et al.Determination of the content of serum calcium with methylthymol blue as chromogenic reagent[J].Spectroscopy and Spectral Analysis,1998,18(4):485-487.
39.李佐同,靳学慧,张亚玲,等.水稻幼苗可溶性糖及可溶性蛋白含量与抗瘟性的关系[J].北方水稻,2009,39(4):6-9.
Li Z T,Jin X H,Zhang Y L,et al.The relationship between soluble protein,soluble sugar content and rice blast resistance of rice seedlings[J].North Rice,2009,39(4):6-9.
40.Gigliolii-guivarc’h N,Pierre J N,Brown S,et al.The light-dependent transduction pathway controlling the regulatory phosphorylation of C4phosphoenolpyruvate carboxylase in protoplasts from digitaria sanguinalis[J].The Plant Cell,1996,8(4):573-586.
41.陈平波,李霞.低浓度NO对高表达转玉米C4型pepc水稻光合的促进[J].植物研究,2012,32(4):402-409.
Chen P B,Li X.Promotion of photosynthesis of transgenic rice plant with overexpressing C4pepcfrom maize under low concentration NO[J].Bulletin of Botanical Research,2012,32(4):402-409.
42.Shao R X,Wang K B,Shangguan Z P.Cytokinin-induced photosynthetic adaptability ofZeamaysL.to drought stress associated with nitric oxide signal:probed by ESR spectroscopy and fast OJIP fluorescence rise[J].Journal of Plant Physiology,2010,167(6):472-479.
43.Hu X L,Wang W,Li C Q,et al.Cross-talks between Ca2+/CaM and H2O2in abscisic acid-induced antioxidant defense in leaves of maize plants exposed to water stress[J].Plant Growth Regulation,2008,55(3):183-198.
44.Lecourieux D,Ranjeva R,Pugin A.Calcium in plant defence-signalling pathways[J].New Phytology,2006,171(2):249-269.
45.Cao Y Y,Yang M T,Chen S Y,et al.Exogenous sucrose influences antioxidant enzyme activities and reduces lipid peroxidation in water-stressed cucumber leaves[J].Biologia Plantarum,2015,59(1):147-153.
46.Gupta A K,Kaur N.Sugar signalling and gene expression in relation to carbohydrate metabolism under abiotic stresses in plants[J].Journal of Biosciences,2005,30(5):761-776.
47.Matsuoka M,Minami E I.Complete structure of the gene for phosphoenolpyruvate carboxylase from maize[J].European Journal of Biochemistry,1989,181(3):593-598.
48.Lepiniec L,Keryer E,Philippe H.Sorghumphosphoenolpyruvate carboxylase gene family:structure,function and molecular evolution[J].Plant Molecular Biology,1993,21(3):487-502.
49.Fan Z Q,Li J Y,Lu M Z,et al.Overexpression of phosphoenolpyruvate carboxylase fromJatrophacurcasincreases fatty acid accumulation inNicotianatabacum[J].Acta Physiologiae Plantarum,2013,35(7):2269-2279.
50.Hu L,Li Y,Xu W G,et al.Improvement of the photosynthetic characteristics of transgenic wheat plants by transformation with the maize C4phosphoenolpyruvate carboxylase gene[J].Plant Breeding,2012,131(3):385-391.
51.Wang Y M,Xu W G,Hu L,et al.Expression of maize gene encoding C4-pyruvate orthophosphate dikinase(PPDK) and C4-phosphoenolpyruvate carboxylase(PEPC) in transgenicArabidopsis[J].Plant Molecular Biology Reporter,2012,30(6):1367-1374.
52.Nayyar H,Gupta D.Differential sensitivity of C3and C4plants to water deficit stress:association with oxidative stress and antioxidants[J].Environmental and Experimental Botany,2006,58(1-3):106-113.
53.钱宝云,李霞.植物气孔运动调节的新进展[J].植物研究,2013,33(1):120-128.
Qian B Y,Li X.New research progress on the regulation of stomatal movement in plant[J].Bulletin of Botanical Research,2013,33(1):120-128.
54.Couée I,Sulmon C,Gouesbet E,et al.Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants[J].Journal of Experimental Botany,2006,57(3):449-459.
55.Bolouri-moghaddam M R,Le ROY K,Xiang L,et al.Sugar signalling and antioxidant network connections in plant cells[J].FEBS Journal,2010,277(9):2022-2037.
56.胡梦芸,李辉,张颖君,等.水分胁迫下葡萄糖对小麦幼苗光合作用和相关生理特性的影响[J].作物学报,2009,35(4):724-732.
Hu M Y,Li H,Zhang Y J,et al.Photosynthesis and related physiological characteristics affected by exogenous glucose in wheat seedlings under water stress[J].Acta Agronomica Sinica,2009,35(4):724-732.
57.闫素芳,于洋,葛青,等.外源蔗糖对小麦幼苗耐盐性的影响[J].中国生态农业学报,2012,20(2):225-230.
Yan S F,Yu Y,Ge Q,et al.Effect of exogenous sucrose application on wheat seedling salt tolerance[J].Chinese Journal of Eco-Agriculture,2012,20(2):225-230.
58.任承刚,李霞.外源过氧化氢对孕穗期转C4pepc水稻及原种光合特性的影响[J].华北农学报,2010,25(4):130-135.
Ren C G,LI X.Effect of Exogenous H2O2on photosynthetic characteristics inPEPCtransgenic rice[J].Acta Agriculturae Boreali-Sinica,2010,25(4):130-135.
59.刘小龙,李霞,钱宝云,等.植物体内钙信号及其在调节干旱胁迫中的作用[J].西北植物学报,2014,34(9):1927-1936.
Liu X L,Li X,Qian B Y,et al.Ca2+signal transduction and its regulation role under drought stress in plant[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34(9):1927-1936.
60.Echevarría C,Garcia-maurio S,Alvarez R,et al.Salt stress increases the Ca2+-independent phosphoenolpyruvate carboxylase kinase activity in sorghum leaves[J].Planta,2001,214(2):283-287.
61.Sánchez R,Flores A,Cejudo F J.Arabidopsisphosphoenolpyruvate carboxylase genes encode immunologically unrelated polypeptides and are differentially expressed in response to drought and salt stress[J].Planta,2006,223(5):901-909.
62.Brown N J,Palmer B G,Stanley S,et al.C4acid decarboxylases required for C4photosynthesis are active in the mid-vein of the C3speciesArabidopsisthaliana,and are important in sugar and amino acid metabolism[J].The Plant Journal,2010,61(1):122-133.
63.李霞,任承钢.ABA、BA和DPI对高表达玉米C4pepc水稻光合特性及叶绿素荧光特性的影响[J].植物生理学报,2012,48(6):549-556.
LI X,REN C G.Effects on photosynthetic and fluorescence characteristics under treatments of ABA,BA or DPI in the transgenic rice with over-expressionC4pepcgene[J].Plant Physiology Journal,2012,48(6):549-556.
64.Huo K,Li X,He Y F,et al.Exogenous ATP enhance signal response of suspension cells of transgenic rice(OryzasativaL.) expressing maizeC4-pepcencoded phosphoenolpyruvate carboxylase under PEG treatment[J].Plant Growth Regulation,2017,1(82):55-67.
National Natural Science Foundation of China(31571585,31371554);The Agricultural Science and Technology Innovation Fund of Jiangsu in China[CX(14)5004];The Basic Scientific Support Project of Jiangsu Academy of Agricultural Sciences(ZX[16]2002)
introduction:WU Min-Yi(1994—),female,undergraduate,mainly engaged in photosynthetic physiology of rice.
date:2016-12-28
DroughtResponseinOverexpressionofMaizePhosphoenolpyruvateCarboxylaseRiceSeedlingsTreatedbyInhibitorsofABAandHXKPathway
WU Min-Yi1,2LI Xia1*HE Ya-Fei1,4ZHANG Chen1,3YAN Ting1,3
(1.Institute of Food Crops,Jiangsu High Quality Rice Research and Development Center,Nanjing Branch of China National Center Rice Improvement,Jiangsu Academy of Agricultural Sciences,Nanjing 210014;2.Jiangsu Key Laboratory for Microbes and Functional Genomics,Jiangsu Engineering and Technology Research Center for Industrialization of Microbial Resources,College of Life Sciences,Nanjing Normal University,Nanjing 210023;3.College of Life Science,Nanjing Agricultural University,Nanjing 210095;4.College of Biology and Environment,Nanjing Forestry University,Nanjing 210037)
The experiment was conducted to study the mechanism of drought tolerance inC4- phosphoenolpyruvate carboxylase(PEPC) gene(C4-PEPC) transgenic rice(PC), PC and its untransformed wild-type rice lines, Kitaake(WT) as materials. Pretreated by light(light intensity: 600 μmol·m-2·s-1) and dark on two rice lines with 4 leaves for 24 h, the pretreated rice lines were then conducted by 15% polyethylene glycol-6000(PEG-6000) simulated drought stress conditions for 4 h. Two inhibitors(one for Abscisic acid: 100 μmol·L-1nordihydroguaiaretic acid(NDGA) and the other for hexokinase(HXK): 10 mmol·L-1glucosamine(Gluc) were also added by root during the PEG-6000 treatment. Compared with WT rice lines, there were higher relative water content, lower malondialdehyde content and pro content in PC rice lines after drought treatment for 4 h involved in ABA and HXK pathways, conferring drought tolerance. But pre-dark treatment reduced the advantage of PC for drought tolerance. Soluble sugar content in two rice lines were increased in pre-light treatment and decreased in pre-dark treatment, which were regulated by ABA and HXK pathway. Among them, the Gluc inhibition of soluble sugar content in PC pre-light treated was the largest after the PEG treatment. There was no difference in soluble protein content of two rice lines either pretreated by light and dark during the PEG treatment. Similarly, pre-dark treatment reversed or eliminated the changes in two rice lines, which trends changed synchronously as those of sucrose, glucose and fructose contents. PEPC activities in PC lines did not change by pre-light or pre-dark treatments, showed PC belongs to constitutive expression. ABA and HXK pathways regulated negatively PEPC activity, which was synchronous with its low level of glucose in PC lines. Therefore, PC rice lines alleviated the damages of drought stress by sugar involved in ABA and HXK pathways, exhibiting stable photosynthetic ability and drought tolerance.
Oryza.sativaL.;phosphoenolpyruvate carboxylase;drought;sugar;abscisic acid;hexokinase
国家自然科学基金(31571585;31371554);江苏省自主创新基金(CX[(14)5004]);江苏省农业科学院基本科研业务专项项目(ZX(16)2002)
吴敏怡(1994—),女,本科,主要从事水稻光合生理方面的研究。
* 通信作者:E-mail:jspplx@jaas.ac.cn
2016-12-28
* Corresponding author:E-mail:jspplx@jaas.ac.cn
S511.01
A
10.7525/j.issn.1673-5102.2017.03.011
