姜黄素衍生物的合成及抗氧化活性的研究
2017-11-09臧永军陈乃富陈艳君姜雪萍
臧永军,陈乃富,陈艳君,姜雪萍,2
(1.皖西学院 生物与制药工程学院,安徽 六安 237012;2.皖西学院 中药研究与开发工程技术研究中心,安徽 六安 237012)
姜黄素衍生物的合成及抗氧化活性的研究
臧永军1,陈乃富1,陈艳君1,姜雪萍1,2
(1.皖西学院 生物与制药工程学院,安徽 六安 237012;2.皖西学院 中药研究与开发工程技术研究中心,安徽 六安 237012)
以姜黄素为原料,分别与布洛芬、丁香酸反应,合成2种新的姜黄素单酯衍生物,其结构经1H-NMR和MS确证。并通过DPPH法测定它们清除自由基的能力,结果显示:合成的两种衍生物均保留了原有的抗氧化活性,其中姜黄素-丁香酸单酯在较高浓度时对自由基的清除能力要强于姜黄素本身。
姜黄素;合成;单取代衍生物;抗氧化
姜黄素(Curcumin)是一种天然多酚类化合物,研究表明姜黄素具有抗氧化、抗肿瘤、抗菌、抗炎等多种生物活性[1],其分子结构简单且对称,在体内基本无毒,来源丰富,被认为是一种具有开发前景的天然化合物[2]。但由于姜黄素的水溶性较差,在体内的生物利用度低,直接影响其在药品和食品领域中的应用[3]。所以以姜黄素为先导化合物,对其进行结构修饰,引入相应的药效、药动基团合成姜黄素衍生物,以增加其水溶性和生物活性成为近些年来研究的热点[4]。文献报道[5],姜黄素的两个酚羟基对其生物活性有重要影响,其单取代衍生物因保留了一端游离的酚羟基,一方面可以保持或增强姜黄素的相关活性,另一方面引入的基团可改善其理化性质,弥补其药动学的不足。为此,本文设计合成2种姜黄素的单酯衍生物,并采用DPPH(1,1-二苯基-2-三硝基苯肼)法研究其抗氧化活性,以期获得理化性质更优、抗氧化活性更高的新化合物。
1 实验材料
1.1 仪器
WRS-1B数字熔点仪(上海索光光电技术有限公司),温度计未经校正;Varian-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Trace DSQ FINNIGSN型质谱仪;TU-1901型紫外可见光分光光度计(北京普析通用仪器设备有限公司);FA1004型电子天平(上海精科天平)等。
1.2 试剂
实验所需的姜黄素、布洛芬、丁香酸、二氯甲烷、吡啶、氯化亚砜、无水乙醇、乙酸乙酯、二环己基碳二亚胺(DCC)和4-二甲氨基吡啶(DMAP)等均为国产市售分析纯试剂。
2 实验方法
2.1 姜黄素衍生物的制备
2.1.1 姜黄素-布洛芬单酯的合成(1)
参照文献[6-7],冰浴条件下,在装有温度计、回流管和搅拌子的150 mL三口烧瓶中加入布洛芬1.03 g (5 mmol),吡啶1滴,缓慢加入4 mL氯化亚砜,然后置70 ℃油浴中恒温搅拌反应2 h。反应完后,减压蒸除未反应的氯化亚砜,留置备用。向另一150 mL三口瓶中加入姜黄素1.84 g(5 mmol),冰盐浴条件下缓慢加入吡啶0.8 mL(10 mmol),然后滴加上述反应液。滴加完后控温0 ℃搅拌反应,TLC监测反应进程。反应完成后,往反应瓶中加20 mL无水乙醇加热回流,过滤,得黄色油状物,经硅胶柱层析[硅胶200~300目,V(石油醚)∶V(乙酸乙酯) = 5∶1)],得黄色固体1.6 g,收率为57.2%(以姜黄素计)。数据表征:m.p. 102~104 ℃;1H-NMR (400 MHz, CDCl3) δ: 0.93 (d, 6H,J=4.0 Hz), 1.63 (d, 3H,J=4.0 Hz), 1.87~1.90 (m, 1H), 2.49 (d, 2H,J=4.0 Hz), 3.77 (s, 3H), 3.95 (s, 3H), 4.00 (d, 1H,J=4.0 Hz), 5.83 (s, 1H), 7.34(d, 2H,J=8.0 Hz), 7.16(d, 2H,J=8.0 Hz),7.60(d, 1H,J=12.0 Hz), 7.62(d, 1H,J=12.0 Hz), 6.49(d, 1H,J=12.0 Hz), 6.53(d, 1H,J=12.0 Hz), 6.94(d, 1H,J=8.0 Hz), 6.96(d, 1H,J=8.0 Hz), 7.06(d, 1H,J=8.0 Hz), 7.11(d, 1H,J=8.0 Hz);ESI-MS(m/z): 556.7{[M+1]+}。经1H-NMR和MS分析鉴定,数据与目标分子相符。
2.1.2 姜黄素-丁香酸单酯的合成(2)
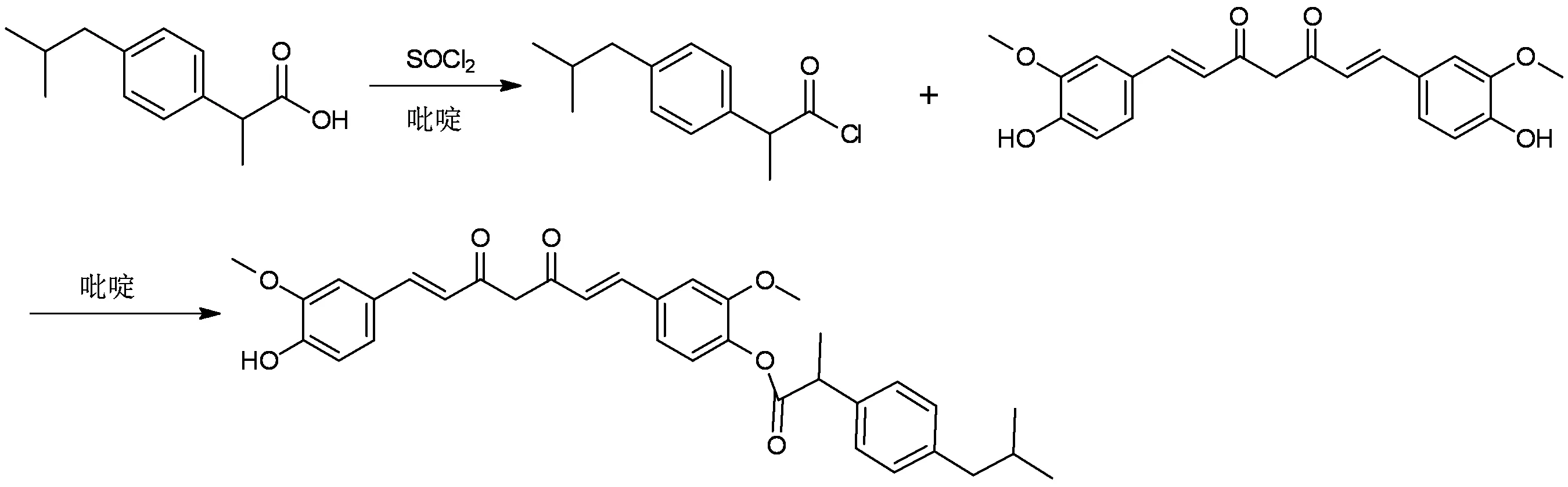
图1 姜黄素-布洛芬单酯的合成

图2 姜黄素-丁香酸单酯的合成
参照文献[8],称取姜黄素1.84 g(5 mmol),加入30 mL二氯甲烷溶解后,加入DCC 1.03 g(5 mmol)和催化量的DMAP,搅拌0.5 h,加入丁香酸1.5 g(7.5 mmol),常温下反应24 h,TLC监测大多数原料反应完。反应液用20 mL饱和食盐水洗涤2次,有机层用无水硫酸镁干燥,过滤,减压蒸除二氯甲烷,得黄色固体,经硅胶柱层析[硅胶200~300目,V(石油醚)∶V(乙酸乙酯) = 2∶1)],得黄色固体1.4 g,产率52.4%(以姜黄素计)。数据表征:m.p. 122~124 ℃;1H-NMR (400 MHz, CDCl3) δ: 3.89 (s, 3H), 3.94 (s, 3H), 4.00(s, 6H), 5.86 (s, 1H), 6.03 (s, 1H), 3.95 (s, 3H), 4.00 (d, 1H,J=4.0 Hz), 5.86 (s, 1H), 6.03s, 1H), 6.50(d, 1H,J=12.0 Hz), 6.59(d, 1H,J=12.0 Hz), 7.62(d, 1H,J=12.0 Hz), 7.64(d, 1H,J=12.0 Hz), 6.95(d, 2H,J=4.0 Hz),7.08(s, 1H), 7.50(s, 2H), 7.54(d, 1H,J=4.0 Hz), 7.14(d, 1H,J=8.0 Hz), 7.22(d, 1H,J=8.0 Hz), 7.19~7.23(m, 2H);ESI-MS(m/z):548.6{[M+1]+}。经1H-NMR和MS分析鉴定,数据与目标分子相符。
2.2 DPPH法抗氧化活性测试
2.2.1 1×10-4mol/L DPPH溶液的配制
准确称取1 mg DPPH,用适量无水乙醇溶解后,转入100 mL容量瓶中,用无水乙醇定容至刻度,轻摇混匀,低温避光保存备用。
2.2.2 样品测量
以乙醇为溶剂,分别配制5×10-5mol/L、10×10-5mol/L、20×10-5mol/L、40×10-5mol/L、80×10-5mol/L、160×10-5mol/L的姜黄素和待测样品溶液。参照文献[9-11]方法,稍有改进,量取2 mL DPPH溶液,分别与2mL不同浓度的样品溶液混合,避光37 ℃放置30 min,在519 nm处测吸光度As。DPPH自由基清除率P计算如下:
P(%) =[1-(As-Ay)/A0]× 100%
其中,Ay为2 mL样品溶液与2 mL乙醇混匀后的吸光度;A0为2 mL乙醇溶液与2 mL DPPH溶液混匀后的吸光度。
3 结果与讨论
3.1 衍生物的合成
3.1.1 姜黄素-布洛芬单酯的合成
在1的合成中,布洛芬分子中有一个羧基,可以与SOCl2反应生成活性更高的酰氯,然后将酰氯直接与姜黄素成酯,反应操作方便,转化率高。由于姜黄素结构中含有2个酚羟基,因此合成单取代的产物比双取代的产物难度更大。实验中需严格控制布洛芬的用量、反应温度及反应时间,因此实验研究了此三种变量对产物收率的影响。
3.1.1.1 布洛芬用量对收率的影响
对原料配比进行了考察,结果见表1。由表1可知,当布洛芬用量低于姜黄素用量时,产物收率较低,实验中发现姜黄素的剩余量较多,因此可适当增加布洛芬的用量;当姜黄素与布洛芬物质的量比达到1∶1时,单酯产物收率明显增加;随着反应物布洛芬用量的增加,当n(姜黄素):n(布洛芬)为1∶1.2时,单酯产物收率降低,实验中发现双酯副产物生成量增加。由此初步判断,其原料最佳配比为n(姜黄素):n(布洛芬)为1∶1,有利于单酯化目标产物的生成。
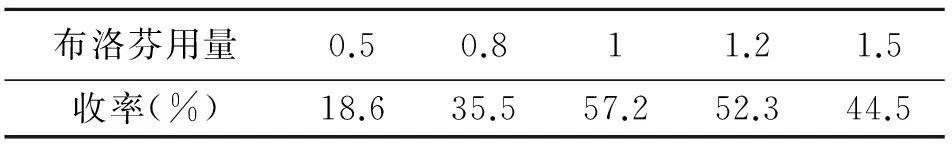
表1 布洛芬用量对收率的影响
布洛芬用量=n(布洛芬)∶n(姜黄素),其他条件同2.1.2。
3.1.1.2 反应温度对收率的影响
酰氯是一种较为活泼的酰化试剂,若反应温度过高,会生成多取代产物等杂质,且反应液颜色变黑,造成单取代收率降低且产物分离困难。故对实验温度进行考察,结果见表2,-15 ℃温度较低,大量原料未反应,20 ℃温度过高,副产物增多,影响产物的收率,故初步确定0 ℃效果较佳。
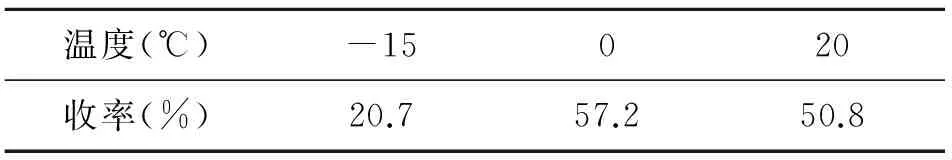
表2 反应温度对收率的影响
其他条件同2.1.2。
3.1.1.3 反应时间对收率的影响
考察了反应时间对收率的影响,如表3,反应时间过短,则大量原料未反应,故收率低。当时间超过40 min后,收率无明显增加现象,甚至因双取代产物增加而导致单取代产物收率下降。故初步判定40 min为最佳反应时间。
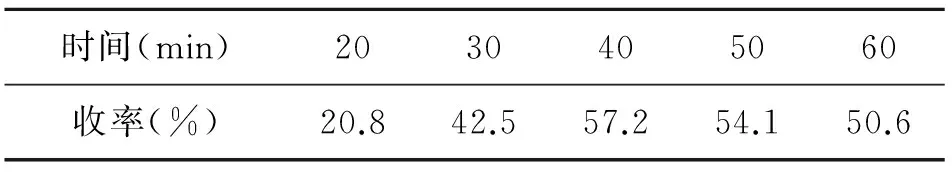
表3 反应时间对收率的影响
其他条件同2.1.2。
3.1.2 姜黄素-丁香酸单酯的合成
合成2时,由于丁香酸分子同时中含有羧基和酚羟基,如将丁香酸酰化会发生自身酯化反应。故采用DCC为缩合剂,DMAP为催化剂直接缩合,反应条件较为温和,由于丁香酸酚羟基两侧含有甲氧基,产生的位阻作用不利于其参与反应,避免自身酯化。实验中发现丁香酸的用量对目标化合物影响较大,如表4,丁香酸用量较少时,大量原料未反应,用量较多时,双取代产物增加,因此选择1.5当量的丁香酸。而反应的时间及温度对该步反应影响较小。

表4 丁香酸用量对合成姜黄素-丁香酸单酯的影响
丁香酸用量=n(丁香酸)∶n(姜黄素),其他条件同2.1.3。
3.2 DPPH法抗氧化活性测试
根据2.2方法,测得A0为0.847,样品浓度及样品在不同浓度下所测得的Ay和As值见表5。
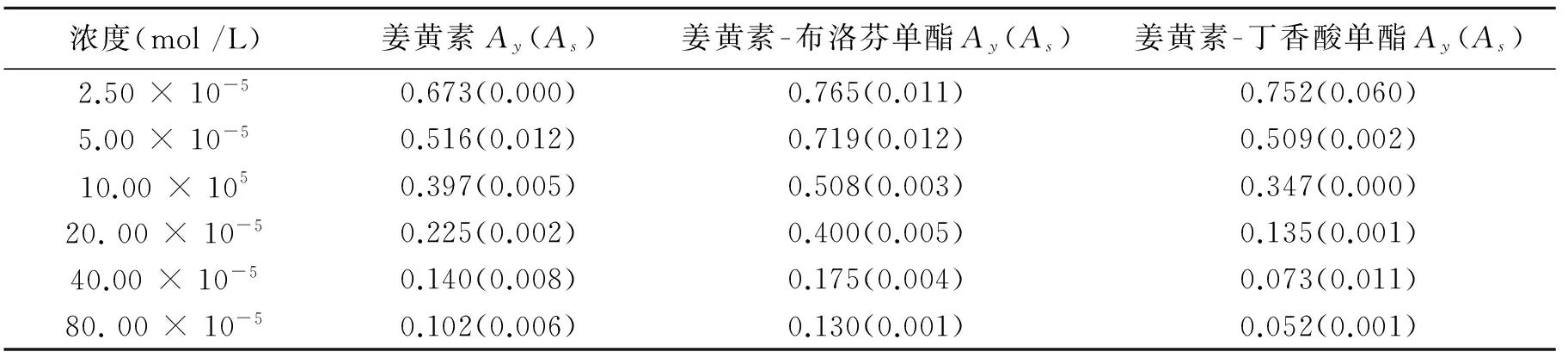
表5 不同浓度样品清除DPPH·实验的吸光度
由表5中数据,计算出清除率,并做出浓度-清除率关系图,见图3,分别为姜黄素和两种衍生物在6种倍数浓度下对DPPH·的清除作用的分布图。由图可见三种物质均有较好的DPPH·清除能力,且在测试的浓度范围内,先是清除率均随浓度的增加呈明显上升趋势;当被测样品浓度超过40×10-5mol/L时,随着浓度的增加,曲线趋于平缓,说明对DPPH·的清除已达到饱和,此时三者的清除率分别为:姜黄素丁香酸单酯92.68%,姜黄素85.23%,姜黄素布洛芬单酯80.80%。其中姜黄素-布洛芬单酯在实验浓度内,对DPPH·的清除率都低于姜黄素,表明其抗氧化能力较姜黄素有所减弱;姜黄素-丁香酸单酯在2.5×10-5mol/L、5×10-5mol/L其清除率与姜黄素相当,而当浓度约超过10×10-5mol/L后对DPPH·的清除能力明显要强于姜黄素本身,表明在较高浓度时黄素-丁香酸单酯对DPPH·的清除能力较姜黄素增加。
结果表明在纯化学体系中对DPPH·的清除作用强度顺序为姜黄素丁香酸单酯>姜黄素>姜黄素布洛芬单酯。这可能是因为丁香酸分子中含有两个给电子的甲氧基和一个酚羟基,增加了整个分子的电子云密度,从而增加了其清除自由基的作用[12]。而布洛芬取代分子没有该类基团,且减小了整个分子的水溶性,使其抗氧化作用减弱。目前关于姜黄素及其衍生物抗氧化性比较的报道还比较少,其具体的构效关系及机制有待进一步研究。
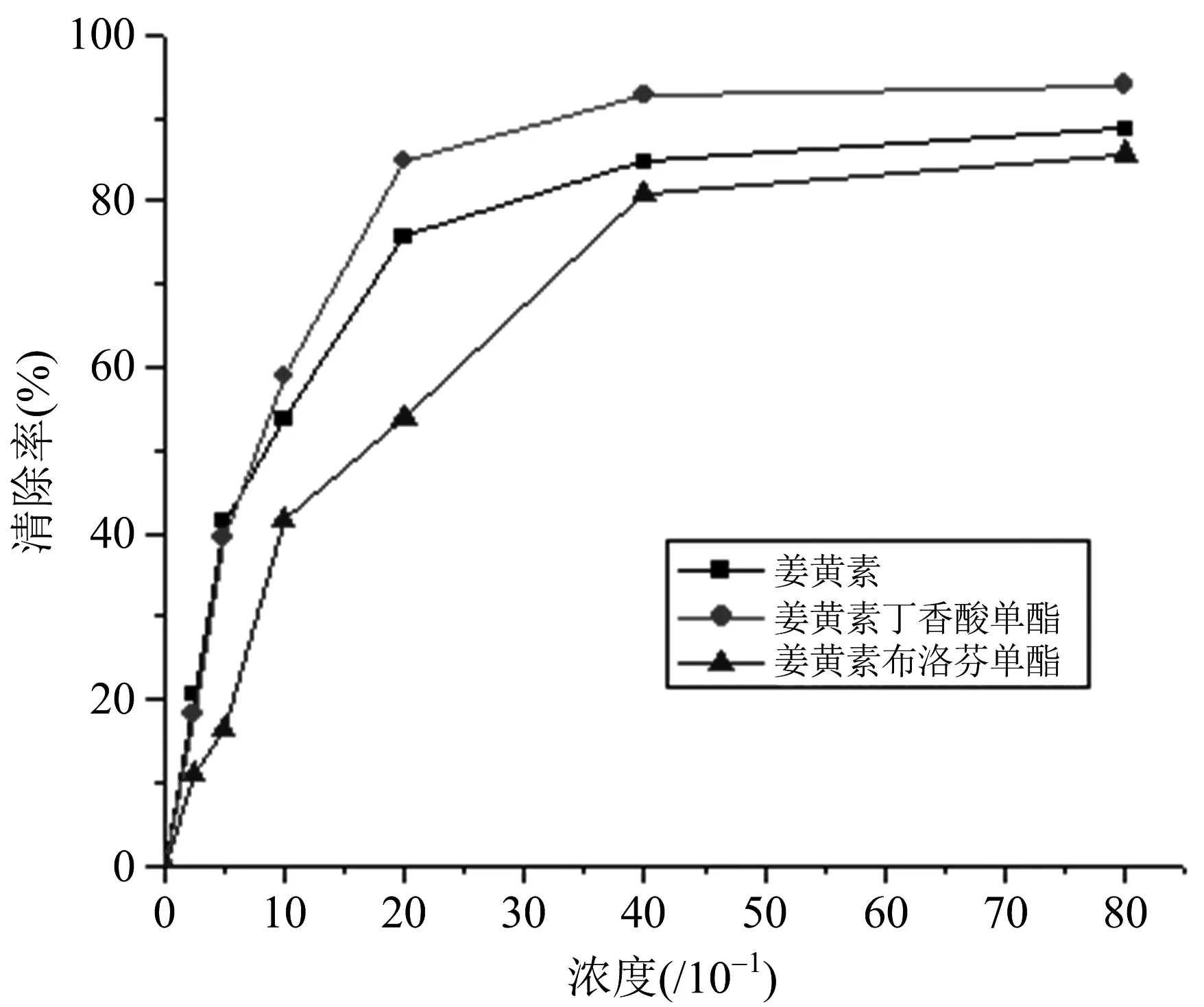
图3 姜黄素和两种衍生物对DPPH自由基的清除作用
4 结论
综上所述,本文通过二步酰化法和缩合法分别得到姜黄素-布洛芬单酯和姜黄素-丁香酸单酯,收率分别为57.2%和52.4%,其化学结构经1H-NMR和MS确证。并对该类化合物清除DPPH·的活性进行了研究,通过对比实验,发现两种衍生物对DPPH·都具有较好的清除能力。其中姜黄素-丁香酸单酯在较高浓度时对DPPH·的清除能力当清除率明显要强于姜黄素本身。提示姜黄素酚羟基单取代的衍生物的抗氧化活性可能会优于姜黄素,为进一步深入研究奠定了基础。
[1]秦伟,王鑫,刘磊.姜黄素与丙酸酐不对称反应产物的合成[J].中国药房,2014,25(11):984-986.
[2]Agrawal D K, Mishra P K. Curcum in and Its Analogues: Potential Anticancer Agents [J]. Med Res Rev, 2010(30):818-860.
[3]陈莉敏,康建军,刘洋,等.姜黄素类似物的合成及体外抗氧化活性研究[J].天然产物研究与开发,2011,23(4):722-722.
[4]舒波,夏伯候,严东,等.阿司匹林姜黄素酯的合成[J].化学世界,2014,55(3):169-171.
[5]Du Z Y, Liu R R, Shao W Y, et al. α-Glucosidase Inhibition of Natural Curcuminoids and Curcumin Analogs[J]. Eur J Med Chem, 2006, 41(2):213-213.
[6]王静,王鑫,刘磊,等.姜黄素酚羟基衍生物的合成[J].中国药房,2014,25(15):1349-1351.
[7]王华森,怀其勇.姜黄素衍生物的合成及抑菌活性研究[J].天然产物研究与开发,2013(25):237-240.
[8]Liu W F, Li Y L, Yue L. Synthesis and Biological Evaluation of Curcumin Derivatives Containing NSAIDs for their Anti-inflammatory Activity[J]. Bioorganic & Medicinal Chemistry Letters, 2015(25): 3044-3051.
[9]Li X, Lin J, Gao Y X, et al. Antioxidant Activity and Mechanism of Rhizoma Cimicifugae [J]. Chemistry Central Journal, 2012,6(1):140-140.
[10]邹淑君,于子惠,许树军,等.橙皮苷及橙皮素清除自由基活性的研究[J].中医药学报,2013,41(1):65-67.
[11]翟广玉,马海英,颜子童.槲皮素镍的合成、表征及其生物活性研究[J].化学试剂,2014,36(5):392-396.
[12]刘庆庆,张薇娜,刘琴.不同方法比较黄酮类化合物抗氧化性及其构效关系分析[J].食品工业科技,2016,37(23):109-114.
SynthesisandAntioxidantActivitiesofCurcuminDerivatives
ZANG Yongjun1,CHEN Naifu1,CHEN Yanjun1,JIANG Xueping1,2
(1.SchoolofBiologyandPharmaceuticalEngineering,WestAnhuiUniversity,Lu’an237012,China;2.CenterofTraditionalChinesemedicineR﹠D,WestAnhuiUniversity,Lu’an237012,China)
Curcumin monoester derivatives were synthesized with syringate, ibuprofen and curcumin. The structure of the target products were confirmed by1H-NMR and MS. And their abilities to scavenge DPPH free radical were evaluated. The results revealed that both of them exhibited antioxidant activities. The scavenging activity of DPPH of curcum-syringate derivative was stronger than that of curcumin in high concentration.
curcumin; synthesis; monoester derivatives; antioxidant
R284
A
1009-9735(2017)05-0077-04
2017-04-07
安徽省教育厅一般项目(KJ103762015B16);皖西学院自然科学基金青年项目(WXZR201613)。
臧永军(1990-),男,安徽六安人,助教,硕士,研究方向:天然产物合成与修饰;通信作者:陈乃富(1962-),男,安徽六安人,教授,硕士生导师,研究方向:中药生物技术、中药资源与质量研究。
