鲟源病原菌HD0824的分离鉴定及药敏特性研究
2017-11-09杨移斌夏永涛杨先乐艾晓辉
杨移斌,刘 洋,夏永涛,杨先乐,艾晓辉*
(1.中国水产科学研究院长江水产研究所, 湖北 武汉 430223; 2.江西省奉新县畜牧水产局, 江西 奉新 330700; 3.中国水产科学研究院北京院部, 北京 100039; 4.上海海洋大学 国家水生动物病原库, 上海 201306)
鲟源病原菌HD0824的分离鉴定及药敏特性研究
杨移斌1,刘 洋2,夏永涛3,杨先乐4,艾晓辉1*
(1.中国水产科学研究院长江水产研究所, 湖北 武汉 430223; 2.江西省奉新县畜牧水产局, 江西 奉新 330700; 3.中国水产科学研究院北京院部, 北京 100039; 4.上海海洋大学 国家水生动物病原库, 上海 201306)
【目的】对患病西伯利亚鲟进行病原分离、鉴定及药敏实验,为鲟嗜水气单胞菌病的防控提供参考。【方法】从患病的西伯利亚鲟(Acipenserbaerii)的体内分离到一株致病菌株HD0824,该菌株具有高致病性,能使小白鼠24 h 内死亡。经过人工感染,感染用鱼出现与自然发病相同的症状,表明菌株HD0824为鲟鱼此病病原。【结果】菌株HD0824为革兰氏阴性杆,无芽孢和荚膜,在兔血平板上能形成明显的β-溶血,蛋白酶活性很强。经过生理生化鉴定及16S rDNA序列分析,菌株HD0824为嗜水气单胞菌(Aeromonashydrophila),同源性达99 %。此外,分离菌株HD0824对庆大霉素、强力霉素、氯霉素、丁胺卡那霉素、氟苯尼考、头孢噻肟、阿奇霉素及左氧氟沙星8种药物高度敏感,对新霉素中度敏感。【结论】分离菌株HD0824是西伯利亚鲟病原菌,养殖时可选用庆大霉素及氟苯尼考等药物进行防控。
嗜水气单胞菌(Aeromonashydrophila);西伯利亚鲟(Acipenserbaerii);鉴定;药敏特性
【研究意义】鲟鱼隶属于鲟形目(Acipenseriformes)全身大部分是软骨,常被称为软骨硬鳞鱼类。鲟鱼是大型经济鱼类,因其肉质鲜美、骨脆营养丰富、具有较高的食用经济价值,特别是用其卵加工而成的鱼子酱富含高蛋白、微量元素和多种维生素,更是驰名中外的高档食品,素有“黑色黄金”之称。【前人研究进展】目前中国鲟鱼养殖种类主要有西伯利亚鲟、史氏鲟等,西伯利亚鲟因具有生长速度快、适应能力强、成活率高、抗病力强、食用营养丰富、鱼籽酱品质好等特点,使其成为鲟鱼养殖产量最大的品种[1]。然而随着人工养殖规模不断扩大,养殖节约化程度不断提高。鲟鱼养殖受到各种疾病困扰[2-8],病害已经成为鲟鱼健康养殖的一大阻力,因此对于鲟鱼养殖中遇到的疾病进行病原分离鉴定及药敏试验显得尤为重要。2011年9月初在浙江省衢州市鲟鱼养殖场发现西伯利亚鲟出现以肛门红肿溃烂,肝脏充血出血,体壁充血,脾脏充血发黑,性腺溃烂甚至掉出体外,性腺上分布有出血点,有大量血水流从生殖孔流出为主要症状的急性败血症,死亡率高达80 %,死亡个体大多在20 kg左右,最大个体达50 kg,损失极为严重。【本研究切入点】本研究从发病的西伯利亚鲟体内分离到一株细菌HD0824,动物攻毒试验表明此细菌具有很强的致病力,经常规生理生化鉴定,16S rDNA基因系列测定和系统发育分析的方法对该细菌进行了分类鉴定,并进一步研究其药敏特性。【拟解决的关键问题】以期丰富鲟鱼疾病病原的生物学特性,为鲟鱼疾病科学有效防控提供理论指导。
1 材料与方法
1.1 供试材料
1.1.1 病鱼收集 自然患病鲟鱼来源于浙江省衢州鲟鱼养殖基地,取自然发病症状典型的鲟鱼为备用材料。
1.1.2 主要仪器 恒温培养箱,冰箱,高压蒸汽灭菌锅,摇床,PCR仪,核酸电泳仪,显微镜,无菌操作台,恒温水浴锅,电子炉。
1.1.3 主要试剂 普通营养琼脂、脑心浸出液、胰蛋白胨大豆琼脂(TSA)、兔血营养琼脂、10 g/L脱脂奶蔗糖胰蛋白胨琼脂培养基、水解酪蛋白琼脂(MH)按常规方法自配;细菌生化微量鉴定管购自杭州微生物试剂有限公司;细菌基因组DNA提取试剂盒、PCR扩增细菌16S rDNA试剂盒,TaqDNA聚合酶均购自上海生工生物工程技术服务有限公司;药敏纸片购自杭州微生物试剂有限公司;革兰染料购自杭州微生物试剂有限公司。
1.1.4 试验动物 健康西伯利亚鲟,由浙江省衢州市鲟鱼养殖基地提供;6周龄雌性12只小白鼠购自上海实验动物中心。
1.2 试验方法
1.2.1 流行病学调查 调查养殖场鲟鱼发病率及死亡率,了解发病鲟鱼种类及规格大小,掌握养殖水域环境状况。查看鲟鱼发病各个时期症状及解剖观察,确定鲟鱼此疾病的基本症状,取发病症状典型的病鱼备用。
1.2.2 病毒排除试验 取病鱼溃烂明显的性腺作为病毒排除试验材料,将其剪碎,其后在研钵中加玻璃珠继续研磨,加等量生理盐水,5000转离心10 min,取上清液,加入每1 mL上清液中加入10 000单位的抗生素,包括青霉素和庆大霉素,经5次冻融后使用。感染用鲟鱼10尾平均分成2组,试验组每尾西伯利亚鲟注射上清液0.2 mL,对照组每尾注射等量生理盐水。试验期间正常投喂,连续充氧,保持水温26 ℃,水质良好,溶氧正常。定期观察鲟鱼动态,记录发病及死亡情况。结果试验组西伯利亚鲟未出现自然发病症状,更未出现死亡,故排除病原为病毒的可能性。
1.2.3 病原菌分离纯化 选具有典型自然发病症状濒死的西伯利亚鲟,用75 %的酒精反复擦拭病鱼体表后,在无菌条件下,取性腺、肝脏等病灶部位少许以及少量血水,分别于胰蛋白胨大豆琼脂(TSA)培养基和普通营养琼脂平板上划线分离,置于28 ℃培养箱中恒温培养24 h,挑起形态一致,优势度大的单一菌落进一步划线纯化,并接种于TSA培养基斜面于4 ℃冰箱保存。
1.2.4 动物攻毒试验 分离纯化后的菌株HD0824接种于营养琼脂上28 ℃培养24 min,用无菌生理盐水洗下菌苔,用麦氏比浊法测定并调节菌悬液浓度为4×107CFU/mL。
人工感染:选取健康的西伯利亚鲟,设1个试验组和1个对照组。试验组为6尾,对照组为4尾,每组设置2个重复。试验组胸鳍基部注射菌悬液0.2 mL,对照组胸鳍基部注射等量无菌生理盐水。试验期间正常投喂,连续充氧,保持水温20~22 ℃,水质良好,溶氧正常。定期观察鲟鱼动态,记录发病及死亡情况,并对濒死鲟鱼及时进行解剖和病原分离。
毒力检测试验:选取健康小白鼠12只,平均分成A、B、C 3 组,A组注射菌悬液0.1 mL,B组注射菌悬液0.2 mL,C 组注射0.2 mL无菌生理盐水,均采取腹腔注射。观察24 h 内小白鼠死亡情况。
1.2.5 病原菌形态学观察及理化特性检测 将分离菌株HD0824接种于普通营养琼脂平板、TSA平板、兔血营养琼脂平板和10 g/L脱脂奶蔗糖胰蛋白胨琼脂培养基平板,28 ℃培养24 h后观察菌落的大小、形态、溶血状况及蛋白酶活性,同时进行革兰氏染色,用光学显微镜进行细菌形态学观察,其他各项生理生化指标的测定参照有关文献进行[9]。
1.2.6 分离菌株HD0824的16S rDNA基因序列测定与分析 (1)PCR模板的制备:将细菌HD0824接种于脑心浸出液培养基(BHI)中,28 ℃摇菌18 h后12 000 r/min离心收集菌体,按细菌基因组DNA提取试剂盒说明书提取细菌总DNA,作为PCR的模板DNA。
(2)16S rDNA基因系列的扩增与测序:用于16S rDNA的PCR反应的引物由上海生工生物工程技术服务有限公司合成。
正向引物为27F:5’-AGAGTTTGATC(C/A)TGGCTCAG-3’(对应于E.coli的16S rRNA基因的第8~27 bp位置);反向引物1492R:5’-GGTTACCTTGTTACGACTT-3’(对应于E.coli的16S rRNA基因的第1492~1510 bp位置);PCR反应条件为:95 ℃变性3 min,94 ℃平衡35 s,55 ℃退火35 s,72 ℃延伸1 min,此阶段35个循环,72 ℃温育10 min。经PCR扩增后的产物进行1.0 %的琼脂糖凝胶电泳检测以证明PCR 扩增得到的片段是否是目的片段后,将PCR的最终产物送上海生工生物工程技术服务有限公司进行纯化和序列测定。
(3)构建系统发育树:将菌株HD0824的16S rDNA序列用运用NCBI数据库中细菌的16S rDNA进行比对,分离菌株HD0824从中选取数株与该株菌基因序列最相似的菌株和几种水产常见病原菌,采用Clustal w软件进行多序列匹配分析,用MEGA5.1软件包中的Neighbor-Joining法构建系统进化树,通过1000 次 Bootstrap检验置信度。
1.2.7 药敏试验 药敏试验采用标准的K-B法,将菌株HD0824接种于脑心浸出液(BHI)培养基,置于28 ℃摇床培养18 h 后涂布于水解酪蛋白琼脂(MH)平板。选择 17 种药敏纸片均匀贴于平板,每个平板贴 5 片,置28 ℃下培养24 h 后测量抑菌圈直径(mm)。根据《现代诊断学手册》[10]标准判定菌株对药物的敏感性特性。
2 结果与分析
2.1 自然发病流行情况调查及临床诊断
2011年9月初浙江省衢州市鲟鱼养殖基地鲟鱼出现鲟鱼死亡,发病后死亡率高达80 %,发病水温在20 ℃及以上,发病个体在5~30 kg。发病初期病鱼精神不振,或静止不动,或狂游不止,有时也贴紧池壁游动,严重者身体失去平衡形成腹部露出水面的现象,几乎不进食。出现症状多数一周内死亡,病鱼受到刺激后可能数小时内死亡。发病鲟鱼主要集中在西伯利亚鲟,症状表现为鲟鱼肛门一侧出现细线红肿,有开始溃烂症状,解剖后看到肝脏充血肿大而且出血,脾脏严重充血发黑,肾脏充血,腹腔有大量出血导致倒提鲟鱼从生殖孔流出体外,体壁严重充血,也有体壁未充血的,性腺有大量出血点,产生溃烂,更严重的是生殖孔与腹腔相连的膈膜烂穿,肛门一侧溃烂开口,性腺掉出,直至鲟鱼死亡。此病流行于水温在20 ℃及以上,水温低于20 ℃亦可能发病,但较少。发病鲟鱼集中在西伯利亚鲟,其余鲟鱼发病较少,雌雄鲟鱼都可能发病。发病鲟鱼个体目前发现最小3龄,据调查其他养殖基地也有类似疾病。
2.2 病原菌分离纯化
从具有典型发病症状濒死的病鱼取性腺、肝脏等病灶部位少许以及少量血水划线于普通营养琼脂平板和TSA平板上,置于28 ℃恒温培养箱培养24 h 后经纯化获得一株优势细菌,编号HD0824。该菌在营养琼脂平板和TSA平板上生长良好,形成圆形,表面光滑,边缘整齐,中央菌落呈凸起状,直径0.9~1.1 mm的透明的菌落。
2.3 动物攻毒试验
2.3.1 人工感染 试验组注射菌悬液12 h后,试验用鱼出现精神不振,或静止不动,或狂游不止,肛门出现红肿溃烂,14 h 后出现死亡,24 h 试验组全部死亡,而对照组无任何异常。解剖后看到肝脏充血肿大而且出血,脾脏严重充血发黑,肾脏充血,腹腔有大量出血导致倒提鲟鱼从生殖孔流出体外,体壁严重充血,性腺有大量出血点,产生轻微溃烂,性腺未因肛门烂开而掉出体外,与自然发病鲟鱼症状基本一致。并从感染死亡鲟鱼肝脏、性腺及血水中分离到与菌株HD0824形态、生理生化特性和16S rDNA基因序列分析一致的细菌,表明菌株HD0824是西伯利亚鲟此病病原菌。
2.3.2 毒力检测试验 试验组小白鼠在24 h 内死亡率达100 %,注射剂量为0.2 mL的试验组先出现死亡,解剖后发现小白鼠肝脏严重出血并且坏死,肠道也出现出血现象。
2.4 病原菌形态学观察
分离菌株HD0824为革兰氏阴性短杆菌,没有芽胞和荚膜。在TSA平板上菌落呈圆形,表面光滑,边缘整齐,中央菌落呈凸起状,直径0.9~1.1 mm的透明的黄色菌落。在普通营养琼脂平板上菌落呈淡黄色,圆形,表面光滑,中央菌落呈凸起状,直径0.6~0.9 mm的透明的菌落。
2.5 病原菌理化特性检测
分离菌株HD0824为具有运动能力的G-杆菌,在兔血营养琼脂平板能产生β-溶血,蛋白酶活性检测呈阳性,其它的生理生化特征见表1。
2.6 分离菌株HD0824的16S rDNA基因PCR扩增结果及系统发育分析
PCR扩增分离株HD0824获得的16S rDNA基因片段约1500 bp。测序结果得出此系列1420 bp,把测序结果与NCBI中已收录的相关性较高的16S rDNA序列进行比对分析表明,从发病西伯利亚鲟体内分离的细菌16S rDNA基因序列与嗜水气单胞菌(Aeromonashydrophila)同源性最高,均为99 %,选取了检索的部分16S rDNA用Neighbor-Joining方法进行系统发育学分析,其系统发育树如图1所示。在系统发育树上菌株HD0824与嗜水气单胞菌(A.hydrophila)聚为一个分支。根据分离菌的形态特征及理化特性,结合16S rDNA序列测定与系统发育分析结果,判定该菌为嗜水气单胞菌(A.hydrophila)。
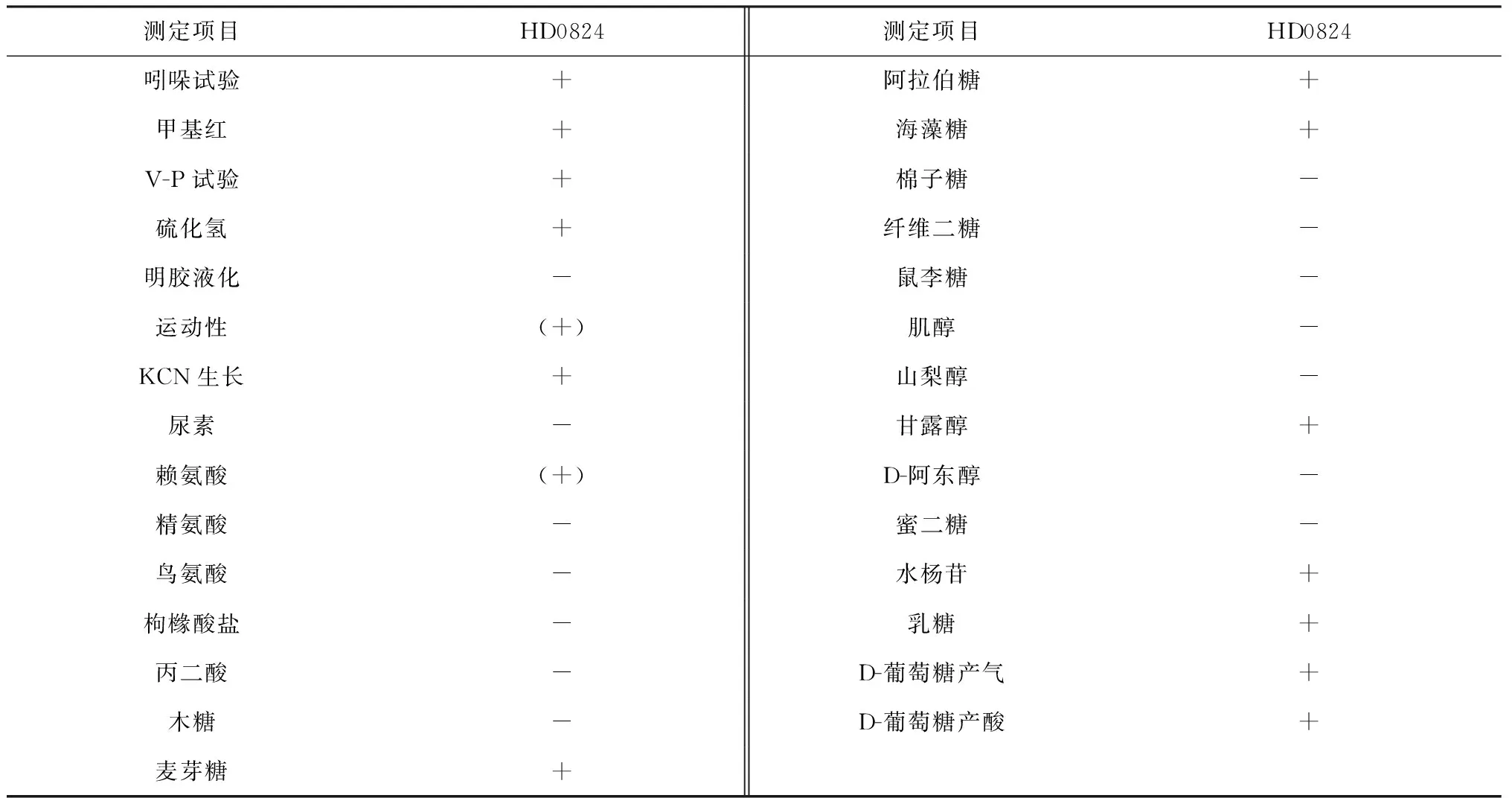
表1 HD0824菌株的生理生化特征
注:“+”表示阳性,“-”表示阴性,“(+)”表示阳性反应超过24h,“(-)”表示阴性反应超过24h,“d”表示11 %~89 %菌株为阳性。
Note:‘+’ means positive; ‘-’ means negative; ‘(+)’ The time of positive reaction exceed 24 h; ‘(-)’ The time of negative reaction exceed 24h; ‘d’ means 11 %-89 % strain is positive.
2.7 药敏试验结果
从表2可以看出,分离菌株HD0824对庆大霉素、强力霉素、氯霉素、丁胺卡那霉素、氟苯尼考、头孢噻肟、阿奇霉素及左氧氟沙星8种药物高度敏感,对新霉素中度敏感。
3 讨 论
本研究从发病西伯利亚鲟肝脏、性腺及少量血水中均分离到一株优势度达99 %病原菌HD0824,为革兰氏阴性短状杆菌。通过动物攻毒试验,发现其属高致病性病原菌,人工感染西伯利亚鲟后产生肛门出现红肿溃烂,肝脏充血肿大而且出血,脾脏严重充血发黑,肾脏充血,腹腔有大量出血导致倒提鲟鱼从生殖孔流出体外,体壁严重充血,性腺有大量出血点,产生轻微溃烂与自然发病鲟鱼症状一致,表明此细菌为鲟鱼此病的病原菌之一。根据细菌的形态学特征和生理生化特性初步确定为嗜水气单胞菌(A.hydrophila),但由于其在利用D-甘露糖等与嗜水气单胞菌标准菌株存在一定差异(表1),故而不能进行准确的鉴定,这也是细菌生化鉴定的弱点所在,每个反应的程度受到各方面的影响,很难统一,故需寻找一种更为准确的方法加以鉴定,和生化鉴定结合达到准确分类鉴定细菌的目的。目前随着科学技术的快速发展,特别是分子生物领域取得突破性进展,细菌的鉴定也进入到分子生物学时代,多种基因型分类方法也应运而生,如DNA杂交、rDNA指纹图、质粒图谱、(G+ C)mol %、16S rDNA序列分析及Gyrb序列分析等。目前,由于16S rDNA 序列分析已广泛应用于水产动物病原菌的鉴定[11-12]。本研究基于HD0824菌株的16S rDNA基因序列构建了系统发育树,结果表明该菌与嗜水气单胞菌同源性达到了99 %,同时结合形态学和理化特征鉴定该菌为嗜水气单胞菌。本次西伯利亚鲟发病水温在20 ℃左右,出现的症状与报道的败血症有一定的相似之处,但是不同的是本次发病鲟鱼出现了性腺严重溃烂,甚至掉出体外,值得关注,溃烂的原因可能是嗜水气单胞菌被解体后释放毒素造成的,这提示治疗包括嗜水气单胞菌在内的革兰氏阴性菌引起的疾病应注意使用抗菌药后,需对体内细菌释放的内毒素加以清除,才能达到更好的治疗效果。
嗜水气单胞菌是在自然界中广泛存在的[13],是一种典型的人-畜-鱼共患病病原菌。嗜水气单胞菌(A.hydrophica),属弧菌科(Virbhonaceae),气单胞菌属(Aeromonas),为革兰阴性短杆菌,极端单鞭毛,无芽孢和荚膜,散在排列。对环境要求不高,普遍存在于淡水、污水、淤泥、土壤和人类粪便中,专性需氧,生长温度5~40 ℃,最适温度28 ℃,pH 6~11,最适为pH 7,分为致病性和非致病性菌株[14]。致病性菌株可感染鱼类、两栖类、爬行类、鸟类和哺乳类等动物,主要症状为急性出血性败血症,慢性感染症状一般为皮肤溃烂。该菌可引起淡水鱼细菌性败血症,蛙类的红腿病,中华鳖的红脖子病、红底斑病、穿孔病、腐皮病等[14-15]。尤其是每年的7-9月份,由于气温较高,应激较大,往往造成该病爆发[14]。自20世纪90年代以来,该病原菌常引起我国淡水养殖鱼类的暴发性败血症,给水产养殖业造成了极大的经济损失[2-5]。本次研究中从发病西伯利亚鲟体内分离到的嗜水气单胞菌使鲟鱼性腺溃烂掉出体外尚属第一次报到,其具有较高的溶血素及蛋白酶活性,毒力很强。随着养殖规模的扩大,养殖水域环境日益恶化,及鲟鱼产品贸易来往,为嗜水气单胞菌的传播提供了途径和场所,使得其危害不断增大,流行区域大增。因此在鲟鱼养殖过程中要重视嗜水气单胞菌的感染,对其感染产生的新症状加以分析,及时找到防治方法减少养殖生产损失。

图1 根据16S rDNA基因序列同源性构建的系统发育树Fig.1 Phylogenetic tree based on 16S rDNA sequence homolog

药物Drug抑菌直径判断标准(mm)Judgmentstandardofinhibitionzonediameter耐药Resistant中度敏感Mediumsensitivity高度敏感Highlysensitive药物含量(μg·disc-1)Dose抑菌直径(mm)Inhibitionzonediameter敏感性Sensitivity强力霉素≤1213~15≥163022S丁胺卡那霉≤1415~16≥173023S氟苯尼考≤1213~17≥187528S链霉素≤1112~14≥151014R氯霉素≤1213~17≥183020S头孢噻肟≤1415~22≥233025S先锋霉素V≤1415~17≥183014R青霉素≤1920~27≥2810U0R红霉素≤1314~22≥231512R克林霉素≤1415~20≥2120R阿莫西林≤1314~17≥18100R阿奇霉素≤1314~17≥181525S利福平≤1617~19≥20515R左氧氟沙星≤1314~16≥17530S痢特灵≤1415~16≥1730013R庆大霉素≤1213~14≥151023S新霉素≤1213~16≥173014I
注:S表示高度敏感,I表示中度敏感,R表示耐药。
Note:S is highly sensitive, I is medium sensitivity, and R is resistant.
分离菌株HD0824对庆大霉素、强力霉素、氯霉素、丁胺卡那霉素、氟苯尼考、头孢噻肟、阿奇霉素及左氧氟沙星8种药物高度敏感,对新霉素中度敏感,与孟彦等分离到的嗜水气单胞菌的药敏特性不同[3],也与李圆圆等[4]和褚卫华等[16]分离到的嗜水气单胞菌的药敏特性不同[4],产生这些药敏特性差异的原因可能是不同地区嗜水气单胞菌所处环境,水域条件,气候状况,及接触的药物不同导致耐药性不同[17]。在生产上可以选用本研究中高敏药物进行防治,但是由于是理论研究,故不是所有的药物都可以用于生产,更多是研究此病原菌的药敏特性,如氯霉素就可以用氟苯尼考替代用于养殖生产疾病防治。从药敏试验结果来看,化学药物是疾病防治的有效手段,但是由于长期使用,病原菌对常用抗生素已经产生了极强的耐药性,这样必能导致疾病防治失败,这就警示我们在养殖生产中需慎重考虑使用抗生素,尽可能寻找生物防治等办法控制疾病发生,避免造成更大损失。
[1]崔 禾,何建湘,郑维中. 我国鲟鱼产业现状分析及发展建议[J]. 中国水产,2006(6):8-9.
[2]杨治国. 鲟鱼嗜水气单胞菌的分离及鉴定[J]. 淡水渔业,2001,31(5):40-41.
[3]孟 彦,肖汉兵,张 林,等. 施氏鲟出血性败血症病原茵的分离和鉴定[J]. 华中农业大学学报,2007,26(6):822-826.
[4]李圆圆,曹海鹏,何 珊,等. 鲟源致病性嗜水气单胞菌X1的分离鉴定与药敏特性研究[J]. 微生物学通报,2008,35(8):1186-1191.
[5]曹海鹏,杨先乐,高 鹏,等. 鲟细菌性败血综合征致病菌的初步研究[J]. 淡水渔业,2007,37(2):53-56.
[6]潘厚军,刘晓勇,常藕琴,等. 西伯利亚鲟停乳链球菌的分离、鉴定与致病性[J]. 中国水产科学,2009,16(6):891-904.
[7]Bauer O N, Pugachev O N, Voronin V N. Review study of parasites and diseases of sturgeons in Russia:a review[J]. J Appl Ichthyol,2002,18:420-429.
[8]Hua Y P, Wang D. A review of sturgeon virosis[J]. J For Res,2005,16(1):79-82.
[9]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[10]王淑娟. 现代诊断学手册[M]. 北京:北京医科大学中国协和医科大学联合出版社,1995.
[11]周素明,李安兴,马 跃,等. 养殖鱼类链球菌病病原的分离鉴定及其16S rDNA分析[J]. 中山大学学报,2007,46(2):68-71.
[12]王国良,祝璟琳,金 珊. 养殖大黄鱼(Pseudosciaenacrocea)3种致病弧菌的分子鉴定及其系统发育学分析[J]. 海洋与湖沼,2008,39(1):162-167.
[13]Hristo D. The importance ofAeromonashydrophilain food safety[J]. Food Control,2006,17:474-483.
[14]黄琪琰. 水产动物疾病学[M]. 上海:上海科学技术出版社,1998:103-139.
[15]陆承平. 致病性嗜水气单胞菌及其所致鱼病综述[J]. 水产学报,1992(16):282-288.
[16]储卫华,于 勇. 鲟鱼嗜水气单胞菌的分离与鉴定[J]. 淡水渔业,2003,33(2):16-17.
[17]李爱华,蔡桃珍,吴玉深,等. 我国鱼类病原-嗜水气单胞的耐药性研究[J]. 微生物学报,2001,28(1):58-63.
IsolationandIdentificationPathogenicBacteriaHD0824fromAcipenserbaeriiandItsAntibioticSensitivity
YANG Yi-bin1,LIU Yang2,XIA Yong-tao3,YANG Xian-le4,AI Xiao-hui1*
(1.Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Hubei Wuhan 430223, China; 2.Animal Husbandry and Aquatic Products Bureau of Fengxin County, Jiangxi Fengxin 330700, China; 3.Chinese Academy of Fishery Sciences, Beijing 100039, China; 4.State Collection Center of Aquatic Pathogen, Shanghai Ocean University, Shanghai 201306, China)
【Objective】The study was aimed at the isolation, identification and antibiotic sensitivity of pathogen from sickedAcipenserbaerii, which would provide a reference for control and prevention disease forAcipenserbaerii.【Method】The pathogenic bacterial strain HD0824 from Siberian sturgeon(Acipenserbaerii) suffering diseases was isolated, which could make laboratory rat die within 24 hours. The typical diseased symptoms as naturally occurred were experimentally reproduced after artificial infection, indicating the strains HD0824 was the pathogen of this diseases of sturgeon. 【Result】Strain HD0824 was gram negative, no spore and capsule, which had β-hemolytic activity on rabbit blood agar and had strong protease activity. By means of physiological and biochemical identification and 16S rDNA sequence analysis, strain HD0824 was identified asAeromonashydrophilawith 99 % homology. In addition, strain HD0824 was highly sensitive to gentamicin, doxycycline, chloramphenicol, amikacin, florfenicol, cefotaxime, azithromycin and levofloxacin and intermediately sensitive to one kind of antibiotics including neomycina. 【Conclusion】The isolated strain HD0824 was the pathogenic bacteria ofAcipenserbaerii, which could be prevented by administering drugs such as gentamicin and florfenicol in fisheries farming.
Aeromonashydrophila;Acipenserbaerii; Identification; Antibiotic sensitivity
1001-4829(2017)5-1239-06
10.16213/j.cnki.scjas.2017.5.044
2016-05-20
公益性行业(农业)科研专项(201203085)
杨移斌(1988-),男,助理研究员,主要从事水生动物病害临床诊断及其防控技术研究,E-mail:yangyb19888@126.com;*为通讯作者:艾晓辉(1968-),男,研究员,研究方向:水产动物药理学,E-mail:aixh@ yfi.ac.cn。
S941
A
(责任编辑 陈 虹)
