磁共振成像表观扩散系数对前列腺癌分级诊断的价值
2017-11-09郑信德陈财忠缪熙音郭怡菁
郑信德,陈财忠,缪熙音,郭怡菁
复旦大学附属中山医院放射诊断科,上海 200032
·论著·
磁共振成像表观扩散系数对前列腺癌分级诊断的价值
郑信德,陈财忠*,缪熙音,郭怡菁
复旦大学附属中山医院放射诊断科,上海 200032
目的回顾分析前列腺癌、前列腺增生及正常前列腺的磁共振成像(magnetic resonance imaging,MRI)信号差异,探讨表观扩散系数(apparent diffusion coefficient,ADC)在前列腺癌分级中的价值。方法收集复旦大学附属中山医院2013年1月至2014年3月收治的前列腺癌患者40例(包括高危组和低中危组)和前列腺增生患者11例,均经手术或穿刺病理诊断证实;同时,入组正常对照组20例,均为健康志愿者。对3组患者及志愿者进行常规MRI检查及弥散加权成像(magnetic resonance diffusion weighted imaging,DWI)检查,比较各组的T2WI信号强度、T1WI平扫动静脉期的信号强度和ADC值,并将前列腺癌的ADC值与Gleason评分进行相关分析,确定利用ADC值鉴别高危与低中危前列腺癌的临界值。结果在T2WI信号强度和ADC值方面,前列腺癌组、前列腺增生组和正常对照组依次递增,3组间差异均有统计学意义(P<0.05);在T1WI信号强度方面,只有正常前列腺中央带的动静脉期信号强度差值显著高于前列腺癌组和前列腺增生组,差异有统计学意义(P<0.05)。前列腺癌的ADC值与Gleason评分负相关(r=-0.401,P=0.010),即Gleason评分越高,ADC值越小。以ADC值0.70×10-3mm2/s为临界值,鉴别诊断低中危组和高危组前列腺癌的敏感度为 96.4%,特异度为58.3%。结论T2WI信号强度和ADC值可用于鉴别前列腺癌、前列腺增生及正常前列腺,T1WI动静脉期信号差值也有一定的参考价值;前列腺癌ADC值与Gleason评分有一定的相关性,提示ADC值可用于前列腺癌临床危险度的分级诊断。
前列腺肿瘤;磁共振成像;肿瘤分级
前列腺癌是发达国家最常见的实质性肿瘤之一,占男性肿瘤的15%。2012年,美国大约有 241 740 例前列腺癌新发病例,且每6例确诊患者中就有1例死亡[1]。据一项全球调查研究显示,前列腺癌在184个国家中位居男性高发肿瘤的前3位[2]。前列腺癌在亚洲地区的发病率和死亡率虽不及欧美地区,但有逐年上升的趋势,可能与生活方式的西化有关[3]。
前列腺癌的诊断和分级对指导临床医师选择治疗方案及判断患者预后具有重要意义。前列腺肿瘤的鉴别诊断及其恶性程度的无创评估是近年来前列腺癌磁共振成像(magnetic resonance imaging,MRI)研究的两大热点[4]。因此,本研究通过比较前列腺癌、前列腺增生和正常前列腺的MRI弥散加权成像(diffusion weighted imaging,DWI)检查信号强度差异,分析表观扩散系数(apparent diffusion coefficient,ADC)值与Gleason评分的关系,以期为前列腺癌的诊断及分级提供参考。
1 资料与方法
1.1 一般资料 收集复旦大学附属中山医院2013年1月至2014年3月收治的前列腺癌患者40例,年龄54~84岁,平均(68.5±13.1)岁。所有前列腺癌患者均经病理证实:其中,经根治术的手术标本病理证实者33例,肿瘤体积占前列腺体积的1%~80%,平均17.6%;经穿刺活检病理证实者7例。前列腺癌患者主要症状为排尿困难、尿潴留、血尿和血精等;血清前列腺特异性抗原(PSA)水平为4.9~1 340.0 ng/mL,平均70.0 ng/mL;Gleason评分为6~10分,平均7.3分。所有前列腺癌患者在接受根治术或穿刺活检前均进行过常规MRI-DWI检查,在接受MRI检查前均未接受过任何治疗。穿刺活检患者系在B超引导下接受直肠穿刺活检,采用六分区法将前列腺分为基底部、体部和尖部3部分,再以中央沟为界分为左右两侧;穿刺所得前列腺组织,采用Gleason评分标准进行评价。
另外,收集同期经穿刺活检病理证实的前列腺增生患者11例,年龄54~78岁,平均(66.2±11.5)岁;正常对照组20例,年龄30~77岁,平均(60.5±14.7)岁,均为健康志愿者,无泌尿系统疾病,PSA值在正常范围,MRI未见异常。
1.2 检查方法 运用Siemens Avanto 1.5T MRI扫描仪行MRI-DWI检查。MRI检查以体线圈为射频发射线圈,以腹部相控阵线圈为接收线圈。患者取仰卧位,行前列腺轴位TSE T2WI扫描:重复时间(TR)2 400 ms,回波时间(TE)108 ms;层厚4 mm;视野(FOV)20 cm ×20 cm;激励次数(NEX) 2次;矩阵320×272。冠状位TSE T2WI扫描:TR 2 510 ms,TE 108 ms;层厚4 mm;FOV 22 cm×22 cm;NEX 2次;矩阵320×192。矢状位TSE T2WI扫描:参数同冠状位。并行TSE T1WI扫描:TR 560 ms,TE 9.4 ms;层厚4 mm;FOV 20 cm×20 cm;NEX 2次;矩阵320×224。T1WI三期增强扫描所用造影剂为钆喷酸葡胺注射液30 mL,以1.6 mL/s速度自肘静脉注入,18~20 s后开始动脉期扫描。DWI检查:TR 3 300 ms,TE 69 ms;层厚6 mm;FOV 36 cm×36 cm;矩阵128×100。扩散敏感系数(b值)分别采用0 s/mm2和800 s/mm2,取层面选择、频率编码和相位编码3个方向。
1.3 图像分析 在工作站上分别测量前列腺癌、前列腺增生和正常前列腺的T2WI信号强度、T1WI平扫、动脉期、静脉期的信号强度及ADC值。由于前列腺癌中85%具有多灶性[5],故在测量时选择体积最大的病灶进行测量;对于无明显结节的前列腺癌,则选择T2WI信号及ADC值最低的区域进行测量。每例患者的数据均由2名从事泌尿生殖系统影像诊断的医师分别测量,结果取平均值;二者测量时感兴趣区(region of interest,ROI)的面积要尽可能一致,ROI的位置根据病理证实为前列腺癌和前列腺增生的区域来选取,尽量避开外周带与中央腺体的交界处、前列腺周围脂肪、精囊根部、血管、出血或钙化灶。
1.4 统计学处理 采用SPSS 20.0软件对检测结果进行统计学处理。首先分别对3组图像的T2WI信号强度、T1WI平扫及增强信号强度和ADC值进行正态性检验和方差齐性检验,若符合标准,则进行单因素方差分析,并采用LSD法进行组间比较;若不符合,则进行Kruskal-Wallis 检验,并采用Mann-Whitney检验进行组间两两比较。然后对前列腺癌组的ADC值与Gleason评分进行Pearson相关分析,再根据2009版《中国泌尿外科疾病诊断治疗指南》前列腺癌危险因素分析标准(Gleason评分≤6分为低危,7分为中危,≥8分为高危),将40例前列腺癌患者分为低中危组(Gleason评分<8)和高危组(Gleason评分≥8),对2组患者生存情况分别进行受试者工作特征(ROC)曲线分析,并计算曲线下面积,从而判断低中危组与高危组的临界值。检验水准(α)为0.05。
2 结 果
2.1 前列腺癌患者的MRI信号特征 40例前列腺癌患者的MRI特点包括:T1WI为低信号或稍高信号,T2WI为低信号,DWI为高信号,ADC值为低信号;动态增强后动脉期轻中度强化,静脉期持续强化(图1)。
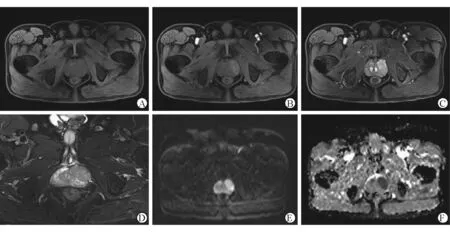
图1 前列腺癌患者的MRI信号特征
2.2 前列腺癌、前列腺增生和正常前列腺的MRI信号差异 结果(表1)表明:3组数据中ADC值符合正态分布,方差齐性检验显示F=0.952(P>0.01),方差分析显示F=90.597(P<0.001),组间两两比较显示3组ADC值间的差异均有统计学意义(P<0.05);其中,前列腺癌组的ADC值明显低于前列腺增生组和正常前列腺组,尤以正常前列腺外周带的ADC值最高。
3组T2WI信号强度测量值不符合正态分布,Kruskal-Wallis检验显示3组的T2WI信号强度差异有统计学意义(χ2=45.513,P<0.05),组内两两比较差异经Mann-Whitney检验显示差异有统计学意义(P<0.05);其中,前列腺癌组T2WI值明显低于前列腺增生组和正常前列腺组,尤以正常前列腺外周带的T2WI值最高。
3组T1WI信号强度测量值也不符合正态分布,Kruskal-Wallis检验显示T1WI信号强度各数据(包括平扫、动脉期、静脉期的信号强度,动脉期与平扫的差值,以及静脉期与动脉期的差值)中,只有正常前列腺中央带的动静脉期信号强度差值与前列腺癌、前列腺增生间差异有统计学意义(Mann-Whitney检验,P<0.05),前者明显高于后2者,尤以前列腺增生组最低;其余各项数据均显示组间差异无统计学意义。

表1 前列腺癌、前列腺增生、正常前列腺外周带及中央带的MRI信号测量值
2.3 前列腺癌MRI诊断的ADC值与Gleason评分的关系 对前列腺癌组测得病灶的ADC值与其Gleason评分进行Pearson相关分析,得出相关系数r=-0.401,P=0.010。由此可以认为,ADC值与Gleason评分之间明显负相关(图2)。
根据临床危险度分级,将前列腺癌分为低中危组(Gleason评分<8)和高危组(Gleason评分≥8),2组ADC值的ROC曲线分析(图3)显示:曲线下面积为0.799,当ADC值为0.70×10-3mm2/s时,分级判断的敏感度为96.4%,特异度为58.3%。

图2 前列腺癌MRI诊断ADC值与Gleason评分的相关散点图

图3 ADC值对低中危组(Gleason评分<8)和高危组(Gleason评分≥8)前列腺癌诊断的ROC曲线
3 讨 论
目前,超声引导下穿刺活检是诊断前列腺癌的金标准,通过穿刺所得的Gleason评分还可作为判断前列腺癌分化程度和预后情况的主要根据。然而,穿刺活检有一定的漏诊率,每年有大量的穿刺结果为假阴性[6],再加上这是一种有创性检查,部分患者存在心理障碍,且穿刺后可能出现出血、感染、疼痛、尿潴留和性功能障碍等一系列并发症,故难以作为长期检测的方法。
欧洲泌尿生殖放射学会(European Society of Urogenital Radiology,ESUR)推荐T2WI+DWI+DCE-MRI作为前列腺癌诊断的扫描方案[7];但也有研究对比了多种扫描方案后认为,T2WI+DWI对前列腺癌的诊断效能仅略低于T2WI+DWI+DCE-MRI和T2WI+DWI+DCE-MRI+MRS,因此推荐T2WI+DWI作为前列腺癌筛查的常规扫描序列[8]。本研究结果显示,前列腺癌、前列腺增生和正常前列腺外周带3组间的ADC值和T2WI信号强度差异均有统计学意义,而3组间T1WI的信号强度及强化差值的差异均无统计学意义,前列腺癌和前列腺增生仅与正常中央腺体的T1WI动静脉期强化差值有明显差异。这些结果说明,日常工作中的动态增强扫描对于前列腺癌的诊断意义可能小于ADC值和T2WI信号强度。
Issa等[9]研究认为,肿瘤组织水分子运动减低是因为具有更高核质比的肿瘤上皮细胞代替了富含水的腺泡结构,正常前列腺腺泡是沿尿道周围向外辐射的线性分布,而肿瘤上皮细胞的存在会破坏这种正常结构,同时腺体的内部结构本身也可能发生紊乱,以上因素的共同结果是使ADC值下降。而正常前列腺外周带间质疏松,平滑肌分布稀疏,实质主要由大而丰富的腺泡构成,腺腔内为含蛋白少的稀薄液体,相应的水分子扩散受限程度较小,因此T2WI信号高,ADC值高。前列腺增生腺体较正常前列腺排列更紧密,间质成分更多,限制了水分子的扩散,但其细胞密度及细胞形态功能仍接近正常前列腺组织,故其水分子运动受限程度介于前列腺癌和正常前列腺外周带之间。ADC值即能够有效地反映前列腺癌、前列腺增生及正常外周组织中这种微观流动效应的差别[10]。
Issa等[9]报道的正常外周带平均ADC值分别为(1.91±0.46)×10-3mm2/s。李飞宇等[11]对腺体型增生、间质型增生和前列腺癌的ADC值进行测量,所得结果的平均值分别为(1.80±0.20)×10-3mm2/s、(1.56±0.18)×10-3mm2/s和(1.27±0.21)×10-3mm2/s。Oto等[12]测得腺体型增生的ADC值为(1.73±0.28)×10-3mm2/s,基质型增生为(1.27±0.21)×10-3mm2/s。Sato等[13]研究显示,前列腺癌的平均ADC值为(1.11±0.41)×10-3mm2/s,正常外周带为(1.68±0.40)×10-3mm2/s。本研究结果显示,前列腺增生的平均ADC值为(1.41±0.20)×10-3mm2/s,前列腺癌为(0.94±0.21)×10-3mm2/s,正常外周带为(1.70±0.21)×10-3mm2/s,这些数据均与以往研究结果具有一致性。
本研究还发现,前列腺癌的ADC值与Gleason评分负相关(r=-0.401,P=0.010)。可能的解释是,增多的癌细胞加重了前列腺腺体基质的纤维化,并使其结构更加扭曲,从而导致高级别肿瘤的水分子运动相对更加受限,与Turkbey等[14]的研究结果基本一致。另外,本研究还计算出了鉴别诊断低中危组与高危组前列腺癌的ADC临界值,认为ADC值为0.70×10-3mm2/s时,判断前列腺癌临床危险度的敏感性和特异性都较好,可以此实现前列腺癌恶性程度的无创评估。
本研究尚存在一定的局限性:(1)样本量小,所得结论还需更大样本量的研究加以验证;(2)通过穿刺病理结果确定ROI,可能会对数据测量产生一定的主观偏倚,但本研究旨在探讨前列腺癌与前列腺增生、正常前列腺的信号差异,并分析前列腺癌ADC值与Gleason评分的关系,而非探讨MRI的诊断效能,因此采用这种方法可以更准确地选取病灶位置,确保结果的可靠性;(3)没有测量T1WI和T2WI值,而是直接测量信号强度,与真实的T1WI和T2WI值可能存在误差,但是考虑到T1mapping和T2mapping在临床工作中并没有列入常规检查,因此本研究对于放射科医师日常工作中诊断前列腺癌仍具有一定的参考价值。
综上所述,T2WI信号强度和ADC值可用来鉴别前列腺癌、前列腺增生及正常前列腺,另外T1WI动静脉期信号差值也有一定的参考价值;前列腺癌ADC值与Gleason评分有一定相关性,设定ADC临界值有助于判定前列腺癌的临床危险度分级。
[ 1 ] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1):10-29.
[ 2 ] BRAY F, JEMAL A, GREY N, et al. Global cancer transitions according to the Human Development Index (2008-2030): a population-based study[J]. Lancet Oncol, 2012, 13(8):790-801.
[ 3 ] XIA S J, CUI D, JIANG Q. An overview of prostate diseases and their characteristics specific to Asian men[J]. Asian J Androl, 2012, 14(3):458-464.
[ 4 ] 王 良. 前列腺癌磁共振诊断的优越性和局限性[J]. 放射学实践, 2014(5):466-468.
[ 5 ] BONEKAMP D, JACOBS M A, EL-KHOULI R, et al. Advancements in MR imaging of the prostate: from diagnosis to interventions[J]. Radiographics, 2011, 31(3):677-703.
[ 6 ] THOMPSON J E, VAN LEEUWEN P J, MOSES D, et al. The diagnostic performance of multiparametric magnetic resonance imaging to detect significant prostate cancer[J]. J Urol, 2016, 195(5):1428-1435.
[ 7 ] BARENTSZ J O, RICHENBERG J, CLEMENTS R, et al. ESUR prostate MR guidelines 2012[J]. Eur Radiol, 2012, 22(4):746-757.
[ 8 ] 沈钧康, 赵文露, 杨 毅, 等. 1.5T MR功能成像序列联合T2WI对前列腺癌筛查的临床价值[J]. 中华放射学杂志, 2014, 48(1):38-42.
[ 9 ] ISSA B.Invivomeasurement of the apparent diffusion coefficient in normal and malignant prostatic tissues using echo-planar imaging[J]. J Magn Reson Imaging,2002,16(2):196-200.
[10] 王霄英, 丁建平, 周良平, 等. 前列腺癌的MR扩散成像初步研究[J]. 中华放射学杂志, 2005, 39(11):1207-1209.
[11] 李飞宇, 王霄英, 许玉峰, 等. 良性前列腺增生的ADC值定量分析[J]. 实用放射学杂志, 2007, 23(5):661-664.
[12] OTO A, KAYHAN A, JIANG Y, et al. Prostate cancer: differentiation of central gland cancer from benign prostatic hyperplasia by using diffusion-weighted and dynamic contrast-enhanced MR imaging[J]. Radiology, 2010, 257(3):715-723.
[13] SATO C, NAGANAWA S, NAKAMURA T, et al. Differentiation of noncancerous tissue and cancer lesions by apparent diffusion coefficient values in transition and peripheral zones of the prostate[J]. J Magn Reson Imaging, 2005, 21(3):258-262.
[14] TURKBEY B, SHAH V P, PANG Y, et al. Is apparent diffusion coefficient associated with clinical risk scores for prostate cancers that are visible on 3-T MR images?[J]. Radiology, 2011, 258(2):488-495.
Diagnosis value of apparent diffusion coefficient of magnetic resonance imaging in grading of prostate cancer
ZHENG Xin-de, CHEN Cai-zhong*, MIAO Xi-yin, GUO Yi-jing
Department of Diagnostic Radiology, Zhongshan Hospital, Fudan University, Shanghai 200032, China
Objective: To retrospectively analyze the magnetic resonance imaging (MRI) signal differences between prostate cancer, benign prostatic hyperplasia, and normal prostate, and to explore the value of apparent diffusion coefficient (ADC) in prostate cancer grading.MethodsForty cases of prostate cancer and eleven cases of benign prostatic hyperplasia in Zhongshan Hospital Affiliated to Fudan University between January 2013 to March 2014 were enrolled, which were all confirmed by surgery or biopsy. At the same time, 20 normal cases were arranged as the control group, which were healthy volunteers. All the patients and volunteers were obtained informed consent. The T2WI signal intensity, T1WI signal intensity (including unenhanced, arterial and venous phase) and ADC value of the three groups were compared after MRI and magnetic resonance diffusion weighted imaging (DWI). Then the correlation between ADC value of prostate cancer and Gleason score was analyzed to determine the critical value of ADC in the identification of high-risk and low-risk prostate cancer.ResultsIn terms of T2WI signal intensity and ADC values, there were significant differences among the three groups (P<0.05). In terms of T1WI signal intensity, only the difference of dynamic and venous phase in central gland of normal prostate was significantly different from that in prostate cancer and benign prostatic hyperplasia (P<0.05),with the former higher than the latter two. The ADC value of prostate cancer was negatively correlated with Gleason score (r=-0.401,P=0.010). The higher the Gleason score, the smaller the ADC value. When the critical value of ADC was 0.70×10-3mm2/s, the sensitivity of identifying low/intermediate-risk group and high-risk group for prostate cancer was 96.4%, and the specificity was 58.3%.ConclusionsT2WI signal intensity and ADC value can be used to identify prostate cancer, benign prostatic hyperplasia, and normal prostate. T2WI signal differences of dynamic and venous phase also have a certain reference value. The ADC value of prostate cancer is related to Gleason score, suggesting that it may be used for grading the clinical risk of prostate cancer.
prostatic neoplasms; magnetic resonance imaging; neoplasm grading
2016-12-19接受日期2017-09-01
郑信德,技师. E-mail: zhenghuiade@126.com
*通信作者(Corresponding author). Tel: 021-64041990-2876, E-mail: chen.caizhong@zs-hospital.sh.cn
10.12025/j.issn.1008-6358.2017.20161164
R 737.25
A
[本文编辑] 叶 婷, 张艺鸣
