喉癌、喉良性病变及声带息肉组织HPV-DNA及P16蛋白的表达差异
2017-11-09秦雪梅叶宣光顾立新朱小平
李 强,秦雪梅,叶宣光,顾立新,朱小平
复旦大学附属金山医院耳鼻咽喉-头颈外科,上海 201508
·短篇论著·
喉癌、喉良性病变及声带息肉组织HPV-DNA及P16蛋白的表达差异
李 强,秦雪梅,叶宣光,顾立新,朱小平*
复旦大学附属金山医院耳鼻咽喉-头颈外科,上海 201508
目的检测喉癌、喉良性病变组织及声带息肉组织中HPV-DNA及P16蛋白的表达水平,探讨HPV感染与喉癌发生的相关性。方法收集2011年5月至2015年7月就诊于复旦大学附属金山医院耳鼻咽喉-头颈外科的256例患者,其中喉鳞状细胞癌34例、喉良性病变(非声带息肉)15例、声带息肉207例,男性184例、女性72例,中位年龄56岁。采用实时荧光PCR法检测喉鳞状细胞癌组织和喉良性病变组织HPV-DNA水平。采用免疫组化法观察喉癌组织、喉良性病变及声带息肉中P16蛋白的表达。结果实时荧光PCR检测发现34例喉鳞状细胞癌组织中HPV-DNA阳性率为8.8%(3/34),喉良性病变均为阴性(0/15),两组间HPV-DNA阳性率差异无统计学意义。免疫组化染色显示喉鳞状细胞癌、喉良性病变、声带息肉组织P16蛋白阳性表达率分别为32.4%(11/34)、46.7%(7/15)和47.8%(99/207),其中声带息肉组织P16蛋白阳性率高于喉癌组织,差异有统计学意义(P=0.046)。结论喉癌组织HPV-DNA阳性率略高于喉良性病变;P16蛋白在喉癌组织的表达略低于喉良性病变,明显低于声带息肉。
喉癌;喉良性病变;声带息肉;人乳头状瘤病毒(HPV);实时荧光PCR
喉癌是常见的头颈部恶性肿瘤之一,与人乳头状瘤病毒(human papillomavirus, HPV)感染存在一定关系。因此,HPV感染一直是喉癌病因学研究的热点[1-2]。HPV亚型多达51种,其中HPV16E6、E7蛋白可促进喉鳞状细胞癌细胞系增殖,抑制其分化,使肿瘤细胞恶性增强,亦可引起蛋白酶体的降解和部分肿瘤抑制基因蛋白泛素化[3-4]。高危亚型HPV16/18被发现与喉癌的发生、发展密切相关,但对于喉癌患者HPV16/18感染率的研究结果仍存在较大争议[5-6]。头颈肿瘤中P16蛋白表达水平与HPV-DNA阳性率有很好的一致性,是临床上判断是否感染HPV的重要生物学标志物[7-8]。因此,本研究采用实时荧光PCR检测人喉鳞癌组织和喉良性病变组织中HPV-DNA及P16的表达水平,探讨它们与喉癌的关系,为HPV相关喉癌的预后研究及进一步的基因诊疗提供新的思路。
1 资料与方法
1.1 一般资料 收集2011年5月至2015年7月就诊于复旦大学附属金山医院耳鼻咽喉-头颈外科的256例患者,其中喉癌34例、喉良性病变(非声带息肉)15例、声带息肉207例,男性184例、女性72例,中位年龄56岁。34例喉癌均经病理确诊为鳞状细胞癌,其中声门上型14例、声门型18例、声门下型2例;病理确诊颈淋巴结转移17例,无淋巴结转移17例。喉良性病变(非声带息肉)患者包括病理证实的囊肿9例,乳头状瘤5例,喉不典型增生1例。
1.2 主要试剂及仪器 固定组织基因组DNA提取试剂盒购自康为世纪生物科技有限公司(试剂货号:CW0547,试剂批号:00151507)。人乳头瘤病毒核酸检测定量试剂盒购自广州安必平医药科技股份有限公司(试剂批号:2016001)。P16蛋白免疫组化试剂盒为小鼠抗人p16INK4a蛋白单克隆抗体试剂盒(批号:16K70103),购于北京中杉金桥生物技术有限公司。
1.3 实时荧光PCR检测HPV-DNA水平 参照试剂盒说明书,提取标本核酸,进行浓度测定。对提取的DNA进行扩增。分别加入提取后的待测样本核酸5 μL,阴性质控品、阳性质控品各5 μL,盖紧管盖,瞬时离心后转移至扩增检测区。95℃,15 min;1 cycle 94℃,15 s;55℃,45 s;共40 cycles。55℃时采集荧光。反应体积50 μL。结果判读:根据Ct值及扩增曲线判断结果。
1.4 免疫组化染色检测P16蛋白的表达 切取石蜡标本5~10 μm数片,70℃烤片2 h后二甲苯Ⅰ、Ⅱ、Ⅲ各5 min;无水乙醇5 min;80%乙醇5 min;蒸馏水中洗3 min;pH值6.0柠檬酸盐缓冲液置于高压锅内,电磁炉最高火力2 100 W加热至沸腾后放入切片,盖上盖、加上压力阀,待开始冲气时计时并将火力调整到1 300 W,2 min 30 s后关闭电源,打开锅盖让其自然冷却至室温。切片置蒸馏水中洗 3 min。3%过氧化氢中室温放置10 min,去除内源性过氧化物酶。蒸馏水洗3 min去除3%过氧化氢,PBS洗3 min。逐一将组织周围水分擦干,逐一滴加相应第一抗体,37℃孵育45 min。PBS冲洗,PBS放置3 min,将组织周围水分擦干滴加适量二抗,37℃孵育30 min。PBS冲洗,PBS放置3 min,将组织周围水分擦干滴加适量DAB显色液,显微镜下观察3~10 min至显色完全。自来水冲洗 1 min,苏木精染液染1 min,自来水冲洗3 min,1%盐酸乙醇分化1~3 s,自来水冲洗10 min。85%乙醇5 min。95%乙醇5 min。无水乙醇5 min,2次。二甲苯5 min,3次。中性树胶封片,贴上标签。采用双盲法由2位高年资病理科医师阅片,以细胞质和细胞核棕色染色为阳性。
1.5 统计学处理 采用SPSS 20.0软件进行数据分析,两组间比较和相关性分析采用χ2检验。检验水准(α)为0.05。
2 结 果
2.1 喉癌、喉良性病变组织HPV-DNA的表达 结果表明:34例喉鳞癌组织HPV-DNA阳性3例,阳性率8.8%;喉良性病变组织HPV-DNA均为阴性,阳性率为0,两组间阳性率差异无统计学意义(P=0.235)。
2.2 喉癌、喉良性病变及声带息肉组织P16蛋白的表达 结果(图1)表明:P16蛋白阳性染色位于胞核或胞质内。34例喉鳞癌组织P16蛋白阳性11例,阳性率32.4%;15例喉良性病变P16蛋白阳性为7例,阳性率46.7%;207例声带息肉组织P16蛋白阳性99例,阳性率47.8%。喉癌组织P16蛋白阳性率低于声带息肉组织,差异有统计学意义(χ2=3.997,P=0.046)。
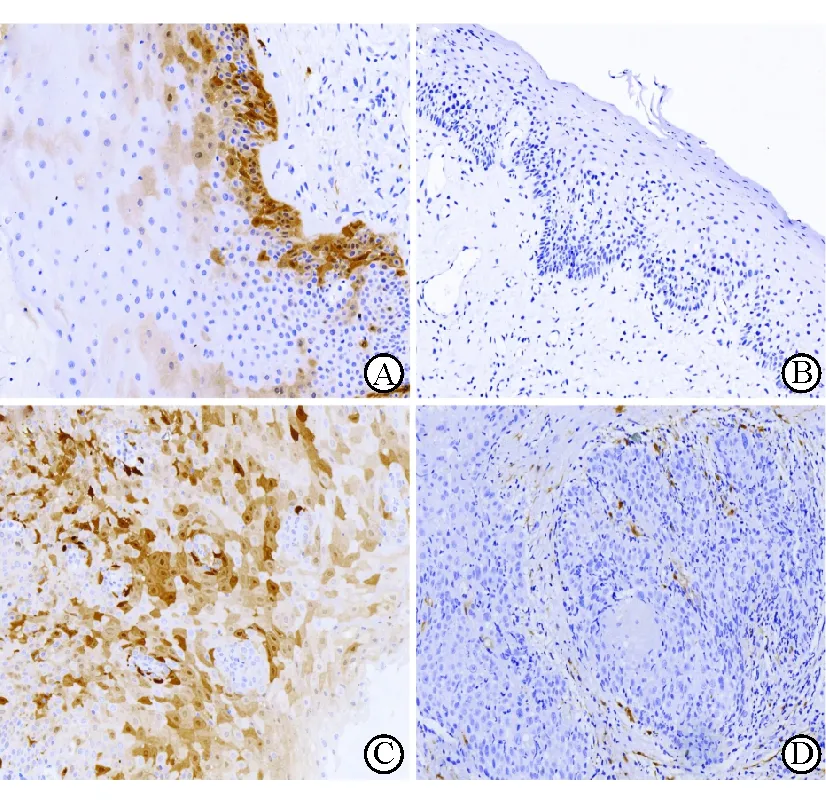
图1 免疫组化染色测定喉组织P16蛋白表达
3 讨 论
HPV感染可能是喉癌发生的独立危险因素。HPV的致癌作用是目前喉癌病毒病因学研究的重要内容之一,特别是HPV16和HPV18,被认为是与喉癌发生密切相关的高危类型,提示高危型HPV感染是喉癌发病学中不容忽视的致病因子[9],但目前关于喉癌与HPV感染间的关系仍存在较多争议,喉癌患者HPV感染率为3%~100%。样本量、样本保存方法、检测手段和检测HPV的分型是导致检测结果差异较大的主要原因,其中检测方法影响最大[4-9]。PCR是目前检测HPV基因组最敏感的方法,能从100 000个细胞中检测出1个受感染细胞,因此本研究采用PCR法进行检测。
HPV16和HPV18是最常见的高危类型,而HPV16感染占所有HPV阳性头颈肿瘤的86%~95%[5]。本研究发现34例喉癌组织中仅3例(8.8%)患者HPV阳性,与国内其他研究[10-11]结果基本一致。但Xu等[12]回顾分析673例喉癌患者病理资料显示HPV感染率为4.9%(33/674),而且3年的总生存率和无病生存率在HPV阳性和阴性组之间差异无统计学意义,提出HPV感染不是喉鳞状细胞癌的发病及预后的参考因素。本研究仅3例喉癌组织表现HPV-DNA阳性,考虑到病例数太少且分布不均,因此没有针对生存结果进行分组随访分析。Matsuzaki等[13]回顾性分析144例喉癌、癌前病变、喉乳头状瘤和非肿瘤性病变组织中高危和低危的HPV-DNA状态,发现HPV感染状态与喉癌、癌前病变及非肿瘤性疾病无相关性。Hernandez等[14]报道在非侵袭性喉癌患者中HPV-DNA阳性率21%(31/148),最多见的亚型为HPV16和HPV22,且女性患者的阳性率略高,为33%(9/27),校准年龄和就诊时间等因素后发现女性喉癌患者HPV感染的风险更高。
应注意的是,并不是所有P16阳性的头颈肿瘤都为HPV阳性。Hong等[15]对647例口咽癌患者组织中HPV-DNA与P16阳性率进行分析,发现以P16 50%作为节点,有25%的患者HPV-DNA阳性但P16阴性,1%的患者HPV-DNA阴性但P16阳性。因此,目前HPV检测首选P16免疫组化作为筛选,P16阳性者建议进一步行HPV-DNA检测。P16基因的失活可以由基因缺失、突变或5′端启动子区域的高度甲基化引起。免疫组化检测只能反映P16蛋白表达情况,不能反映出基因水平的异常,故本组所检测到的P16蛋白的缺失是由哪一种基因异常所致尚不清楚。本研究结果显示喉癌组织P16蛋白阳性率32.4%,低于声带息肉组47.8%(P=0.046),同样低于喉良性病变组46.7%,提示抑癌基因P16的失活与喉癌的发生可能有一定的关系。Young等[16]报道P16在喉癌组织中阳性率仅6.5%(20/307),且随访数据表明P16阳性组和P16阴性组之间的2年总生存率和无治疗失败生存率差异无统计学意义。
综上所述,本研究结果显示喉癌组织中HPV-DNA的阳性率略高于喉良性病变,喉癌组织P16蛋白表达略低于喉良性病变,明显低于声带息肉组织,提示HPV感染与喉癌发生的关系并不明确,仍有待进一步大样本研究证实。
[ 1 ] FUSCONI M, CAMPO F, GALLO A, et al. Laryngeal cancer, HPV DNAvsE6/E7 mRNA test: a systematic review[J]. J Voice, 2017,31(2):248.e1-248.e5.
[ 2 ] 沈 纳,白广平,高天乐,等. 上调miR-519d对喉鳞癌细胞增殖及凋亡的影响[J].中国临床医学,2015,22(5):582-585.
[ 3 ] WANG C J, PALEFSKY J M.Human papillomavirus (HPV) infections and the importance of HPV vaccination[J].Curr Epidemiol Rep,2015,2(2):101-109.
[ 4 ] 沈敏娜,吴 炯,张春燕,等.上海地区高危人群及体检人群HPV亚型感染分布调查[J].中国临床医学,2016,23(5):597-601.
[ 5 ] MOHAMADIAN ROSHAN N, JAFARIAN A, AYATOLLAHI H, et al. Correlation of laryngeal squamous cell carcinoma and infections with either HHV-8 or HPV-16/18[J]. Pathol Res Pract, 2014,210(4):205-209.
[ 6 ] TSIMPLAKI E, ARGYRI E, SAKELLARIDIS A, et al. Oropharyngeal and laryngeal but not oral cancers are strongly associated with high-risk human papillomavirus in 172 Greek patients[J]. J Med Virol, 2017,89(1):170-176.
[ 7 ] CASTELLSAGUÉ X, ALEMANY L, QUER M, et al. HPV Involvement in head and neck cancers: comprehensive assessment of biomarkers in 3 680 patients[J]. J Natl Cancer Inst, 2016,108(6):djv403.
[ 8 ] KARPATHIOU G, MONAYA A, FOREST F, et al. p16 and p53 expression status in head and neck squamous cell carcinoma: a correlation with histological, histoprognostic and clinical parameters[J]. Pathology, 2016,48(4):341-348.
[ 9 ] GHEIT T, ABEDI-ARDEKANI B, CARREIRA C, et al. Comprehensive analysis of HPV expression in laryngeal squamous cell carcinoma[J]. J Med Virol, 2014,86(4):642-646.
[10] 吴俊福, 周佳青. 喉癌及喉良性病变中HPV不同亚型的检测[J].现代肿瘤医学, 2012,20(9):1813-1816.
[11] 魏 炜, 宋韫韬, 张宝云, 等. 喉鳞状细胞癌患者人乳头瘤病毒感染的检测分析[J]. 中华实验和临床病毒学杂志, 2013,27(1):22-24.
[12] XU Y, LIU S, YI H, et al. Human papillomavirus infection in 674 Chinese patients with laryngeal squamous cell carcinoma[J]. PLoS One, 2014,9(12):e115914.
[13] MATSUZAKI H, MAKIYAMA K, SUZUKI H, et al. Human papillomavirus infection status of various laryngeal diseases in Japan: a comprehensive study[J]. J Voice, 2017,31(4):504.e35-504.e40.
[14] HERNANDEZ B Y, GOODMAN M T, LYNCH C F, et al. Human papillomavirus prevalence in invasive laryngeal cancer in the United States[J]. PLoS One, 2014,9(12):e115931.
[15] HONG A, JONES D, CHATFIELD M, et al. HPV status of oropharyngeal cancer by combination HPV DNA/p16 testing: biological relevance of discordant results[J]. Ann Surg Oncol, 2013,20 Suppl 3:S450-S458.
[16] YOUNG R J, URBAN D, ANGEL C, et al. Frequency and prognostic significance of p16(INK4A) protein overexpression and transcriptionally active human papillomavirus infection in laryngeal squamous cell carcinoma[J]. Br J Cancer, 2015,112(6):1098-1104.
Expression of HPV-DNA and P16 protein in laryngeal cancer, benign laryngeal lesions, and vocal cord polyps
LI Qiang, QIN Xue-mei,YE Xuan-guang,GU Li-xin,ZHU Xiao-ping*
Department of ENT, Jinshan Hospital, Fudan University, Shanghai 201508, China
Objective: To detect the expression of HPV-DNA and P16 protein in laryngeal cancer, laryngeal benign lesion tissue, and vocal cord polyp tissue, and to explore the correlation between HPV infection and laryngeal cancer.MethodsThe clinical data of 256 patients who had been treated in Department of Otorhinolaryngology & Head and Neck Surgery of Jinshan Hospital, Fudan University from May 2011 to July 2015 were collected. There were 34 cases of laryngeal squamous cell carcinoma, 15 cases of benign laryngeal lesions (non-vocal cord polyps), 207 cases of vocal cord polyps, 184 males and 72 females, with a median age of 56 years. The levels of HPV-DNA in laryngeal squamous cell carcinoma tissues and benign laryngeal lesions were detected by real-time fluorescence PCR. Immunohistochemical staining was used to detect the expression of P16 protein in laryngeal cancer tissues, laryngeal benign lesions and vocal cord polyps.ResultsReal time fluorescence PCR detection showed that the HPV-DNA positive rate in 34 cases of laryngeal squamous cell carcinoma was 8.8% (3/34), and it was all negative (0/15) in benign laryngeal lesions. There was no significant difference in the HPV-DNA positive rate between the two groups. Immunohistochemical staining showed that the positive expression rate of P16 protein in laryngeal squamous cell carcinoma, benign laryngeal lesions and vocal cord polyp tissues was 32.4% (11/34), 46.7% (7/15), and 47.8% (99/207). The positive rate of P16 protein in vocal cord polyp tissues was higher than that of laryngeal cancer tissues, and the difference was statistically significant (P=0.046).ConclusionsThe positive rate of HPV-DNA in laryngeal cancer tissues is slightly higher than that in benign laryngeal lesions. The expression of P16 protein in laryngeal cancer tissues is slightly lower than that in benign laryngeal lesions, and is significantly lower than that in vocal cord polyps.
laryngeal cancer; benign laryngeal lesions; vocal cord polyp; human papillomavirus (HPV); real-time fluorescence PCR
2017-06-29接受日期2017-08-02
上海市金山区科学技术创新基金项目(2014-3-20). Supported by Science and Technology Innovation Fund of Jinshan District of Shanghai(2014-3-20).
李 强,主治医师. E-mail: stronglee2000@foxmail.com
*通信作者(Corresponding author).Tel:021-34189990-5342,E-mail: yggan65@hotmail.com
10.12025/j.issn.1008-6358.2017.20170552
R 739.65
A
[本文编辑] 廖晓瑜, 贾泽军
