雷帕霉素通过抑制TLR4、IL-6、PGE2表达促进口腔鳞状细胞癌细胞凋亡研究*
2017-11-08张齐梅伍宝琴聂敏海
张齐梅,周 骢,杨 莉,伍宝琴,谭 红,聂敏海△
(西南医科大学附属口腔医院:1.牙周黏膜科;2.检验科,四川泸州 646000)
论著·基础研究doi:10.3969/j.issn.1671-8348.2017.28.004
雷帕霉素通过抑制TLR4、IL-6、PGE2表达促进口腔鳞状细胞癌细胞凋亡研究*
张齐梅1,周 骢1,杨 莉2,伍宝琴1,谭 红1,聂敏海1△
(西南医科大学附属口腔医院:1.牙周黏膜科;2.检验科,四川泸州 646000)
目的探讨雷帕霉素促进人口腔鳞状细胞癌SCC-15细胞凋亡是否与抑制TOLL样受体-4(TLR4)、白细胞介素(IL)-6、前列腺素E2(PGE2)表达有关。方法培养人口腔鳞状细胞癌SCC-15细胞株,雷帕霉素干预后,CCK-8法检测SCC-15细胞活性,Hochest33342/PI双染检测SCC-15细胞凋亡,Transwell法检测细胞侵袭能力,蛋白质印迹法(Western blot)检测TLR4蛋白表达水平, ELISA法检测IL-6、PGE2表达。结果雷帕霉素促进细胞凋亡,SCC-15细胞侵袭能力明显降低。雷帕霉素干预后,IL-6、PGE2水平降低,TLR4蛋白表达减少,与阴性组比较差异有统计学意义(P<0.05)。结论雷帕霉素促进人口腔鳞状细胞癌细胞凋亡可能与抑制TLR4、IL-6、PGE2表达有关。
口腔鳞状细胞;雷帕霉素;免疫逃逸
慢性炎症促进肿瘤逃逸是炎症与肿瘤相关性的重要因素之一[1]。TOLL样受体-4(Toll like receptor 4,TLR4)是体内重要的免疫因子,通过激活炎症因子参与体内的炎症反应。TLR4也参与了肿瘤细胞免疫逃逸,通过诱导肿瘤细胞生成大量免疫抑制性因子抑制免疫细胞启动免疫应答,同时局部感染细胞大量增殖并抑制细胞凋亡[2-3]。白细胞介素6(interleukin-6,IL-6)和前列腺素E2(prostaglandin E 2,PGE2)是TLR4下游重要的炎症因子,参与了细胞增殖、凋亡、迁移和浸润[4-5]。口腔鳞状细胞癌(oral squamous cell carcinomas,OSCC)发病率和病死率均较高,是人类头颈部常见的恶性肿瘤之一[6-7],目前OSCC发病机制不太清楚。雷帕霉素是从吸水链霉菌狭霉中分离的药物,具有很强的免疫抑制特性[8]。TLR4是否参与了OSCC的免疫逃逸,雷帕霉素是否能通过抑制TLR4介导的免疫抑制,从而促进OSCC的凋亡目前尚不清楚。本文检测雷帕霉素对人口腔鳞状细胞癌SCC-15细胞株凋亡影响,探讨TLR4、IL-6和PGE2在其中的作用。
1 材料与方法
1.1材料 人IL-6、PGE2 ELISA试剂盒(武汉优尔生科技股份有限公司),兔抗人β-actin、TLR4抗体,辣根过氧化物酶标记山羊抗兔IgG抗体(Abcam公司),雷帕霉素(Sigma公司),人口腔鳞状细胞癌SCC-15细胞株(上海拜力生物有限公司)。
1.2方法
1.2.1CCK-8法检测SCC-15细胞活性 分为阴性组,雷帕霉素采用2.5、5、10、20、40 ng/mL 5个剂量组干预,每个浓度3个复孔,24 h后每孔加入CCK-8 10 μL继续培养1 h,酶标仪450 nm波长测吸光度值(A值),其反应细胞活力情况。
1.2.2Hochest33342/PI双染检测SCC-15细胞凋亡 根据CCK-8结果,将雷帕霉素干预浓度定为5、10、20 ng/mL,阴性组为对照。SCC-15细胞与雷帕霉素共同培养24 h后Hochest33342/PI双染检测细胞凋亡。具体方法为收集细胞悬浮于1 mL培养基中,加入10 μL蒸馏水溶解的Hochest 33342储存液(100 mg/L),染色15 min;冰上冷却,3 000 g×5 min离心,去上清液,细胞重悬1 mL磷酸盐缓冲液(PBS),加5 μL PI液(1 g/L,蒸馏水溶解),混匀,荧光显微镜观察。细胞核蓝色为正常细胞,亮蓝色为凋亡细胞,红色为死亡细胞。
1.2.3细胞侵袭实验 采用BD公司的基质胶包被的侵袭小室观察雷帕霉素对SCC-15细胞侵袭能力的影响。Matrigel chambers加入500 μL不含血清的RPMI1640培养基中室温放置1 h,使基质胶水化,弃多余培养基。下室孔板内加入750 μL含20%FBS的RPMI1640培养基。离心收集细胞,用含0.1% BSA的RPMI1640重悬细胞至4×105/mL,取200 μL加入上室。干预时间为24 h。24 h后,用棉签抹去上室未能穿膜的细胞,用100%甲醇固定10 min。用0.1%结晶紫染色细胞并在显微镜下计数。
1.2.4蛋白质印迹法(Western blot)检测TLR4蛋白表达 将细胞分为阴性组和雷帕霉素5、10、20 ng/mL组。雷帕霉素与细胞共培养24 h后胰酶消化,收集细胞,加入预冷的RIPA裂解液500 μL,冰上裂解60 min,4 ℃,12 000 g/min×15 min。上样后100 V恒压电泳90 min转至PVDF膜,50 g/L脱脂牛奶室温封闭1 h,加入适当浓度一抗(TLR4 1∶1 000,β-actin 1∶1 000),冰箱4 ℃孵育过夜,PBST漂洗15 min×3次,加入辣根过氧化物酶(HRP)标记的二抗(羊抗兔1∶1 000),室温孵育1 h,PBST漂洗15 min×3次。化学试剂发光,曝光并采集图像,image lab软件3.0版分析目的蛋白条带的灰度值与内参条带的灰度值。
1.2.5ELISA法检测IL-6、PGE2表达 雷帕霉素5、10、20 ng/mL与细胞共培养24 h后收集上清液。按说明书操作,酶标仪A450 nm读取IL-6和PGE2值。
2 结 果
2.1雷帕霉素对SCC-15细胞活性影响 结果显示,雷帕霉素5个剂量组干预后,细胞活性逐渐降低,与阴性组比较,雷帕霉素5、10、20、40 ng/mL能抑制细胞活性(P<0.05)。见图1。
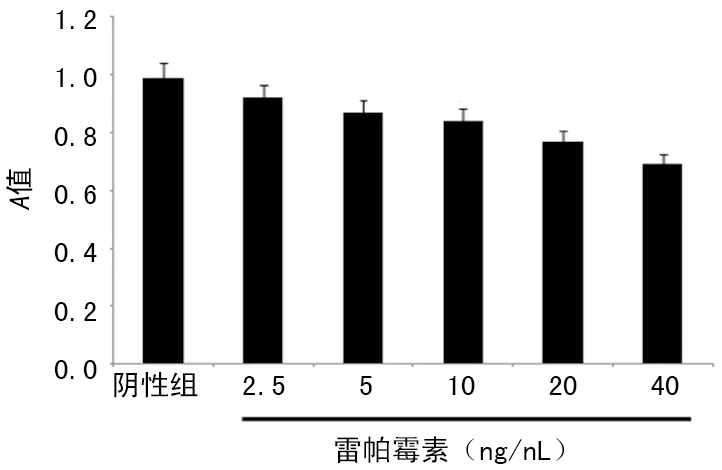
图1 雷帕霉素对SCC-15细胞活性影响
2.2雷帕霉素对SCC-15细胞凋亡的影响 结果显示,阴性组细胞形态呈圆形,淡蓝色,几乎无凋亡细胞。雷帕霉素干预后多数细胞细胞核呈亮蓝色染色,呈凋亡特征性改变,凋亡细胞较多,还可见红色的死亡细胞。见图2。
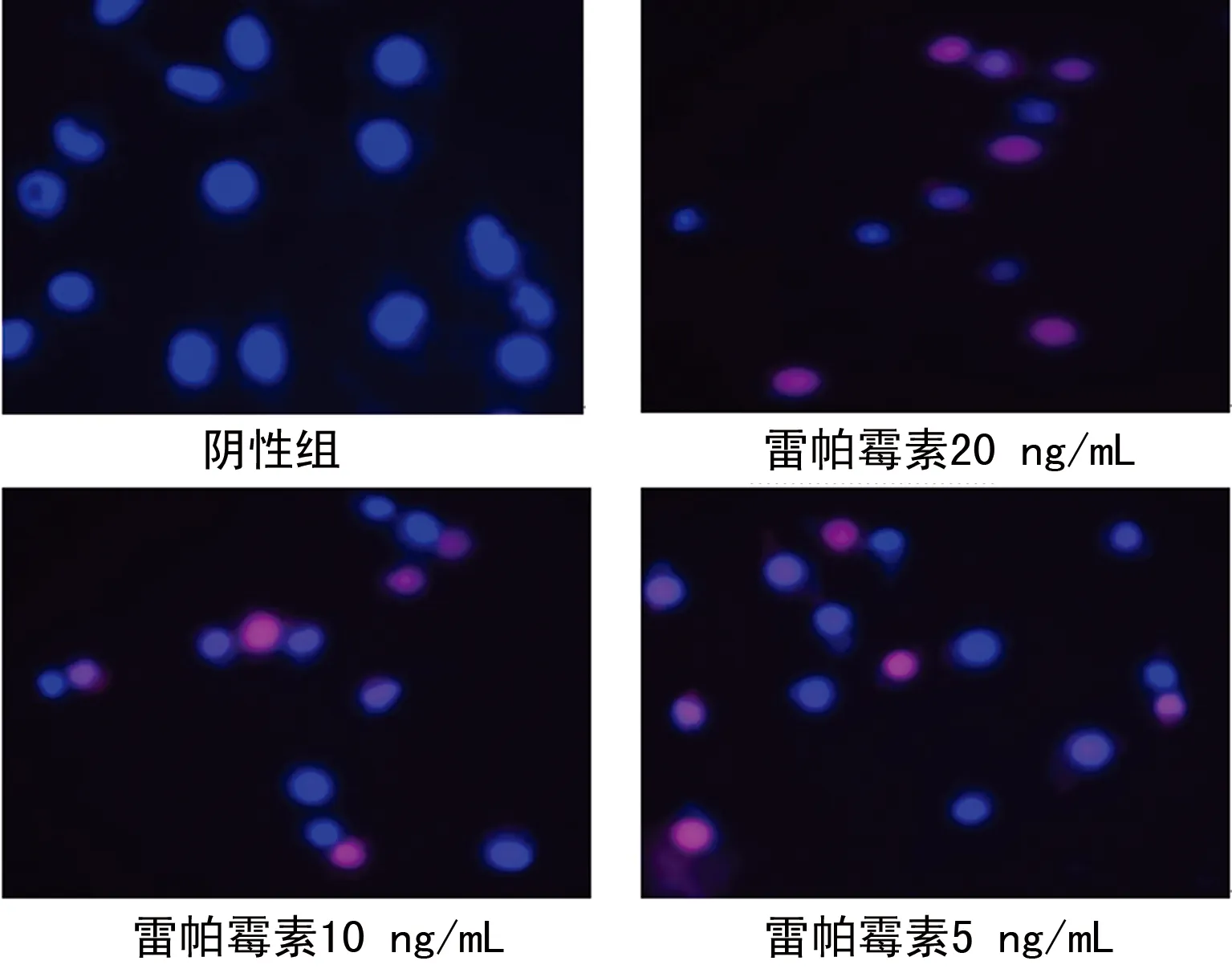
图2 雷帕霉素对SCC-15细胞凋亡的影响
2.3雷帕霉素对SCC-15细胞侵袭影响 阴性组SCC-15细胞穿膜细胞数为(112.20±24.36)个,雷帕霉素5、10、20 ng/mL干预后穿膜细胞数分别为(78.87±6.47)、(62.14±7.31)、(58.24±7.71)个,与阴性组比较差异有统计学意义(P<0.05)。见表1。
表1 雷帕霉素对SCC-15细胞侵袭、TLR4表达及IL-6和PGE2水平的影响
a:P<0.05,与阴性组比较
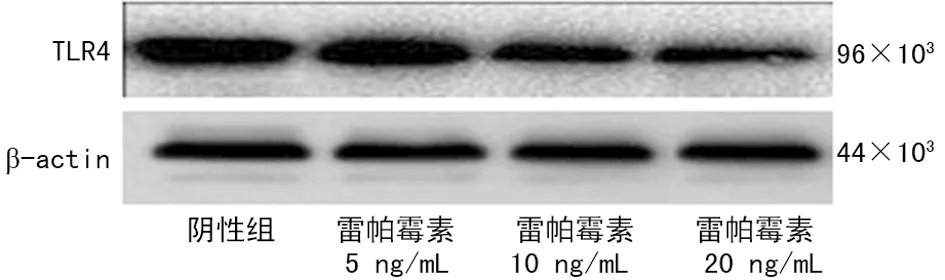
图3 雷帕霉素对SCC-15细胞TLR4蛋白的表达影响
2.4雷帕霉素对SCC-15细胞TLR4蛋白的表达影响 SCC-15细胞中TLR4蛋白表达增加,TLR4/β-actin灰度值比值为1.33±0.11。雷帕霉素5、10、20 ng/mL干预后TLR4蛋白表达减少,与阴性组比较差异有统计学意义(P<0.05)。见表1、图3。
2.5雷帕霉素对SCC-15细胞IL-6和PGE2水平的影响 雷帕霉素5、10、20 ng/mL干预后IL-6和PGE2水平降低,与阴性组比较差异有统计学意义(P<0.05)。见表1。
3 讨 论
TLR4信号与肿瘤免疫逃逸如凋亡抵抗有关,TLR4通路通过诱导免疫抑制性因子和趋化因子促进肿瘤转移,比如结肠癌细胞[9-10]。因此,抑制TLR4信号及相关炎症因子的表达、阻断免疫逃逸可能会成为防治肿瘤的有效策略。
雷帕霉素是P13K/Akt通路活化的强有力的抑制剂,选择性抑制LPS诱导Akt和NF-κB活化是抑制免疫逃逸和逆转TLR4凋亡抵抗的主要通路[11-12]。雷帕霉素是一种具有很强免疫抑制作用的药物,对过敏性脑炎、淋巴组织增生病等自身免疫性疾病和移植排斥有一定作用[13]。近来雷帕霉素被引入治疗肺及结肠癌,主要通过下调mTOR介导的cyclins D1、E和A,抑制相应激酶活性阻滞G1~S期细胞周期从而使细胞发生凋亡[14]。雷帕霉素也具有抑制肿瘤的浸润和迁移[15]。
本研究结果显示,雷帕霉素5个剂量组可以降低细胞活性,与阴性组比较差异有统计学意义(P<0.05),提示雷帕霉素能够抑制SCC-15细胞活性。实验结果还显示,雷帕霉素还具有促进SCC-15细胞凋亡的作用。雷帕霉素对SCC-15细胞侵袭能力结果显示,阴性组SCC-15细胞穿膜细胞数为(112.20±24.36)个,雷帕霉素5、10、20 ng/mL干预后穿膜细胞数分别为(78.87±6.47)、(62.14±7.31)、(58.24±7.71)个,与阴性组比较差异有统计学意义(P<0.05)。提示雷帕霉素能够抑制SCC-15细胞运动力,抑制其侵袭能力。
进一步分析雷帕霉素对TLR4表达及下游炎症因子IL-6和PGE2水平影响,SCC-15细胞中TLR4蛋白表达增加,雷帕霉素5、10、20 ng/mL干预后TLR4蛋白表达减少(P<0.05)。干预后IL-6和PGE2水平降低(P<0.05),提示雷帕霉素在促进细胞凋亡的同时,也抑制了TLR4和下游因子IL-6和PGE2的表达。
综上所述,本研究显示雷帕霉素通过促进OSCC细胞凋亡,抑制细胞活性和侵袭能力,其机制可能与抑制TLR4和下游因子IL-6和PGE2表达,阻断了肿瘤免疫逃逸有关。其是否还可以通过其他机制干预OSCC尚需进一步研究。
[1]Mittelbronn M,Platten M,Zeiner P,et al.Macrophage migration inhibitory factor (MIF) expression in human malignant gliomas contributes toimmune escape and tumour progression[J].Acta Neuropathol,2011,122(3):353-365.
[2]Siddle HV,Kreiss A,Tovar C,et al.Reversible epigenetic down-regulation of MHC molecules by devil facial tumour disease illustratesimmune escape by a contagious cancer[J].Proc Natl Acad Sci U S A,2013,110(13):5103-5108.
[3]Zeljic K,Supic G,Jovic N,et al.Association of TLR2,TLR3,TLR4 and CD14 genes polymorphisms with oral cancer risk and survival[J].Oral Dis,2014,20(4):416-424.
[4]Kim R,Emi M,Tanabe K.Cancer cell immune escape and tumor progression by exploitation of anti-inflammatory and pro-inflammatory responses[J].Cancer Biol Ther,2005,4(9):924-933.
[5]Husvik C,Khuu C,Bryne M,et al.PGE2 production in oral cancer cell lines is COX-2-dependent[J].J Dent Res,2009,88(2):164-169.
[6]Van Zyl A,Bunn BK.Clinical features of oral cancer[J].SADJ,2012,67(10):566-569.
[7]Hoshikawa H,Goto R,Mori T,et al.Expression of prostaglandin E2 receptors in oral squamous cell carcinomas and growth inhibitory effects of an EP3 selective antagonist,ONO-AE3-240[J].Int J Oncol,2009,34(3):847-852.
[8]Xia W,Hou M.Macrophage migration inhibitory factor induces autophagy to resist hypoxia/serum deprivation-induced apoptosis via the AMP-activated protein kinase/mammalian target of rapamycin signaling pathway[J].Mol Med Rep,2016,13(3):2619-2626.
[9]Yu LX,Yan L,Yang W,et al.Platelets promote tumour metastasis via interaction between TLR4 and tumour cell-released high-mobility group box1 protein[J].Nat Commun,2014(5):5256-5264.
[10]Monteiro LS,Delgado ML,Ricardo S,et al.Phosphorylated mammalian target of rapamycin is associated with an adverse outcome in oral squamous cell carcinoma[J].Oral Surg Oral Med Oral Pathol Oral Radiol,2013,115(5):638-645.
[11]Sun Q,Zheng Y,Liu Q,et al.Rapamycin reverses TLR4 signaling-triggered tumor apoptosis resistance by disrupting Akt-mediated Bcl-xL upregulation[J].Int Immunopharmacol,2008,8(13/14):1854-1858.
[12]Mathews ES,Appel B.Cholesterol biosynthesis supports myelin gene expression and axon ensheathment through modulation of P13K/Akt/mTor signaling[J].J Neurosci,2016,36(29):7628-7239.
[13]Xu C,Zhang H,Liu C,et al.Rapamycin inhibits Erk1/2-mediated neuronal apoptosis caused by cadmium[J].Oncotarget,2015,28 (25):21452-21467.
[14]Wang YD,Su YJ,Li JY,et al.Rapamycin,an mTOR inhibitor,induced apoptosis via independent mitochondrial and death receptor pathway in retinoblastoma Y79 cell[J].Int J Clin Exp Med,2015,8(7):10723-10730.
[15]Fagone P,Donia M,Mangano K,et al.Comparative study of rapamycin and temsirolimus demonstrates superimposable anti-tumourpotency on prostate cancer cells[J].Basic Clin Pharmacol Toxicol,2013,112(1):63-69.
EffectsofrapamycinonpromotingoralsquamouscancercellapoptosisbyinhibitingTLR4,IL-6andPGE2expression*
ZhangQimei1,ZhouCong1,YangLi2,WuBaoqin1,TanHong1,NieMinhai1△
(1.DepartmentofPeriodontalMucosalMembrane;2.DepartmentofClinicalLaboratory,AffiliatedStomatologicalHospitalofSouthwestMedicalUniversity,Luzhou,Scihuan646000,China)
ObjectiveTo investigate whether the effects of rapamycin on promoting oral squamous cancer cell apoptosis is related with inhibiting TLR4 expression and inflammatory factor IL-6 and PGE2 expression.MethodsHuman oral squamous carcinoma SCC-15 cell line was cultured and interfered by rapamycin.Then the activity of SCC-15 cells was detected by CCK 8,the SCC-15 cells apoptosis was detected by the Hochest33342/PI double staining,the invasion ability was determined by the transwell method.The TLR4 protein expression level was detected by Western blot and IL-6 and PGE2 expressions were detected by ELISA.ResultsRapamycin could promote cell apoptosis,the invasion ability of SCC-15 cells was significantly decreased.After rapamycin intervention,the TLR4 protein expression was decreased and expression levels of IL-6 and PGE2 were reduced,showing statistical difference as compared with the negative group (P<0.05).ConclusionRapamycin promotes oral squamous cancer SCC-15 cell apoptosis,which may be related with inhibiting TLR4,IL-6 and PGE2 expression.
oral squamous cell;rapamycin;immune escape
四川省应用基础研究计划基金资助项目(2013JY0126);四川省科技厅-泸州市科技局-西南医科大学联合科研基金资助项目(LY-62)。
张齐梅(1977-),主治医师,硕士,主要从事口腔黏膜病的病因及防治研究。△
,E-mail:nieminhai@126.com。
R780.1
A
1671-8348(2017)28-3900-03
2017-04-18
2017-06-21)
10.3969/j.issn.1671-8348.2017.28.005
