1株虾夷扇贝苗种培育用益生菌的筛选及其对幼体存活和生长的影响
2017-11-08赵学伟李明梁峻刘继晨孙雪莹马悦欣
赵学伟,李明,梁峻,刘继晨,孙雪莹,马悦欣
(1.獐子岛集团股份有限公司,辽宁 大连 116001;2.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
1株虾夷扇贝苗种培育用益生菌的筛选及其对幼体存活和生长的影响
赵学伟1,李明1,梁峻1,刘继晨2,孙雪莹2,马悦欣2
(1.獐子岛集团股份有限公司,辽宁 大连 116001;2.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
为筛选出虾夷扇贝Patinopectenyessoensis苗种培育用潜在益生菌,采用培养方法从虾夷扇贝幼体及养殖水环境中共分离出300株细菌,经过产淀粉酶、纤维素酶和蛋白酶能力测定,及以灿烂弧菌为指示菌株的拮抗活性测定,从中筛选出既能产酶又拮抗灿烂弧菌Vibriosplendidus的W115菌株。溶血试验结果显示,W115菌株不产生溶血素, 不具有潜在的致病性;以终浓度为1×106cells/mL的W115菌株浸浴感染受精后48 h 的扇贝幼体49 d,结果显示,该菌株对扇贝幼体是安全的;16S rRNA基因序列同源性分析表明,W115菌株与埃氏假交替单胞菌Pseudoalteromonasespejiana相似性为100%;将该菌株以终浓度1×104cells/mL和1×106cells/mL添加在虾夷扇贝苗种培育水体中,以不加潜在益生菌为对照组,每组设3个平行,养殖扇贝幼体至出库(共49 d),在第11天(壳顶幼体期)、26天 (匍匐幼体期)、49天(稚贝期)时测定并计算幼体存活率和特定生长率(SGR),结果显示,1×104cells/mL组3个时期幼体的存活率和第26天匍匐幼体及第49天稚贝的SGRs均显著高于对照组(P<0.05),而1×106cells/mL组3个时期幼体的存活率和SGRs与对照组均无显著性差异(P>0.05)。研究表明,埃氏假交替单胞菌W115菌株可促进虾夷扇贝幼体的存活和生长。
虾夷扇贝; 苗种培育;益生菌;筛选;存活;生长
虾夷扇贝Patinopectenyessoensis为冷水性贝类,具有生长快、味道鲜美、经济价值高等特点,是中国北方主要的贝类养殖品种,其产量近年来增长迅猛[1]。然而,在虾夷扇贝育苗过程中通常因为致病菌的感染,导致苗种大量死亡,制约了虾夷扇贝养殖业的发展[2]。在双壳贝类苗种培育过程中,使用抗菌药物来防治细菌性疾病较为普遍[3],但容易导致细菌产生抗药性[4]。而益生菌作为抗生素替代品在扇贝幼体养殖中的应用已引起国内外学者的广泛关注[5-6]。研究表明,益生菌可提高紫扇贝Argopectenpurpuratus和海湾扇贝Argopectenirradians幼体的成活率[5,7]。目前,关于虾夷扇贝苗种培育过程中使用益生菌的报道较少[6]。本研究中,从虾夷扇贝幼体及苗种培育池中筛选出1株潜在益生菌,并研究其对扇贝幼体存活和生长的影响,旨在为益生菌在虾夷扇贝大规模菌种培育中的应用提供参考。
1 材料与方法
1.1材料
在虾夷扇贝苗种培育过程中,用无菌筛绢网收集受精卵、担轮幼虫、D型幼虫、壳顶幼虫和稚贝5个发育时期的幼体,同时取苗种培育水样。
将0.1 g用无菌海水漂洗过的幼体与适量无菌海水混合后匀浆。对匀浆液及苗种培育水样进行梯度稀释,在2216E平板上分离纯化,获得纯培养[8-9]。
1.2方法
1.2.1 试验菌株的产酶能力 采用点种法测定菌株的产淀粉酶、纤维素酶和蛋白酶能力。将试验菌株分别于培养基平板上点种淀粉培养基、产纤维素酶培养基和海水酪素琼脂,15 ℃下培养,4 d后加入卢氏碘液以后,若菌落周围出现无色透明圈则表示淀粉被分解,可确定为产淀粉酶阳性,反之则为阴性;加入刚果红溶液以后,若菌落周围出现无色透明的晕圈者为产纤维素酶阳性,无晕圈则为阴性;7 d后菌落周围出现透明圈者为产蛋白酶阳性,反之则为阴性。以水解圈直径(Dh)与菌落直径(Dc)之比(Dh/Dc)初步判定产酶能力[10]。
1.2.2 试验菌株的拮抗活力 将指示菌虾夷扇贝幼体大量死亡的致病菌灿烂弧菌VibriosplendidusV1菌株[2]接种于2216E液体培养基中过夜培养,取适当稀释菌液0.l mL涂布于2216E平板上,然后用接种环点种具有产酶能力的供试菌,15 ℃下培养24 h后,观察菌落周围是否产生抑菌圈,以抑菌圈直径(Di)与菌落直径(Dc)之比(Di/Dc)初步判定供试菌株的拮抗活力;在涂布V1菌株的2216E固体平板上放牛津杯,将有拮抗活力菌株接种于2216E液体培养基上培养(15 ℃),36 h后离心(5000 r/min,10 min),取上清液200 μL注入牛津杯,15 ℃下培养48 h后观察抑菌现象。
1.2.3 溶血试验 将待测菌株和阳性对照(V1菌株)点种于5%羊血琼脂平板,15 ℃下培养48 h,根据菌落周围透明圈的形成来判断溶血素的产生。
1.2.4 潜在益生菌的毒性试验 将筛选的潜在益生菌(W115菌株)接种到2216E液体种子培养基中,震荡培养过夜(20 ℃,150 r/min),将种子接种到2216E液体培养基中培养16 h(20 ℃,150 r/min),离心后(5000 r/min,10 min),细胞用生理盐水重悬,用血球计数板计数。
将受精后48 h的健康扇贝幼体置于6个盛有50 L沙滤海水的塑料桶中,初始密度为(9.33±1.53) 个/mL,其中,试验组3桶,水中添加W115菌株,使菌浓度达到1×106cells/mL,另外3桶为对照组,水中不添加潜在益生菌。静水充气饲养,试验期间水温为14~16 ℃,pH为7.8~8.2,盐度为31.5~32.5,每天早上换水25 L并吸底,然后投饵(叉鞭金藻Dicrateriainornata、新月菱形藻Nitzschiaclosterium和青岛大扁藻Platymonashelgolandica)并加菌, 持续49 d,对幼体进行密度测定并计算死亡率(%),计算公式为
死亡率=(A0-At)/A0×100%。
其中:At为试验第t天时的幼体密度(ind./mL);A0为幼体初始密度(ind./mL)。
1.2.5 潜在益生菌的初步鉴定 将筛选得到的潜在益生菌菌株接种到2216E液体培养基中过夜培养,提取细菌基因组DNA,16S rRNA基因PCR扩增及PCR产物的测序方法同文献[10]。将获得的DNA序列在EzBioCloud(http://www.ezbiocloud. net/eztaxon)提供的公共数据库中进行序列同源性比对,从结果中取相似性最高的序列,初步确定种属。
1.2.6 潜在益生菌对幼体存活和生长的影响 虾夷扇贝苗种培育过程在獐子岛集团育苗基地进行。幼体受精后48 h进行优选,优选后将幼体随机分配到盛有50 L沙滤海水的塑料桶中。设不添加潜在益生菌的对照组和添加W115菌株的两个浓度组(1×104cells/mL和1×106cells/mL),每组设3个平行。幼体初始密度为(9.33±1.53) 个/mL,初始壳长为(107.33±4.30) μm,静水充气饲养,试验条件及日常管理同毒性试验,按不同生长时期,分别投喂叉鞭金藻、新月菱形藻和青岛大扁藻,每周根据幼体发育情况调整饵料投喂量,在添加潜在益生菌第11天壳顶幼体期、第26天匍匐幼体期(下网帘时)和第49天稚贝期(出库时)对幼体进行密度测定并计算存活率(%), 同时从每个平行取30个幼体在显微镜下测量壳长,并计算幼体的特定生长率(SGR,%/d),计算公式分别为
存活率=At/A0×100%,
SGR=(lnLt-lnL0)/t×100%。
其中:At为试验第t天时幼体的幼体密度(ind./mL);A0为幼体初始密度(ind./mL);Lt为试验第t天时幼体的壳长(μm);L0为幼体初始壳长(μm);t为试验时间(d)。
1.3数据处理
试验数据以平均值±标准差表示,用SPSS 16.0软件对幼体死亡率(对照组和试验组)数据进行独立样本T检验;对幼体存活率和特定生长率(对照组和两个W115菌浓度组)数据进行单因素方差分析和Tukey多重比较;显著性水平设为0.05。
2 结果与分析
2.1试验菌株的产酶能力
从扇贝幼体及苗种培育水中分离出300株细菌,其中167株能产淀粉酶,46株能产纤维素酶,80株能产蛋白酶,28株产3种酶(表1)。
2.2试验菌株的拮抗活力
将28株产3种酶的菌株进行拮抗试验,结果显示,W115和S76菌株对病原菌有拮抗作用,其Di/Dc值分别为4.98和1.90。两菌株36 h发酵液的抑菌效果见图1,W115菌株的抑菌活性较高。

表1 产3种酶的菌株Tab.1 Strains producing three enzymes
注:Dh为水解圈直径;Dc为菌落直径
Note:Dhdenotes diameter of hydrolysis zone;Dcdenotes colony diameter
2.3试验菌株的溶血活性
依据拮抗活性结果,选W115和S76菌株进行溶血试验,结果S76菌株为β-溶血,只有W115菌株不产生溶血素(图2)。
2.4潜在益生菌的毒性
根据产酶、拮抗和溶血试验结果,选取潜在益生菌W115菌株进行浸浴试验,结果显示,试验组和对照组幼体死亡率无显著性差异(P>0.05)(表2),表明该菌株在1×106cells/mL浓度下对扇贝幼体安全。

表2 W115菌株对虾夷扇贝幼体的致病性Tab.2 Pathogenicity of the strain W115 to Yesso scallop larvae
2.5潜在益生菌的初步鉴定
经过产酶、拮抗、溶血和安全性试验,筛选得到1株潜在益生菌W115,16S rRNA基因序列同源性表明,W115菌株与埃氏假交替单胞菌Pseudoalteromonasespejiana的序列相似性为100%。
2.6潜在益生菌对虾夷扇贝幼体存活和生长的影响
由表3可见:当水体中W115菌株浓度为1×104cells/mL时,11、26、49 d时虾夷扇贝幼体的存活率均显著高于对照组(P<0.05),而1×106cells/mL组3个时间的存活率与对照组均无显著性差异(P>0.05)。
由表4可见:当水体中W115菌株浓度为1×104cells/mL时,26 d时虾夷扇贝匍匐幼体和49 d时稚贝的特定生长率均显著高于对照组(P<0.05),但11 d时壳顶幼体和1×106cells/mL浓度组3个时期的幼体与对照组均无显著性差异(P>0.05)。

表3 不同浓度的W115菌株对虾夷扇贝幼体存活率的影响Tab.3 Effects of different concentrations of strain W115 on the survival rate of Yesso scallop larvae %
注:同列中标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05), 下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia

图1 W115和S76菌株对V1菌株的抑制效果Fig.1 Inhibition of strains W115 and S76 to indicator strain V1
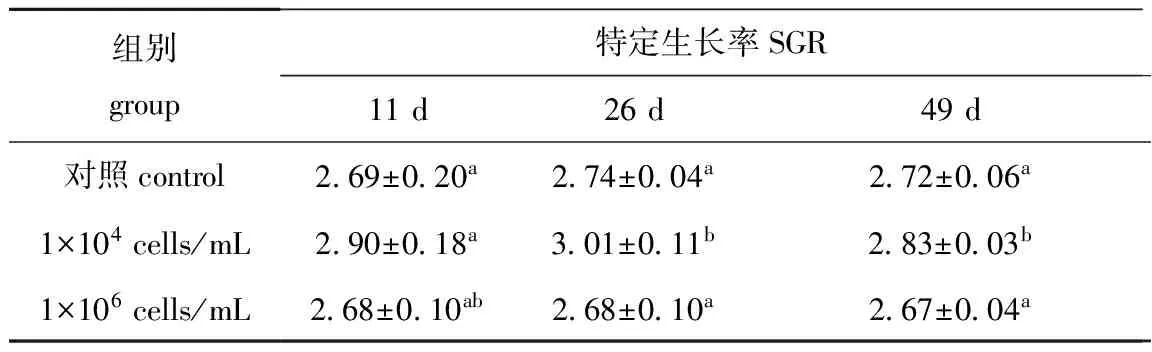
表4 不同浓度的W115菌株对虾夷扇贝幼体特定生长率的影响Tab.4 Effects of different concentrations of strain W115 on the specific growth rate of Yesso scallop larvae %/d
3 讨论
3.1虾夷扇贝苗种培育用潜在益生菌的筛选
本研究中,依据产酶能力、拮抗活性、溶血活性和毒性试验结果,筛选出1株产淀粉酶、蛋白酶、纤维素酶,对致病菌灿烂弧菌有拮抗活性、不产生溶血素和对虾夷扇贝幼体无致病性的潜在益生菌埃氏假交替单胞菌W115菌株。
具有产酶能力的菌株能促进养殖动物对饵料的消化,对养殖动物来说是有益菌群[11-12]。从南非鲍Haliotismidae消化道筛选出具有降解蛋白质和淀粉的潜在益生菌,可明显提高鲍肠区的蛋白酶活力,从而使其对蛋白的消化和吸收显著增加[13]。通过产淀粉酶、蛋白酶和纤维素酶的能力从刺参Apostichopusjaponicus肠道中筛选出3株潜在益生菌,在幼参养殖过程中投喂含3株菌的饵料,可促进其消化和/或增强免疫功能[14-17]。产蛋白酶、纤维素酶和淀粉酶等消化酶能力的菌株广泛存在于贝类的养殖环境及贝类生物体内,如从近江牡蛎Crassostreahongkongensis肠道[18-19]和养殖水体[20],以及九孔鲍Haliotisdiversicolor肠道中均可分离出高比例的产酶菌株[21]。与前人研究结果类似,本试验中从幼体及养殖水环境中分离出产酶菌株的比例高达97.7%,其作用可能是分解淀粉、纤维素和蛋白质为可直接被宿主吸收利用的小分子物质。
除了产酶能力外,拮抗病原菌活性常被作为体外筛选潜在益生菌的有效途径之一,细菌通过产生抗菌物质抑制病原菌生长[22]。从杂色鲍及皱纹盘鲍Haliotisdiscushannai肠道和美洲牡蛎Crassostreavirginica及海湾扇贝消化腺筛选出有效拮抗鲍、牡蛎和扇贝病原体的菌株[23-25]。溶血试验主要用于排除具有潜在致病性菌株[23-24,26]。为确保筛选益生菌的安全性,一般采用体外浸浴或体内注射等方法[24-25]检验其对宿主的致病性。本试验中采用与前人研究类似的方法,筛选出对虾夷扇贝幼体无致病性的潜在益生菌W115菌株。
3.2潜在益生菌对虾夷扇贝幼体存活和生长的影响
已有研究表明,通过体外拮抗菌筛选方法已鉴定出在双壳类幼体养殖上效果较好的益生菌[5,7,25,27],如弧菌Vibriosp. 11可保护紫扇贝幼体免受病原菌鳗弧菌Vibrioanguillarum的感染[27];将混合菌(弧菌Vibriosp. C33+假单胞菌Pseudomonassp. 11+芽孢杆菌Bacillussp. B2)加入到水体中能够提高紫扇贝幼体存活率,使其在不使用抗生素的情况下顺利度过浮游幼体阶段[5];OY15菌株可显著提高经病原菌弧菌B183菌株攻毒后牡蛎幼体存活率[25];将有益细菌A18菌株加入到苗种培育水体,可提高海湾扇贝幼苗各个发育期的成活率,且以1×104cells/mL组扇贝幼苗成活率最高[7]。将交替单胞菌Alteromonassp. CA2菌株添加于幼体养殖水体中,能提高太平洋牡蛎Crassostreagigas幼体的存活率和生长速度[28]。本研究中,将W115菌株以1×104cells/mL加入到苗种培育水中,能有效提高虾夷扇贝幼体的存活和生长,这与王祥红等[7]、Douillet等[28]的研究结果基本一致。其原因是与该菌株可为扇贝幼体提供营养有关,还是该菌株与其他细菌的拮抗与竞争来抑制杂菌生长有关,有待于进一步研究。
[1] 李文姬,谭克非.日本解决虾夷扇贝大规模死亡的启示[J].水产科学,2009,28(10):609-612.
[2] Liu Jichen,Sun Xueying,Li Ming,et al.Vibrioinfections associated with Yesso scallop (Patinopectenyessoensis) larval culture[J].Journal of Shellfish Research,2015,34(2):213-216.
[3] Miranda C D,Rojas R,Abarca A,et al.Effect of florfenicol and oxytetracycline treatments on the intensive larval culture of the Chilean scallopArgopectenpurpuratus(Lamarck,1819)[J].Aquaculture Research,2013,45(1):16-30.
[4] Dubert J,Osorio C R,Prado S,et al.Persistence of antibiotic resistantVibriospp. in shellfish hatchery environment[J].Microbial Ecology,2015,72(4):851-860.
[5] Riquelme C E,Jorquera M A,Rojas A I,et al.Addition of inhibitor-producing bacteria to mass cultures ofArgopectenpurpuratuslarvae (Lamarck,1819)[J].Aquaculture,2001,192(2-4):111-119.
[6] 刘彤,周志刚,周军,等.微生态制剂在虾夷扇贝育苗中的应用试验[J].齐鲁渔业,2012,29(11):18-19.
[7] 王祥红,杜宗军,陈刚,等.有益细菌A18在海湾扇贝(Argopectenirradians)育苗中的应用[J].高技术通讯,2002,12(8):84-88.
[8] 李明,刘继晨,孙雪莹,等.育苗阶段虾夷扇贝幼体中可培养细菌的多样性[J].大连海洋大学学报,2016,31(4):374-379.
[9] 孙雪莹,刘继晨,李明,等.虾夷扇贝苗种培育水中可培养细菌群落分析[J].大连海洋大学学报,2017,32(3):316-322.
[10] 杨志平,孙飞雪,刘志明,等.刺参肠道潜在产酶益生菌的筛选和鉴定[J].大连海洋大学学报,2013,28(1):17-20.
[11] Vine N G,Leukes W D,Kaiser H.Probiotics in marine larviculture[J].FEMS Microbiology Review,2006,30(3):404-427.
[12] Balcázar J L,de Blas I,Ruiz-Zarzuela I,et al.The role of probiotics in aquaculture[J].Veterinary Microbiology,2006,114(3-4):173-186.
[13] Macey B M,Coyne V E.Improved growth rate and disease resistance in farmedHaliotismidaethrough probiotic treatment[J].Aquaculture,2005,245(1-4):249-261.
[14] 刘姣,韩华,孙飞雪,等.饵料中添加芽孢杆菌BC26对刺参幼参消化酶、免疫反应和抗病力的影响[J].大连海洋大学学报,2013,28(6):568-572.
[15] Ma Yuexin,Sun Feixue,Zhang Congyao,et al.Effects ofPseudoalteromonassp. BC228 on digestive enzyme activity and immune response of juvenile sea cucumber (Apostichopusjaponicus)[J].Journal of Ocean University of China,2014,13(6):1061-1066.
[16] 杨志平,徐哲,张萃粹,等.饵料中添加弧菌BC232对幼参免疫反应及抗病力的影响[J].水产科学,2014,33(11):708-712.
[17] 李璐瑶,孙丕海,包鹏云,等.饲料中添加混合益生菌对刺参幼参免疫反应和抗氧化性能的影响[J].大连海洋大学学报,2016,31(3):261-266.
[18] 祝玲,杨吉霞,蔡俊鹏,等.近江牡蛎肠道细菌及其产酶能力[J].湛江海洋大学学报,2005,25(1):10-13.
[19] 王瑞旋,冯玉婷,冯娟,等.近江牡蛎Crassostreahongkongensis体内细菌的周年变化及细菌产酶能力[J].海洋环境科学,2012,31(6):851-854,866.
[20] 杨吉霞,蔡俊鹏,余德民.近江牡蛎养殖水体中细菌产酶能力的研究[J].河北渔业,2004(5):6-9.
[21] 王志,蔡俊鹏,徐丽.九孔鲍肠道中产酶菌株的筛选及其与深圳湾菌株的比较[J].粮食与饲料工业,2005(5):34-36.
[22] Sugita H,Hirose Y,Matsuo N,et al.Production of the antibacterial substance byBacillussp.strain NM 12,an intestinal bacterium of Japanese coastal fish[J].Aquaculture,1998,165(3-4):269-280.
[23] 蒋庆茹,柯才焕,虞晋晋,等.杂色鲍肠道益生菌的分离和鉴定[J].厦门大学学报:自然科学版,2012,51(4):782-788.
[24] 姜海峰,刘小林,常亚青,等.皱纹盘鲍(Haliotisdiscushannai)肠道潜在益生菌的筛选及对幼鲍生长的影响[J].海洋与湖沼,2013,44(2):482-487.
[25] Lim H J,Kapareiko D,Schott E J,et al.Isolation and evaluation of new probiotic bacteria for use in shellfish hatcheries:I.isolation and screening for bioactivity[J].Journal of Shellfish Research,2011,30(3):609-615.
[26] Schulze A D,Alabi A O,Tattersall-Sheldrake A R,et al.Bacterial diversity in a marine hatchery:balance between pathogenic and potentially probiotic bacterial strains[J].Aquaculture,2006,256(1-4):50-73.
[27] Riquelme C,Araya R,Vergara N,et al.Potential probiotic strains in the culture of the Chilean scallopArgopectenpurpuratus(Lamarck,1819)[J].Aquaculture,1997,154(1):17-26.
[28] Douillet P,Langdon C J.Effects of marine bacteria on the culture of axenic oysterCrassostreagigas(Thunberg) larvae[J].The Biological Bulletin,1993,184(1):36-51.
SelectionofoneprobioticstrainforlarvicultureanditseffectsonlarvalsurvivalandgrowthofYessoscallopPatinopectenyessoensis
ZHAO Xue-wei1, LI Ming1, LIANG Jun1,LIU Ji-chen2, SUN Xue-ying2, MA Yue-xin2
(1.Zhangzidao Group Company Limited, Dalian 116001, China; 2.Key Laboratory of Mariculture and Stock Enhancement in North China’s Sea, Ministry of Agriculture, Dalian Ocean University, Dalian 116023, China)
In order to select the potential prbiotics for larviculture of Yesso scallopPatinopectenyessoensis,three hundred bacterial strains were isolated from the Yesso scallop larvae and water of larval rearing tanks by Zobell 2216E. Two strains were screened based on isolates producing a variety of enzymes (amylase, cellulase and protease) and having antagonistic activity against pathogenVibrosplendidus. Hemolysis was tested in two strains and the results showed that strain W115 did not secrete hemolysin, without potential pathogenicity. Forty-eight hours larvae post-fertilization were challenged by strain W115 at 1×106cells/mL for 49 d, confirming that strain W115 was safe for scallop larvae. Similarity analysis of 16S rRNA gene sequences indicated that the strain W115 had 100% similarity toPseudoalteromonasespejiana. Strain W115 was added to seawater in six tanks for larviculture of the Yesso scallop at final concentrations of 1×104cells/mL and 1×106cells/mL, respectively. No potential probiont was added to three control tanks. The larvae were cultured to juvenile before outdoor breeding (49 d in total) and effects of strain W115 on the larval survival rate and the specific growth rate (SGR) were determined on 11th(umbo larvae stage), 26th(creeping larvae stage) and 49th days (juvenile stage). The survival rates and SGRs of the larvae were significantly enhanced on 11th, 26th and 49th days and on 26th and 49th days, respectively, in comparison with the controls when strain W115 was added to seawater at the concentration of 1×104cells/mL (P<0.05), however,there were no significant differences in survival rate and SGR between the 1×106cells/mL concentration treatment and the control group(P>0.05). It is concluded thatPseudoalteromonasespejianaW115 improves the survival and growth of Yesso scallop larvae.
Patinopectenyessoensisi; larviculture; probiotics; selection; survival; growth
10.16535/j.cnki.dlhyxb.2017.05.003
2095-1388(2017)05-0514-06
Q954.4
A
2017-03-06
国家“十二五”科技支撑计划项目(2013BAD23B01);獐子岛集团科研项目(99801214)
赵学伟(1975—), 男,高级工程师。E-mail:zhaoxuewei@sina.com
马悦欣(1963—), 女, 博士, 教授。E-mail:mayuexin@dlou.edu.cn
