跑台运动对高脂饮食喂养的肥胖小鼠比目鱼肌脂质沉积和血管内皮生长因子B表达的影响
2017-11-08张靓马谨高海宁李灵杰
张靓 马谨 高海宁 李灵杰
1 北京师范大学体育与运动学院(北京 100875)
2 沈阳体育学院运动人体科学学院
跑台运动对高脂饮食喂养的肥胖小鼠比目鱼肌脂质沉积和血管内皮生长因子B表达的影响
张靓1马谨1高海宁2李灵杰1
1 北京师范大学体育与运动学院(北京 100875)
2 沈阳体育学院运动人体科学学院
目的:观察跑台运动对高脂饮食诱导的肥胖小鼠骨骼肌脂质沉积和血管内皮生长因子B(VEGFB)及其受体表达的影响。方法:32只5周龄健康雄性C57BL/6小鼠,随机分成对照组(n=8)和高脂喂养组(n=24),分别进行普通饲料和高脂饲料喂养,8周后筛选肥胖小鼠16只,随机分为高脂安静组和高脂运动组,每组各8只。高脂运动组跑台训练方案为:跑速25 m/min,每次60min,每周5次,持续8周,对照组和高脂安静组不进行运动。小鼠处死前测定体重,小鼠比目鱼肌油红O染色观察脂质沉积,免疫组化法观察比目鱼肌血管内皮生长因子受体-1(VEGFR1)和辅受体Neuropilin-1(NRP1)的表达水平,Realtime PCR方法测定比目鱼肌VEGFB和受体VEGFR1、NRP1的mRNA表达,以及VEGFB上游调节因子PGC-1α mRNA表达。结果:与对照组相比,高脂饮食喂养小鼠体重显著增加(P<0.01),比目鱼肌中脂质沉积增加,VEGFB、VEGFR1、NRP1和PGC-1α mRNA表达无显著变化。与高脂安静组小鼠相比,高脂运动组小鼠体重显著降低(P<0.01),比目鱼肌中脂质沉积显著减少,VEGFR1 mRNA表达显著上升(P<0.05),但VEGFB、NRP1和PGC-1α mRNA表达无显著变化。结论:跑台运动对肥胖小鼠比目鱼肌VEGFB的表达无显著作用,但显著上调其受体VEGFR1的表达,提示运动减轻骨骼肌脂质沉积的作用可能与运动增强比目鱼肌VEGFB/VEGFR1作用相关。
跑台运动;骨骼肌脂质沉积;VEGFB;肥胖;比目鱼肌
肥胖时过多的脂肪不仅在皮下和内脏脂肪组织积聚,还在多个非脂肪组织沉积,如肝脏、心肌、骨骼肌和胰腺的β细胞等,这种沉积在非脂肪组织中的脂肪被称为异位脂肪(ectopic fat)[1]。脂肪的异位沉积导致胰岛素作用的靶组织如肝脏、骨骼肌的胰岛素敏感性降低,是胰岛素抵抗及2型糖尿病的重要发病机制[2]。骨骼肌脂质异位沉积是肥胖时骨骼肌代谢改变的显著特征[3]。骨骼肌细胞内脂质(IMCL)是指储存于骨骼肌细胞脂滴中的甘油三酯,在正常情况下,其作为运动时骨骼肌利用的主要能源物质。但肥胖时,骨骼肌对脂质的摄入增加而氧化利用减少,进而导致脂质在骨骼肌内大量沉积,代谢性中间产物神经酰胺和二酰甘油堆积,活性氧大量生成,诱导骨骼肌胰岛素抵抗的发生[4]。减少骨骼肌脂质异位沉积是改善机体胰岛素抵抗的重要途径。
血管内皮生长因子B(vascular endothelial growth factor-B,VEGFB)是1996年发现的血管内皮生长因子家族新成员[5]。从其发现至今,VEGFB在促进血管生成中的作用就一直似是而非,对其生物学功能的认识一直不清晰。与家族其它成员不同,VEGFB在体内主要分布于代谢旺盛的组织和细胞,如心肌、褐色脂肪组织、脑等部位[5,6],尤其在氧化代谢为主的慢肌,VEGFB大量表达、合成和分泌,是肌肉因子的新成员[7]。2010年,瑞典Eriksson实验室接连在Nature上发表文章[8,9],发现VEGFB与一大群核编码的线粒体蛋白存在高度类似的共调节,推测VEGFB可能在能量代谢调节中扮演独特的角色;进一步研究显示骨骼肌VEGFB与其特异性受体血管内皮生长因子受体(vascular endothelial growth factor receptor-1,VEGFR1)和辅受体Neuropilin-1( NRP1)结合后,上调内皮脂肪酸转运蛋白(fatty acid transporter protein,FATP)3或FATP4的表达,促进脂肪酸的转运,参与脂肪在心肌、骨骼肌等部位的异位沉积过程。运动能有效抑制骨骼肌的脂质沉积,运动是否通过VEGFB影响骨骼肌脂代谢?运动对VEGFB的影响如何?目前尚未见文献报道。本实验以高脂饮食喂养的小鼠为肥胖模型,观察8周有氧跑台运动对小鼠比目鱼肌脂质沉积和VEGFB及其受体VEGFR1、NRP1的表达的影响,探讨VEGFB在运动改善骨骼肌脂代谢中的作用。
1 材料与方法
1.1 实验动物与材料
实验动物选用清洁级雄性断乳C57BL小鼠,购于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2014-0001。动物分笼饲养,室内温度为22±5oC,湿度为50% ±10%,明暗交替周期为12 h,自由进食和饮水。所有动物饲料均由沈阳健民动物实验饲料厂提供,按重量计算,普通饲料含有6%的菜籽油和30.5%的小麦淀粉,高脂饲料含有21%的无水黄油和15.5%的小麦淀粉。两种饲料所含的其他营养成分一致,低脂正常饲料和高脂饲料的可吸收能量分别为16.1和19.4 MJ/kg。VEGFR1、NRP1抗体购自Abcam公司(Cambridge,UK),实验中所用其他试剂均为市售分析纯试剂。
1.2 动物分组与运动模型建立
5周龄健康雄性C57BL/6小鼠32只,体重20.34±0.49 g,随机分成对照组(Con组,n=8)和高脂喂养组(n=24),分别进行普通饲料和高脂饲料喂养,8周后,以体重≥对照组平均体重的20%为标准筛选肥胖小鼠16只。高脂喂养肥胖小鼠随机分为高脂安静组(HFD组,n=8)和高脂运动组(HE组,n=8),继续高脂饮食喂养。高脂运动组采用跑台运动,前两周进行适应性训练,从10 m/min,20min/d逐渐递增至第2周末的23~25 m/min(相当于85%VO2max),60min/d,以后的负荷同第2周末负荷,正式训练干预6周[10]。每次训练在下午3点至6点进行,不使用声、光、电等刺激手段。
1.3 取材
小鼠末次运动结束24 h后,禁食过夜,自由饮水。动物处死前,称重;处死后,分离比目鱼肌,部分置于10%的多聚甲醛溶液用于免疫组化染色、部分置于液氮后转入-80oC冰箱保存,用于RNA提取。
1.4 免疫组化染色
比目鱼肌置于10%的多聚甲醛溶液中浸泡过夜,转至20%蔗糖溶液中浸泡过夜,进行石蜡包埋,用于石蜡切片,切片厚度为5µm。石蜡切片脱蜡后用于VEGFR1和NRP1染色。染色流程如下:磷酸盐缓冲液(PBS)洗3次后,过氧化氢孵育5~10分钟,消除内源性过氧化物酶的活性。蒸馏水冲洗后,PBS浸泡5分钟。经10%山羊血清封闭后冲洗,分别滴加1∶200 VEGFR1或1∶100 NRP1一抗、1∶500生物素标记二抗、适量辣根酶或碱性磷酸酶标记的链霉卵白素工作液37oC孵育10~30分钟后,PBS冲洗,显色剂显色。自来水冲洗,复染,脱水,透明,封片,观察结果。随机抽取各组动物比目鱼肌切片(n=3),在200倍视野下随机观察5个视野,确定VEGFR1和NRP1的表达改变。
1.5 油红 O染色
比目鱼肌置于10%的多聚甲醛溶液中浸泡过夜,转至20%蔗糖溶液中浸泡过夜,OCT包埋,用于冰冻切片,切片厚度为5µm。组织切片经固定,蒸馏水洗1min后,油红O(0.5 g油红O粉末溶解于100 ml异丙醇中,加热溶解,过滤,使用时与蒸馏水3∶2混合使用。)染色5~20min,60%异丙醇溶液漂洗,蒸馏水清洗,苏木精染核,水洗,甘油封片,观察结果。随机抽取各组动物比目鱼肌切片(n=3),在200倍视野下随机观察5个视野,确定油红O的面积。
1.6 Real-time PCR测定比目鱼肌VEGFB、VEGFR 1和NRP 1的mRNA水平
采用Trizol一步法提取骨骼肌总RNA,天根逆转录系统(TianGen Biotech,Beijing)进行逆转录。realtime PCR反应体积共20µL:Super Real Pre Mix Plus(SYBR Green)体 系(TransGene Biotech,Beijing)15 ml,10 mmol/L的上下游引物各0.5 ml,cDNA 模板5 ml。GAPDH的上游引物:5’-ACA GCA ACA GGG TGG TGG AC-3’;下游引物为:5’-TTT GAG GGT GCA GCG AAC TT-3’;VEGFB 的上游引物:5’-GGA GGT GGT GGT ACC TCT GA-3’;下游引物为:5’-GCA TTC ACA TTG GCT GTG TT-3’;VEGFR1的上游引物:5’-GGA GGA GTA CAA CAC CAC GG-3’;下游引物为:5’-TTG AGG AGC TTT CAC CGA AC-3’;NRP1的上游引物:5’-GGA GCT CTA GGG CTG TGA AG-3’;下游引物为:5’-CCT CCT GTG AGC TGG AAG TC-3’。PGC-1α的上游引物:5’-GGA GCC GTG ACC ACT GAC A-3’;下游引物为:5’-TGG TTT GCT GCA TGG TTC TG-3’。所有引物均由生工生物工程(上海)股份有限公司合成。经95oC 7分钟变性后,进行95oC 30 s,60oC 30 s,72oC 40 s,热循环40次。Real-time PCR于ABI 7500荧光定量PCR仪(Applied Biosystems,USA)上进行,以GAPDH作为内参。
1.7 统计方法
实验结果以均数±标准差(±s)表示。数据采用Prism 5.0软件进行单因素方差分析处理,P<0.05为有显著性差异。
2 结果
2.1 跑台运动对高脂喂养的肥胖小鼠体重的影响
由图1可见,HFD组体重显著大于Con组(P<0.01),高脂饮食诱导小鼠出现显著的肥胖;HE组体重显著低于HFD组(P<0.01),8周的跑台运动显著逆转了高脂饮食诱导的体重增加,提示运动减轻了小鼠肥胖。
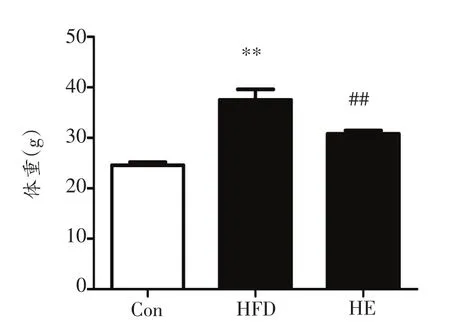
图1 各组小鼠体重比较
2.2 跑台运动对高脂喂养的肥胖小鼠比目鱼肌脂质沉积的影响
油红O染色结果如图2所示:对照组比目鱼肌中无红色脂滴,高脂安静组比目鱼肌中可见有红色油滴呈片状分布,油滴大小不一,提示高脂饮食喂养的小鼠比目鱼肌中有明显的脂质沉积现象。高脂运动组比目鱼肌中红色脂滴消失,提示8周的跑台运动显著逆转了高脂饮食诱导的骨骼肌脂质沉积。
2.3 跑台运动对高脂喂养的肥胖小鼠比目鱼肌VEGFB及其受体VEGFR 1、NRP 1mRNA表达的影响
与对照组相比,高脂安静组小鼠比目鱼肌VEGFB、NRP1 mRNA表达均无显著变化(P>0.05)。与高脂安静组相比,高脂运动组小鼠比目鱼肌VEGFR1 mRNA的表达显著上调(P<0.05),但VEGFB、NRP1 mRNA表达无显著变化(P>0.05)(图3)。
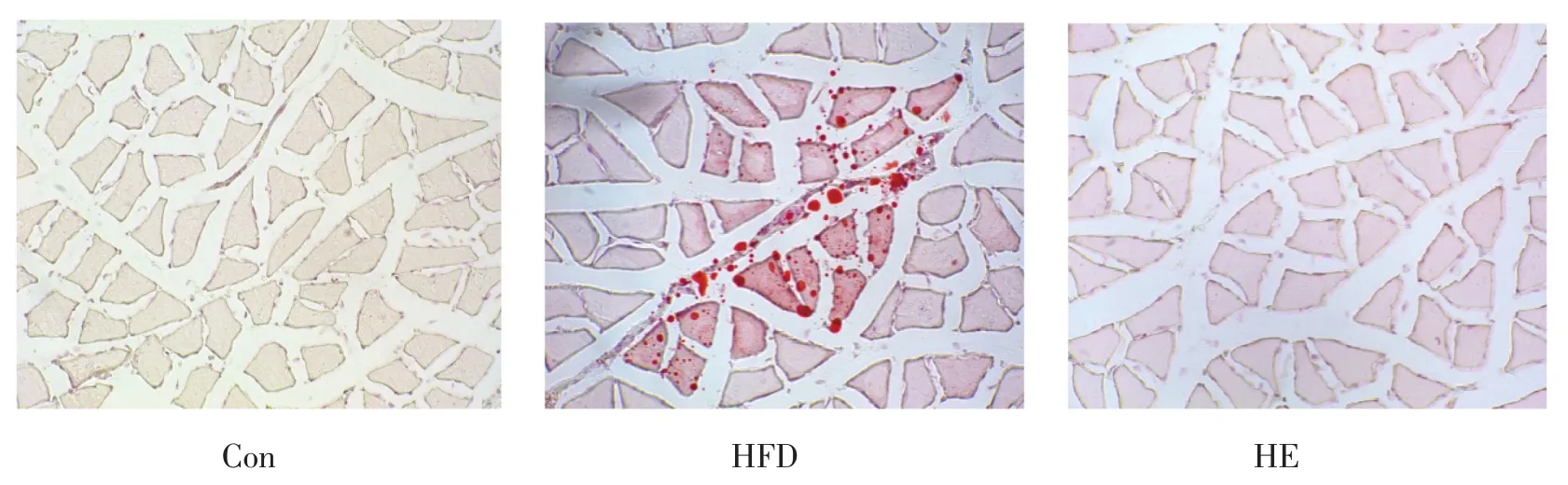
图2 各组小鼠比目鱼肌油红O染色结果(200×)
2.4 跑台运动对高脂喂养的肥胖小鼠比目鱼肌VEGFR 1、NRP 1蛋白表达的影响
比目鱼肌中VEGFR1、NRP1蛋白水平和VEGFR1、NRP1的mRNA结果一致。图4显示,与对照组相比,高脂安静组小鼠比目鱼肌VEGFR1、NRP1蛋白表达水平无显著变化,跑台训练则显著增加了肥胖小鼠比目鱼肌VEGFR1的蛋白表达,而对NRP1的表达水平没有影响。结果提示,运动显著增加骨骼肌VEGFR1的蛋白水平。

图4 比目鱼肌免疫组化结果
2.5 跑台运动对高脂喂养的肥胖小鼠比目鱼肌PGC-1 α的影响
与对照组相比,高脂安静组小鼠比目鱼肌过氧化物酶体增殖物激活受体γ辅激活因子 1α(peroxisome proliferator-activated receptor-γcoactivator-1α,PGC-1α)mRNA表达无显著变化(P>0.05),与高脂安静组相比,高脂运动组小鼠比目鱼肌PGC-1α mRNA表达无显著变化(P>0.05)(图5)。
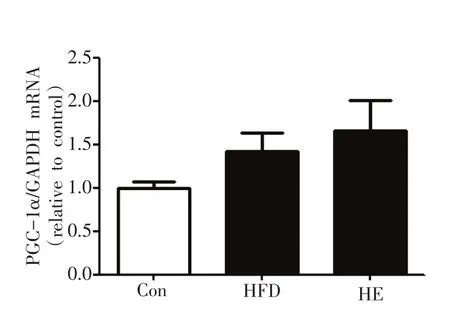
图5 各组小鼠比目鱼肌PGC-1α mRNA表达比较(n为4~6)
3 讨论
3.1 运动对骨骼肌脂质沉积的作用
骨骼肌是脂质摄取和利用的主要器官,大量研究表明,骨骼肌中的甘油三酯含量与胰岛素敏感性密切相关。肌细胞内甘油三酯积聚会降低胰岛素敏感性,进而导致胰岛素抵抗的发生[11,12]。大量人体和动物实验证实,运动能显著减少骨骼肌脂质沉积。Burcher等[13]利用磁共振波谱分析技术,发现10名健康男性在进行了一次2小时、强度为50%~60%最大摄氧量的运动后,骨骼肌脂质含量显著降低。Dotzert等研究发现[14],在糖尿病大鼠,10周、强度为75%最大摄氧量的跑台运动,股四头肌红肌油红O染色阳性率显著减少,提示脂质沉积减少。在本实验中,我们发现高脂安静组较对照组,油红O染色结果显示骨骼肌脂质沉积明显增加。而高脂运动组骨骼肌的脂质沉积明显改善,提示运动纠正了高脂饮食引起的骨骼肌脂质沉积,与以往研究结果相同。
3.2 VEGFB在脂代谢中的作用
VEGF家族成员有着丰富的生物学功能,主要表现在促进微静脉、小静脉通透性增加,血管内皮细胞增殖、迁移及诱导血管生成等作用。与家族的其它成员相比,VEGFB的生物学作用一直不太明确。2010年,Eriksson团队发现VEGFB在调节脂质异位沉积中起着关键作用[8,9]。
研究发现 VEGFB敲除小鼠的体重随年龄增长而增加,在16~18周时体脂含量与野生小鼠相比已增加近50%,附睾、腹膜后、腹股沟及皮下脂肪垫的重量均显著升高60%~90%[8],而心脏、肌肉及褐色脂肪等组织中异位脂肪的沉积显著减少。利用同位素示踪技术发现,对野生型小鼠和VEGFB敲除小鼠分别进行14C标记的油酸灌胃2小时后,VEGFB敲除小鼠心脏、肌肉和褐色脂肪组织中油酸的含量显著低于野生型小鼠,24小时后,油酸主要分布于白色脂肪组织中,提示VEGFB能够调节脂质在体内的分布[7,8]。进一步的实验发现,VEGFB敲除特异性地下调某些组织的血管内皮细胞脂肪酸转运蛋白FATP3或 FATP4的表达,进而抑制长链脂肪酸的摄取,因而减少组织中脂滴含量;在培养的内皮细胞,VEGFB处理显著上调 FATP3和FATP4的表达,同时长链脂肪酸的摄入显著增加[7,8]。VEGFR1和NRP1共同介导了VEGFB在内皮细胞的作用。不管是VEGFR1抗体还是NRP1抗体均显著抑制了VEGFB诱导的内皮细胞FATP3的表达,此外,内皮特异敲除NRP1的小鼠出现了与VEGFB敲除同样的表型改变,提示VEGFR1和NRP1共同介导了VEGFB的作用。其下游的信号通路可能是由磷脂酰肌醇3(phosphatidylinositol-3-OH kinase,PI3K)所介导的[7,9]。
有研究发现,肥胖时骨骼肌VEGFB的表达显著升高。Hagberg等[9]在60%的高脂饮食喂养16周的肥胖C57BL/6小鼠和22周龄的瘦素受体敲除db/db小鼠中发现,骨骼肌内源性VEGFB的mRNA表达升高。在本实验中,没有发现高脂饮食对骨骼肌VEGFB及其受体有显著影响。由于VEGFB表达受营养状况的调节非常明显,禁食会显著抑制心肌中VEGFB的表达[8]。在本实验中动物处死之前均是禁食过夜,可能是本研究与报道不一致的原因。
3.3 运动对骨骼肌VEGFB及其受体的调节作用
VEGFB及其受体在骨骼肌中大量表达,运动对它们表达的影响如何,目前尚不清楚。有人体研究报道,受试者在5分钟自行车测力计热身后,以左腿作为对照,右腿以5秒/次的速度进行单边跳跃至力竭,运动后30分钟和48小时取大腿股外侧肌活检,结果发现,在运动结束后30分钟和48小时右腿VEGFB与对照腿相比没有明显差异,但是运动后48小时较运动后30分钟VEGFB有明显的上升趋势[15]。Bostrom等研究发现,12周龄的B6小鼠经3周的自由跑轮运动后,骨骼肌中VEGFB的mRNA表达水平比安静组显著增加[16]。Riikka等研究发现[17],小鼠在一次1小时跑台运动(跑台角度2.5度,跑速21米/分钟)结束后3小时腓肠肌VEGFB和VEGFR1的mRNA表达没有变化,运动后6小时,VEGFB的mRNA水平上升15%,但并没有显著性差异。在本研究中我们发现,运动虽然没有显著上调肥胖小鼠比目鱼肌VEGFB的表达,但却显著增加了VEGFB的受体VEGFR1的mRNA和蛋白的表达,提示VEGFB/VEGFR1在运动改善骨骼肌脂质代谢中发挥一定的作用。
PGC-1α是与能量代谢关系密切的转录辅助活化因子,在线粒体合成、调节适应性产热、骨骼肌纤维类型转换等过程中发挥重要作用,被认为是运动改善代谢作用关键的效应分子。有研究报道,PGC-1α能显著诱导骨骼肌 VEGFB的表达。与野生组小鼠相比,在骨骼肌特异性转染PGC-1α的小鼠,VEGFB表达显著上调,而骨骼肌特异敲除 PGC-1α的小鼠,VEGFB表达则显著降低[16]。在本研究中,不管是高脂安静组还是高脂运动组,作为VEGFB上游的转录调节因子PGC-1α的mRNA表达均未有显著改变。有研究提示,运动后骨骼肌PGC-1α的表达有很强的时效性[18],在本实验中,取材时间是末次运动后48小时,此时PGC-1α表达回到安静水平,与先前文献报道一致,也可能部分解释了运动对VEGFB表达无明显作用的原因。
4 结论
8周的跑台运动显著降低了肥胖小鼠体重,降低骨骼肌脂质沉积,显著上调骨骼肌VEGFR1的 mRNA和蛋白表达,提示VEGFB/VEGFR1可能参与了运动诱导的骨骼肌脂质代谢过程。
[1]Coen PM,Goodpaster BH.Role of intramyocelluar lipids in human health[J].Trends Endocrinol Metab,2012,23(8):391-398.
[2]Szendroedi J,Roden M.Ectopic lipids and organ function[J].Curr Opin Lipidol,2009,20(1):50-56.
[3]张靓,刘小园,唐朝枢.肥胖与骨骼肌重塑[J].生理科学进展,2012,43(6):405-410.
[4]van Herpen NA,Schrauwen-Hinderling VB.Lipid accumulation in non-adipose tissue and lipotoxicity[J].Physiol Behav,2008,94(2):231-241.
[5]Olofsson B,Pajusola K,Kaipainen A,et al.Vascular endothelial growth factor B,a novel growth factor for endothelial cells[J].Proc Natl Acad Sci U S A,1996,93(6):2576-2581.
[6]Lagercrantz J,Farnebo F,Larsson C,et al.A comparative study of the expression patterns for vegf,vegf-b/vrf and vegf-c in the developing and adult mouse[J].Biochim Biophys Acta,1998,1398(2):157-163.
[7]马谨,张靓.肌肉因子新成员:血管内皮生长因子B[J].生理科学进展,2015,46(04):299-303.
[8]Hagberg CE,Falkevall A,Wang X,et al.Vascular endothelial growth factor B controls endothelial fatty acid uptake[J].Nature,2010,464(7290):917-921.
[9]HagbergCE,Mehlem A,FalkevallA,etal.Targeting VEGF-B as a novel treatment for insulin resistance and type 2 diabetes[J].Nature,2012,490(7420):426-430.
[10]Kwon SM,Park HG,Jun JK,et al.Exercise,but not quercetin,ameliorates inflammation,mitochondrial biogenesis,and lipid metabolism in skeletal muscle after strenuous exercise by high-fat diet mice[J].J Exerc Nutrition Biochem,2014,18(1):51-60.
[11]Simoneau JA,Colberg SR,Thaete FL,et al.Skeletal muscle glycolytic and oxidative enzyme capacities are determinants of insulin sensitivity and muscle composition in obese women[J].FASEB J,1995,9(2):273-278.
[12]Amati F,Dube JJ,Alvarez-Carnero E,et al.Skeletal muscle triglycerides,diacylglycerols,and ceramides in insulin resistance:another paradox in endurance-trained athletes[J]?Diabetes,2011,60(10):2588-2597.
[13]Bucher J,Krusi M,Zueger T,et al.The effect of a single 2 h bout of aerobic exercise on ectopic lipids in skeletal muscle,liver and the myocardium[J].Diabetologia,2014,57(5):1001-1005.
[14]Dotzert MS,Murray MR,McDonald MW,et al.MetabolomicResponseofSkeletalMuscletoAerobicExercise Training in Insulin Resistant Type 1 Diabetic Rats[J].Sci Rep,2016,6:26379.
[15]Kivela R,Kyrolainen H,Selanne H,et al.A single bout of exercise with high mechanical loading induces the expression of Cyr61/CCN1 and CTGF/CCN2 in human skeletal muscle[J].J Appl Physiol(1985),2007,103(4):1395-1401.
[16]Bostrom P,Wu J,Jedrychowski MP,et al.A PGC1-alphadependent myokine that drives brown-fat-like development of white fat and thermogenesis[J].Nature,2012,481(7382):463-468.
[17]Kivela R,Silvennoinen M,Lehti M,et al.Exercise-induced expression of angiogenic growth factors in skeletal muscle and in capillaries of healthy and diabetic mice[J].Cardiovasc Diabetol,2008,7:13.
[18]赵婷婷,丁树哲.大鼠游泳运动后骨骼肌PGC-1αmRNA表达的时相性变化[J].上海体育学院学报,2006,30(3):41-44.
Effects of Treadmill Running on Intramyocellular Lipid Deposition and VEGFB Expression in Soleus Muscle of High-fat Diet Mice
Zhang Jing1,MA Jin1,Gao Haining2,Li Lingjie1
1 School of Physical Education and Sports Science,Beijing Normal University,Beijing 100875,China
2 Department of Kinesiology,Shenyang Sport University,Shenyang 110102,China
Zhang Jing,Email:zhangjing@bnu.edu.cn
ObjectiveTo observe the effect of treadmill running on skeletal muscle lipid deposition,and the expression of vascular endothelial growth factor-B(VEGFB)and its receptor in soleus muscles of high-fat diet mice.MethodsThirty-two 5-week-old C57BL/6 male mice were randomly divided into a control group(n=8)and a high-fat diet group(n=24),and fed with normal and high-fat diet respectively.Eight weeks later,16 obesity mice were selected from the latter group and randomly divided into a sedentary group(n=8)and a treadmill running group(n=8).The running group underwent treadmill running at 25 m/min for an hour every day,five days a week for 8 weeks,while the other two groups did not do any exercises.The weight was measured before the mice were killed.The soleus lipid deposition level was determined using oil red O staining,The expression of VEGFR1 and Neuropilin-1(NRP1)was determined using the immunohistochemical staining,while the mRNA expression of VEGFB,VEGFR1,NRP1 and peroxisome proliferator-activated receptor-γcoactivator-1α(PGC-1α)was detected using the real-time PCR.ResultsCompared with the control group,a significant increase was observed in the weight and the soleus lipid deposition of the high-fat diet group,while there were no significant differences in the expression of VEGFB,NRP1,VEGFR1 and PGC-1α.mRNA between the two groups.Compared with the sedentary obese mice,significant decrease in the body weight and soleus lipid deposition,significant increase in VEGFR1 mRNA expression,but no significant changes in the expression of VEGFB,NRP1 and PGC-1α mRNA were observed in the treadmill-running obese mice.ConclusionThe treadmill running has no effect on the VEGFR1 expression in soleus of obese mice,but significantly up-regulates the expression of its receptors.It indicates that the treadmill running can lower the intramyocellular lipid deposition as it can strengthen the VEGFB/VEGFR1 in soleus muscles.
treadmill running,intramyocellular lipid deposition,VEGFB,obesity,soleus
2017.03.09
国家自然科学基金(31471137,81273096)
张靓,Email:zhangjing@bnu.edu.cn
