有氧运动对大鼠大脑皮质和海马组织Wnt/β-Catenin信号通路的影响
2017-11-08房国梁赵杰修张漓李鹏飞李良杨星雅于涛
房国梁 赵杰修 张漓 李鹏飞 李良 杨星雅 于涛
国家体育总局体育科学研究所(北京 100061)
有氧运动对大鼠大脑皮质和海马组织Wnt/β-Catenin信号通路的影响
房国梁 赵杰修 张漓 李鹏飞 李良 杨星雅 于涛
国家体育总局体育科学研究所(北京 100061)
目的:探讨有氧运动对大鼠大脑皮质和海马组织Wnt/β-Catenin信号通路的影响,为揭示有氧运动改善神经系统功能提供一定的理论基础。方法:雄性6周龄SD大鼠(n=40)随机分为安静对照组(CG组,n=20)和运动组(EG组,n=20)。EG组大鼠进行为期8周的跑台训练。最后一次训练结束后48小时,分离所有大鼠大脑皮质和海马组织。通过荧光定量PCR和Western blot检测各组大鼠大脑皮质和海马组织中Wnt、β-Catenin、LRP5、LRP6、Axin1、CK1以及GSK3β mRNA和蛋白含量及其磷酸化水平。结果:经过8周跑台训练后,EG组大鼠大脑皮质和海马组织Wnt1和Wnt3两种亚型mRNA和蛋白含量均显著高于CG组;β-Catenin mRNA水平虽未发生显著变化,但其蛋白含量却显著高于CG组,同时其Ser33/Ser37和Thr41/Ser45位点的磷酸化水平显著低于CG组。EG组LRP5和LRP6 mRNA和蛋白含量均显著高于CG组;而Axin1和CK1 mRNA和蛋白含量均显著低于CG组。EG组GSK3β mRNA和蛋白含量并未发生显著改变,但其Ser9位点的磷酸化水平显著高于CG组。结论:有氧运动能够提高大鼠大脑皮质和海马组织中Wnt和Wnt受体蛋白LRP5及LRP6的含量;降低Axin1和CK1的含量;抑制GSK3β的活性;从而降低了β-Catenin的磷酸化水平,提高其稳定性。因此,有氧运动能够增强大鼠大脑皮质和海马组织Wnt/β-Catenin通路信号活性,激活下游基因的转录。
有氧运动;大脑皮质;海马组织;Wnt;β-Catenin
1 前言
Wnt/β-Catenin信号通路在细胞分化、胚胎发育和体内稳态等多个生物学过程中具有关键调控作用[1,2]。典型的Wnt/β-Catenin信号通路主要由Wnt家族分泌蛋白、β-连环蛋白(β-Catenin)、卷曲蛋白(Frizzled,Fz)、低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related proteins,LRP5/6)、轴蛋白(Axin)、腺瘤性结肠息肉病蛋白(adenomatous polyposis coli,APC)、酪蛋白激酶1(casein kinase 1,CK1)、糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3β)及T细胞因子/淋巴增强因子(T-cell factor/Lymphoid enhancing factor ,TCF/LEF)等组成[3,4]。
该通路对β-Catenin浓度的调控处于中心地位。当无Wnt蛋白时,细胞质中的Axin-APC-GSK3β-CK1复合体处于稳定状态。Axin结合β-Catenin,促使β-Catenin被CK1和GSK3β磷酸化[5]。CK1可以磷酸化β-Catenin第45位丝氨酸,该位点磷酸化将导致β-Catenin能够随后被GSK3β磷酸化[6]。GSK3β通过磷酸化β-Catenin第33、37位丝氨酸和第41位苏氨酸[7],使其被E3泛素连接酶β-TrCP识别,泛素化后被蛋白酶体降解,从而降低了细胞质中β-Catenin的浓度[5]。而细胞外的Wnt蛋白与细胞膜上的受体蛋白Fz和LRP5/6结合后,引起LRP5/6多个位点的磷酸化和Wnt-Fz-LRP5/6复合体的形成。磷酸化的LRP5/6可以与Axin结合,导致Axin-APC-GSK3β-CK1复合体的解聚,从而增强细胞质中β-Catenin的稳定[8]。随后β-Catenin进入细胞核与TCF/LEF结合从而激活下游基因的转录[2]。
研究发现Wnt/β-Catenin信号通路对于神经系统的发育,包括皮质模式建立、突触形成等至关重要[9]。而大量研究表明体育运动能够对神经系统产生多方面的积极影响。长期的体育运动尤其是有氧运动可以显著改善突触可塑性[10],加快神经冲动传递速度[11],增强神经元的存活[12],促进神经系统执行和认知功能[13]等。那么有氧运动对神经系统产生的积极影响是否是通过Wnt/β-Catenin信号通路发挥作用的?本研究通过观察8周有氧运动后大鼠大脑皮质和海马组织Wnt/β-Catenin信号通路各因子的变化情况,阐明有氧运动对Wnt/β-Catenin信号通路的影响,为揭示有氧运动对神经系统的积极影响提供一定的理论基础。
2 材料与方法
2.1 动物饲养及分组
实验选用6周龄健康雄性SD大鼠40只,体重270.2±20.2 g,随机分为安静对照组(CG组,n=20)和运动组(EG组,n=20)。常规分笼饲养,自由进食饮水,光照比为12 h∶12 h,温度20±2℃,相对湿度40%~60%。
2.2 训练方案
适应性饲养1周后,所有大鼠先进行1周的适应性跑台训练,速度为10 m/min,每天训练10min,连续训练5天。EG组大鼠在随后8周时间内进行跑台训练,速度从15 m/min增至28 m/min,训练时间从30min增至60min,跑台坡度为0o。依据Bedford[14]等的研究,采用中等强度跑台训练,相当于50%VO2max负荷强度。每周一至周五训练,休息2天。CG组大鼠则一直处于安静状态,其他生活条件与EG组相同。
2.3 样品制备
在最后一轮训练结束后48 h,所有大鼠用10%水合氯醛溶液腹腔麻醉,断头取脑。先剪开大鼠头皮,然后用直镊将大鼠头盖骨拨开,用直镊小心将大脑皮质拨开,切取右侧大脑皮质。海马组织位于大脑皮质底部,两侧大脑皮质拨开后,暴露出两侧海马组织,将海马组织与大脑皮质及周围脑组织分开,小心取出。以上操作均在冰上进行。将取出的大脑皮质和海马组织迅速放入液氮冷冻,然后将样品转入-80℃冰箱中保存待测。
2.4 荧光定量PCR实验
分别取两组大鼠大脑皮质和海马组织各50 mg,放入冰预冷的玻璃匀浆器中,然后加入1 mL Trizol裂解液,充分匀浆,使组织细胞裂解,采用氯仿异丙醇法提取海马组织总RNA,利用逆转录酶逆转录得到cDNA。然后利用各目的基因序列设计特异性引物,进行荧光定量PCR实验。引物序列见表1,所有引物由华大基因合成。最后根据各反应孔的ct值,计算各组目的基因的相对表达量。

表1 引物合成序列
2.5 Western blot实验
分别取两组大鼠大脑皮质和海马组织各80 mg,在液氮中研磨后,迅速加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA蛋白裂解液1 mL进行细胞组织的充分裂解。4℃,12000 ×g离心15min,取400 μL上清液然后加入100 μL 5×蛋白上样缓冲液,放入100℃水浴锅中进行蛋白变性,持续10min。然后进行SDSPAGE电泳,电泳后将蛋白转至硝酸纤维素膜上,用5%脱脂奶粉室温封闭膜1 h,然后将膜与稀释好的一抗4℃孵育过夜(实验中用到的一抗Wnt1、Wnt3和CK1抗体购自Abcam公司;LRP5、LRP6和Axin1抗体购自Cell Signaling Technology公司;Phospho-β Catenin Ser33/Ser37和Phospho-β Catenin Thr41/Ser45抗体购自 Invitrogen公司;GSK3β、Phospho-GSK3β Ser9、β-Catenin和β-actin抗体购自碧云天公司。次日用TBST洗膜3次,每次5min,洗去残留一抗,然后将膜与稀释好的二抗室温孵育1 h(实验中用到的二抗HRP标记山羊抗兔 IgG和HRP标记山羊抗小鼠 IgG购自Beyotime公司),然后用TBST洗膜4次,每次5min,以洗去残留的二抗。最后使用ECL化学发光试剂和X光片检测蛋白信号。
2.6 灰度分析及数据统计
使用ImageJ软件进行Western blot条带的灰度分析,应用SPSS 13.0软件进行统计学分析,文中所有统计数据为3次独立实验结果的平均值±标准差,显著性检验选择双尾t检验,P<0.05示差异有统计学意义。
3 结果
3.1 有氧运动提高大鼠大脑皮质和海马组织中Wnt蛋白含量
经过8周跑台训练后,EG组大鼠大脑皮质和海马组织中Wnt1和Wnt3两种亚型mRNA水平均显著高于CG组(图1A,B),其中Wnt1 mRNA水平分别为CG组水平的 1.76倍和 2.01倍(图1A,P<0.01),而 Wnt3 mRNA水平分别为CG组水平的1.69倍和1.81倍(图1B,P<0.01)。EG组大鼠大脑皮质和海马组织Wnt1和Wnt3蛋白水平同样高于CG组(图1C),其中Wnt1蛋白水平分别为CG组水平的1.56倍和1.59倍(图1D,P<0.01),而Wnt3蛋白水平分别为CG组水平的1.52倍和1.65倍(图1E,P<0.01)。上述结果说明8周有氧运动后大鼠大脑皮质和海马组织中Wnt转录和翻译水平显著提高,从而提高了Wnt蛋白的含量。
3.2 有氧运动增强大鼠大脑皮质和海马组织 β-Catenin的稳定性
经过8周的跑台训练后,EG组大鼠大脑皮质和海马组织β-Catenin mRNA水平与CG组相比并无显著性差异(图2A)。EG组大鼠大脑皮质和海马组织中β-Catenin总蛋白水平均显著高于CG组(图2B),分别约是CG组水平的1.59倍和1.46倍(图2C,P<0.01)。但EG组β-Catenin Ser33/Ser37和Thr41/Ser45位点的磷酸化水平却显著低于CG组(图2B),其中Ser33/Ser37位点的磷酸化水平分别约为CG组水平的44.74%(P<0.01)和52.46%(P<0.05)(图2D),而Thr41/Ser45位点的磷酸化水平分别约为CG组水平的40.53%和48.46%(图2E,P<0.01)。上述结果说明8周有氧运动能够显著降低大鼠大脑皮质和海马组织中β-Catenin的磷酸化水平,从而抑制了β-Catenin被蛋白酶体降解。
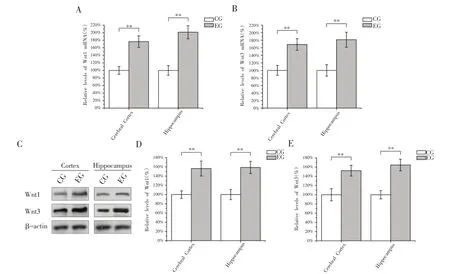
图1 有氧运动对大鼠大脑皮质和海马组织Wnt的影响
3.3 有氧运动提高大鼠大脑皮质和海马组织中Wnt受体蛋白LRP 5/ 6的含量
经过8周跑台训练后,EG组大鼠大脑皮质和海马组织中LRP5和LRP6 mRNA水平均显著高于CG组,其中LRP5 mNRA水平分别约为CG组水平的1.86倍和1.94倍(图3A,P<0.01),LRP6 mNRA水平分别约为CG组水平的2.35倍和2.54倍(图3B,P<0.01)。EG组大鼠其大脑皮质和海马组织中LRP5和LRP6的蛋白水平均显著高于CG组(图3C),LRP5蛋白水平分别约为CG组水平的1.74倍和1.79倍(图3D,P<0.01),LRP6蛋白水平分别为CG组水平的2.29倍和2.09倍(图3E,P<0.01)。上述结果说明8周有氧运动能够显著提高大鼠大脑皮质和海马组织中Wnt受体蛋白LRP5和LRP6的含量,从而提高了Wnt/β-Catenin信号通路从细胞外向细胞内信号传导的速率。
3.4 有氧运动降低了Axin 1和CK 1的含量,抑制了GSK 3 β的活性
Axin-APC-GSK3β-CK1复合体对β-Catenin的泛素化降解十分重要,因此,我们检测了有氧运动对Axin1、CK1和GSK3β的影响。如图4A,B所示,8周跑台训练后EG组大鼠大脑皮质和海马组织中Axin1和CK1 mRNA水平显著低于CG组,其中Axin1 mRNA水平分别为CG组水平的42.58%和47.48%(图4A,P<0.01),CK1 mRNA水平分别为CG组水平的43.26%和50.48%(图4B,P<0.01)。而GSK3β的mRNA水平与CG组相比并无显著性差异(图4C)。EG组大鼠其大脑皮质和海马组织中Axin1和CK1蛋白水平同样低于CG组(图4D)。其中EG组Axin1蛋白水平分别为CG组水平的47.12%和55.34%(图4E,P<0.01),而CK1蛋白水平分别为CG组水平的59.10%(P<0.01)和65.01%(P<0.05)(图4F)。但GSK3β总蛋白水平并未发生显著改变(图4D,G)。而EG组大鼠大脑皮质和海马组织GSK3β Ser9位点的磷酸化水平显著高于CG组(图4D),分别约为CG组水平的1.89倍和1.71倍(图4H)。上述结果说明8周有氧运动能够显著降低大鼠大脑皮质和海马组织中Axin1和CK1的含量,提高GSK3β Ser9位点的磷酸化水平抑制其激酶活性,从而减少CK1和GSK3β对β-Catenin的磷酸化作用。
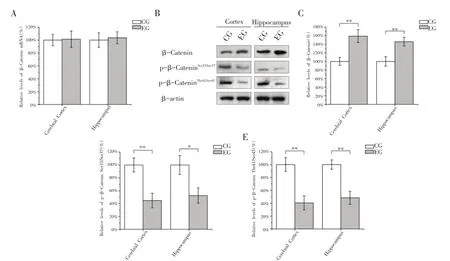
图2 有氧运动对大鼠大脑皮质和海马组织β-Catenin的影响
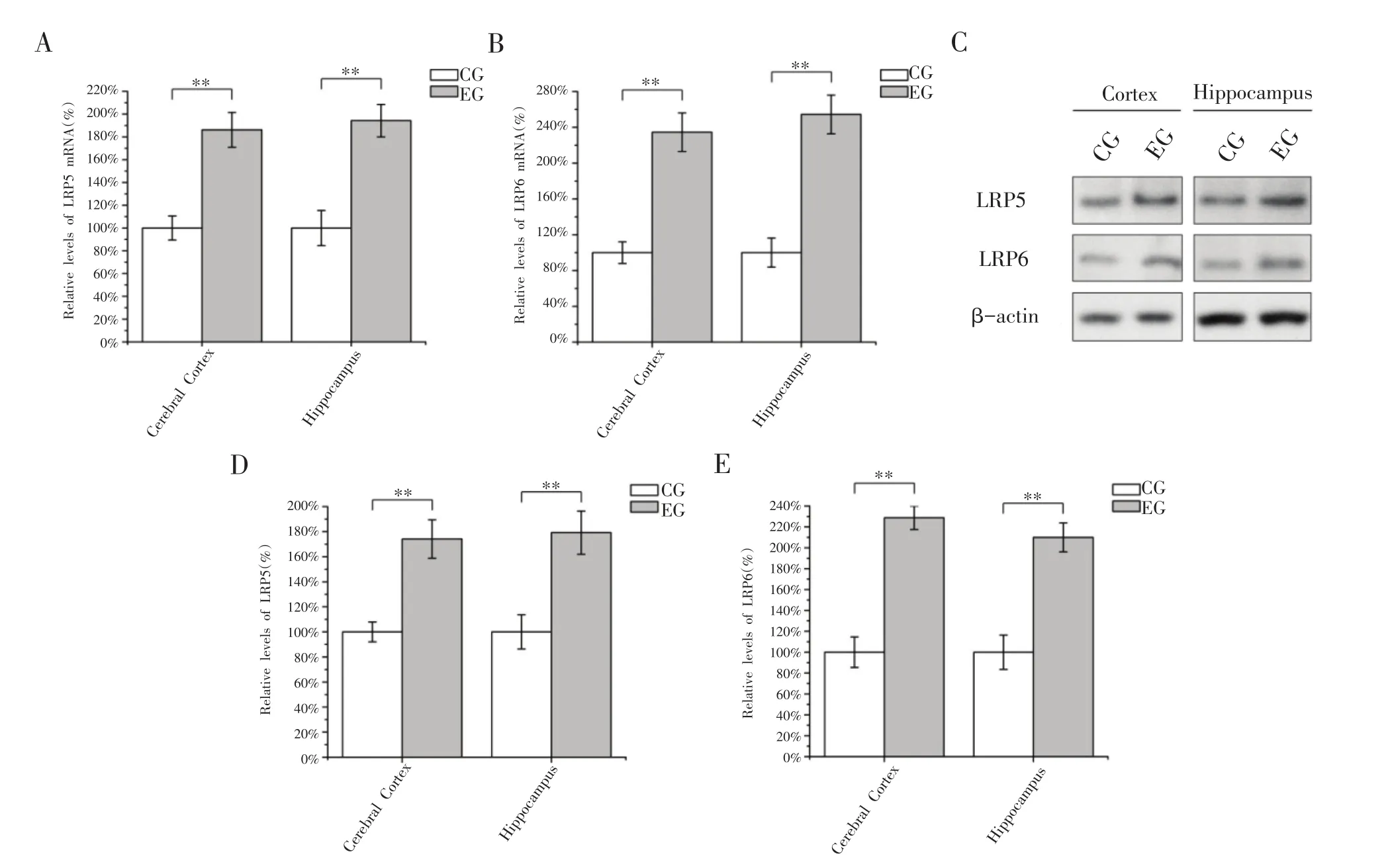
图3 有氧运动对大鼠大脑皮质和海马组织Wnt受体蛋白LRP5/6的影响
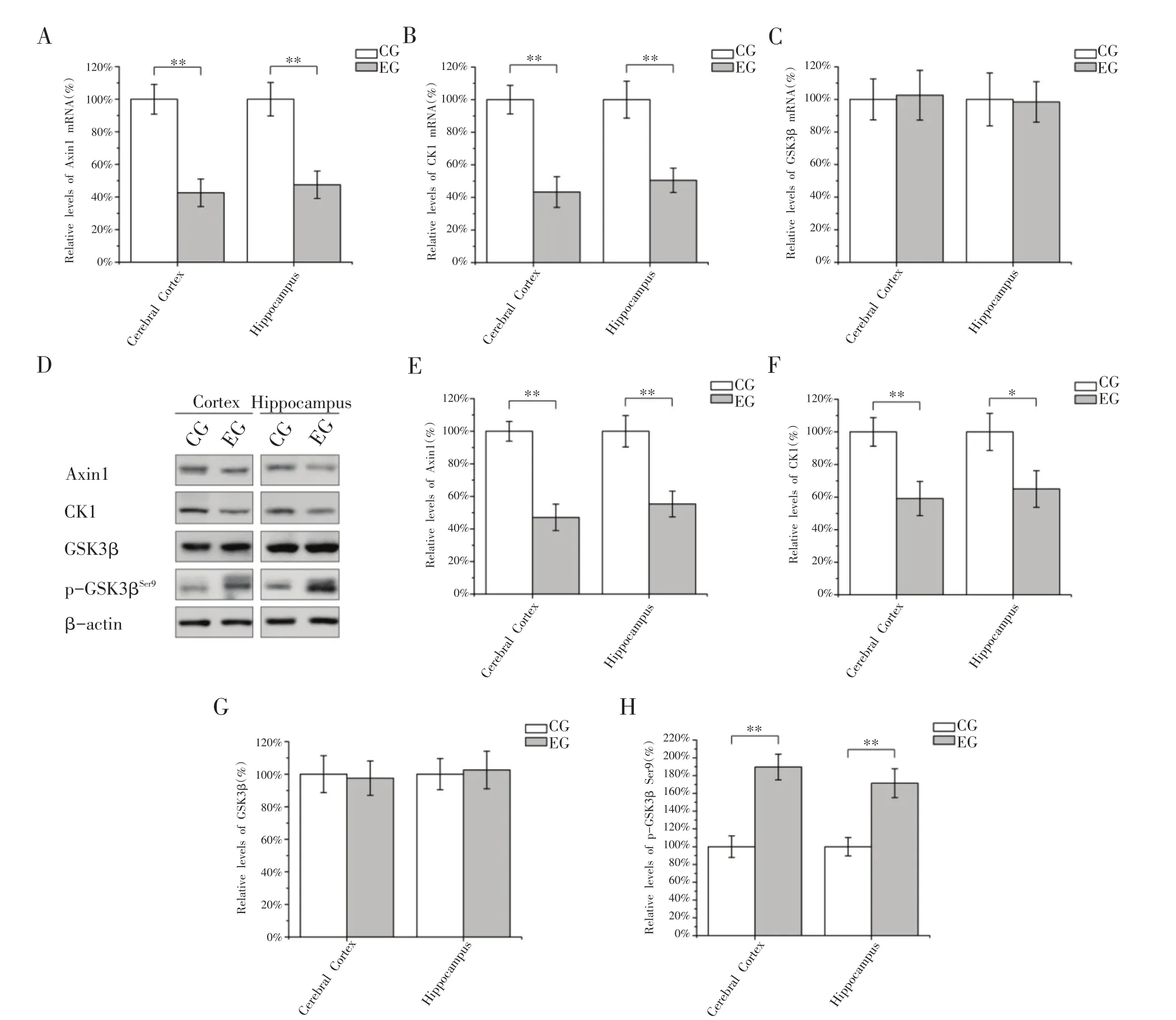
图4 有氧运动对大鼠大脑皮质和海马组织Axin1、CK1和GSK3β的影响
4 讨论
研究发现,长期跑台训练后大鼠海马组织中Wnt蛋白拮抗剂Dkk-1的含量显著下降,并且抑制了Axin1的活性,降低了β-Catenin的磷酸化水平,从而减少了β-Catenin的降解[15]。Okamoto等研究发现自主运动能够显著增加小鼠DG区星型胶质细胞内Wnt3的表达[16]。另外在Wnt跨膜受体Frzb基因敲除小鼠中,自主运动对其神经发生的上调作用减弱[17]。因此,Wnt/β-Catenin信号通路在有氧运动对神经系统产生的积极影响中发挥重要的调控作用。
哺乳动物Wnt蛋白具有19种亚型,其中Wnt1和Wnt3两种亚型含量较为丰富[18]。本研究发现,8周跑台训练后大鼠大脑皮质和海马组织中Wnt1和Wnt3两种亚型mRNA和蛋白水平均显著升高,这反映出细胞外Wnt蛋白整体含量的上升。说明有氧运动能够提高大鼠大脑皮质和海马组织中Wnt蛋白含量,从而激活Wnt/β-Catenin信号通路。但有氧运动后Wnt1和Wnt3在大脑皮质和海马组织中的提高幅度并不相同,海马组织中Wnt1和Wnt3 mRNA与蛋白水平的提高幅度更大。
β-Catenin作为该信号通路中最重要的调控因子,其细胞质中浓度变化是调控关键。本实验发现,8周跑台训练后大鼠大脑皮质和海马组织中β-Catenin mRNA水平并未发生显著变化,但是其蛋白水平却显著升高;同时我们检测到β-Catenin Ser33/Ser37和Thr41/Ser45位点的磷酸化水平显著降低。这说明在转录水平有氧运动对β-Catenin并没有产生影响;但在蛋白质水平,有氧运动后β-Catenin特定位点的磷酸化水平降低,从而减少了被蛋白酶体的降解,提高了细胞质中β-Catenin的含量,有利于β-Catenin进入细胞核与TCF/LEF结合,从而激活下游基因的转录[2]。此外,有氧运动后大脑皮质中β-Catenin总蛋白水平略高于海马组织,这与大脑皮质中β-Catenin的磷酸化水平略低于海马组织有关,从而减少了β-Catenin的降解。
本研究检测了有氧运动对Wnt/β-Catenin信号通路中LRP5、LRP6、Axin1、CK1和GSK3β的影响。LRP5和LRP6作为Wnt蛋白受体,属于低密度脂蛋白受体相关蛋白家族,单次跨膜,其胞外域具有4个EGF和3个LDLR重复序列,胞内域富含脯氨酸[19]。当Wnt蛋白与LRP5和LRP6结合后,LRP5和LRP6胞内域被磷酸化,磷酸化的LRP5和LRP6能够与Axin结合,导致Axin-APC-GSK3β-CK1复合体的解聚,促进了β-Catenin的稳定[20]。实验中我们发现,8周跑台训练后大鼠大脑皮质和海马组织中LRP5和LRP6 mRNA和蛋白含量均显著上升,这说明长期有氧运动后LRP5和LRP6含量上升,提高了Wnt/β-Catenin通路信号传导速率,促进了LRP5和LRP6与Axin的结合。其中,海马组织中LRP5和LRP6含量提高的幅度更高。而有氧运动后Axin1和CK1的mRNA和蛋白水平显著下降,同时GSK3β的激酶活性受到抑制,这些结果都反映出Axin-APC-GSK3β-CK1复合体含量和活性的降低,降低了CK1和GSK3β对β-Catenin的磷酸化作用,从而减少β-Catenin被蛋白酶体的降解,进而有利于胞质中的β-Catenin进入细胞核,激活下游靶基因。而大脑皮质中Axin1和CK1含量以及GSK3β活性下降更为显著,这也是大脑皮质中β-Catenin磷酸化水平低于海马组织的原因。
我们在取材时选取了大脑皮质和海马组织两种具有不同结构和功能的大脑组织进行了检测。大脑皮质位于大脑的表层,是机体的最高级神经中枢,控制着听觉、视觉、触觉、情感、抽象思维、语言、判断和躯体运动等多种高级功能[21]。而Wnt/β-Catenin信号通路对大脑皮质模式建立、突触形成具有重要调控作用[9]。因此,我们推测有氧运动对人思维判断、情感调节和躯体运动等能力的提高可能是通过提高大脑皮质中Wnt/β-Catenin通路活性而产生的。海马组织位于大脑丘脑和内侧颞叶之间,负责信息存储,控制着学习与记忆[22]。Wnt/β-Catenin信号通路功能紊乱会加速海马组织中β-淀粉样蛋白和神经纤维缠结的形成从而导致阿尔茨海默病的发生[23]。有研究表明有氧运动能够减缓大脑老化[24],提高学习和记忆能力,对于防治阿尔茨海默病等神经系统退行性疾病有积极作用[25]。因此,我们推测有氧运动可能是通过提高海马组织中Wnt/β-Catenin通路活性从而提高大脑学习与记忆能力,延缓阿尔茨海默病等神经系统退行性疾病的发生。
5 结论
长期有氧运动提高了大鼠大脑皮质和海马组织中Wnt、LRP5和LRP6蛋白含量,降低Axin1和CK1的浓度,抑制GSK3β的活性,进而提高了β-Catenin的稳定性。因此,长期有氧运动能够提高大鼠大脑皮质和海马组织Wnt/β-Catenin通路信号活性,进而激活下游靶基因。
[1]Logan CY,Nusse R.The Wnt signaling pathway in development and disease.Annu Rev Cell Dev Biol,2004,20:781-810.
[2]Clevers H,Nusse R.Wnt/beta-catenin signaling and disease.Cell,2012,149(6):1192-1205.
[3]MacDonald BT,He X.Frizzled and LRP5/6 receptors for Wnt/beta-catenin signaling.Cold Spring Harb Perspect Biol,2012,4(12)
[4]He X,Semenov M,Tamai K,et al.LDL receptor-related proteins 5 and 6 in Wnt/beta-catenin signaling:arrows point the way.Development,2004,131(8):1663-1677.
[5]Stamos JL,Weis WI.The beta-catenin destruction complex.Cold Spring Harb Perspect Biol,2013,5(1):a007898.
[6]Amit S,Hatzubai A,Birman Y,et al.Axin-mediated CKI phosphorylation of beta-catenin at Ser 45:a molecular switch for the Wnt pathway.Genes Dev,2002,16(9):1066-1076.
[7]Yost C,Torres M,Miller JR,et al.The axis-inducing activity,stability,and subcellular distribution of betacatenin isregulated in Xenopusembryosbyglycogen synthase kinase 3.Genes Dev,1996,10(12):1443-1454.
[8]MacDonald BT,Yokota C,Tamai K,et al.Wnt signal amplification via activity,cooperativity,and regulation of multiple intracellular PPPSP motifs in the Wnt co-receptor LRP6.J Biol Chem,2008,283(23):16115-16123.
[9]Nouri N,Patel MJ,Joksimovic M,et al.Excessive Wnt/beta-catenin signaling promotes midbrain floor plate neurogenesis,but results in vacillating dopamine progenitors.Mol Cell Neurosci,2015,68:131-142.
[10]Patten AR,Sickmann H,Hryciw BN,et al.Long-term exercise is needed to enhance synaptic plasticity in the hippocampus.Learn Mem,2013,20(11):642-647.
[11]Ma Q.Beneficial effects of moderate voluntary physical exercise and its biological mechanisms on brain health.Neurosci Bull,2008,24(4):265-270.
[12]Wu CW,Chang YT,Yu L,et al.Exercise enhances the proliferation of neural stem cells and neurite growth and survival of neuronal progenitor cells in dentate gyrus of middle-aged mice.J Appl Physiol(1985),2008,105(5):1585-1594.
[13]Heyn P,Abreu BC,Ottenbacher KJ.The effects of exercise training on elderly persons with cognitive impairment and dementia:a meta-analysis.Arch Phys Med Rehabil,2004,85(10):1694-1704.
[14]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures.J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[15]Bayod S,Mennella I,Sanchez-Roige S,et al.Wnt pathway regulation by long-term moderate exercise in rat hippocampus.Brain Res,2014,1543:38-48.
[16]Okamoto M,Inoue K,Iwamura H,et al.Reduction in paracrine Wnt3 factors during aging causes impaired adult neurogenesis.FASEB J,2011,25(10):3570-3582.
[17]Lories RJ,Peeters J,Szlufcik K,et al.Deletion of frizzled-related protein reduces voluntary running exercise performance in mice.Osteoarthritis Cartilage,2009,17(3):390-396.
[18]Toledo EM,Colombres M,Inestrosa NC.Wnt signaling in neuroprotection and stem cell differentiation.Prog Neurobiol,2008,86(3):281-296.
[19]Brown SD,Twells RC,Hey PJ,et al.Isolation and characterization of LRP6,a novel member of the low density lipoprotein receptorgene family.Biochem BiophysRes Commun,1998,248(3):879-888.
[20]Zeng X,Tamai K,Doble B,et al.A dual-kinase mechanism for Wnt co-receptor phosphorylation and activation.Nature,2005,438(7069):873-877.
[21]Shipp S.Structure and function of the cerebral cortex.Curr Biol,2007,17(12):R443-449.
[22]Opitz B.Memory function and the hippocampus.Front Neurol Neurosci,2014,34:51-59.
[23]De Ferrari GV,Avila ME,Medina MA,et al.Wnt/betacatenin signaling in Alzheimer's disease.CNS Neurol Disord Drug Targets,2014,13(5):745-754.
[24]Fang G,Zhao J,Li P,et al.Long-term treadmill exercise inhibits neuronal cell apoptosis and reduces tau phosphorylation in the cerebral cortex and hippocampus of aged rats.Science Bulletin,2017,62(11):755-757.
[25]Tanigawa T,Takechi H,Arai H,et al.Effect of physical activity on memory function in older adults with mild Alzheimer's disease and mild cognitive impairment.Geriatr Gerontol Int,2014,14(4):758-762.
Effects of Aerobic Exercise on Wnt/β-Catenin Pathway in the Cerebral Cortex and Hippocampus of Rats
Fang Guoliang,Zhao Jiexiu,Zhang Li,Li Pengfei,Li Liang,Yang Xingya,Yu Tao
China Institute of Sport Science,Beijing 100061,China
Fang Guoliang,Email:fangguoliang@ciss.cn
ObjectiveTo explore the effect of aerobic exercise on Wnt/β-Catenin pathway in the cerebral cortex and hippocampus of rats,so as to provide theoretical basis for conforming that aerobic exercise can improve the function of the nervous system.MethodsSix-week-old Sprague-Dawley male rats were randomly assigned to a sedentary control group(CG)and an aerobic exercise group(EG).The rats in the EG group underwent an 8-week treadmill training and their cerebral cortex and hippocampus were isolated at 48h after the last exercise.The mRNA levels of Wnt,β-Catenin,LRP5,LRP6,Axin1,CK1 and GSK3β were analyzed using quantitative PCR,while the protein and phosphorylation levels were assayed using Western blotting.ResultsAfter 8 weeks of treadmill exercise,the average mRNA and protein levels of Wnt1 and Wnt3 in the EG group were significantly higher than those in the CG group.Although there were no signi fi cant differences in β-Catenin mRNA levels between EG and CG groups,the protein levels of β-Catenin in the EG group were significantly higher than those in the CG group.Meanwhile,the phosphorylation levels of β-Catenin Ser33/Ser37 and Thr41/Ser45 were significantly lower than those in the CG group.In the EG group,the mRNA and protein levels of LRP5 and LRP6 were significantly higher than those in the CG group,while those of Axin1 and CK1 were significantly lower than the CG group.Moreover,no significant differences were observed in the mRNA and protein levels of GSK3β between the two groups,but the phosphorylation levels of GSK3β Ser9 in the EG group were significantly higher than the CG group.ConclusionAerobic exercises can increase the levels of Wnt and Wnt receptor,protein LRP5 and LRP6,decrease the levels of Axin1 and CK1,inhibit the activity of GSK3β,altogether lowering the phosphorylation of β-Catenin to promote the stableness of β-Catenin.Therefore,the aerobic exercise can increase Wnt/β-Catenin pathway activity and activate the downstream gene transcription in the cerebral cortex and hippocampus of rats.
aerobic exercise,cerebral cortex,hippocampus,Wnt,β-Catenin
2017.06.06
国家体育总局体育科学研究所基本科研业务费资助项目 (基本15-10和16-49)
房国梁,Email:fangguoliang@ciss.cn
