HIF-1α@Fe3O4纳米颗粒标记缺氧条件下胰腺癌PANC1细胞及其MRI表现
2017-11-08谢晓东王冬青张磊宋廉李丹沈文荣
谢晓东 王冬青 张磊 宋廉 李丹 沈文荣
HIF-1α@Fe3O4纳米颗粒标记缺氧条件下胰腺癌PANC1细胞及其MRI表现
谢晓东 王冬青 张磊 宋廉 李丹 沈文荣
目的探讨新型纳米颗粒缺氧诱导因子-1α(HIF-1α)螯合四氧化三铁探针(HIF-1α@Fe3O4)标记胰腺癌PANC1细胞的可行性及其3.0T MRI扫描时T2WI信号的改变。方法在缺氧条件下培养胰腺癌PANC1细胞,采用蛋白质印迹法检测细胞HIF-1α及干细胞标志蛋白CD133、Oct-4、Sox-2的表达。收集缺氧培养24 h的PANC1细胞,并分别与5、15、45 μg/ml的HIF-1α@Fe3O4纳米颗粒共孵育24 h,检测HIF-1α@Fe3O4标记的PANC1细胞数及细胞存活率,采用3.0T MRI扫描记录细胞在T2WI图上的信号强度。结果在缺氧培养下PANC1细胞HIF-1α表达量较常氧培养组明显增加,且随着缺氧时间的延长进一步增加(P值均<0.05),干细胞标志蛋白CD133、Oct-4、Sox-2的表达与HIF-1α表达呈正相关。PANC1细胞与不同浓度HIF-1α@Fe3O4共孵育24 h后,胞质内蓝色铁染颗粒细胞呈浓度依赖性增多,45 μg/ml浓度时最高,达100%。常氧培养组、缺氧培养未标记组及缺氧培养45 μg/ml HIF-1α@Fe3O4标记组的细胞存活率分别为(87.0±2.1)%、(84.7±2.7)%、(85.0±3.8)%,差异无统计学意义(P>0.05)。通过3.0T MRI扫描,未标记组及5、15、45 μg/ml HIF-1α@Fe3O4标记组细胞T2WI的信号强度比分别为1.017±0.046、0.793±0.041、0.447±0.032、0.240±0.031,各组间差异有统计学意义(F=80.0,P<0.05)。结论缺氧有利于胰腺癌PANC1细胞干细胞特性的维持。 HIF-1α@Fe3O4探针可成功标记缺氧培养下高表达HIF-1α的PANC1细胞,且标记细胞在3.0T MRI扫描的T2WI图上的信号强度减弱。
胰腺肿瘤; 缺氧诱导因子-1α; 肿瘤干细胞 ; 磁共振成像
【Fundprogram】 Jiangsu Cancer Hospital Project (ZN201611); Social Development Foundation of Jiangsu Province(BE2015668)
肿瘤干细胞目前被认为是肿瘤生长、复发、远处转移及放化疗抵抗的根源所在[1-2]。新的研究表明,肿瘤微环境对于干细胞作用的发挥及维持有着重要作用[3-4],缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)作为微环境中缺氧条件下的核心转录因子,参与调节肿瘤细胞凋亡、增殖和迁移能力等生物学行为,是胰腺癌侵袭和转移的重要分子机制之一。纳米磁粒子四氧化三铁(Fe3O4)因具有良好的生物相容性和MRI信号敏感性而常用于离体和活体生物学研究。为此,本研究构建纳米磁粒子Fe3O4标记的特异性HIF-1α探针(HIF-1α@Fe3O4),观察缺氧培养条件下胰腺癌PANC1细胞 HIF-1α表达的变化以及对于肿瘤干细胞特性的维持作用,为后期MRI靶向监测及靶向治疗胰腺癌奠定实验基础。
材料与方法
一、细胞株与试剂
人胰腺癌细胞株PANC1购于中国科学院上海生物科学研究所;胎牛血清(FBS)、细胞培养基DMEM-F12购自美国Gibco公司;二甲亚砜(DMSO)、四甲基偶氮唑蓝(MTT)购自Sigma公司;CD133、Oct-4、Sox-2、HIF-1α抗体均购自美国CST公司。
二、方法
1.PANC1细胞分组:PANC1细胞分为常氧培养及缺氧培养两组。常氧培养为PANC1细胞在20% O2、5% CO2、75% N2环境下培养。缺氧培养为PANC1细胞在1% O2、5% CO2、94% N2的厌氧培养盒中培养12 h,再在常氧条件下培养12 h,取循环1~2次培养的细胞进行实验。
2.细胞CD133、Oct-4、Sox-2及HIF-1α蛋白表达的检测:收集两组分别培养0、12、24 h的对数生长期PANC1细胞,提取细胞蛋白,采用蛋白质印迹法常规检测细胞CD133、Oct-4、Sox-2及HIF-1α蛋白表达量。应用凝胶成像系统扫描条带的灰度值,以目的条带与内参条带的灰度值比作为蛋白相对表达量。
3.HIF-1α@Fe3O4标记PANC1细胞:收集缺氧培养的PANC1细胞,将细胞密度调整为5×105/ml,接种于6孔板,分别加入0、5、15、45 μg/ml的HIF-1α@Fe3O4,常规条件下培养24 h,用预冷的PBS清洗细胞3遍,然后用4%的戊二醛固定20 min,加入普鲁士蓝试剂(2%亚铁氰化钾和6%盐酸混合溶液)孵育30 min后用1%核固红复染5 min。在200倍镜下随机选取5个视野,计数胞内有蓝色铁染颗粒的细胞数。
4.细胞增殖检测:收集常规培养、缺氧培养未标记及缺氧培养45 μg/ml HIF-1α@Fe3O4标记的PANC1细胞,调整细胞密度为1×105/ml,接种于96孔板,每孔200 μl,每组5个复孔。培养24后,每孔加入5 mg/ml的MTT溶液20 μl,继续培养4 h,弃上清,每孔加150 μl DMSO,置摇床上振荡10 min。上酶标仪测定各孔A490值,计算细胞存活率。细胞存活率(%)=(标记细胞A490值/未标记细胞A490值)×100%。
5.标记PANC1细胞的MRI扫描:取缺氧培养的PANC1细胞,接种6孔板,分别加入5、15、45 μg/ml HIF-1α@Fe3O4培养24 h,弃上清,用PBS重复洗涤3次,消化收集、离心沉淀细胞,用30 μl PBS和20 μl 2%的琼脂糖重悬细胞后放入EP管中,EP管置于试管架上于3.0 T MRI下行T2WI扫描,勾画感兴趣区域(ROI),面积为5 mm×5 mm。记录ROI的信号强度,结果以各浓度标记组的信号确定与未标记组(0浓度)信号强度比值表示。
三、统计学处理
结 果
一、缺氧培养下PANC1细胞HIF-1α、CD133、Oct-4、Sox-2蛋白表达
缺氧培养下PANC1细胞HIF-1α的蛋白表达量较常氧培养组明显增加(t值分别为4.957、9.535,P值均<0.05),且随着缺氧时间延长,HIF-1α的表达水平增加(图1)。干细胞标志蛋白CD133、Oct-4、Sox-2的表达量与HIF-1α的变化一致,较常氧培养组显著增加,差异有统计学意义(t值分别为2.992、11.95;3.073、3.928;3.208、11.27;P值均<0.05,图1)。
二、HIF-1α@Fe3O4标记的PANC1细胞及其存活率
将5、15、45 μg/ml的HIF-1α@Fe3O4分别与PANC1共孵育24 h,可见PANC1细胞胞质内有不同程度的蓝色铁染颗粒,且随着纳米粒子浓度的增加而增加,以45 μg/ml浓度时的标记率最高,达100%。而未标记的PANC1细胞内未见蓝色铁染颗粒(图2)。经MTT法检测,常氧培养组、缺氧培养未标记组及缺氧培养45 μg/ml HIF-1α@Fe3O4标记组细胞的存活率分别为(87.0±2.1)%、(84.7±2.7)%、(85.0±3.8)%,差异无统计学意义(F=0.1830,P>0.05)。
三、HIF-1α@Fe3O4标记的PANC1细胞的MRI表现
HIF-1α@Fe3O4标记的PANC1细胞在T2WI图像上信号减低,且随着标记物浓度的增加,信号减低更明显(图3),未标记组及5、15、45 μg/ml HIF-1α@Fe3O4标记组细胞的信号强度比分别为1.017±0.046、0.793±0.041、0.447±0.032、0.240±0.031,各组间差异有统计学意义(F=80.0,P<0.05)。
讨 论
肿瘤干细胞是存在于肿瘤组织中很少量的具有干细胞特性的细胞群体,其在肿瘤的增殖、侵袭、转移、耐药及复发方面起着根本性的作用。肿瘤干细胞的表面特异性蛋白主要有CD133、CD44、CD24、Oct-4、Sox-2及c-myc[5-7]。HIF-1α作为一种缺氧条件下的核心转录因子,参与肿瘤细胞的转录、新生血管形成及肿瘤转移等过程[8-9],而瘤旁及正常组织中无HIF-1α表达。Akakurat等[10]报道,20株胰腺癌细胞均有HIF-1α表达。本研究结果显示,缺氧培养条件下PANC1细胞的HIF-1α表达较常氧培养细胞显著增加,并随着缺氧时间的延长表达量逐渐增加,同时干细胞标志蛋白CD133、Oct-4、Sox-2的表达也呈时间依赖性地显著升高,提示缺氧环境有利于肿瘤干细胞特性的维持,其机制可能是通过上调HIF-1α蛋白的表达而发挥作用,与本课题组前期研究的结果[11]以及Zhu等[12]、Hashimoto等[13]的研究结果一致。
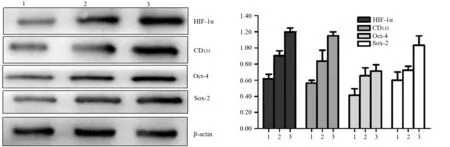
图1 缺氧培养0(1)、12(2)、24(3)h的PANC1细胞HIF-1α、CD133、Oct-4、Sox-2蛋白表达

图2 未标记(2A)及5(2B)、15(2C)、45(2D) μg/ml HIF-1α@Fe3O4标记的PANC1细胞(普鲁士蓝染色 ×200)

图3 缺氧培养下未标记组(3A)及5(3B)、15(3C)、45(3D) μg/ml HIF-1α@Fe3O4标记组PANC1细胞的T2WI信号
Fe3O4作为一种顺磁性物质,易在T2WI上引起信号的改变。为更深入研究HIF-1α的生物学作用,本研究构建了HIF-1α@Fe3O4纳米探针,通过与PANC1细胞在缺氧条件下共培养,HIF-1α可进入细胞与HIF-1α的结合位点竞争性结合,且不影响细胞的活力。结果显示,HIF-1α@Fe3O4探针可成功标记缺氧培养下高表达HIF-1α的PANC1细胞,且标记细胞在T2WI图像的信号显著降低,为通过MRI检查实现靶向监测及后期靶向治疗打下实验基础。
[1] Zhao J. Cancer stem cells and chemoresistance: The smartest survives the raid[J]. Pharmacol Ther,2016,160:145-158. DOI:10.1016/j.pharmthera.2016.02.008.
[2] Yang M, Liu P, Peng H. Cancer stem cells, metabolism, and therapeutic significance[J]. Tumor Biol,2016,37(5):5735-5742.DOI:10.1007/s13277-016-4945-x.
[3] Mora-Blanco LE, Lorens JB, Labarge MA. The tumor microenvironment as a transient niche: a modulator of epigenetic states and stem cell functions[M]//Trends in Stem Cell Proliferation and Cancer Research. Springer Netherlands, 2013:463-478. DOI:10.1007/978-94-007-6211-4_17.
[4] Burness ML, Sipkins DA. The stem cell niche in health and malignancy[J]. Semin Cancer Biol,2010,20(2):107-115.DOI:10.1016/j.semcancer.2010.05.006.
[5] Natarajan TG, Ganesan N, Fitzgerald KT. Cancer stem cells and markers: new model of tumorigenesis with therapeutic implications[J]. Cancer Biomark, 2010, 9(1-6):65-99.DOI:10.3233/CBM-2011-0173.
[6] Murar M, Vaidya A. Cancer stem cell markers: premises and prospects[J]. Biomark Med, 2015, 9(12):1331-1342.DOI:10.2217/bmm.15.85.
[7] Feng D, Peng G, Li W, et al. Identification and characterization of tumorigenic liver cancer stem cells by CD133 and CD24[J]. J Biomaterials Tissue Engineering, 2015, 5(8):635-646.DOI: 10.1166/jbt.2015.1363.
[8] Matsuo Y, Ding Q, Desaki R, et al. Hypoxia inducible factor-1 alpha plays a pivotal role in hepatic metastasis of pancreatic cancer: an immunohistochemical study[J]. J Hepatobiliary Pancreat Sci, 2014, 21(2):105-112.DOI: 10.1002/jhbp.6.
[9] Chang Q, Qin R, Huang T, et al. Effect of antisense hypoxia-inducible factor 1alpha on progression, metastasis, and chemosensitivity of pancreatic cancer[J]. Pancreas, 2006, 32(3):297-305.
[10] Akakura N, Kobayashi M, Horiuchi I, et al. Constitutive expression of hypoxia-inducible factor-1alpha renders pancreatic cancer cells resistant to apoptosis induced by hypoxia and nutrient deprivation[J]. Cancer Res, 2001, 61(17):6548-6554.
[11] 谢晓东, 朱海涛, 吴荧荧,等. HIF-1α@Fe3O4纳米颗粒标记对胰腺癌干细胞增殖及凋亡的影响[J]. 中华胰腺病杂志, 2015, 15(1):22-25. DOI:10.3760/cma.j.issn.1674-1935.2015.01.006.
[12] Zhu H, Wang D, Liu Y, et al. Role of the Hypoxia-inducible factor-1 alpha induced autophagy in the conversion of non-stem pancreatic cancer cells into CD133+, pancreatic cancer stem-like cells[J]. Cancer Cell Int, 2013, 13(1):119.DOI: 10.1186/1475-2867-13-119.
[13] Hashimoto O, Shimizu K, Semba S, et al. Hypoxia induces tumor aggressiveness and the expansion of CD133-positive cells in a hypoxia-inducible factor-1α dependent manner in pancreatic cancer cells.[J]. Pathobiology, 2011, 78(4):181-192.DOI: 10.1159/000325538.
(本文编辑:吕芳萍)
HIF-1α@Fe3O4labeledpancreaticcancerPANC1cellsunderhypoxiaanditsMRIdetection
XieXiaodong,WangDongqing,ZhangLei,SongLian,LiDan,ShenWenrong.
DepartmentofRadiology,JiangsuCancerHospital,Nanjing210009,China
Correspondinauthor:ShenWenrong,Email:jszlyyct@sohu.com
ObjectiveTo explore the feasibility of novel nano-particle HIF-1α@Fe3O4labeled pancreatic cancer PANC1 cells as well as the changes of signal intensity in 3.0T MRI scan.MethodsPancreatic cancer PANC1 cells were cultured in hypoxia condition, and hypoxia-inducible-factor-1α(HIF-1α) and stem cell markers CD133, Oct-4, Sox-2 were detected by Western blot assay. Cells cultured under hypoxia for 24 h were collected and then co-incubated with 5, 15 and 45 μg/ml HIF-1α@Fe3O4for 24 h. The number of HIF-1α@Fe3O4labeled PANC1 cells and cell survival rate were detected, and the signal intensity of T2WI image for PANC1 cells was measured by a 3.0T MRI system.ResultsIn hypoxia condition, HIF-1α level was obviously increased compared with that of normoxic culture, which was further increased with the increase of hypoxia time(allP<0.05) . Stem-cell markers CD133, Oct-4 and Sox-2 was positively correlated with HIF-1α level. Co-cultured with different concentrations of HIF-1α@Fe3O4for 24 h, blue-stained iron particles in cytoplasm of PANC1 cells was dosage-dependently increased, and the peak was at the concentration of 45 μg/ml, which could reach 100%. The survival rate of the PANC1 cells cultured in normoxic condition, the unlabeled and labeled in hypoxic condition group were(87.0±2.1)%, (84.7±2.7)% and (85±3.8)%, respectively, and the difference was not statistically significant(P>0.05). In 3.0T MRI scan, T2WI signal intensity in unlabeled group and 5, 15 and 45 μg/ml labeled group was 1.017±0.046, 0.793±0.041, 0.447±0.032 and 0.240±0.031, and the difference was not statistically significant(F=80.0,P>0.05).ConclusionsHypoxia condition could promote and maintain the stemness in PANC1 cells. HIF-1α@Fe3O4probe could successfully label HIF-1α highly expressed PANC1 cells during hypoxia condition, and a significant decrease in T2WI signal intensity can be detected by a 3.0T MRI system.
Pancreatic neoplasms; Hypoxia-inducible factor1, aipha submit; Neoplastic stem cell; Magnetic resonance imaging
10.3760/cma.j.issn.1674-1935.2017.05.009
210009 南京,江苏省肿瘤医院影像科(谢晓东、张磊、李丹、沈文荣);江苏大学附属医院影像科(王冬青、宋廉)
沈文荣,Email: jszlyyct@sohu.com
江苏省肿瘤医院院级课题(ZN201611);江苏省社会发展项目(BE2015668)
2017-03-12)
