CT纹理分析在量化胰腺囊腺瘤影像表型中的诊断价值
2017-11-08胡征宇沈起钧冯湛张亮万国仕陈足廷胡晓杰罗超群赵奋华
胡征宇 沈起钧 冯湛 张亮 万国仕 陈足廷 胡晓杰 罗超群 赵奋华
CT纹理分析在量化胰腺囊腺瘤影像表型中的诊断价值
胡征宇 沈起钧 冯湛 张亮 万国仕 陈足廷 胡晓杰 罗超群 赵奋华
目的通过CT纹理分析量化胰腺囊腺瘤特殊的影像纹理,为胰腺囊性肿瘤的鉴别诊断提供客观的影像学依据。方法回顾性分析2009年1月至2016年12月间浙江大学附属第一医院放射科及杭州市第一人民医院放射科经病理证实的胰腺浆液性囊腺瘤48例和黏液性囊性肿瘤34例患者的胰腺增强CT图像。在增强CT扫描实质期5个断层图上根据肿瘤边界描画出感兴趣区域。从纹理细腻(σ=1.0)到纹理粗糙(σ=2.5)获得平均灰度强度、像素分布的方差、熵值、偏度和峰度等参数。对有统计学意义的纹理参数绘制受试者操作特征(ROC)曲线,计算ROC曲线下面积(AUC)及诊断敏感性、特异性。对高、低年资医师用传统CT征象分析方法诊断的准确性进行比较。结果2名放射科医师间测量信度系数为0.809~0.997,一致性非常高。与黏液性囊性肿瘤比较,浆液性囊腺瘤不同滤值时的偏度、滤值为2.5时的方差(5.93±9.02比1.29±0.62)、熵值(2.39±0.61比2.02±0.39)、峰度(30.18±42.55比8.80±4.34)差异均有统计学意义(P值均<0.05),而其他值之间的差异均无统计学意义。有差异的参数诊断两类囊性肿瘤的AUC介于0.56~0.84之间。低年资医师和高年资医师用传统CT征象分析方法诊断的准确性分别为60%和71%。结论CT纹理分析不仅能有效地量化胰腺囊腺瘤的异质性,而且在鉴别诊断中也能发挥有效的作用。
胰腺; 囊腺瘤,浆液; 囊腺瘤,黏液; 图像处理,计算机辅助; 体层摄影术,螺旋计算机
Fundprogram:Zhejiang Provincial Medical Science and Technology Research Fund(2017KY051);Hangzhou Agricultural and Social Development Research Project(164519)
CT纹理分析是一种评估医学图像中病变异质性的工具,通过将CT图像中抽象纹理结构特征进行量化与标准化,发现人们肉眼所不能发现的图像细节信息。这种定量技术不仅能预测患者的疗效和预后[1-2],而且还应用于鉴别肿瘤的类型[3-5]。胰腺囊腺瘤分为浆液性和黏液性两种。浆液性囊腺瘤是胰腺的良性肿瘤,仅在有症状时才进行手术切除[6-7],而黏液性囊腺瘤则不同,具有潜在恶性特征,即使没有症状也应手术切除[8]。传统的CT定量分析[9-10]并不能对两者的鉴别诊断提供可靠的客观依据,主要依靠影像科医师长期阅片形成的主观性、经验性信息。本研究通过CT纹理分析方法以客观量化胰腺囊腺瘤特殊的影像纹理,为胰腺囊性肿瘤的鉴别提供一种非侵入性的影像学定量标准。
资料与方法
一、一般资料
回顾性分析2009年1月至2016年12月间浙江大学附属第一医院放射科和杭州市第一人民医院放射科经手术病理证实的胰腺浆液性囊腺瘤48例和黏液性囊性肿瘤34例患者的胰腺对比增强CT数据。纳入标准:(1)所有患者术前在同一CT机上使用同一扫描序列行胰腺增强三期CT扫描,包括平扫、实质期和门静脉期;(2)病灶在CT轴位图像上至少能显示7个层面;(3)所有手术切除标本、经皮穿刺或超声内镜细针穿刺抽吸物均经细胞学或病理学检查证实;(4)CT扫描前未行放、化疗等治疗。排除标准:碘对比剂过敏或肾功能严重不全者。
48例浆液性囊腺瘤中男性9例,女性39例,年龄30~80岁,平均(54±12)岁,肿瘤最大横径2.3~10.5 cm,平均(4.1±9. 9)cm;34例黏液性囊性肿瘤中男性4例,女性30例,年龄29~69,平均(46±11)岁,肿瘤最大横径2.5~11.5 cm,平均(4.4±1.6)cm。患者症状包括腹痛、腹胀、上腹不适等,部分患者无明显症状。本研究通过医院伦理委员会批准,患者或家属均签署知情同意书。
二、影像学检查方法
采用东芝16层螺旋CT或西门子16层螺旋CT(管电压120 kV,管电流150~350 mA)以胰腺标准扫描方案采集图像。扫描方案:平扫,扫描范围从膈顶至髂嵴,层厚5 mm;实质期(动脉晚期),延迟35 s,扫描范围从腹腔干上方1 cm至十二指肠第3段,若平扫图像肿瘤上下径超过此范围,需扩大范围扫描,包含整个肿瘤,层厚3 mm;门静脉期,延迟60 s,扫描范围同平扫,层厚5 mm。使用非离子型对比剂(欧乃派克或优维显,碘含量350或370 mg/ml)经外周静脉注入,注射速率为3~5 ml/s,剂量为80~100 ml。扫描前采用清水(750~1 000 ml)作为口服对比剂充盈胃腔和十二指肠腔。
三、影像分析
由1名低年资放射科住院医师和1名具有15年以上腹部CT诊断经验的放射科副主任医师分别采用双盲法进行阅片。取实质期5个层面图像,以肿瘤最大径层面为中心层面,再上下各取连续2个层面。手动勾画病灶的边界作为感兴趣区(region of interest,ROI),提取ROI内数据行CT纹理分析(图1、2)。同时根据传统CT征象分析方法进行诊断。

图1 胰腺黏液性囊性肿瘤的实质期细腻过滤(1A)和粗糙过滤(1B)CT图
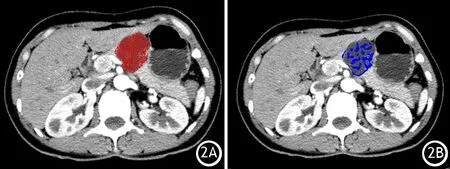
图2 胰腺浆液性囊性肿瘤的实质期细腻过滤(2A)和粗糙过滤(2B)CT图
四、纹理分析
纹理分析的数据处理基于MATLAB(版本号R2013b),步骤与计算方法与已发表的部分CT纹理分析研究基本一致[1-5]。纹理分析包括过滤原始图像和过滤后图像纹理的量化两个过程。图像滤波使用高斯拉普拉斯算子的带通滤波器,通过在1.0~2.5范围内改变滤值(σ)来选择不同的空间域范围,滤值为1.0表示纹理细腻(过滤器宽度为4像素或1.2 mm),滤值为2.5表示纹理粗糙(过滤器宽度为12像素或3.6 mm)。经过纹理和直方图算法分析ROI内平均灰度强度、像素分布的方差、熵值、偏度和峰度等参数,每个参数测量3次,取均值。
五、统计学处理
使用R语言进行统计学分析。应用组内相关系数(intra-class correlation coefficient, ICC)评估两名放射科医师间各自测量的肿瘤ROI各项参数,观察者间信度系数<0.4表示信度较差,>0.75表示信度良好,0.4~0.75之间表示信度中等;两组囊腺瘤的纹理参数使用双样本t检验比较,P<0.05为差异有统计学意义。对有统计学意义的参数再绘制受试者工作特征(ROC)曲线,计算ROC曲线下面积(AUC),确定诊断临界值及鉴别诊断胰腺囊腺瘤的敏感性和特异性。同时采用约登指数对2名医师传统的CT征象分析方法诊断的准确性进行比较。
结 果
一、两名医师测量可信度比较
2名放射科医师间测量信度系数为0.809~0.997,一致性非常高(表1)。
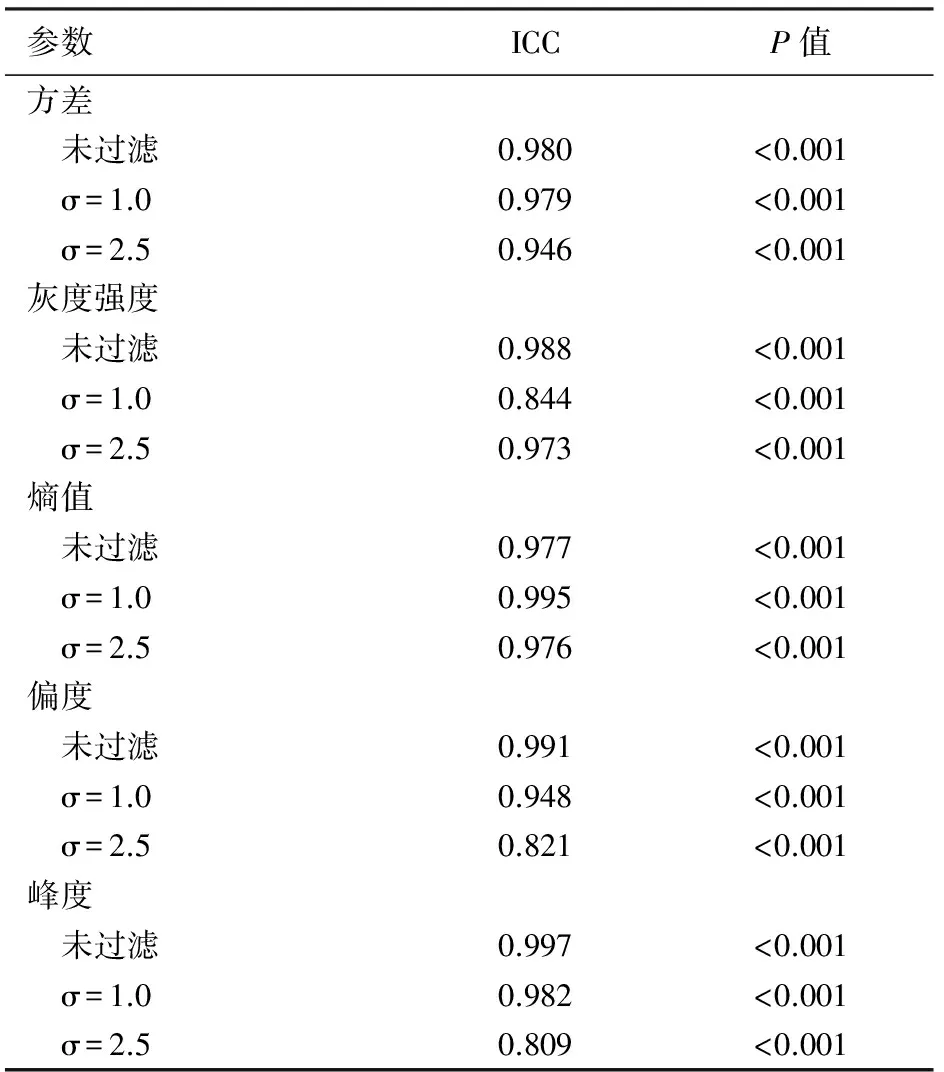
表1 低年资医师与高年资医师测量的纹理参数比较
二、浆液性囊腺瘤与黏液性囊性肿瘤的CT纹理参数比较及其诊断效能
浆液性囊腺瘤与黏液性囊性肿瘤在不同滤波滤值下测量的纹理参数见表2。两类胰腺囊性肿瘤间未过滤及滤值为1.0、2.5时的偏度,滤值为2.5时的方差、熵值、峰度的差异均有统计学意义(P值均<0.05),而其他值之间的差异均无统计学意义。上述具有统计学意义的6个纹理参数的AUC介于0.56~0.84之间,滤值为2.5时熵值的敏感性最高,方差的特异性最高(表3)。
三、不同年资的医师用传统CT征象分析方法诊断的准确性比较
低年资医师诊断的约登指数、敏感性、特异性、准确性分别为0.18、58%、60%、60%;高年资医师分别为0.44、68%、76%、71%。
讨 论
既往对胰腺囊腺瘤的定量与半定量指标的研究结果不完全一致,甚至存在矛盾。Choi等[11]认为黏液性囊性肿瘤最大囊腔直径一般>2 cm,但Cohen-Scali等[12]认为仅凭最大囊直径很难作出鉴别诊断。Manfredi等[13]报道浆液性囊腺瘤和黏液性囊性肿瘤囊壁厚度平均值分别为2 mm和4 mm,事实上如此纤薄的囊壁非常容易受到容积效应和测量者误差的影响。此外,病灶中心的星状瘢痕及瘢痕钙化被认为是浆液性囊腺瘤的特异性表现[14],但该征象发生率仅20%左右[6],诊断价值有限。Shah等[15]、Bassi等[16]的研究认为,胰腺囊性病灶囊壁的厚薄、囊壁的强化、病灶形态、病灶内分隔及钙化灶的存在等无鉴别诊断价值,所以,需联合多个相关指标才能提高诊断率。另外, CT图像上明显的异质性常常融入了光子的噪声,掩盖任何潜在的生物学上的不均匀性[17],而LoG滤波能放大图像特征并减少光子噪声的影响,从而提高评估和量化病灶异质性的能力,因此CT纹理分析可提供更为真实反映病灶整体特征的定量参数。
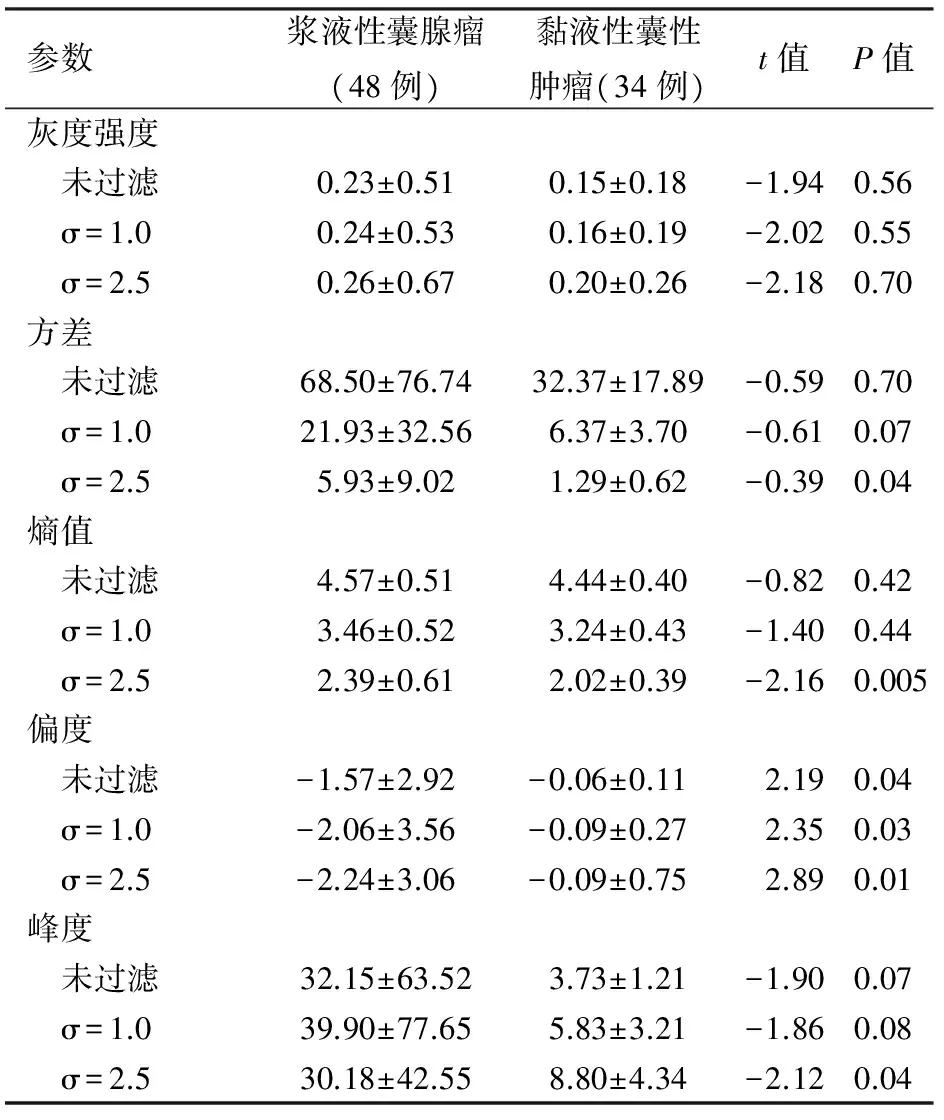
参数浆液性囊腺瘤(48例)黏液性囊性肿瘤(34例)t值P值灰度强度 未过滤0.23±0.510.15±0.18-1.940.56 σ=1.00.24±0.530.16±0.19-2.020.55 σ=2.50.26±0.670.20±0.26-2.180.70方差 未过滤68.50±76.7432.37±17.89-0.590.70 σ=1.021.93±32.566.37±3.70-0.610.07 σ=2.55.93±9.021.29±0.62-0.390.04熵值 未过滤4.57±0.514.44±0.40-0.820.42 σ=1.03.46±0.523.24±0.43-1.400.44 σ=2.52.39±0.612.02±0.39-2.160.005偏度 未过滤-1.57±2.92-0.06±0.112.190.04 σ=1.0-2.06±3.56-0.09±0.272.350.03 σ=2.5-2.24±3.06-0.09±0.752.890.01峰度 未过滤32.15±63.523.73±1.21-1.900.07 σ=1.039.90±77.655.83±3.21-1.860.08 σ=2.530.18±42.558.80±4.34-2.120.04
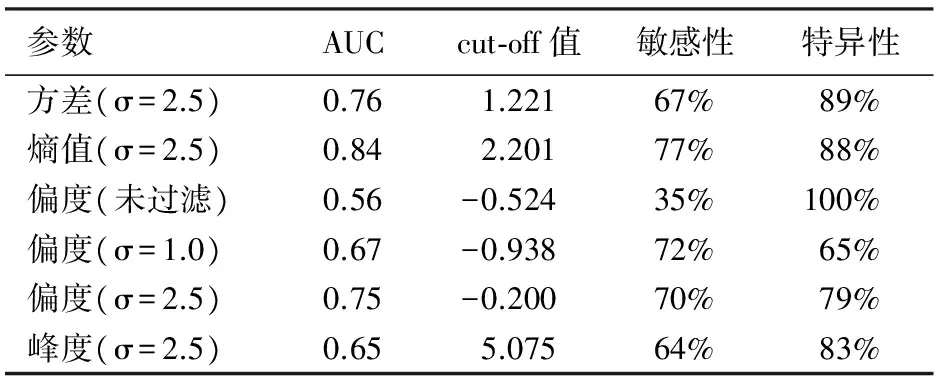
表3 不同滤值时的6个参数诊断胰腺囊腺瘤的效能
本研究结果表明,CT纹理分析能客观量化胰腺囊腺瘤的纹理特征,滤波后的方差、熵值、偏度以及峰度能较好地反映囊腺瘤的整体特征。熵值是纹理不规则度及混乱度的量化指标[1],与黏液性囊性肿瘤相比,浆液性囊腺瘤显示为更高的熵值,提示浆液性囊腺瘤具有更大的异质性。其原因可能是浆液性囊腺瘤在影像上均表现为大小不等的多发囊腔影,且数量众多,囊内可见中央瘢痕样结构以及分隔,含丰富的血管组织,因而在增强CT图像上肿瘤间质表现为中等至明显强化,且纹理特征的异质性大。黏液性囊性肿瘤通常表现为单发大囊或虽为多囊但囊腔数量远少于浆液性囊腺瘤,其间质的血供也不如后者,因此纹理特征表现较为简单,熵值也较低。方差也是与异质性呈正相关的量化指标[18-19],浆液性肿瘤的方差明显大于黏液性肿瘤。同样,异质性更大的浆液性肿瘤在直方图上亦具有更大的不对称性和更高的峰值。本研究结果显示,灰度平均值对两类肿瘤的鉴别差异无统计学意义,与既往研究中的平均CT衰减值意义相同,即使进行了滤波处理,灰度平均值仍然无太大的鉴别意义。
通过对有统计意义参数的效能分析,在粗糙纹理下测得的方差、熵值和偏度对鉴别胰腺囊腺瘤有较好的诊断效能,且对于同一参数,如偏度,随着粗糙度的增加,光子噪声的影响减小,反映感兴趣区域的真实异质性的能力增强,明显提高了诊断准确性。而经滤波器放大图像特征后,原本在未过滤图像或细腻滤波后图像中无统计学意义的参数出现了显著差异,如方差、熵值和峰度,说明在不同滤波下纹理分析的优势所在。因本研究病例中含有个别实型和寡囊型浆液性囊腺瘤,因此给结果带来一定的影响。
尽管传统CT的定性和定量方法在一定程度上已经能大部分满足临床的需要,但是如果能深层次挖掘医学图像中的更为客观的定量指标并得以验证,可以为影像的标准化诊断添加更为有效的信息。本研究通过与传统CT征象分析方法的比较,显示CT纹理分析的诊断准确性丝毫不亚于前者,甚至在某些参数如粗糙纹理下的方差、熵值和偏度方面具有更高的诊断效能。然而低、高年资医师由于诊断经验不同,用传统CT定量方法得出的诊断准确性差异非常大,而纹理分析方法无需丰富的临床经验,只需医师描画出肿瘤边界,半自动化地分析肿瘤影像,就能够出色地完成“放射组学”中特征提取与量化的核心任务,避免了其他经验性的影像指标的判读。
本研究亦存在一些不足之处,本研究为回顾性,样本量不够大,存在固有的局限性和无法预测性;研究只采用了两组滤波数据,从结果来看,粗糙纹理分析的效果更好。是否增加其他滤波组及其他纹理参数来获取更有效的数据有待于进一步研究;尽管测量数据时已尽可能排除容积效应的干扰,但在描画肿瘤边界时仍无法完全避免。因此,有待更多的对比研究进行验证。
[1] Rao SX, Lambregts DM, Schnerr RS, et al. Whole-liver CT texture analysis in colorectal cancer: Does the presence of liver metastases affect the texture of the remaining liver?[J]. United European Gastroenterol J, 2014, 2(6): 530-538.DOI:10.1177/2050640614552463.
[2] Ganeshan B, Goh V, Mandeville HC, et al. Non-small cell lung cancer: histopathologic correlates for texture parameters at CT[J]. Radiology, 2013, 266(1): 326-336. DOI:10.1148/radiol.12112428.
[3] Ba-Ssalamah A, Muin D, Schernthaner R, et al. Texture-based classification of different gastric tumors at contrast-enhanced CT[J]. Eur J Radiol, 2013, 82(10): E537-E543. DOI:10.1016/j.ejrad.2013.06.024.
[4] Huang YL, Chen JH, Shen WC. Diagnosis of hepatic tumors with texture analysis in nonenhanced computed tomography images[J]. Acad Radiol, 2006, 13(6): 713-720. DOI:10.1016/j.acra.2005.07.014.
[5] Raman SP, Chen Y, Schroeder JL, et al. CT texture analysis of renal masses: pilot study using random forest classification for prediction of pathology[J]. Acad Radiol, 2014, 21(12): 1587-1596. DOI:10.1016/j.acra.2014.07.023.
[6] Curry CA, Eng J, Horton KM, et al. CT of primary cystic pancreatic neoplasms: can CT be used for patient triage and treatment?[J]. Am J Roentgenol, 2000, 175(1): 99-103. DOI:10.2214/ajr.175.1.1750099.
[7] Lal A, Bourtsos EP, DeFrias DV, et al. Microcystic adenoma of the pancreas: clinical, radiologic, and cytologic features[J]. Cancer, 2004, 102(5): 288-294.
[8] Zamboni G, Scarpa A, Bogina G, et al. Mucinous cystic tumors of the pancreas: clinicopathological features, prognosis, and relationship to other mucinous cystic tumors[J]. Am J Surg Pathol, 1999, 23(4): 410-422.
[9] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026.
[10] Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors. European organization for research and treatment of cancer, national cancer institute of the united states, national cancer institute of Canada[J]. J Natl Cancer Inst, 2000, 92(3): 205-216.
[11] Choi JY, Kim MJ, Lee JY, et al. Typical and atypical manifestations of serous cystadenoma of the pancreas: imaging findings with pathologic correlation[J]. AJR Am J Roentgenol, 2009, 193(1): 136-142. DOI:10.2214/AJR.08.1309.
[12] Cohen-Scali F, Vilgrain V, Brancatelli G, et al. Discrimination of unilocular macrocystic serous cystadenoma from pancreatic pseudocyst and mucinous cystadenoma with CT: initial observations[J]. Radiology, 2003, 228(3): 727-733. DOI:10.1148/radiol.2283020973.
[13] Manfredi R, Ventriglia A, Mantovani W, et al. Mucinous cystic neoplasms and serous cystadenomas arising in the body-tail of the pancreas: MR imaging characterization[J]. Eur Radiol, 2015, 25(4): 940-949. DOI:10.1007/s00330-014-3493-2.
[14] Kim YH, Saini S, Sahani D, et al. Imaging diagnosis of cystic pancreatic lesions: pseudocyst versus nonpseudocyst[J]. Radiographics, 2005, 25(3): 671-685. DOI:10.1148/rg.253045104.
[15] Shah AA, Sainani NI, Kambadakone AR, et al. Predictive value of multi-detector computed tomography for accurate diagnosis of serous cystadenoma: radiologic-pathologic correlation[J]. World J Gastroenterol, 2009, 15(22): 2739-2747.
[16] Bassi C, Salvia R, Molinari E, et al. Management of 100 consecutive cases of pancreatic serous cystadenoma: wait for symptoms and see at imaging or vice versa?[J]. World J Surg, 2003, 27(3): 319-323.DOI:10.1007/s00268-002-6570-7.
[17] Ganeshan B, Miles KA. Quantifying tumour heterogeneity with CT[J]. Cancer Imaging, 2013, 13: 140-149. DOI:10.1102/1470-7330.2013.0015.
[18] Barras CD, Tress BM, Christensen S, et al. Quantitative CT Densitometry for Predicting Intracerebral Hemorrhage Growth[J]. Am J Neuroradiol, 1900, 34(6): 1139-1144.
[19] Connor D, Huynh TJ, Demchuk AM, et al. Swirls and spots: relationship between qualitative and quantitative hematoma heterogeneity, hematoma expansion, and the spot sign[J]. Neurovascular Imaging, 2015, 1(1): 1-8.
(本文编辑:吕芳萍)
DiagnosticvalueofCTtextureanalysisinthequantificationofradiologicalphenotypeforpancreaticcystadenoma
HuZhengyu,ShenQijun,FengZhan,ZhangLiang,WanGuoshi,ChenZuting,HuXiaojie,LuoChaoqun,ZhaoFenhua.
DepartmentofRadiology,SecondPeople′sHospitalofYuhangDistrict,Hangzhou311121,China
Correspondingauthor:ShenQijun,Email:Shenqijun80@163.com
ObjectiveTo provide objective parameters for differentiating pancreatic cystic tumors via using computed tomography texture analysis (CTTA) to quantify the special imaging features of pancreatic cystadenomas.MethodsEnhanced CT images of pancreas from patients who were admitted in Department of Radiology in First Hospital affiliated with Zhejiang University and First People′s Hospital of Hangzhou City and pathologically diagnosed as pancreatic serous cystadenomas (n=48) and mucinous cystadenomas (n=34) from January 2009 to December 2016 were retrospectively analyzed. Regions of interest were drawn on the parenchymal phase CT images in 5 slices according to the border of the tumors. Mean grey level intensity (M), variance (V), entropy (E), skewness (Ske) and kurtosis (Kur) were obtained from fine texture (σ=1.0) to coarse texture (σ=2.5). Receiver operating characteristic (ROC) curve for texture parameters with statistically difference was drawn, and the area under curve (AUC), diagnostic sensitivity and specificity were calculated. The diagnostic accuracy of senior and junior doctors was compared with the traditional CT analysis method.ResultsReliability coefficient of the two radiologists was 0.809~0.997 with high consistency. Compared with mucinous cystic tumors, serous cystadenomas had a significantly different V (5.93±9.02vs1.29±0.62), E (2.39±0.61vs2.02±0.39) and Kur(30.18±42.55vs8.80±4.34) in Ske0 of 2.5 (P<0.05), and there were no statistically significant differences on other parameters. The AUC of differential parameters for diagnosing two kinds of cystic tumors ranged from 0.56 to 0.84.The diagnostic accuracy of the traditional CT analysis method by junior doctor and senior radiologist was 60% and 71%, respectively.ConclusionsCTTA can not only effectively quantify the heterogeneity of pancreatic cystadenomas, but also is effective in the differentiation.
Pancreas; Cystadenoma, serous; Cystadenoma, mucinous; Image processing, computer-assisted; Tomography, spiral computed
10.3760/cma.j.issn.1674-1935.2017.05.010
311121 杭州,余杭区第二人民医院放射科(胡征宇、万国仕、陈足廷、胡晓杰、罗超群);杭州市第一人民医院放射科(沈起钧);浙江大学附属第一医院放射科(冯湛);浙江省肿瘤医院放射科(张亮);东阳市人民医院放射科(赵奋华)
沈起钧,Email:shenqijun80@163.com
浙江省医药卫生科技科研基金项目(2017KY051);杭州市农业与社会发展科研项目(164519)
2017-04-05)
