瑞舒伐他汀钙在脑梗死患者治疗中的应用价值
2017-11-07岳现化周锦豹
岳现化, 唐 怡, 周锦豹
(陕西省延安市志丹县人民医院 神经内科, 陕西 志丹, 717500)
瑞舒伐他汀钙在脑梗死患者治疗中的应用价值
岳现化, 唐 怡, 周锦豹
(陕西省延安市志丹县人民医院 神经内科, 陕西 志丹, 717500)
瑞舒伐他汀钙; 脑梗死; 超敏C反应蛋白; 动脉粥样硬化; 血脂; 颈动脉内膜
目前,中国脑梗死的发病率和致死率均较高[1]。大量的研究结果[2-3]显示,炎症反应、高脂血症以及颈动脉粥样硬化等在脑梗死的发生发展过程中发挥着重要作用。动脉粥样硬化(AS)是脑梗死的基础病变。超敏C反应蛋白(hs-CRP)是炎症反应的一个重要指标,同时也是心脑血管疾病患者的一个重要危险因子[4]。他汀类药物不仅可以降低低密度脂蛋白胆固醇(LDL-C)水平,还有降低炎症反应、稳定AS斑块、保护内皮细胞等作用[5]。本研究对脑梗死患者采用瑞舒伐他汀钙进行治疗,探析其对患者血清hs-CRP、血脂以及AS的影响,现报告如下。
1 资料与方法
1.1 一般资料
前瞻性分析2014年2月—2015年1月在本院接受治疗的78例脑梗死患者的临床资料,本研究方案经本院医学伦理委员会审核通过,患者均知情同意并签署知情同意书,其中4例患者为脱落病例。入选者均符合全国脑血管疾病会议于1995年修订的相关诊断标准[6], 其中女33例,男41例,平均年龄(67.1±11.9)岁。入组标准: ① 血清磷酸肌酸酶(CPK)≤正常值上限3倍; ② 血清谷丙转氨酶(ALT)及谷草转氨酶(AST)≤正常值上限1.5倍; ③ 耐受他汀类药物。排除标准: ① 合并严重消化道疾病以及心、肝、肾等疾病患者; ②自身免疫性疾病以及脑部转移性肿瘤患者; ③ 脑栓塞患者。脱落标准: 因个人或家庭原因主动退出研究的患者。
1.2 研究方法
受试者入院后接受脑保护、活血化瘀、抗氧自由基、抗血小板以及脱水缓解脑水肿等一系列治疗,持续口服10 mg/d瑞舒伐他汀钙(英国阿斯利康分包装,国药准字: J20120006)6个月。
在入院第2天的清晨、治疗后1周及6个月时分别抽取患者空腹静脉血,并及时将血清分离,采用BECKMANLX20全自动生化分析仪(Beckman公司,美国)检测血清hs-CRP、高密度质蛋白胆固醇(HDL-C)、LDL-C、甘油三酯(TG)以及总胆固醇(TC)的水平,比较各指标治疗前后水平的变化情况。
采用多普勒超声检查受试者的颈动脉内膜中层厚度(IMA),详细记录受试者治疗前、后各指标水平变化情况。患者接受检查时取仰卧位,其头部偏向对侧的45°, 将颈总动脉分叉处附近1~2 cm处作为本次测量部位。IMT评价标准: 参照第2届血管和浅表器官国际超声研讨会议上所制定的颈动脉狭窄标准作为IMT评价标准,即IMT低于1.0 mm为正常; 1.0~1.5 mm为IMT增厚; 局限性IMT至少为1.5 mm为颈动脉粥样斑块形成。
1.3 统计学方法
本研究中的数据均采用SPSS 19.0软件进行分析。数据计量以均数±标准差形式表示,比较采用t检验和卡方(χ2)检验。P<0.05为差异有统计学意义。
2 结 果
脑梗死患者治疗后1周时血清hs-CRP水平显著降低(P<0.05), 治疗后6个月时LDL-C、TG以及TC水平显著降低, HDL-C显著上升(P<0.05)。见表1。治疗前,脑梗死患者左侧和右侧IMT分别为(1.11±0.19)、(1.15±0.22) mm, 治疗后6个月IMT分别为(0.82±0.09)、(0.89±0.18) mm, 均较治疗前显著降低(P<0.01)。患者治疗后无不良反应。
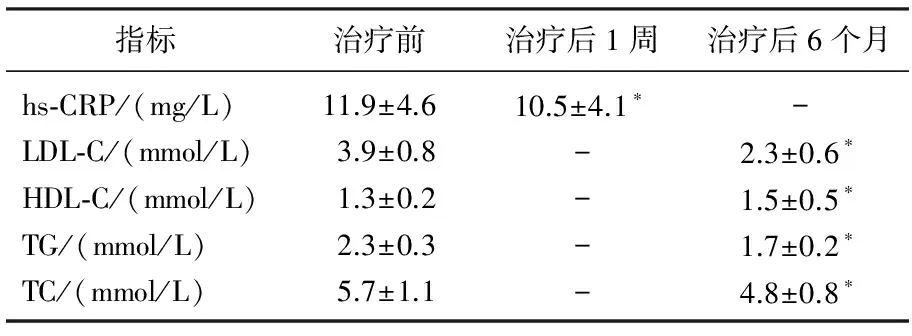
表1 治疗前后血清hs-CRP与血脂各指标水平变化的比较
与治疗前相比, *P<0.05。
3 讨 论
缺血性脑卒中是脑血管疾病中最为常见的一种,根据其危险因素的不同可以分为可干预性(颈动脉狭窄、高血压、血脂异常等)与不可干预性(遗传、种族、性别及年龄等)两种[7]。他汀类药物不仅具有调脂作用,还有改善血管内皮功能、抑制炎症反应以及抗动脉粥样硬化等作用[8]。
急性脑梗死患者由于脑组织受损而导致急性炎症反应,体内血清hs-CRP浓度急剧上升,受损程度加重,从而导致炎症反应更加剧烈[9]。hs-CRP属于急性炎症反应时相蛋白,正常人体内其浓度极低,其浓度一般在组织受损或炎症反应发生后的6~8 h时开始上升,而在7~12 d后慢慢恢复正常[10]。急性脑梗死发作时,脑组织受损导致急性炎症反应出现,受损严重程度随着血清hs-CRP浓度的上升而加重[11]。据报道[12], hs-CRP水平在脑梗死的发生发展过程中扮演了重要的角色。hs-CRP表达水平的上升尤其是持续上升的患者,其预后往往较差,致死率较高,同时功能恢复能力也较差。本实验发现,治疗后1周时脑梗死患者的血清hs-CRP水平显著降低(P<0.05), 说明10 mg/d的瑞舒伐他汀钙在一定程度上抑制了脑梗死患者的急性期炎症反应。
动脉粥样硬化(AS)是脑梗死发生的一个重要病因,而高脂血症又是AS的一个重要危险因子[13]。LDL-C是AS发生过程的一个重要血脂成分和独立危险因子,AS的发生过程最早开始于LDL-C于内膜下的堆积,T淋巴细胞和单核细胞的募集以及内皮细胞的激活,增进了炎症反应的发生; 单核细胞进一步分化为巨噬细胞,将经修饰的脂蛋白吞噬,最终形成泡沫细胞; AS斑块中T细胞将该区域内的抗原识别出,进而使Th1反应上调,对局部炎症反应的发生起到了诱导的作用,增大斑块; 炎症反应的激活导致了局部蛋白质的水解、管腔闭塞或者血栓形成以及斑块破裂,故LDL-C是引发AS的根本原因[14-15]。本实验发现,连续服用瑞舒伐他汀钙6个月后,脑梗死患者的LDL-C显著降低, HDL-C水平明显上升, TG以及TC水平明显下降,说明瑞舒伐他汀钙的调脂作用显著。
颈动脉内膜中层厚度(IMA)增厚是早期AS的有效预测指标[16]。大量研究资料结果[17]显示,颈动脉硬化导致脑梗死发作的病理机制主要有以下几个方面: 颈动脉狭窄降低了远端的灌注压,致使分水岭区无法及时供血,导致低灌注性梗死或边缘带梗死; 未破裂或破裂的AS斑块表面高低不一,凝血因子和血小板被激活,从而形成血栓; 不稳定斑块的破裂将远端的血管栓死; AS斑块持续增大导致血管堵塞。他汀类药物抗AS作用不仅可以直接作用于血脂,还能通过以下几个方面稳定斑块: ① 可以剂量依赖性地对平滑肌细胞的增殖和迁移进行抑制; ② 直接对血管平滑肌细胞的迁移和增殖进行抑制,对细胞凋亡过程进行诱导,进而延缓AS的发生和发展; ③ 使血中LDL水平下降,使斑块内脂核缩小,降低了斑块表面的张力,使内皮细胞增加,进一步使斑块纤维帽加固[18-19]。本实验发现,脑梗死患者连续6个月口服瑞舒伐他汀钙后,其IMT值显著降低,说明其抗AS作用良好。
他汀类药物是目前应用较为广泛的具有降血脂作用的一类药物[20-23]。尽管其他降脂药物也能使LDL-C降低,但是仅他汀类药物能降低卒中初发和再发。瑞舒伐他汀钙是近期上市的他汀类药物,有着较强的低亲脂性和肝脏选择性,其通过对细胞中信号转导的抑制作用来使C反应蛋白(CRP)表达降低,显著缓解内皮功能,保护内皮细胞,稳定且逆转AS斑块[24-26]。据报道[27-28],瑞舒伐他汀钙可以显著升高HDL-C的表达水平,同时降低TG和LDL-C的表达水平,进而逆转AS,其安全性良好。本实验未发现10 mg/d瑞舒伐他汀钙所致的显著不良反应,说明瑞舒伐他汀钙的安全性较为可靠。
[1] 张金臣. 瑞舒伐他汀钙对脑梗死患者血脂、超敏C-反应蛋白水平的影响[J]. 实用临床医药杂志, 2011, 15(11): 93-95.
[2] Wang S S, Hu S W, Zhang Q H, et al. Mesenchymal Stem Cells Stabilize Atherosclerotic Vulnerable Plaque by Anti-Inflammatory Properties[J]. PLoS One, 2015, 10(8): e0136026-34.
[3] 黄红波, 刘庚勋, 李正贤. 老年脑梗死患者颈动脉粥样硬化斑块与血脂变化的研究[J]. 湖南师范大学学报: 医学版, 2011, 08(3): 48-51.
[4] Zhang J Y, Liu B, Wang Y N, et al. Effect of rosuvastatin on OX40L and PPAR-gamma expression in human umbilical vein endothelial cells and atherosclerotic cerebral infarction patients[J]. J Mol Neurosci, 2014, 52(2): 261-8.
[5] Trivedi H K, Patel M C. Development and Validation of a Stability-Indicating RP-UPLC Method for Determination of Rosuvastatin and Related Substances in Pharmaceutical Dosage Form[J]. Sci Pharm, 2012, 80(2): 393-9.
[6] MacDonald G P. Cost-effectiveness of rosuvastatin for primary prevention of cardiovascular events according to Framingham Risk Score in patients with elevated C-reactive protein[J]. J Am Osteopath Assoc, 2010, 110(8): 427-433.
[7] Liu H, Huang X Q, Yang M, et al. MRAS Genetic Variation Is Associated with Atherothrombotic Stroke in the Han Chinese Population[J]. J Clin Neurol, 2013, 9(4): 223-228.
[8] Xu P, Lv L, Li S, et al. Use of high-resolution 3. 0-T magnetic resonance imaging to characterize atherosclerotic plaques in patients with cerebral infarction[J]. Exp Ther Med, 2015, 10(6): 2424-9.
[9] Nozue T, Fukui K, Yamamoto S, et al. C-reactive protein and future cardiovascular events in statin-treated patients with angina pectoris: the extended TRUTH study[J]. J Atheroscler Thromb, 2013, 20(9): 717-23.
[10] Yano Y, Hoshide S, Etoh T, et al. Synergistic effect of chronic kidney disease and high circulatory norepinephrine level on stroke risk in Japanese hypertensive patients[J]. Atherosclerosis, 2011, 219(1): 273-9.
[11] Patel Z B, Patel K S, Shah A S, et al. Preparation and optimization of microemulsion of rosuvastatin calcium[J]. J Pharm Bioallied Sci, 2012, 4(Suppl 1): S118-124.
[12] Kim J, Song T J, Yang S H, et al. Plasma osteoprotegerin levels increase with the severity of cerebral artery atherosclerosis[J]. Clin Biochem, 2013, 46(12): 1036-41.
[13] Li H, Yu Y. Association between ischemic stroke and migraine in elderly Chinese: a case-control study[J]. BMC Geriatr, 2013, 13: 126-33.
[14] Kim S H, Lee J W, Im J A, et al. Monocyte chemoattractant protein-1 is related to metabolic syndrome and homocysteine in subjects without clinically significant atherosclerotic cardiovascular disease[J]. Scand J Clin Lab Invest, 2011, 71(1): 1-9.
[15] Jin H, Sun W, Sun Y, et al. Report of cold agglutinins in a patient with acute ischemic stroke[J]. BMC Neurol, 2015, 15: 222-229.
[16] Luo S, Wang F, Li Z, et al. Effect of the +781C/T polymorphism in the interleukin-8 gene on atherosclerotic cerebral infarction, and its interaction with smoking and drinking[J]. PLoS One, 2013, 8(11): e80246-53.
[17] Li R Y, Cao Z G, Zhang J R, et al. Decreased serum bilirubin is associated with silent cerebral infarction[J]. Arterioscler Thromb Vasc Biol, 2014, 34(4): 946-52.
[18] Alzoman N Z, Sultan M A, Maher H M, et al. Analytical study for the charge-transfer complexes of rosuvastatin calcium with pi-acceptors[J]. Molecules, 2013, 18(7): 7711-9.
[19] Ashour S, Omar S. Validated high-performance liquid chromatographic method for the estimation of rosuvastatin calcium in bulk and pharmaceutical formulations[J]. Int J Biomed Sci, 2011, 7(4): 283-8.
[20] Konya H, Miuchi M, Satani K, et al. Hepatocyte growth factor, a biomarker of macroangiopathy in diabetes mellitus[J]. World J Diabetes, 2014, 5(5): 678-683.
[21] Ojha R, Huang D, An H, et al. Distribution of ischemic infarction and stenosis of intra- and extracranial arteries in young Chinese patients with ischemic stroke[J]. BMC Cardiovasc Disord, 2015, 15(1): 158-164.
[22] Kaila H O, Ambasana M A, Thakkar R S, et al. A New Improved RP-HPLC Method for Assay of Rosuvastatin Calcium in Tablets[J]. Indian J Pharm Sci, 2010, 72(5): 592-8.
[23] Pena J M, Aspberg S, MacFadyen J, et al. Statin therapy and risk of fracture: results from the JUPITER randomized clinical trial[J]. JAMA Intern Med, 2015, 175(2): 171-7.
[24] 刘娟, 张波, 孙晓莉, 等. 氨氯地平联合瑞舒伐他汀钙对老年急性脑梗死合并高血压患者CRP及D-二聚体的影响[J]. 实用临床医药杂志, 2016, 20(23): 9-12.
[25] 戴毅, 吴玉泉, 胡金华. 瑞舒伐他汀钙对急性脑梗死患者血脂和血清超敏C反应蛋白的影响[J]. 中华全科医学, 2015, 13(6): 924-925.
[26] 吴俊丽, 黄卫. 强化血脂对急性脑梗死及TOAST各型患者的影响[J]. 黑龙江医药科学, 2016, 39(4): 42-44.
[27] 周建华, 陈一峰. 瑞舒伐他汀钙对急性脑梗死患者血脂和血清炎症因子的影响[J]. 实用临床医药杂志, 2013, 17(17): 89-90.
[28] 柯莉, 高丹, 陈秋霞, 等. 急性脑梗死患者血浆巯基丙酮酸硫基转移酶及β-淀粉样蛋白42的水平及其临床意义[J]. 第三军医大学学报, 2016, 38(7): 743-746.
R 743
A
1672-2353(2017)19-165-03
10.7619/jcmp.201719057
2017-03-28
陕西省科技厅社会公关计划(2012K15-02-12)
