萘降解菌的分离鉴定、生长特性和降解途径探究*
2017-11-07王若宇任龙飞邵嘉慧张小凡
朱 星 王若宇 汪 锐 白 雪 任龙飞 邵嘉慧 张小凡
(上海交通大学环境科学与工程学院,上海 200240)
萘降解菌的分离鉴定、生长特性和降解途径探究*
朱 星 王若宇 汪 锐 白 雪 任龙飞 邵嘉慧 张小凡#
(上海交通大学环境科学与工程学院,上海 200240)
从天津大港油田附近污染土壤中分离出1株萘降解菌株DGN9,经形态学和16SrDNA测序鉴定,该菌株属于无色杆菌(Achromobactersp.)。其最适生长温度为30 ℃,最适pH为7,最适萘初始质量浓度为1 000mg/L,在NaCl质量分数为1%、2%的条件下生长良好,具有一定的耐盐性。其对萘的可能降解途径为水杨酸降解途径。同时,该菌株对蒽、菲、芘、联苯、对苯二甲酸、邻苯二酚、苯酚、苯甲酸钠、水杨酸、邻苯二甲酸等底物也有降解作用,具有底物生长广谱性。
萘 无色杆菌属 生长特性 降解途径
多环芳烃(PAHs)是指两个或两个以上苯环以线状、角状或簇状排列的稠环有机化合物[1-2],由于疏水性和稳定性使其容易在人体内富集,具有致癌、致畸和致突变效应,是一类普遍存在于环境中的对生态环境和人体健康具有严重危害的难降解污染物[3]。1976年,美国环境保护署(USEPA)就已将16种PAHs列为优先控制的有机污染物[4]。随着研究的进步,越来越多的PAHs被发现,因此寻求高效、经济、环保的PAHs去除方法显得越来越重要。
目前,去除污水中PAHs的方法有物理、化学和生物方法[5]。物理方法因不能彻底降解PAHs,已逐渐被研究人员放弃;化学方法虽然能有效降解PAHs,但同时存在二次污染和高能耗等问题。利用微生物降解PAHs的生物方法具有经济、高效、二次污染少等优势,因此成为了去除污水中PAHs的理想方法。大量研究发现并分离了能以PAHs为碳源进行降解的微生物[6]。萘是PAHs中结构最简单、分子量最小的一种化合物,一直是研究PAHs降解的典型。已报道的萘降解菌很多,主要有反硝化产碱菌(Alcaligenesdenitrificans)、分支杆菌(Mycobacteriumsp.)、恶臭假单胞菌 (Pseudomonasputida)、泡馕假单胞菌(Pseudomonasvesicularis)、荧光假单胞菌(Pseudomonasfluorescens)、红球菌(Rhodococcussp.)和莫拉氏菌(Moraxellasp.)等[7-8]。这些萘降解菌株对盐度要求比较苛刻,关于耐盐性萘降解菌的分离研究还比较少。辛树权等[9]筛选出了一株可在NaCl质量浓度为3 g/L的条件下良好生长的萘降解菌。饶丽[10]发现的萘降解菌可在2%(质量分数)NaCl下良好生长。
无色杆菌(Achromobactersp.)是已知的可用于降解多种难降解污染物的微生物,如石油、苯酚、氯酚和苯甲酸等。唐玉斌等[11]发现,木糖氧化无色杆菌可以降解蒽、菲、芘、4种PAHs,具有生长底物广谱性。李妮等[12]从孔雀绿污染土壤中分离出1株无色杆菌,发现其还可高效脱除孔雀绿。目前,关于无色杆菌降解萘的研究不多。因此,探究无色菌株对萘的降解途径及其广谱性和耐盐性对理解无色杆菌降解PAHs具有一定的指导意义。本研究从天津大港油田附近污染土壤中分离出1株萘降解菌,对其进行形态学观察和16S rDNA测序分析,探究其最佳生长条件,并在最佳条件下对萘的降解途径进行了研究,同时对其广谱性和耐盐性进行了讨论。
1 材料和方法
1.1 材 料
1.1.1 土 样
土样取自天津大港油田附近(38°43′48″N、117°30′36″E),该处土壤长期受石油污染,采集深度为5~10 cm,采集到的土样放入塑封袋中,密封,置于4 ℃冰箱保存。
1.1.2 培养基
无机盐液体培养基[13]:Na2HPO42.2 g、KH2PO40.8 g、(NH4)2SO44.95 g、MgSO4·7H2O 0.2 g、FeSO4·7H2O 10 mg、CaCl2·2H2O 10 mg、酵母粉 50 mg、矿物液10 mL,H2O 1 000 mL。其中,每100 mL矿物液中含ZnSO4·7H2O 50 mg、MnSO4·5H2O 50 mg、Na2MoO4·2H2O 10 mg、CuSO4·5H2O 5 mg、H2O 100 mL。
无机盐固体培养基在无机盐液体培养基的基础上加2%(质量分数)琼脂。
1.1.3 仪 器
安捷伦7890B/5977A气相色谱质谱联用仪(GC/MS), HP-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm);尼康E200光学显微镜;日立S-520扫描电子显微镜(SEM);UV-1800紫外可见分光光度计;Thermo X1R高速离心机;MLS-3750高压灭菌锅。
1.2 方 法
1.2.1 菌株的富集与纯化
取0.5 g土样置于30 mL的蒸馏水中,在30 ℃、180 r/min条件下培养24 h,取上清液3 mL转接到30 mL无机盐液体培养基中,30 ℃、180 r/min条件下培养7 d以富集萘降解菌,分别在萘初始质量浓度为100、300、500、500、500 mg/L时连续富集5次后,选择菌落生长较好的样品在无机盐固体培养基上多次划线分离纯化,-80 ℃甘油保存,编号为DGN9。
1.2.2 菌种鉴定
在光学显微镜和SEM观察的基础上利用16S rDNA测序分析进行鉴定。聚合酶链式反应(PCR)体系:DNA模板0.5 μL,10×Buffer 2.5 μL,dNTP 1 μL,DNA聚合酶0.2 μL, 10 μmol/L引物(27F 5’-AGTTTGATCMTGGCTCAG-3’、1492R 5’-GGTTACCTTGTTACGACTT-3’)各 0.5 μL,加双蒸水至25 μL;扩增条件:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环后72 ℃修复延伸10 min,4 ℃终止反应。扩增产物经测序后在美国国立生物技术信息中心(NCBI)进行blast 比对,通过MEGA 4.1计算遗传距离,邻接法构建系统发育树。
1.2.3 菌株的生长特性测定
菌株的生长特性包括最适生长温度、最适萘初始浓度、最适pH、耐盐性及生长曲线。测定最适生长温度时,设置20、25、30、35 ℃ 4种不同温度,pH为7,萘初始质量浓度为500 mg/L;测定最适萘初始质量浓度时,设置300、500、700、1 000、1 200、1 400 mg/L 6个梯度,温度为30 ℃,pH为7;测定最适pH时,设置pH为6、7、8、9、10,萘初始质量浓度为1 000 mg/L,温度为30 ℃;测定菌株耐盐性时,设置NaCl质量分数为1%、2%、4%、6%、8%,萘初始质量浓度为1 000 mg/L,温度为30 ℃,pH为7。以上试验均于250 mL的三角摇瓶(含90 mL无机盐液体培养基)中进行,180 r/min摇床振荡培养96 h,每隔12 h用紫外可见分光光度计在600 nm波长处测光密度(OD600),每组试验平行3次。生长曲线测定于250 mL三角摇瓶(含90 mL无机盐液体培养基,萘初始质量浓度为1 000 mg/L)中进行,按10%(体积分数,下同)的接种量接种菌株DGN9到90 mL无机盐液体培养基中,30 ℃、180 r/min、pH=7条件下振荡培养96 h,每隔8 h测一次OD600,平行3次,以不接种菌液作为空白(CK)对照。
1.2.4 菌株的萘降解效率测定
将对数期菌株按10%接种量接种到100 mL无机盐液体培养基中(萘初始质量浓度为1 000 mg/L),30 ℃、180 r/min振荡培养,每隔24 h取培养液3 mL,测OD600并用正己烷按1∶1(体积比)萃取,无水硫酸钠脱水,待GC/MS分析。色谱条件:载气为He;进样量为1 μL;升温程序为80 ℃保持2 min,以15 ℃/min升至190 ℃保持2 min,3 ℃/min升至300 ℃保持2 min;质谱条件:离子源温度为230 ℃,检测器温度为315 ℃。
1.2.5 菌株的萘降解途径
通过萘双加氧酶的铁硫蛋白质大亚基基因(nahAC)[14]、水杨醛脱氢酶基因(nahF)[15]、水杨酸羟基化酶基因(nahG)[16]和儿茶酚2,3-双加氧酶基因(nahH)[17]考察菌株的萘降解途径。4种关键酶基因的PCR体系参照1.2.2,相应的引物见表1。扩增条件:95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,32个循环后72 ℃修复延伸7 min。

表1 关键酶基因引物
1.2.6 菌株的底物特异性测定
将对数期菌株按10%接种量分别接种到30 mL含蒽、菲、芘、联苯、对苯二甲酸、邻苯二酚、苯酚、苯甲酸钠、水杨酸、邻苯二甲酸的无机盐液体培养基中(质量浓度均为500 mg/L),在pH=7、30 ℃、180 r/min下振荡培养7 d,测定OD600,平行3次。
2 结果与讨论
2.1 菌株的鉴定
DGN9菌落呈圆形,表面轻微隆起,淡黄色,湿润,半透明,边缘整齐,光滑。革兰氏染色为阴性,在光学显微镜下呈杆状,SEM观察如图1所示。
16S rDNA的测序分析得到的系统发育树表明,菌株DGN9与Achromobacterxylosoxidanssubsp. (GU0145)的同源性达到98.6%,与Achromobacterpulmonis(KT808881.1)的同源性为97.4%,可鉴定为无色杆菌。

图1 DGN9的SEM图Fig.1 SEM image of DGN9
2.2 菌株DGN9的生长特性
由图2(a)可见,30 ℃的生长曲线OD600高于其他温度,因此30 ℃为最适生长温度;图2(b)表明,萘初始质量浓度为1 000 mg/L时,生长曲线的OD600高于其他浓度,因此最适萘初始质量浓度为1 000 mg/L;图2(c)表明,当pH为7~9时,菌株DGN9生长良好,最适pH为7;如图2(d)所示,NaCl质量分数为1%、2%条件下DGN9生长良好,说明DGN9具有一定的耐盐性,但当盐浓度过高时菌株生长受到抑制。
DGN9在萘初始质量浓度为1 000 mg/L的无机盐培养基中30 ℃、180 r/min、pH=7条件下培养96 h的生长曲线如图3所示。前8 h为迟缓期,8~40 h为对数增长期,40~80 h为稳定期,80 h后进入衰亡期。
2.3 菌株DGN9的底物特异性
分别以蒽、菲、芘、联苯、对苯二甲酸、邻苯二酚、苯酚、苯甲酸钠、水杨酸、邻苯二甲酸为碳源,在pH=7、30 ℃、180 r/min条件下振荡培养7 d后,培养基由透明变混浊,OD600明显升高,测定结果如表2所示。由此可见,菌株DGN9可以不同有机物为碳源,具有底物生长广谱性。

表2 DGN9的底物特异性
2.4 菌株DGN9的萘降解途径
4种萘降解途径的关键酶基因PCR扩增结果如图4所示。nahAC和nahG扩增产物条带清晰可见,nahF条带比较模糊,没有观察到nahH的扩增产物条带。目前,已知的萘降解途径主要有两种:一种为水杨酸降解途径;另一种为龙胆酸降解途径,但龙胆酸降解途径比较罕见[18-21]。由关键酶PCR扩增结果可以判断,菌株DGN9对萘的降解可能为水杨酸降解途径,但不排除存在其他未知的降解途径,有待进一步深入研究。

图2 菌株DGN9的生长特性Fig.2 Growth characteristics of DGN9

图3 DGN9 的生长曲线Fig.3 Growth curve of DGN9
3 结 论
菌株DGN9鉴定为无色杆菌,其最佳生长条件为:最适生长温度30 ℃、最适萘初始质量浓度1 000 mg/L、最适pH为7,在NaCl质量分数为1%、2%的条件下可以生长良好。此外,菌株DGN9具有底物生长广谱性,对萘降解途径可能为水杨酸降解途径。
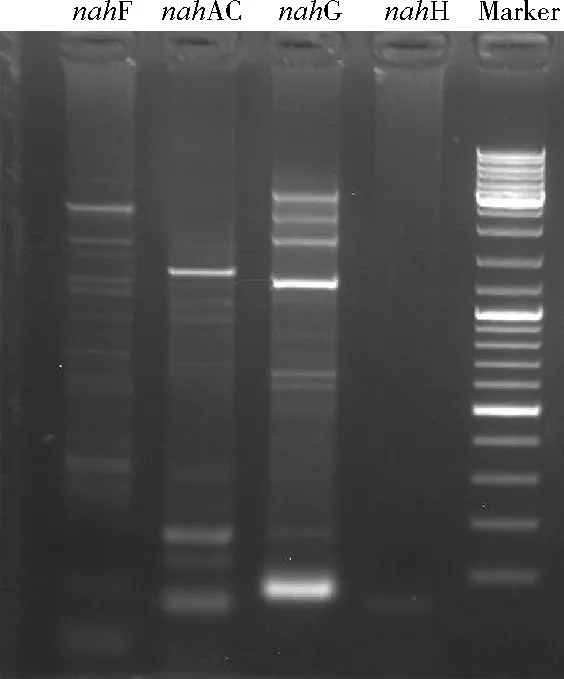
图4 萘降解途径的关键酶基因PCR扩增结果Fig.4 PCR amplification of key enzyme genes
[1] 王连生.有机污染物化学[M].北京:高等教育出版社,2004.
[2] CHRISTOPHE P,GILLES F,PASCAL P.Isolation and characterization of a gene cluster involved in PAH degradation inMycobacteriumsp. strain SNP11:expression inMycobacteriumsmegmatismc2155[J].Research in Microbiology,2007,158(2):175-186.
[3] HARVEY R G.Polycyclic aromatic hydrocarbons:chemistry and carcinogenicity[M].Cambridge:Cambridge University Press,1991.
[4] KEITH L,TELLIARD W.Priority pollutants:Ⅰ - a perspective view[J].Environmental Science & Technology,1979,13(4):416-423.
[5] RUBIO CLEMENTE A,TORRES PALMA R A,PENUELA G A.Removal of polycyclic aromatic hydrocarbons in aqueous environment by chemical treatments:a review[J].Science of the Total Environment,2014,478(8):201-225.
[6] LI Qinggang,WANG Xiaoyu,YIN Guangbo,et al.New metabolites in dibenzofuran cometabolic degradation by a biphenyl-cultivatedPseudomonasputidastrain B6-2[J].Environmental Science & Technology,2009,43(22):8635-8642.
[7] HEDLUND B P,STALERY J T.Vibriocyclotrophicussp. Nov.,a polycyclic aromatic hydrocarbon (PAH)-degrading marine bacterium[J].International Journal of Systematic and Evolutionary Microbiology,2001,51(1):61-66.
[8] SAMANTA S K,BHUSHAN B,JAIN R K.Efficiency of naphthalene and salicylate degradation by a recombinantpseudomonaspuadamutant strain defective in glucose metabolism[J].Applied Microbiology and Biotechnology,2001,55(5):627-631.
[9] 辛树权,刘海音,沈勇.一株萘降解菌的分离及其在石油降解中耐盐性的研究[J].长春师范学院学报,2013,32(2):74-77.
[10] 饶丽.耐盐型萘降解菌的筛选与鉴定[D].武汉:湖北大学,2012.
[11] 唐玉斌,孙常宇,陈芳艳,等.木糖氧化无色杆菌及混合菌群对多环芳烃的降解特性[J].环境工程学报,2010,7(4):1664-1668.
[12] 李妮,李张,李明雄,等.一株无色杆菌属菌株对孔雀绿的脱色降解[J].应用与环境生物学报,2009,15(4):529-533.
[13] 张小凡,小柳津广志.多环芳烃化合物菲分解菌的分离鉴定及分解特性研究[J].上海环境科学,2003,22(8):544-547.
[14] LIOYD JONES G,LAURIE A D,HUNTER D W F,et al.Analysis of catabolic genes for naphthalene and phenanthrene degradation in contaminated New Zealand soils[J].FEMS Microbiology Ecology,1999,29(1):69-79.
[15] LI Wei,SHI Jiandang,WANG Xuegang,et al.Complete nucleotide sequence and organization of the naphthalene catabolic plasmid pND6-1 frompresudomonassp. strain ND6[J].Gene,2004,336(2):231-240.
[16] ZHAO Huabing,CHEN Defu,LI Yongjun,et al.Overexpression,purification and characterization of a new salicylate hydroxylase from naphthalene-degradationPseudomonassp. strain ND6[J].Microbiological Research,2005,160(3):307-313.
[17] CHOSAL D,YOU I S,GUNSALUS I C.Nucleotide sequence and expression of genenahH of plasmid NAH7 and homology with genexylE of TOL pWWO[J].Gene,1987,55(1):19-28.
[18] STAROVOITOV I I,NEFEDOVA M Y,YAKOVLEV G I,et al.Gentisic acid as a microbial oxidation product of naphthalene[J].Russian Chemical Bulletin,1975,24(9):2091-2092.
[19] BUSWEKK J A,PATERSON A,SALKINOJA SALONEN M S.Hydroxylation of salicylic acid to gentisate by a bacterial enzyme[J].FEMS Microbiology Letter,1980,8(3):135-137.
[20] MONTICELLO D J,BAKKER D,SCHELL M,et al.Plasmid-borne Tn5 insertion mutation resulting in accumulation of gentisate from salicylate[J].Applied and Environmental Microbiology,1985,49(4):761-764.
[21] 王艳,辛嘉英,宋昊,等.生物降解萘的研究进展[J].中国生物工程杂志,2009,29(9):119-124.
Isolation,identification,growthcharacteristicsanddegradationpathwayofnaphthalenedegradingbacteria
ZHUXing,WANGRuoyu,WANGRui,BAIXue,RENLongfei,SHAOJiahui,ZHANGXiaofan.
(SchoolofEnvironmentalScienceandEngineering,ShanghaiJiaoTongUniversity,Shanghai200240)
A naphthalene degrading bacteria DGN9 was isolated from Dagang Oil Field in Tianjin. Through morphological analysis and 16S rDNA sequence analysis,DGN9 was identified asAchromobactersp. Its optimum growth temperature was 30 ℃,optimum initial concentration of naphthalene was 1 000 mg/L,and optimum growth pH was 7. DGN9 could grow well when NaCl mass percentage was up to 1% or 2%. The possible degradation pathway might be salicylic acid pathway. The strain could also degrade anthracene,phenanthrene,pyrene,biphenyl,p-phthalic acid,catechol,phenol,sodium benzoate,salicylic acid and phthalic acid,covering a wide variety of substrates.
naphthalene;Achromobactersp.; growth characteristics; degradation pathway
10.15985/j.cnki.1001-3865.2017.04.007
2016-06-20)
朱 星,女,1992年生,硕士研究生,主要从事萃取生物膜反应器处理难降解有机物的研究。#
。
*国家自然科学基金资助项目(No.21577089);上海交通大学大学生创新项目(No.IPP12175)。
