可生物降解塑料与沸石载体体系对硝酸盐氮污染地下水的生物修复研究*
2017-11-07席北斗党秋玲吴龙封李鸣晓
陈 雷 姜 玉, 龚 斌 赵 颖 席北斗 党秋玲 吴龙封 李鸣晓 李 瑞#
(1.吉林建筑大学市政与环境工程学院,吉林 长春130118; 2.中国环境科学研究院,国家环境保护地下水污染模拟与控制重点实验室,北京 100012; 3.中建四局安装工程有限公司,广东 广州 510000)
可生物降解塑料与沸石载体体系对硝酸盐氮污染地下水的生物修复研究*
陈 雷1姜 玉1,2龚 斌2赵 颖2席北斗2党秋玲2吴龙封3李鸣晓2李 瑞2#
(1.吉林建筑大学市政与环境工程学院,吉林 长春130118; 2.中国环境科学研究院,国家环境保护地下水污染模拟与控制重点实验室,北京 100012; 3.中建四局安装工程有限公司,广东 广州 510000)
生物反硝化是修复地下水硝酸盐氮污染的一种有效途径。为进一步确定异养反硝化碳源与载体投加量的配比,取用污水处理厂活性污泥为微生物来源,以可生物降解塑料为新型固相碳源,沸石为微生物载体,设计了9组固相碳源与载体不同配比的柱实验,旨在遴选出可生物降解塑料和沸石的最优配比。同时考察在最优配比时,不同进水硝酸盐氮浓度下的硝酸盐氮去除率、填料降解率、生物膜附着量、生物膜附着效率、反硝化效率等反应特性。结果表明,可生物降解塑料∶沸石(质量比)=2∶1为最优配比。在最优配比下,进水硝酸盐氮质量浓度为40~100mg/L时,异养反硝化对硝酸盐氮具有很好的去除效果(最终去除率均在99%以上),且能够保持较高的反硝化效率,同时载体负载微生物的性能稳定。
地下水 硝酸盐氮 异养反硝化 可生物降解塑料 载体
地下水硝酸盐氮污染已成为世界性问题[1],据《2015中国环境状况公报》显示:全国31个省(区、市)、202个地市级行政区的5 118个地下水监测井(点)中,水质较差和极差的监测井(点)比例分别为42.5%、18.8%,个别地下水水质监测井(点)硝酸盐氮浓度已严重超过《地下水质量标准》(GB/T 14848—93)中的Ⅴ类标准。目前硝酸盐氮的去除方法主要有物理化学法和生物反硝化法两大类[2],从彻底消除硝酸盐氮污染和降低脱硝成本两方面考虑,生物反硝化法是最实用的方法[3-5]。异养反硝化通过生物载体上负载微生物的反硝化作用将硝酸盐氮还原为氮气[6],此过程中碳源供给是异养反硝化微生物生存的必要条件,但地下水中天然有机碳含量往往较低,需要人为投加有机碳源。
采用液相碳源如乙醇、甲醇、乙酸盐时,须严格控制投加量。若投加量过少,会导致异养反硝化不完全,亚硝酸盐氮严重积累;反之,过量投加碳源可能会对地下水造成二次污染,且存在氨氮间接积累的隐患[7]。近年来,一些研究者将木屑、稻草、苜蓿草、树皮、锯屑等[8-14]低成本天然固相碳源应用于异养反硝化工艺中,脱硝效果良好。但是也有研究指出,以上这些材料作为固相碳源时,存在释碳速率不可控、二次污染风险较高、微生物生长与载体降解易造成格栅堵塞等问题[15-16],因此开发新型固相缓释碳源用于地下水的生物脱氮工艺,已成为近年来的研究热点[17]。
可生物降解塑料作为一种新型固相缓释碳源,相比麦秆、锯屑等天然材料,自然溶出的有机碳、氨氮、硝酸盐氮较少,二次污染风险较低[18],是一种经济、高效的固相缓释碳源。沸石是一种包含Na+、K+、Ca2+、Mg2+等金属离子的含水铝硅酸盐矿物质,比表面积较大(一般为100~400 m2/g)。使用沸石作为微生物载体时,能为兼性厌氧微生物(如异养反硝化菌)提供良好的生长环境。本研究以可生物降解塑料为新型固相缓释碳源、沸石为微生物载体,设计了9组不同投加量配比的柱实验,旨在遴选出可生物降解塑料和沸石的最优配比;同时考察在不同进水硝酸盐氮浓度下,硝酸盐氮去除率、填料降解率、生物膜附着量、异养反硝化效率等反应特性。本研究可为异养反硝化去除地下水硝酸盐氮污染的实际应用提供理论参考。
1 材料与方法
1.1 实验装置
柱实验装置如图1所示,进水桶、废水桶均为25 L塑料桶。实验柱为有机玻璃柱,内径3 cm,有效高度20 cm,柱内填充可生物降解塑料以及沸石。出水管运行时接入废水桶,取样时接入封口的干燥锥形瓶中。可生物降解塑料和沸石均从市面上直接购买。可生物降解塑料(颗粒状)由60%(质量分数,下同)的淀粉、30%的人工聚合物及10%的其他黏合剂组成。沸石粒径为2.0~4.0 mm,沸石不仅充当微生物载体,填充后也保证了实验柱的孔隙度。最优配比选择实验中,使用3台蠕动泵(LEAD-2)为9组实验柱配水;硝酸盐氮负荷实验中,使用1台蠕动泵(BT100-1F)为4组实验柱配水。
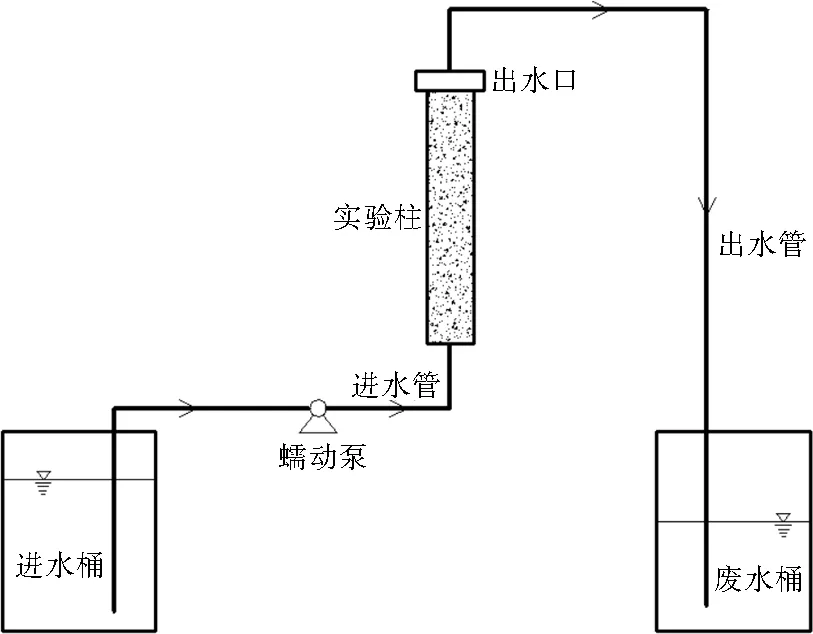
图1 柱实验装置Fig.1 Diagram of column experiment setup
1.2 实验方法
1.2.1 反硝化污泥驯化与挂膜
实验运行前,需培养出适应环境的异养反硝化菌。驯化接种的污泥取自北京市某污水处理厂厌氧消化池,测得悬浮固体(MLSS)为4 529.0 mg/L,挥发性悬浮固体(MLVSS)为 3 013.0 mg/L。将取回的污泥转入5 L烧杯中,在室温下驯化培养,用塑料膜扎紧杯口,以保持烧杯内的厌氧环境。每天弃去上部清液及悬浮污泥,并补充含有葡萄糖、KNO3、NaH2PO4的营养液。
在装填实验柱之前,需对沸石进行挂膜。将已称量好的沸石放入装有反硝化污泥的250 mL锥形瓶中,最优配比选择实验挂膜时污泥MLSS为4 529.0 mg/L,MLVSS为3 013.0 mg/L;硝酸盐氮负荷实验挂膜时污泥MLSS为2 429.4 mg/L,MLVSS为1 341.1 mg/L。装有沸石和污泥的锥形瓶振荡恒温培养7 d(转速80 r/min,温度 16 ℃)。每天加入一定量KNO3、NaH2PO4,维持硝酸盐氮为60 mg/L,TP为12 mg/L。对于只填充沸石的实验柱(1#),在锥形瓶中还需每天加入一定量的葡萄糖,以维持溶液COD为60 mg/L。7 d后,将锥形瓶中的沸石经棉筛网过滤后取出,装填入相应实验柱中。随即将进水泵流量调到最大,将附着性能较差的污泥冲出。实验装置稳定运行7~10 d,完成反硝化污泥的挂膜。
1.2.2 最优配比选择实验
9组实验柱对应的可生物降解塑料与沸石配比、填料总质量见表1,水力停留时间(HRT)控制在2 h左右。所有实验柱进水均使用合成地下水:硝酸盐氮为60 mg/L,TP为12 mg/L。其中1#实验柱只加入葡萄糖作碳源,使进水COD维持在60 mg/L左右。实验柱在(17±2) ℃下先运行10 d,10 d后每隔3 d左右取水样1次,每隔5 d左右取沸石测定生物膜附着量及填料降解率。
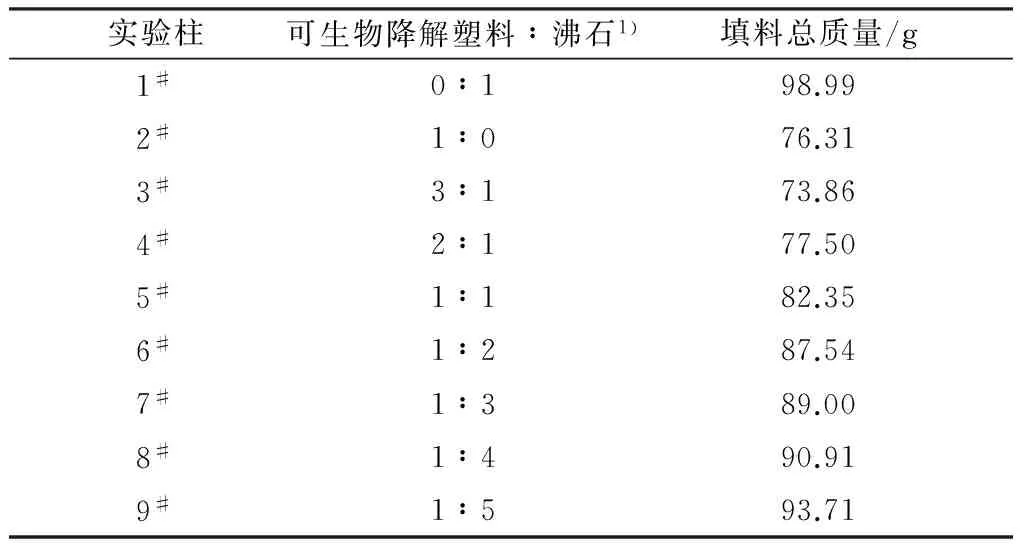
表1 最优配比选择实验中9组实验柱的可生物降解塑料与沸石配比及填料总质量
注:1)以质量比计。
1.2.3 硝酸盐氮负荷实验
根据最优配比选择实验的结果,重新设置4组实验柱进行4种不同硝酸盐氮浓度的负荷实验。为了更贴近于硝酸盐氮重污染地下水,硝酸盐氮负荷实验设定的硝酸盐氮进水浓度较高:其中a实验柱设定进水硝酸盐氮为40 mg/L,填料总质量为88.34 g;b实验柱设定进水硝酸盐氮为60 mg/L,填料总质量为87.75 g;c实验柱设定进水硝酸盐氮为80 mg/L,填料总质量为87.74 g;d实验柱设定进水硝酸盐氮为100 mg/L,填料总质量为87.87 g。HRT控制在12 h左右,TP维持在6 mg/L。实验柱在(22±2) ℃下运行25 d。稳定后,第1周每隔2 d取样1次,之后每隔6 d取样1次。运行结束时,将整个实验柱内的沸石取出,测定生物膜附着量及填料降解率。进出水pH采用HQ30D多参数水质分析仪测定,硝酸盐氮、亚硝酸盐氮、氨氮、TP参照《水和废水监测分析方法》(第4版)测定。
2 结果与讨论
2.1 最优配比选择实验结果分析
2.1.1 出水水质
实验需考虑碳源可能引起的二次污染问题。如果固相碳源自身所释放的污染物较多,其在实际应用中就有较大局限性。有研究表明:可生物降解塑料释放的含氮化合物极少,同时可忽略其对含氮化合物的吸附作用;另外,沸石对硝酸盐氮、亚硝酸盐氮的吸附作用很小,对氨氮有一定的吸附作用,但8 h内就达到平衡,吸附率为54%,之后吸附率基本保持稳定[19]。因此,在长时间的柱实验中,可以忽略由填料的吸附作用而造成的对硝酸盐氮浓度的影响。
整个实验过程中,各实验柱对硝酸盐氮的去除能力基本保持稳定后,硝酸盐氮浓度随时间的变化如图2所示。由图2可以看出,4#、5#实验柱出水硝酸盐氮浓度最低,硝酸盐氮平均去除率分别为46.2%、45.0%。除1#、2#实验柱外,3#实验柱中可生物降解塑料的投加量最多,但是其硝酸盐氮去除率相对较低,这可能是因为碳源的过量投加在某种程度上抑制了微生物的代谢活性[20]。
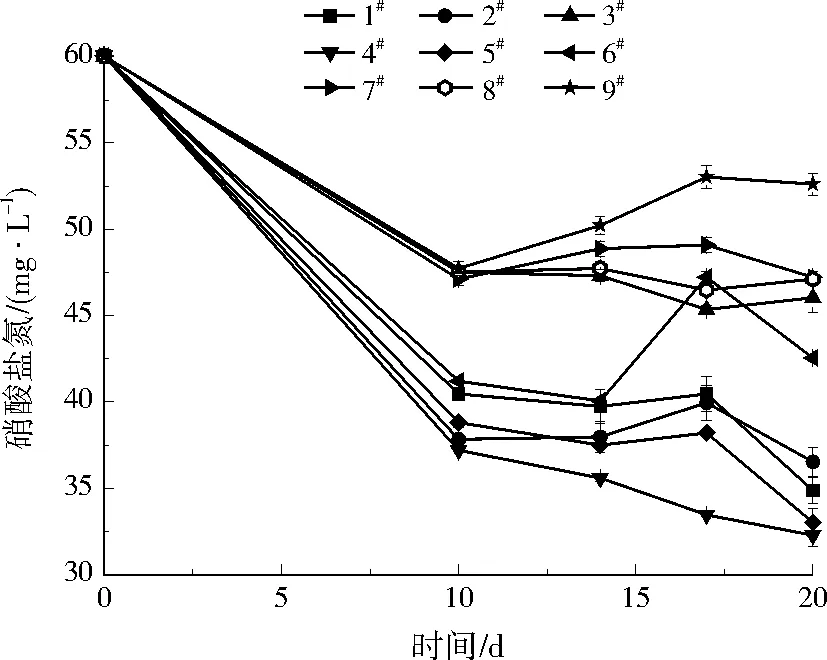
图2 最优配比选择实验中出水硝酸盐氮质量浓度随时间的变化Fig.2 The variation of nitrate nitrogen concentrations in effluent during the optimal ratio selection experiment
亚硝酸盐氮浓度随时间的变化如图3所示。由图3可以看出,1#、3#实验柱亚硝酸盐氮浓度较高,其中1#实验柱出水亚硝酸盐氮在3 mg/L以上。通常亚硝酸盐氮的积累与pH、碳氮比(C/N)、温度、HRT等因素有关。由图4可以看出,整个反应过程pH都控制在6~8,适合反硝化细菌的生长繁殖,因此pH不是造成亚硝酸盐氮积累的主要因素。VAN RIJN等[21]以乙酸为碳源进行反硝化实验,发现当乙酸不足时会有亚硝酸盐氮积累。本实验中,1#实验柱使用葡萄糖做外加碳源,C/N(质量比)为1∶1,有机碳不足可能是造成其亚硝酸盐氮积累的主要原因。另外,实验温度较低((17±2) ℃)和HRT较短(2 h)均可能造成亚硝酸盐氮积累,实验温度较低导致反硝化细菌的活性受到严重抑制,HRT较短致使亚硝酸盐氮没有足够的时间与生物介质接触,不能被完全还原。
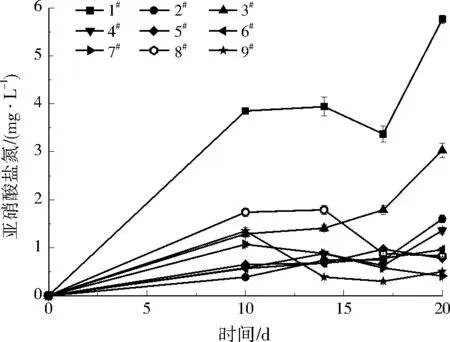
图3 最优配比选择实验中出水亚硝酸盐氮质量浓度随时间的变化Fig.3 The variation of nitrite nitrogen concentrations in effluent during the optimal ratio selection experiment
图4 最优配比选择实验中出水pH随时间的变化Fig.4 The variation of effluent pH during the optimal ratio selection experiment
如图5所示,实验过程中氨氮积累量整体较低,其中3#、4#、5#和9#实验柱始终没有检测到氨氮。8#和1#实验柱的最高出水氨氮分别为0.63、0.55 mg/L,其余实验柱的出水氨氮都在0.5 mg/L以下,符合《生活饮用水卫生标准》(GB 5749—2006)。
图5 最优配比选择实验中出水氨氮质量浓度随时间的变化Fig.5 The variation of ammonium nitrogen concentrations in effluent during the optimal ratio selection experiment
2.1.2 填料降解率与生物膜附着性能
填料降解率(d,%)根据式(1)计算,生物膜附着量(mB,mg/g)根据式(2)计算,生物膜附着效率(EB,%)根据式(3)计算。
(1)
(2)
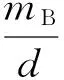
(3)
式中:w0为实验前填料烘干后质量,g;w1为称量皿质量,g;w2为实验后填料放入超声波清洗机中以59 kHz频率振荡清洗15 min,用去离子水冲洗表面,在烘箱中80 ℃烘干后放入称量皿中称量的质量,g;w3为实验后填料放入称量皿中,在烘箱中80 ℃烘干2 h,再在干燥皿中冷却1 h后称量的质量。
本实验测量了两次填料降解率以及生物膜附着量,取样时间间隔为5 d。由于5 d内填料降解率和生物膜附着量均较低,因此在较长周期的实验中可视作两个平行样。测得的填料降解率与生物膜附着量平均值见图6。由图6可以看出,除1#、2#实验柱外,载体平均降解率较低的是3#、9#实验柱,其余实验柱的载体平均降解率相差不大。9组实验柱中平均生物膜附着量较大的是4#、5#、6#、7#、8#实验柱,其生物膜附着量都在15 mg/g以上。将这5组实验柱与2#实验柱对比可以得出,在填料中加入沸石更有利于生物膜的附着。
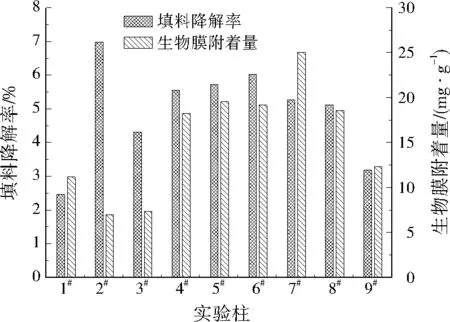
图6 最优配比选择实验中9组实验柱的填料降解率和生物膜附着量平均值Fig.6 Average filler degradation rates and attached biofilm amounts of 9 experimental columns in optimal ratio selection experiment
对比反应前后沸石与可生物降解塑料的表面(见图7),可以观察到生物膜呈现灰褐色,且沸石表面的生物膜附着量多于可生物降解塑料。
微生物依靠降解可生物降解塑料获取碳源进行生长繁殖[22],因此可用生物膜附着效率来体现沸石负载微生物的能力和效率。由表2可以得出:1#、7#、8#、9#实验柱的生物膜附着效率较高;4#、5#、6#实验柱的生物膜附着效率接近;2#、3#实验柱的生物膜附着效率较低。
综合填料降解率、生物膜附着量以及生物膜附着效率来看,4#、5#、6#、7#、8#实验柱生物膜附着量大、生物膜附着效率高,说明这些实验柱的生物膜附着性能较好。

图7 反应前后沸石与可生物降解塑料表面的变化Fig.7 Surface of zeolite and biodegradable plastic before and after the reaction

参数实验柱1#2#3#4#5#6#7#8#9#EB/%451017333432483639
2.1.3 反硝化效率
采用容积反硝化速率(NV,mg/(L·d))、载体反硝化速率(NS,mg/(g·d))、生物膜反硝化速率(NB,mg/(mg·d))3个参数来衡量硝酸盐氮去除过程中的反硝化效率,具体计算分别见式(4)至式(6)。
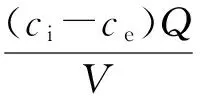
(4)
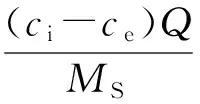
(5)
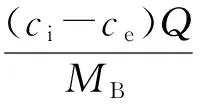
(6)
式中:ci为进水硝酸盐氮质量浓度,mg/L;ce为出水硝酸盐氮质量浓度,mg/L;Q为进水实际流量,L/d;V为实验柱有效体积,L;MS为实验柱内载体质量,g;MB为实验柱内生物膜总质量,mg。
由表3可以看出,容积反硝化速率较高的是1#、2#、4#实验柱,载体反硝化速率较高的是2#、3#、4#实验柱,生物膜反硝化速率较高的也是2#、3#、4#实验柱。不同实验柱中微生物对硝酸盐氮去除效率不同,可能是由于不同实验柱的C/N以及载体环境不同造成的[23]。考虑到实际应用会受到施工成本、地质环境等因素的限制,单位反应区域内的反硝化效率越高,越有利于其在实际工程中的应用[24]。因此,从反硝化效率看,4#实验柱的配比最适合应用于实际。
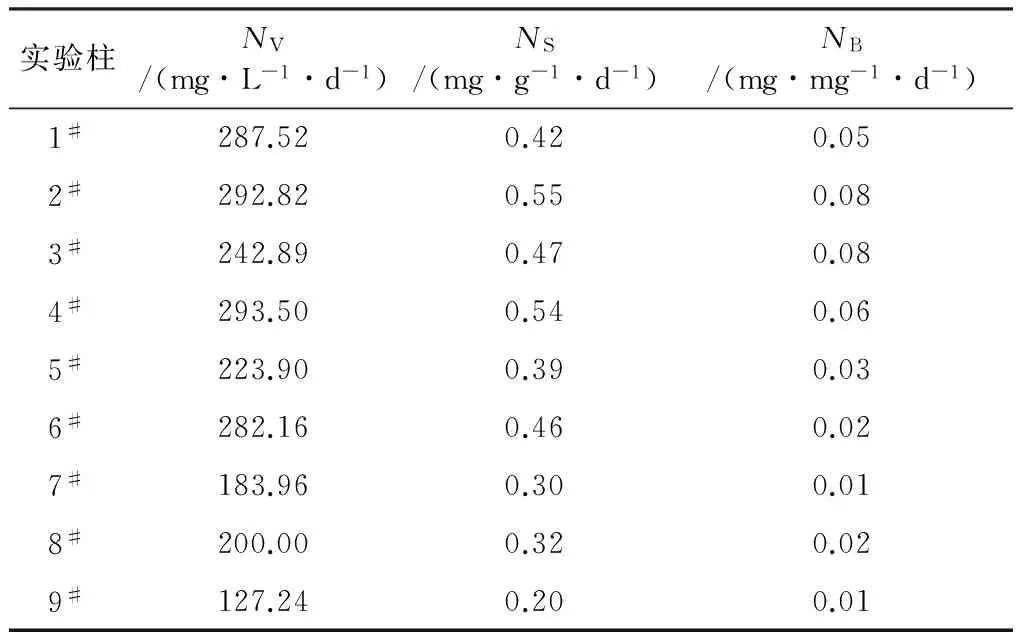
表3 最优配比选择实验中9组实验柱的反硝化效率
综合最优配比实验结果可以看出,4#实验柱中固相碳源与载体的配比最优(即可生物降解塑料∶沸石=2∶1),在该配比下,反硝化效率高、出水水质好、生物膜附着性能良好。
2.2 硝酸盐氮负荷实验结果分析
2.2.1 出水水质情况
设计了4组不同进水硝酸盐氮浓度的柱实验(a、b、c、d实验柱中硝酸盐氮分别为40、60、80、100 mg/L),考察在最优配比条件下,硝酸盐氮去除率、填料降解率、生物膜附着量、反硝化效率等反应特性。由图8可看出,随着反应进行,4实验柱出水硝酸盐氮去除率大幅度提高,最终的硝酸盐氮去除率均达到99%以上。
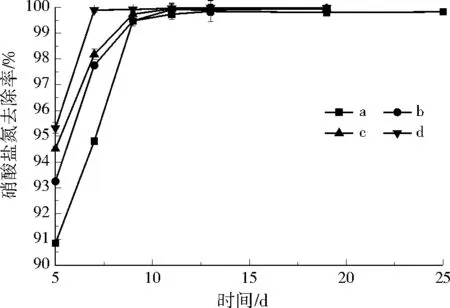
图8 硝酸盐氮负荷实验中硝酸盐氮去除率随时间的变化Fig.8 Variation of nitrate nitrogen removal efficiency during the nitrate nitrogen loading experiment
实验过程中出水始终没有检测到亚硝酸盐氮积累,可能是实验运行过程中温度相对较高((22±2) ℃),HRT长(12 h),反应过程中产生的亚硝酸盐氮有足够的时间与微生物接触反应,从而被还原成氮气,因此亚硝酸盐氮没有积累[25]。此外,虽然实验过程中微生物对磷的利用率不高,但已能够满足微生物的生长需要。
实验过程出水氨氮浓度如图9所示。在实验运行13 d时,4组实验柱均出现不同程度的氨氮积累,c实验柱在运行13 d时测得的氨氮浓度较高,其余实验柱的出水氨氮都在0.8 mg/L以下。氨氮积累可能是由于经历了硝酸盐氮异化还原生成氨氮(DNRA)过程[26]。自然界中生物氮循环包括两种硝酸盐氮还原途径,一种是反硝化过程;另一种是DNRA过程,其最终产物是氨氮[27],具体反应过程见式(7):
(7)
严格厌氧菌、兼性厌氧菌、微嗜氧菌和好氧菌等都可利用硝酸盐氮发生DNRA过程。C/N较高时更容易发生DNRA过程。因此,实验进行13 d时出现明显的氨氮积累,可能是由于在反应后期,溶液中硝酸盐氮浓度太低使实验柱内局部C/N较高[28-31],从而发生了DNRA过程。
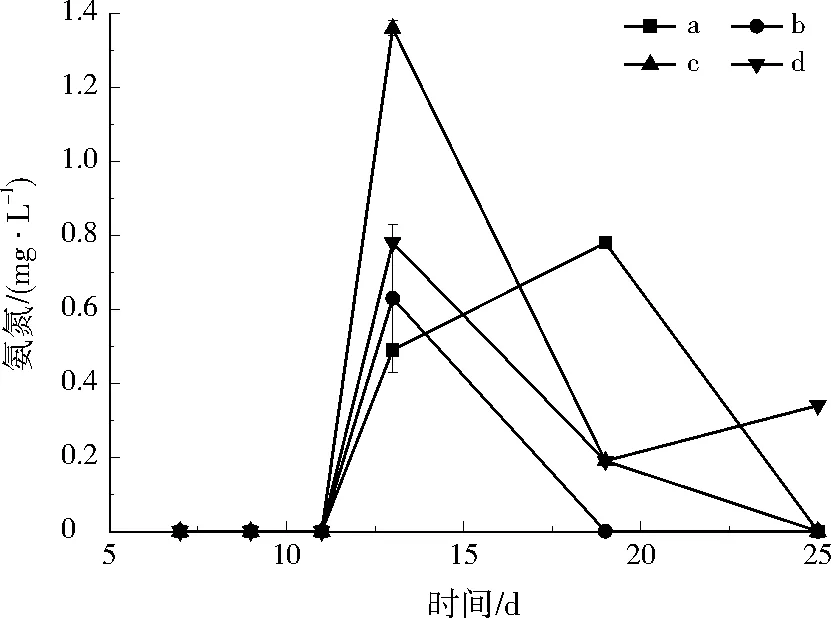
图9 硝酸盐氮负荷实验中出水氨氮质量浓度随时间的变化Fig.9 The variation of ammonium nitrogen concentrations during the nitrate nitrogen loading experiment
2.2.2 填料降解率与生物膜附着性能分析
使用整个实验柱内的沸石,分别测定填料降解率、生物膜附着量及生物膜附着效率,结果见表4。由表4可以看出,相比2.1.2节中4#实验柱的实验结果,4组实验柱的填料降解率均较低,生物膜附着量也均较少,但生物膜附着效率相差不大,表明沸石负载微生物的性能是稳定的。
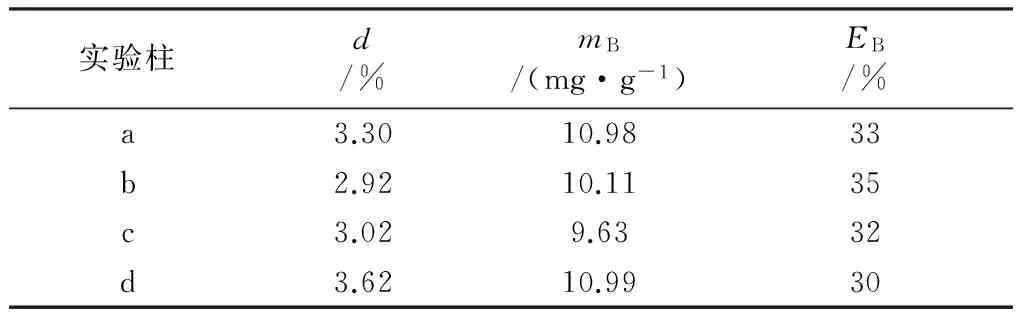
表4 硝酸盐氮负荷实验中4组实验柱的填料降解率、 生物膜附着量及生物膜附着效率
2.2.3 反硝化效率分析
由表5可看出,与2.1.3节中4#实验柱的反硝化效率比,容积反硝化速率和载体反硝化速率均明显偏低。这可能是由于硝酸盐氮负荷实验的HRT(12 h左右)较长,载体及反硝化污泥未达到满负荷运行状态。
综合硝酸盐氮负荷实验结果可以看出,可生物降解塑料与沸石的配比为2∶1时,异养反硝化对硝酸盐氮质量浓度为40~100 mg/L的进水均能够保持较高的反硝化效率,且还能够适应更高的硝酸盐氮进水浓度。

表5 硝酸盐氮负荷实验中4组实验柱的反硝化效率
3 结 论
(1) 可生物降解塑料∶沸石=2∶1为最优配比。
(2) 可生物降解塑料与沸石的配比为2∶1,进水硝酸盐氮为40~100 mg/L时,异养反硝化对硝酸盐氮具有很好的去除效果(最终去除率均在99%以上),并保持较高的反硝化效率,且沸石负载微生物的性能是稳定的。
(3) 最优配比选择实验中,各实验柱出现了不同程度的亚硝酸盐氮积累,其可能原因是实验温度较低且HRT较短。硝酸盐氮负荷实验中,实验温度升高、HRT延长,则未发生亚硝酸盐氮积累。另外,氨氮的积累可能是由于局部C/N过高发生了DNRA过程。
[1] PISCIOTTA A,CUSIMANO G,FAVARA R.Groundwater nitrate risk assessment using intrinsic vulnerability methods:a comparative study of environmental impact by intensive farming in the Mediterranean region of Sicily,Italy[J].Journal of Geochemical Exploration,2015,156:89-100.
[2] 王旭明,从二丁,罗文龙,等.固体碳源用于异养反硝化去除地下水中的硝酸盐[J].中国科学:B辑 化学,2008,38(9):824-828.
[3] OVEZ B.Batch biological denitrification usingArundodonax,Glycyrrhizaglabra,andGracilariaverrucosaas carbon source[J].Process Biochemistry,2006,41(6):1289-1295.
[4] SIERRA ALVAREZ R,BERISTAIN CARDOSO R,SALAZAR M,et al.Chemolithotrophic denitrification with elemental sulfur for groundwater treatment[J].Water Research,2007,41(6):1253-1262.
[5] INES M,SOARES M,ABELIOVICH A.Wheat straw as substrate for water denitrification[J].Water Research,1998,32(12):3790-3794.
[6] 张兰河,左正艳,王旭明.固相反硝化系统中微生物群落结构的研究进展[J].生物技术通报,2015(1):39-45.
[7] XU Ying,QIU Tianlei,HAN Meilin,et al.Heterotrophic denitrification of nitrate-contaminated water using different solid carbon sources[J].Procedia Environmental Sciences,2011,10(1):72-77.
[8] TRUDELL M R,GILLHAM R W,CHERRY J A.An in-situ study of the occurrence and rate of denitrification in a shallow unconfined sand aquifer[J].Journal of Hydrology,1986,83(3):251-268.
[9] VOLOKITA M,BELKIN S,ABELIOVICHA,et al.Biological denitrification of drinking water using newspaper[J].Water Research,1996,30(4):965-971.
[11] ROBERTSON W D.Nitrate removal rates in woodchip media of varying age[J].Ecological Engineering,2010,36(11):1581-1587.
[12] MOORMAN T B,PARKIN T B,KASPAR T C.Denitrification activity,wood loss,and N2O emissions over 9 years from a wood chip bioreactor[J].Ecological Engineering,2010,36(11):1567-1574.
[13] VOGAN J L,FOCHT R M,CLARK D K,et al.Performance evaluation of a permeable reactive barrier for remediation of dissolved chlorinated solvents in groundwater[J].Journal of Hazardous Materials,1999,68(1/2):97-108.
[14] ROBERTSON W D, CHERRY J A. In situ denitrification of septic-system nitrate using reactive porousmedia barriers:field trials[J].Ground Water,1995,33(1):99-111.
[15] LI Rui,FENG Chuanping,CHEN Nan,et al.A bench-scale denitrification wall for simulating the in-situ treatment of nitrate-contaminated groundwater[J].Ecological Engineering,2014,73:536-544.
[16] LI Rui,FENG Chuanping,HU Weiwu,et al.Woodchip-sulfur based heterotrophic and autotrophic denitrification (WSHAD) process for nitrate contaminated water remediation[J].Water Research,2016,89:171-179.
[17] 王允,张旭,张大奕,等.用于地下水原位生物脱氮的缓释碳源材料性能研究[J].环境科学,2008,29(8):2183-2188.
[18] ZHANG Jianmei,FENG Chuanping,HONG Siqi,et al.Behavior of solid carbon sources for biological denitrification in groundwater remediation[J].Water Science and Technology,2012,65(9):1696-1704.
[19] 张建美.地下水硝酸盐原位生物修复固相碳源及磷源性能研究[D].北京:中国地质大学(北京),2012.
[20] 胡细全,胡志操,王春秀,等.天然沸石吸附氨氮和磷的研究[J].环境科学与管理,2009,34(4):72-74,77.
[21] VAN RIJN J,TAL Y,SCHREIER H J.Denitrification in recirculating systems:theory andapplications[J].Aquacultural Engineering,2006,34(3):364-376.
[22] SHEN Zhiqiang,ZHOU Yuexi,HU Jun,et al.Denitrification performance and microbial diversity in a packed-bed bioreactor using biodegradable polymer as carbon source and biofilm support[J].Journal of Hazardous Materials,2013,250/251(8):431-438.
[23] 孙洪伟,郭英,尤永军,等.不同碳氮比(C/N)条件下驯化微生物的反硝化特性[J].环境化学,2014,33(5):770-775.
[24] OBIRI NYARKO F,GRAJALES MESA S J,MALINA G.An overview of permeable reactive barriers for in situ sustainable groundwater remediation[J].Chemosphere,2014,111:243-259.
[25] 罗秀针,徐长安,唐旭,等.反硝化细菌的筛选及其亚硝酸盐降解特性研究[J].福建农业学报,2010,25(4):513-516.
[26] HARDISON A K,ALGAR C K,GIBLIN A E.Influence of organic carbon and nitrate loading on partitioning between dissimilatory nitrate reduction to ammonium (DNRA) and N2production[J].Geochimica et Cosmochimica Acta,2015,164(6):146-160.
[27] RUBOL S,MANZONI S,BELLIN A,et al.Modeling soil moisture and oxygen effects on soil biogeochemical cycles including dissimilatory nitrate reduction to ammonium (DNRA)[J].Advances in Water Resources,2013,62:106-124.
[28] YANG Xinping,WANG Shimei,ZHOU Lixiang.Effect of carbon source,C/N ratio,nitrate and dissolved oxygen concentration on nitrite and ammonium production from denitrification process byPseudomonasstutzeriD6[J].Bioresource Technology,2012,104:65-72.
[29] TONG Shuang,CHEN Nan,WANG Heng,et al.Optimization of C/N and current density in a heterotrophic/biofilm-electrode autotrophic denitrification reactor (HAD-BER)[J].Bioresource Technology,2014,171:389-395.
[30] SGOURIDIS F,HEPPELL C M,WHARTON G,et al.Denitrification and dissimilatory nitrate reduction to ammonium (DNRA) in a temperate re-connected floodplain[J].Water Research,2011,45(16):4909-4922.
[31] BEHRENDT A,TARRE S,BELIAVSKI M,et al.Effect of high electron donor supply on dissimilatory nitrate reduction pathways in a bioreactor for nitrate removal[J].Bioresource Technology,2014,171:291-297.
Studyonthebioremediationofnitratenitrogencontaminatedgroundwaterbybiodegradableplastic-zeolitesystem
CHENLei1,JIANGYu1,2,GONGBin2,ZHAOYing2,XIBeidou2,DANGQiuling2,WULongfeng3,LIMingxiao2,LIRui2.
(1.TheInstituteofMunicipalandEnvironmentEngineering,JilinJianzhuUniversity,ChangchunJilin130118;2.StateEnvironmentalProtectionKeyLaboratoryofSimulationandControlofGroundwaterPollution,ChineseResearchAcademyofEnvironmentalSciences,Beijing100012; 3.ChinaConstructionFourthEngineeringDivisionInstallationEngineeringCo.,Ltd.,GuangzhouGuangdong510000)
Biological denitrification is an efficient method for remediating nitrate nitrogen contaminated groundwater. In order to further confirm the ratio of carbon source to carriers of heterotrophic denitrification,the activated sludges in sewage plant were taken as microbial source,with the biodegradable plastic as innovative solid carbon source and the zeolite as microbial carrier. 9 experiment columns of different ratios were designed to select the optimal ratio of biodegradable plastic to zeolite. The reaction characteristics such as nitrate nitrogen removal rate,filler degradation efficiency,biomembrane adhesion amount,biomembrane adhesion effeciency and denitrification efficiency under different influent nitrate nitrogen concentration were expolered. The results showed that biodegradable plastic∶zeolite (mass fraction)=2∶1 was the optimal ratio. When the influent nitrate nitrogen concentration was 40-100 mg/L with the optimal ratio,heterotrophic denitrification had a good removal efficiency to nitrate nitrogen (the average removal rate of nitrate nitrogen was above 99%),and it could kept a high denitrification efficiency. At the same time,the capability of carriers to load microorganism also kept stable.
groundwater; nitrate nitrogen; heterotrophic denitrification; biodegradable plastic; carrier
10.15985/j.cnki.1001-3865.2017.04.001
2016-05-25)
陈 雷,男,1971年生,博士,教授,研究方向为环境工程。#
。
*国家科技支撑计划项目(No.2014BAL02B03-02)。
