3种沉水植物对再生水水质维护效果的比较*
2017-11-07李兆欣顾永钢黄炳彬
周 雪 李兆欣 顾永钢,3 黄炳彬 刘 操#
(1.北京市水科学技术研究院,流域水环境与生态技术北京市重点实验室,北京 100048; 2.河海大学环境学院,江苏 南京 210098;3.西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
3种沉水植物对再生水水质维护效果的比较*
周 雪1,2李兆欣1顾永钢1,3黄炳彬1刘 操1#
(1.北京市水科学技术研究院,流域水环境与生态技术北京市重点实验室,北京 100048; 2.河海大学环境学院,江苏 南京 210098;3.西安建筑科技大学环境与市政工程学院,陕西 西安 710055)
为了防止再生水利用时出现富营养化现象,选用苦草(Vallisnerianatans(Lour.)Hara)、金鱼藻(CeratophyllumdemersumL.)和穗状狐尾藻(MyriophyllumspicatumL.)3种沉水植物,配合投加鲢鱼(Hypophthalmichthysmolitrix)和椭圆背角无齿蚌(Anadontawoodianaelliptica),对再生水水质进行维护,对比不同组合对再生水的净化和保持效果。结果表明:金鱼藻能较好维护再生水的水质稳定,实验中后期COD、氨氮分别在30、0.4mg/L以下,而且金鱼藻可较好地抑制浮游植物的生长,叶绿素a基本都小于叶绿素a水华阈值(40μg/L),同时鲢鱼和椭圆背角无齿蚌的投加能完善生态系统,并维护再生水pH的稳定。
再生水 沉水植物 金鱼藻 水质维护
随着社会的快速发展,水资源短缺形势越发严峻,再生水成为城市景观用水的重要补给水源,得到广泛利用。但是,由于再生水中部分污染物的浓度远高于天然水体,水体自净能力较差,使得再生水补水型景观水体的水质难以维持稳定。关于再生水回用于景观水体后引起的水质变化及维持水质稳定的措施,也越来越多的得到研究[1-4]。其中,利用水生植物,抑制藻类生长,维护水体生态系统稳定,被广泛研究[5]。对水生植物的研究多集中于沉水植物,作为初级生产者,其在以再生水为水源的景观生态系统调控中具有重要地位[6]。
沉水植物以其特有的生态和景观功能及易于人工操作等优点,在净化水质和修复水生态系统方面受到普遍关注,并开展了大量的研究[7-9]。多数研究模拟再生水的水质条件,自配实验用水,之后引入沉水植物,测试水体污染物的浓度变化情况,以得出净水效果最佳的沉水植物。但在指导实际工程应用时,存在地域应用限制和修复维护效果不佳等现象。
在实验过程中,本研究保持实验用水氮磷浓度恒定,利用水生生物——沉水植物、鲢鱼和河蚌修复维持再生水,以求得适用于北京地区的再生水水体维护生物组合,为北京再生水补水型城市河湖的生态修复,提供应用依据。
1 材料与方法
1.1 水生生物
对沉水植物进行筛选,以适应性好、成活率高、对氮磷富集效果好、光合效率高、美观、具有一定经济价值为标准进行选择[10]。选择较多应用于北方地区水体生态修复中的3种沉水植物[11-13],包括苦草(Vallisnerianatans(Lour.) Hara)、金鱼藻(CeratophyllumdemersumL.)和穗状狐尾藻(MyriophyllumspicatumL.)。实验所用沉水植物购自北京市怀柔区某园艺场,在自来水中驯养5 d后使用。
对水生动物进行筛选,以能够维持水质、吞食浮游动植物、控制水体水华等为标准进行选择。选择鲢鱼(Hypophthalmichthysmolitrix)和椭圆背角无齿蚌(Anadontawoodianaelliptica)作为实验用水生动物,均购自北京市顺义区某鱼塘。
1.2 实验用水
实验用水取自北京某再生水厂的再生水出水,其处理工艺为A2/O+膜生物反应器(MBR)工艺。
1.3 实验方法
实验在北京市顺义区某再生水厂室外进行,搭建防雨棚,放置有机玻璃实验装置,实验装置如图1所示。有机玻璃装置尺寸为1.0 m×1.0 m×1.5 m,加水量为1.2 m3。
图1 实验装置示意图Fig.1 Schematic diagram of experimental equipment
实验周期为2015年8月1日至10月1日。实验组设置:(1)空白组,即只添加再生水;(2)单一沉水植物组,即在空白组上分别投加苦草、金鱼藻和穗状狐尾藻;(3)生态组,即在单一沉水植物组上加入鲢鱼和椭圆背角无齿蚌。沉水植物方式:选取大小一致、生长状况良好的植株,增加配重将其压入实验装置底部。沉水植物的种植量为50株,总鲜质量为(250±25) g,鲢鱼的投加量为(300±5) g,椭圆背角无齿蚌投加量为3只,每只(420±20) g。
实验期间,蒸发水量用再生水补充,并用NaNO3和KH2PO4调节实验用水的TN和TP浓度,使其保持稳定。实验过程中不断加入的氮磷元素,可模拟真实环境中氮磷污染物进入水体的过程,并且能得到实验过程中水生生物系统消耗利用的氮磷元素总量,为工程应用提供基础数据支持。
通过测定水质指标浓度的变化,评价沉水植物对水质的保持效果。测定指标主要有TN、氨氮、TP、COD、pH、水温、叶绿素a。水质指标测试方法参照文献[14]。
2 结果与讨论
2.1 再生水水质
测试了实验用水初始水质,结果如表1所示。目前,北京市《城镇污水处理厂水污染物排放标准》(DB 11890—2012)一级A标准规定:TN≤15 mg/L,TP≤0.5 mg/L。因此,调节实验用水的TN和TP浓度,使TN、TP分别稳定在15、0.5 mg/L左右。
2.2 沉水植物生长状况
实验过程中,定期测定了沉水植物的生长长度,比较了不同实验组沉水植物的生长状况,结果如图2所示。穗状狐尾藻在移植后未能适应再生水环境,未能正常生长;苦草在移植初期未能正常生长,生长适应期过后正常生长,其中单一苦草组中苦草从30 cm左右逐渐生长到40 cm左右,苦草生态组中苦草从30 cm左右逐渐生长到50 cm左右;金鱼藻对再生水环境的适应较好,实验期间生长状况良好,且单一金鱼藻组中的金鱼藻在实验初期生长较迅速,单一金鱼藻组和金鱼藻生态组的金鱼藻均从50 cm左右逐渐生长到70 cm左右。可见,在此再生水环境中,苦草和金鱼藻能较快适应,并正常生长,可用于此再生水体的水质维护,而穗状狐尾藻未能正常生长,在再生水体的水质维护中,应谨慎选择。

表1 实验用水初始水质指标平均值

图2 沉水植物生长情况Fig.2 Growth of submerged plants
实验后期,水温从最初的28 ℃左右下降到18 ℃左右,随着水温的降低,沉水植物生长速度变慢,并逐渐停滞,之后出现腐烂现象,实验结束。由于沉水植物死亡腐烂后,会向水体释放污染物,对水体水质造成污染,因此实际工程应用中,为防止沉水植物死亡腐烂对水体造成二次污染,可在10月初进行收割,以此施加生态管理有利于水体水质的维护。
2.3 氮磷元素投加量对比
由图3可知,投加苦草的实验组中,氮磷元素的消耗量最高,其中单一苦草组的氮、磷元素投加量达到17.04、1.500 g,苦草生态组的氮、磷元素投加量分别为12.18、1.572 g;投加金鱼藻和穗状狐尾藻的实验组,氮磷元素的消耗量相似;空白组出现氮磷元素消耗的情况,可能的原因是水体中浮游植物的生长,利用了水体中的氮磷元素。因此,比较了各实验组的浮游植物的细胞密度,结果如图4所示。空白组浮游植物的细胞密度明显高于其他实验组,空白组浮游植物的生长消耗了水中的氮磷元素。同时,投加水生生物,对水中的浮游植物有较好的抑制作用。
2.4 再生水氨氮变化对比
水体氨氮主要通过生物同化吸收和微生物的硝化与反硝化作用、挥发等机制去除,各种去除机制都直接或间接受植物和浮游植物的影响[15]。对比了各实验组的氨氮变化,结果如图5所示。
沉水植物的投加,使得水体氨氮快速降低,之后氨氮能维持在0.1~0.8 mg/L,其中单一金鱼藻组对水体氨氮的维护效果最好,保持在0.3 mg/L左右,金鱼藻生态组的氨氮基本维持在0.4 mg/L以下,后期出现急增现象,原因是植物出现腐烂现象,植物体中的蛋白质被微生物分解后产生氨基酸,随后氨基酸再进一步分解成氨氮[16]。单一金鱼藻组和金鱼藻生态组对水体氨氮有较好的维护效果,是由于金鱼藻为微生物提供了良好的附着基质和栖息场所,而且金鱼藻光合作用产生的O2也促进了氨氮的硝化去除。空白组出现氨氮降低的原因是水体浮游植物的大量生长,消耗了水中的氨氮。

图3 氮磷元素投加量对比Fig.3 Comparison of nitrogen and phosphorus adding quantity
2.5 再生水COD变化对比
对比了不同实验组COD的变化情况,结果如图6所示。在实验初期,水体中COD均出现快速下降又回升的现象,其原因是由于投加的水生生物存在吸附作用,被吸附的有机物并没有去除,因此之后出现了COD的回升;而空白组COD出现波动现象可能是再生水中的浮游生物生长吸收部分COD,之后存在浮游生物死亡并产生释放,总体上空白组COD稳定在37 mg/L左右。
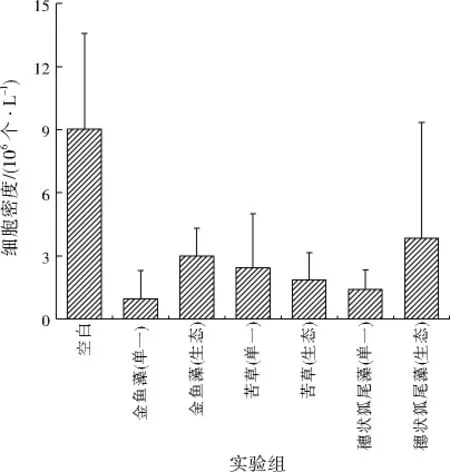
图4 浮游植物的细胞密度对比Fig.4 Comparison of phytoplankton cell density
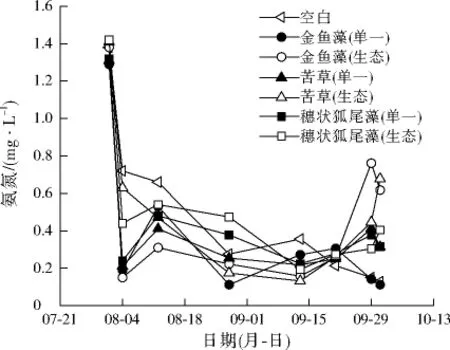
图5 再生水氨氮变化情况Fig.5 Ammonia nitrogen concentration changes of reclaimed water

图6 再生水COD变化情况Fig.6 COD concentration changes of reclaimed water
投加金鱼藻的实验组,水体COD能维持在相对低的水平。单一金鱼藻实验组随着实验的进行,COD总体呈现降低趋势,且在实验中后期COD≤30 mg/L;金鱼藻生态组的COD能维持在30 mg/L左右。投加苦草和穗状狐尾藻的实验组,对COD的去除效果不佳,COD波动明显,部分采样时间甚至超过空白组,原因是部分沉水植物腐烂而导致COD升高,且实验组会出现已沉淀物质再悬浮现象[17],引起水体COD的上升。单一沉水植物组的COD总体低于生态组的原因是底栖软体动物排泄物释放、积累影响到实验水质[18],致使生态组水体COD升高。
2.6 再生水叶绿素a变化对比
随着再生水水温的增高,叶绿素a会出现升高现象,并易发生水华,文献[19]得到叶绿素a的水华阈值为40 μg/L。在实验过程中,叶绿素a的变化情况如图7所示。

图7 再生水叶绿素a变化情况Fig.7 Chla concentration changes of reclaimed water
不同实验组的叶绿素a变化区别较大。空白组叶绿素a峰值达到56.15 μg/L,之后由于水温降低,叶绿素a下降。单一金鱼藻组和金鱼藻生态组对于再生水体的叶绿素a的维护效果较好,其中单一金鱼藻组叶绿素a最高时仅为20.89 μg/L,而金鱼藻生态组的叶绿素a在实验开始时曾达到44.90 μg/L,随后能较好地保持在30 μg/L以下。投加苦草和穗状狐尾藻的实验组,叶绿素a变化较大,对叶绿素a的维护效果弱于金鱼藻。
金鱼藻对叶绿素a有较好控制作用,一方面是通过光和营养物质的竞争,抑制了藻类的生长;另一方面是产生抑制藻类生长的化感物质,通过化感作用抑制藻类生长[20],进而维护了再生水水体的叶绿素a浓度。
2.7 再生水pH变化对比
对比了不同实验组pH的变化情况,结果如图8所示。
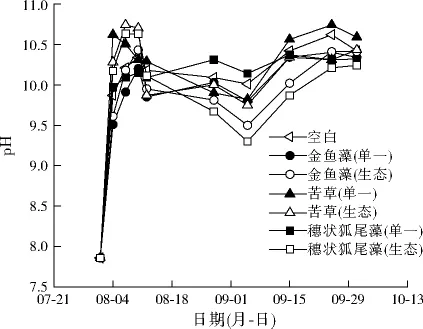
图8 再生水pH变化情况Fig.8 pH changes of reclaimed water
各实验组再生水pH均出现明显升高现象,再生水pH升高的原因是水生植物和浮游植物的光合作用,促进了水体pH的升高[21]。生态组的pH总体低于单一沉水植物组,原因是鲢鱼和椭圆背角无齿蚌的加入,能消化吸收水体中的藻类和有机物碎屑,且水生动物的呼吸作用能释放CO2,溶于水后使水体pH降低[22]。将沉水植物与鲢鱼、椭圆背角无齿蚌组合使用,能完善生态链,促进生态平衡。
3 结 语
(1) 再生水中投加金鱼藻,能较好维护水体的水质稳定,对叶绿素a有较好控制作用,并抑制再生水水体浮游植物的生长,防止水体出现富营养化现象,可应用于北京地区再生水补水型城市河湖的生态修复,与鲢鱼和椭圆背角无齿蚌组合使用,能完善生态链,促进生态平衡。
(2) 由于水箱模拟实验条件与实际水体的真实情况依旧存在较大差距,在水温保持、流速控制等方面存在局限性,因此在实际应用过程中,应针对不同的水文水质条件,进一步研究水生生物的具体投配方式,并配合施加生态管理,以达到水质维护效果好、生态结构稳定性高的效果。
[1] 孟庆义,吴晓辉,赵立新,等.再生水回用于北京景观水体引起的水质变化及其改善措施[J].水资源保护,2011,27(1):51-54.
[2] 杨永东,管运涛,陈俊,等.再生水补充景观水体的富营养化研究[J].环境工程,2012,30(2):135-139.
[3] 李娜,杨建,常江,等.不同工艺再生水补给对景观湖水质变化的影响[J].环境工程学报,2012,6(4):1276-1280.
[4] 范婧,周北海,张鸿涛,等.再生水补充景观水体中藻类的生长比较[J].环境科学研究,2012,25(5):573-578.
[5] 赵原,王彦,汪涛,等.川中丘陵区高富集氮、磷沟渠植物的筛选[J].环境污染与防治,2015,37(10):12-16.
[6] 徐志嫱,刘维,赵洁,等.沉水植物对再生水景观水体水质变化的影响和净化效果[J].水土保持学报,2012,26(2):214-219.
[7] 潘保原,杨国亭,穆立蔷,等.3种沉水植物去除水体中氮磷能力研究[J].植物研究,2015,35(1):141-145.
[8] 何娜,张玉龙,孙占祥,等.水生植物修复氮、磷污染水体研究进展[J].环境污染与防治,2012,34(3):73-78.
[9] 陈志超,张志勇,刘海琴,等.4种水生植物除磷效果及系统磷迁移规律研究[J].南京农业大学学报,2015,38(1):107-112.
[10] 黄亮,黎道丰,蔡庆华,等.不同水生植物对滇池入湖河道污水净化效能的比较[J].生态环境,2008,17(4):1385-1389.
[11] 任文君,田在锋,宁国辉,等.4种沉水植物对白洋淀富营养化水体净化效果的研究[J].生态环境学报,2011,20(2):345-352.
[12] 王瑜.穗花狐尾藻、金鱼藻及圆顶珠蚌对白洋淀水质影响:围隔试验[D].保定:河北大学,2011.
[13] 徐景涛.典型湿地植物对氨氮、有机污染物的耐受性及其机理研究[D].济南:山东大学,2012.
[14] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[15] CHEN X,PELTIER E,STURM B S M,et al.Nitrogen removal and nitrifying and denitrifying bacteria quantification in a stormwater bioretention system[J].Water Research,2013,47(4):1691-1700.
[16] 张菊,邓焕广,王东启,等.不同温度条件下徒骇河沉水植物腐烂对上覆水体中营养盐浓度的影响[J].水资源保护,2011,27(4):22-26.
[17] 吴红飞,魏小飞,关保华,等.沉水植物对鱼类扰动引起的沉积物再悬浮的影响[J].江苏农业科学,2015,43(4):369-371.
[18] 卢晓明,金承翔,黄民生,等.底栖软体动物净化富营养化河水实验研究[J].环境科学与技术,2007,30(7):7-9,115.
[19] 刘波,崔莉凤,刘载文.北京市城区地表水体叶绿素a与藻密度相关性研究[J].环境科学与技术,2008,31(8):29-33.
[20] 孙志伟,邱丽华,段舜山,等.化感作用抑制有害藻类生长的研究进展[J].生态科学,2015,34(6):188-192.
[21] JOHNSON D B,HALLBERG K B.Acid mine drainage remediation options:a review[J].Science of the Total Environment,2005,338(1):3-14.
[22] 敬小军,闵宽洪,姜海洲,等.背角无齿蚌净化精养池塘水质试验[J].南方农业学报,2011,42(4):450-452.
编辑:黄 苇 (2016-02-29)
Comparisonofthreekindsofsubmergedplantsonthereclaimedwaterqualitymaintenance
ZHOUXue1,2,LIZhaoxin1,GUYonggang1,3,HUANGBingbin1,LIUCao1.
(1.BeijingKeyLaboratoryofWaterEnvironmentalandEcologicalTechnologyforRiverBasins,BeijingWaterScienceandTechnologyInstitute,Beijing100048;2.SchoolofEnvironment,HohaiUniversity,NanjingJiangsu210098;3.SchoolofEnvironmentalandMunicipalEngineering,Xi’anUniversityofArchitectureandTechnology,Xi’anShaanxi710055)
In order to prevent eutrophication coursed by the reclaimed water reuse,Vallisnerianatans(Lour.) Hara,CeratophyllumdemersumL. andMyriophyllumspicatumL. were selected,theHypophthalmichthysmolitrixandAnodontawoodianaellipticawere added as well,to maintain the reclaimed water quality. The purification and maintenance effect were compared between different experimental combinations. The results showed that the reclaimed water quality could keep stable in theCeratophyllumdemersumL. experimental group,the COD,ammonia nitrogen concentration could sustain below 30 mg/L and 0.4 mg/L respectively in the middle and later periods.CeratophyllumdemersumL. also could inhibit the growth of phytoplankton,and the chlorophyll a concentration could keep less than threshold of algal blooms (40 μg/L). Simultaneously,the ecological system was completed by the adding ofHypophthalmichthysmolitrixandAnodontawoodianaelliptica,which also maintained the pH value of reclaimed water stable.
reclaimed water; submerged plant;CeratophyllumdemersumL.; water quality maintenance
周 雪,女,1991年生,硕士研究生,研究方向为水体富营养化治理与生态修复。#
。
*北京市科技计划项目(No.Z151100002115008)。
10.15985/j.cnki.1001-3865.2017.05.007
