茧蜂病毒调控寄主细胞的NF-κB信号通路
2017-11-07刘樾彤罗开珺
徐 沙,刘樾彤,罗开珺
(云南大学生命科学学院,云南省高校动物遗传多样性和进化重点实验室,昆明 650091)
茧蜂病毒调控寄主细胞的NF-κB信号通路
徐 沙,刘樾彤,罗开珺*
(云南大学生命科学学院,云南省高校动物遗传多样性和进化重点实验室,昆明 650091)
多分DNA病毒(Polydnaviruses,PDVs)是寄生蜂的共生病毒。已有研究报道PDVs能感染寄主血细胞并有特异性表达,但是,哪些病毒的DNA片段能进入寄主细胞,并参与调控NF-κB信号通路仍然还不清楚。本研究结果初步表明,在双斑侧沟茧蜂病毒(Microplitisbicoloratusbracovirus,MbBV)感染细胞后24 h能导致细胞凋亡,vank86、vank92、ptp109病毒基因片段均能在被感染后的Spli221(斜纹夜蛾)、Sf9(草地贪夜蛾)、High Five(粉纹夜蛾)细胞的DNA中检测到,但转录水平有差异。进一步对这3个基因与NF-κB调控的下游抗菌肽基因(attacin、defensin)和免疫基因酚氧化酶原激活酶(ppA3)的相互关系研究发现:在病毒感染Spli221、Sf9、High Five细胞24 h后,检测到Spli221细胞中attacin、defensin、ppA3的转录本,attacin基因显著下调;过表达Vank86、Vank92、PTP109的Spli221细胞,由LPS刺激后检测到只表达单个病毒蛋白的Spli221细胞中的attacin、defensin、ppA3的 mRNA表达水平无显著变化。研究初步揭示了MbBV病毒感染Spli221细胞后抑制NF-κB信号通路,但单个病毒蛋白不能抑制NF-κB信号通路,实验结果为进一步深入研究多个病毒基因的共同作用及其在害虫生物防治中的应用打下了基础。
多分DNA病毒;脂多糖;NF-κB;抗菌肽;酚氧化酶原激活酶
多分DNA病毒(Polydnaviruses,PDVs)是与寄生鳞翅目的膜翅目姬蜂科Iehneumoniae和茧蜂科Bracoindae寄生蜂共生的一类昆虫病毒(Dupuyetal., 2006; Amico and Slavicek, 2012)。这两类病毒的DNA以原病毒的形式整合到寄生蜂的基因组中并以垂直传播的方式传给子代寄生蜂(Desjardinsetal., 2008)。病毒在雌蜂卵巢中的萼细胞的细胞核中进行复制和组装,成熟的病毒粒子储存在卵巢萼液中,当雌蜂产卵时,病毒粒子随同寄生蜂的卵一起被注射到寄主血腔中,已有报道表明,进入寄主血腔的病毒DNA能整合到寄主细胞中开始转录(Becketal., 2011)。实验室前期的研究结果发现13个基因的mRNA可以在寄生后的寄主血淋巴中检测到,其中包括有:编码蛋白络氨酸磷酸酯酶(Protein tyrosine phosphatase,PTP)的基因和编码病毒锚蛋白重复序列结构(Viral Ankyrin repeat,vank)的基因(Lietal., 2014)。茧蜂病毒中的PTPs蛋白通过抑制免疫细胞的细胞骨架来阻止寄主卵细胞被包囊(Whitfield, 1990; Espagneetal., 2004)。Vanks蛋白属于IκB-like家族,这类蛋白的锚蛋白重复结构序列和果蝇NF-κB信号通路中IκB家族成员的cactus蛋白具有相似的结构域(Belvin and Anderson, 1996; Sankaretal., 1998; Bae and Kim, 2009)。这两种蛋白是否具有抑制寄主免疫反应的功能,仍然需要详细的研究去证实。
免疫刺激因子脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁成分,会激发昆虫的先天免疫反应(刘甜和罗开珺,2011)。已有研究报道LPS可以激活小鼠肺损伤中的NF-κB信号通路(Guha and Mackman, 2001; Tianzhu and Shumin, 2015)。NF-κB信号通路是Toll和IMD两条信号通路下游的一个关键分子,果蝇中Toll信号通路被病原体激活后促使NF-κB核转录因子Dorsal/Dif从IκB家族成员Cactus上释放,从而进入细胞核(Lehmingetal., 1995; Nicolasetal., 1998)。IMD信号通路激活后会诱导Relish蛋白上caspase 8调控的片段降解,导致形成NF-κB的N端Rel-68片段进入细胞核而C端Rel-49留在细胞质中与ank蛋白结合,发挥抑制作用(Stovenetal., 2000; Stovenetal., 2003; 卢新民和叶恭银,2006)。激活Toll和IMD信号通路中的NF-κB核转录因子,调控抗菌肽基因(AMPs)和其他基因的表达(Lemaitreetal., 1996; Chevignonetal., 2014),保护寄主抵御微生物(病毒、细菌、真菌、原生动物)的入侵(Rutschmannetal., 2002; Panetal., 2012)。然而茧蜂病毒中的ptps和vanks是否参与寄主细胞NF-κB信号通路的调控,目前研究尚不清楚。
本文以双斑侧沟茧蜂病毒(Microplitisbicoloratusbracovirus,MbBV)和Spli221(斜纹夜蛾Spodopteralitura)、Sf9(草地贪夜蛾Spodopterafrugiperda)、High Five(粉纹夜蛾Trichoplusiani)细胞为研究对象,对MbBV-ptp和MbBV-vank病毒片段的功能进行研究。研究表明:MbBV-vank86,vank92和ptp109的病毒基因片段能在被感染的昆虫细胞的DNA中被检测到,但转录水平有差异。并且MbBV感染Spli221细胞后抑制了NF-κB信号通路活性,但用LPS刺激过表达Vank86、Vank92的Spli221细胞后发现不能抑制NF-κB下游抗菌肽attacin、防御素defensin的表达,表明MbBV病毒可以抑制NF-κB信号通路,但只表达Vanks中单个病毒蛋白不能调控NF-κB信号通路。这为实验室进一步深入研究多个病毒基因共同参与作用及其在害虫生物防治中的应用打下了基础。
1 材料和方法
1.1 昆虫细胞培养
Spli221斜纹夜蛾细胞系(Yanaseetal., 1998)、High Five粉纹夜蛾细胞系(Robertetal., 1994)(由中山大学有害生物控制与资源利用国家重点实验室赠与);Sf9细胞系(Vaughnetal., 1977)(由云南省出入境检验检疫局动检处赠与),以上细胞系均由本实验室培养、传代和冻存。培养的培养基为含10%胎牛血清的Hyclone TNM-FH昆虫培养基,培养于27℃细胞培养箱中。
1.2 病毒粒子的纯化及感染
依照实验室前期的纯化方法将病毒粒子进行纯化(Luo and Pang, 2006),病毒粒子纯化好以后,将培养好的不同细胞均匀铺在细胞瓶中,按1×105细胞用一个雌蜂病毒量进行感染(Luo and Pang, 2006; Becketal., 2011),分别在感染后(post infection,p.i.)观察细胞形态。
1.3 感染寄主细胞中病毒DNA片段的检测
提取感染后72 h、2周、1个月的细胞DNA进行病毒DNA片段检测,DNA提取试剂盒购买于北京天根生化科技有限公司。
1.4 感染寄主细胞中病毒mRNA的转录检测
提取感染后72 h、2周、1个月的细胞mRNA反转录为cDNA后进行病毒mRNA的转录检测。RNA提取试剂盒(RNAisoTM Plus);RT-PCR(Perfect Real Time)反转录试剂盒购于大连宝生物有限公司。
1.5 引物设计和合成
设计引物时,根据MbBV病毒转录组测序发现的双斑侧沟茧蜂vank86、vank92、ptp109基因序列和attacin、defensin和ppA3的序列(Lietal., 2014)。本论文中所用的引物,均由英潍捷基(上海)贸易有限公司合成,具体序列及说明见表1。
1.6 茧蜂病毒的vank86、vank92、ptp109的真核表达载体构建
取本实验室已构建好的E-pMD-19T菌液,加A+抗性过夜培养,用试剂盒提取质粒,对vank86、vank92、ptp109进行双酶切,用同样的酶切位点对真核pIZT/V5-His载体进行双酶切。随后将T载体上的目的基因片段和真核表达载体片段进行胶回收,连接,转化大肠杆菌DH5α,鉴定(刘信毅和罗开珺,2015)。过夜培养鉴定连接正确的菌液,用无内毒素质粒提取试剂盒提取质粒,用于真核细胞系的转染和表达。质粒提取试剂盒E.Z.N.A Plasmid Mini Kit I和Endo-free Plasmid Mini Kit II购于OMEGA生物公司,大肠杆菌DH5α购于昆明云科生物技术有限公司。
1.7 细胞转染和LPS的免疫刺激
用实验室已建立的转染方法(Liuetal., 2013)转染寄主Spli 221细胞48 h后用LPS刺激24 h,LPS的终浓度为15 μg/mL,对照组加入等量的PBS。
1.8 Western blot检测
真核表达中,细胞转染72 h后,提取细胞总蛋白,用BCA法测定蛋白浓度。取50 ug蛋白上样电泳,300 mA转膜1.5 h,5%的脱脂牛奶室温封闭1 h,洗膜后真核表达用V5标签抗体(1 ∶2000)孵育过夜和二抗(1 ∶5000)孵育1 h,洗膜后用ECL发光液曝光显影(刘信毅和罗开珺,2015)。Tubulin抗体、蛋白Marker、HRP偶联的羊抗鼠二抗及BeyoECL Plus 购于碧云天公司,V5抗体购于Invitrogen公司。

表1 本研究所用到的引物Table 1 Primers used in this study
1.9 实时荧光定量PCR(qRT-PCR)检测
MbBV病毒感染Spli 221、Sf 9、High Five细胞和过表达Vank86、Vank92、PTP109蛋白的Spli221细胞,提取RNA进行反转录,然后进行实时荧光定量PCR(qRT-PCR)检测attacin、defensin、ppA3转录水平的变化,最终使用非参数T检验分析。
2 结果与分析
2.1 MbBV感染导致昆虫细胞形成凋亡小体
实验室先前的研究表明,双斑侧沟茧蜂自然寄生斜纹夜蛾后能够诱导血细胞发生凋亡(Luo and Pang, 2006)。为研究MbBV能否直接诱导其它昆虫细胞凋亡,我们用纯化后的MbBV病毒粒子感染Spli221、Sf9、High Five细胞。发现感染24 h后 Spli221细胞出现凋亡小体,并一直延续到48 h仍能观察到凋亡小体,但是,随着时间的延长,在感染后72 h,就不能观察到细胞的凋亡小体(图1A);在Sf9细胞中,凋亡小体的出现从感染后24 h一直延续到72 h(图1B);同样,在High Five细胞中,凋亡小体的出现从感染后24 h一直延续到72 h(图1C)。结果发现,MbBV病毒粒子的感染能诱导昆虫细胞发生凋亡,而感染后24 h在3种昆虫细胞中都出现了稳定的凋亡症状。

图1 MbBV病毒感染不同昆虫细胞后的形态Fig. 1 Morphology of different cells after MbBV infected注:A,MbBV感染Spli221细胞24 h、48 h、72 h时的细胞形态;B,MbBV感染Sf9细胞24 h、48 h、72 h时的细胞形态;C,MbBV感染High Five细胞24 h、48 h、72 h时细胞形态观察;比例尺= 10 μm。Note: A, morphology of Spli221cell after MbBV infected 24 h, 48 h, 72 h; B, morphology of Sf9 cell after MbBV infected 24 h, 48 h, 72 h; C, morphology of High Five cell after MbBV infected 24 h, 48 h, 72 h; bar=10 μm.
2.2 MbBV感染的昆虫细胞内,病毒DNA片段的检测
实验室的数据显示,在感染后短时间内(5 h),均能在被感染的细胞中检测到上述3个基因的DNA片段和转录mRNA(Yuetal., 2016),为进一步探明随感染时间的变化被病毒感染的细胞中是否还存在病毒DNA片段,本研究提取了感染后72 h、2周、1个月的细胞基因组DNA,用vank86、vank92、ptp109引物(表1)进行PCR检测,结果在细胞的DNA中发现了vank86、vank92、ptp109基因片段(图2A、B、C),但是在感染后72 h,ptp109只在Spli221细胞的DNA中检测到(图2B),结果表明被MbBV感染的细胞DNA中都存在有vank86、vank92、ptp109基因片段。
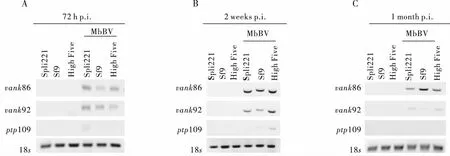
图2 MbBV病毒感染不同昆虫细胞后琼脂糖凝胶电泳检测Fig.2 Analysis of MbBV infected different cells by agarose gel electrophoresis注:图通过Image J反转;A,MbBV感染Spli221、Sf9、High Five细胞72 h后PCR电泳检测;B,MbBV感染Spli221、Sf9、High Five细胞2周后PCR电泳检测;C,MbBV感染Spli221、Sf9、High Five细胞1个月后PCR电泳检测。Note: The picture Inverting by Image J; A, analysis of PCR product are amplified vank86, vank92, ptp109 when MbBV infected different insect cells(Spli221、Sf9、High Five) 72 h; B, analysis of PCR product are amplified vank86, vank92, ptp109 when MbBV infected different insect cells(Spli221, Sf9, High Five) 2 weeks; C, analys of PCR product is amplified vank86, vank92, ptp109 when MbBV infected different insect cells(Spli221, Sf9, High Five) 1 month.
2.3 MbBV感染后,昆虫细胞内病毒基因的转录检测
为了进一步探明随感染时间的变化,在感染细胞DNA中存在的病毒基因片段vank86、vank92、ptp109是否能在细胞内进行转录,本研究提取了MbBV感染后72 h、2周、1个月的细胞总RNA,转录为cDNA,进行RT-PCR检测。结果发现在感染后72 h三种昆虫细胞均不能检测到vank86、vank92、ptp109基因片段的mRNA转录(图3A)。但2周时vank86基因片段在Spli221、Sf9、Hive Five细胞中有mRNA的转录,vank92基因片段在Sf9、Hive Five细胞中有mRNA的转录(图3B)。1个月时vank86和vank92基因片段只在Sf9细胞中有mRNA的转录(图3C);相反,ptp109基因片段在整个感染过程中都未能检测到mRNA的转录。结果表明,vank86、vank92、ptp109在MbBV感染不同昆虫细胞时随感染时间的延长有转录水平的差异。
2.4 MbBV病毒调控凋亡细胞的NF-κB信号通路,抑制抗菌肽基因attacin的转录
实验室前期报道了,双斑侧沟茧蜂影响寄主血细胞凋亡的主要信号通路,包括NF-κB信号通路(Lietal., 2014)。Bitra等2012年报道了毁侧沟茧蜂病毒能调控NF-κB信号通路(Bitraetal., 2012)。为检测MbBV病毒感染Spli221、Sf9、High Five细胞后是否能调控NF-κB信号通路,于是检测了NF-κB信号通路调控的下游抗菌肽基因attacin和defensin的转录(Shubha,1999)。结果发现病毒感染细胞Sf9、High Five细胞后NF-κB信号通路未被激活(未检测到抗菌肽基因attacin和defensin的转录)。检测到病毒感染Spli221细胞24 h后attacin显著下调(图4)。结果表明,在病毒感染Spli221细胞以后,MbBV病毒抑制Spli221细胞中的NF-κB信号通路。

图3 MbBV感染不同昆虫细胞后RT-PCR检测Fig.3 RT-PCR detection of MbBV infected different cells注:图通过Image J反转;A,MbBV感染Spli221、Sf9、High Five细胞72 h后RT-PCR检测;B,MbBV感染Spli221、Sf9、High Five细胞2周后RT-PCR检测;C,MbBV感染Spli221、Sf9、High Five细胞1个月后RT-PCR检测。Note: The picture Inverting by Image J; A, analysis of RT-PCR product is amplified vank86, vank92, ptp109 when MbBV infected different insect cells(Spli221, Sf9, High Five) 72 h; B, analysis of RT-PCR product is amplified vank86, vank92, ptp109 when MbBV infected different insect cells (Spli221, Sf9, High Five) 2 weeks; C, analysis of RT-PCR product is amplified vank86,vank92,ptp109 when MbBV infected different insect cells(Spli221, Sf9, High Five) 1 month.
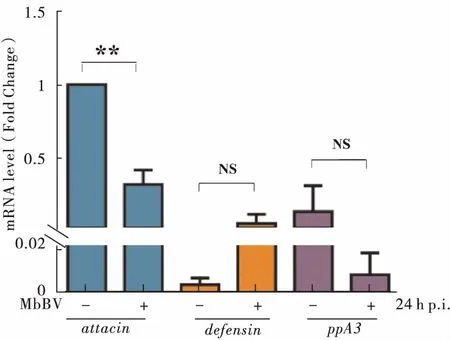
图4 MbBV病毒感染Spli221细胞后抗菌肽基因和免疫基因的检测Fig.4 Amps and immune gene transcription detection after MbBV infected Spli221注:非参数T检验,*表示差异显著(P<0.05),**表示差异显著(P<0.01),NS表示没有显著差异(P>0.05)。Note: Nonparametric tests; *, means significant difference between treatment and control; **, means extremely significant difference between treatment and control; NS, means no significant difference between treatment and control.
2.5 表达单个病毒蛋白不能抑制LPS刺激下的NF-κB信号通路
MbBV病毒感染细胞后,会表达多个病毒蛋白一起参与免疫反应,为检测只表达单个病毒蛋白的细胞是否也能抑制NF-κB信号通路,于是本研究构建只表达单一病毒蛋白的Vank86、Vank92、PTP109真核表达载体(图5A),将验证正确的质粒转染进Spli221细胞,72 h后提取细胞总蛋白,用能识别载体本身表达的V5序列的标签抗体进行Western blot实验,发现Vank86、Vank92蛋白在大于23 kDa处有一条特异性的条带,与预期的融合蛋白大小一致。Vank86的融合蛋白大小为24 kDa,Vank92的融合蛋白大小为23 kDa,然而PTP109在44 kDa处出现一条主要带(图5B)。
在Spli221细胞中过表达Vank86、Vank92、PTP109 48 h后,加入LPS刺激细胞24 h后,检测attacin、defensin、ppA3的mRNA水平,发现表达Vank86蛋白后,attacin基因表达上调,而表达Vank92蛋白、PTP109蛋白后没有引起attacin、defensin、ppA3在mRNA水平的变化,以上结果表明:Vank86、Vank92、PTP109不能抑制Spli221细胞中由LPS刺激引起的NF-κB信号通路的变化,调控抗菌肽基因attacin和defensin的转录,暗示只表达单个病毒蛋白不能抑制NF-κB信号通路。

图5 MbBV基因片段在昆虫细胞中的表达及对抗菌肽相关基因表达的影响(两次独立实验)Fig.5 MbBV segments expression in insect cells and the influence of Amps and immune gene(two independent experiment)注:非参数T检验,*表示差异显著(P<0.05),NS表示没有显著差异(P>0.05);A,vank86、vank92、ptp109真核表达结构;B,Western blot检测Vank86、Vank92、PTP109在Spli221中融合蛋白的表达;C,Vank86不能抑制attacin、ppA3的表达;D,Vank92不能抑制attacin、defensin、ppA3的表达;E,PTP109不能抑制attacin、defensin、ppA3的表达。Note: Nonparametric tests; *, means significant difference between treatment and control; NS, means no significant difference between treatment and control. A, vank86, vank92, ptp109 eukaryotic expression structure; B, expression of fusion protein Vank86-V5-His, Vank92-V5-His, PTP109-V5-His determined by Western blot in Spli221 cells; C, Vank86 didn’t inhibite attacin’s, ppA3’s expression; D, Vank92 didn’t inhibite attacin’s, defensin’s, ppA3’s expression; E, PTP109 didn’t inhibite attacin’s,defensin’s,ppA3’s expression.
3 结论与讨论
PDVs可以诱导寄主细胞凋亡,但感染除寄主细胞外的细胞是否会导致细胞凋亡,目前研究尚少。本文研究表明MbBV病毒感染Spli221、High Five、Sf9细胞后会诱导细胞发生短期的凋亡(图1),Sf9细胞在病毒感染后的凋亡细胞的出现时间长于High Five和Spli221细胞,可能与Sf9中存在低水平的激活型Caspase3凋亡蛋白有关(Liuetal., 2013)。High Five和Spli221细胞凋亡可能与细胞中的PI3K信号通路失活有关(Liuetal., 2010)。Spli221细胞感染24 h和48 h细胞表面出现膨泡,但感染Spli221细胞72 h未观察到细胞凋亡。非常有趣的发现是,在感染72 h后,未能观察到Spli221细胞、High Five细胞、Sf9细胞凋亡,这可能是由于病毒随着感染时间的推移,失去转录能力。
病毒DNA可以整合到细胞中(Burke and Strand, 2012)。本研究结果显示,MbBV病毒vank86、vank92、ptp109基因片段可以在被感染的Spli221细胞、High Five细胞、Sf9细胞中检测到。本文研究发现vank86、vank92基因片段在Spli221、High Five、Sf9稳定细胞系中检测到,然而ptp109基因片段不能在稳定细胞系中检测到。已有研究报道Tranosemarostraleichnovirus(TrIV)病毒基因组DNA能整合到Tranosemarostralevirus萼液细胞的细胞系中(Gundersen-Rindal and Pedroni, 2006;Doucetetal., 2007)。本研究中,仅用了病毒基因进行PCR检测,并不能确定这些基因片段整合进了被病毒感染的细胞中,但已经建立了能稳定检测到病毒DNA的细胞系,正在进行下一步的探索研究。
为了进一步验证寄主细胞中病毒基因的转录表达,本研究进行RT-PCR检测发现vank86、vank92、ptp109基因片段转录水平有差异,vank86、vank92、在2周和1个月时在Sf9细胞中都有转录,但在Spli221细胞和High Five细胞中ptp109未检测到转录,未转录的现象可能需要做更精确的实时荧光定量水平的检测。以上结果表明MbBV病毒基因片段进入寄主细胞后可能行使功能。
在Glyptapantelesindiensisbracovirus(GiBV)病毒中的ptp和vanks,ptp可能会和信号转导有关,而vanks和抑制NF-κB信号途径有关(Gundersen-Rindal and Pedroni, 2006)。于是推测ptp和vanks基因编码的蛋白可能会参与到寄主的免疫系统中。病毒Vank蛋白缺少N端和C端的调控结构域,这些蛋白可以有效的抑制寄主昆虫的NF-κB信号通路(Espagneetal., 2004; Gundersen-Rindal and Pedroni, 2006)。PDV抑制寄主血淋巴的黑化(melanizadoll)时,寄主免疫系统的抗菌抗病毒能力也会受到影响(Ashida and Brey, 1995)。然而在检测MbBV病毒感染Spli221、Sf9、High Five细胞后,未检测到Sf9和High Five细胞中抗菌肽基因和酚氧化还原激活酶的变化,这可能与细胞的种类有关,不同的细胞对外界信号的敏感度存在差异,导致细胞中信号通路的激活之间存在差异。然而检测到Spli221细胞中的NF-κB信号通路活性受到抑制,这可能是由于病毒蛋白和Spli221细胞中NF-κB蛋白发生相互作用(Hongladaetal.,2005),具体原因还需进一步研究。通过LPS刺激Spli221细胞后并未检测到Vank86、Vank92、PTP109会对NF-κB信号通路产生影响,猜测可能是因为MbBV病毒粒子感染细胞时,存在多个病毒蛋白一起发挥抑制作用,而用LPS刺激表达单个病毒蛋白的细胞时,病毒蛋白并不能很好的发挥作用,从而不能抵御外界刺激。可能需要一起表达多个病毒蛋白才能发挥作用,具体原因还需要更进一步的实验进行探究。
本实验室通过病毒感染细胞后发现病毒会促进昆虫细胞产生凋亡小体,并在被感染的细胞中检测到了病毒基因片段,同时MbBV病毒可以抑制Spli221细胞中的NF-κB信号通路,该研究结果为后期实验室开展深入的病毒基因的功能研究打下了基础。
References)
Amico VD, Slavicek J. Interactions between nucleopolyhedroviruses and polydnaviruses in larval lepidoptera [J].MolecularVirology, 2012: 126-146.
Ashida M, Brey PLT. Role of the integument in insect defense: Pro-phenol oxidase cascade in the cuticular matrix [J].ProceedingsoftheNationalAcademyofSciencesoftheUSA, 1995, 92(23): 10698-10702.
Bae S, Kim Y. IκB genes encoded inCotesiaplutellaebracovirus suppress an antiviral response and enhance baculovirus pathogenicity against the diamondback moth,Plutellaxylostella[J].Invertebr.Pathol., 2009, 102(1): 79-87
Bai SF, Li X, Sun SJ. Polydnavirus genome organization and gene expression in parasitoid [J].JournalofHenanAgriculturalUniversity, 2004, 38(3): 313-318. [白素芬, 李欣, 孙淑君. 寄生蜂多分DNA病毒基因组结构及基因表达[J]. 河南农业大学学报, 2004, 38(3): 313-318]
Beck MH, Zhang S, Bitra K,etal. The encapsidated genome ofMicroplitisdemolitorbracovirus integrates into the hostPseudoplusiaincludens[J].JournalofVirology, 2011, 85(22): 11685-11696.
Belvin MP, Anderson KV. Interactions between nucleopolyhedroviruses and polydnaviruses in larval lepidoptera [J].CellDev.Biol., 1996, 12: 393-416.
Bitra K, Suderman RJ, Strand MR. Polydnavirus ank proteins bind NF-kappaB homodimers and inhibit processing of Relish [J].PLoSPathog., 2012, 8(5): e1002722.
Burke GR, Strand MR. Polydnaviruses of parasitic wasps: Domestication of viruses to act as gene delivery vectors [J].Insects, 2012, 3(1): 91-119.
Chevignon G, Theze J, Cambier S,etal. Functional annotation ofCotesiacongregatabracovirus: Identification of viral genes expressed in parasitized host immune tissues [J].JournalofVirology, 2014, 88(16): 8795-8812.
Desjardins CA, Gundersen-Rindal DE, Hostetler JB,etal. Comparative genomics of mutualistic viruses ofGlyptapantelesparasitic wasps [J].GenomeBiol., 2009, 9(12): R183.
Doucet D, Levasseur A, Beliveau C,etal. In vitro integration of an ichnovirus genome segment into the genomic DNA of lepidopteran cells [J].JournalofGeneralVirology, 2007, 88(1): 105-113.
Dupuy C, Huguet E, Drezen JM.Unfolding the evolutionary story of polydnaviruses [J].VirusResearch, 2006, 117(1): 81-89.
Espagne E, Dupuy C, Huguet E,etal. Genome sequence of a polydnavirus: Insights into symbiotic virus evolution [J].Science, 2004, 306(5694): 286-289.
Fleming J-AGW. Polydnaviruses: Mutualists and pathogens [J].AnnualReviewofEntomology, 1992, 37(1): 401-425.
Guha M, Mackman N. LPS induction of gene expression in human monocytes [J].CellularSignalling, 2001, 13(2): 85-94.
Gundersen-Rindal D, Pedroni M.Characterization and transcriptional analysis of protein tyrosine phosphatase genes and an ankyrin repeat gene of the parasitoidGlyptapantelesindiensispolydnavirus in the parasitized host [J].JournalofGeneralVirology, 2006, 87(2) 311-322.
Honglada T, Beck MH, and Strand MR. Inhibitor κB -like proteins from a polydnavirus inhibit NF-κB activation and suppress the insect immune response [J].DepartmentofEntomology, 2005, 102(32):11426-11431.
Ibrahim A, Kim Y. Transient expression of protein tyrosine phosphatases encoded inCotesiaplutellaebracovirus inhibits insect cellular immune responses [J].Naturwissenschaften, 2008, 95(1): 25-32.
Lehming N, Mcguire S, Brickman J,etal. Interactions of a Rel protein with its inhibitor [J].Biochemistry, 1995, 92(22): 10242-10246.
Lemaitre B, Nicolas E, Michaut L,etal. The dorsoventral regulatory gene cassettespatzle/Toll/cactuscontrols the potent antifungal response inDrosophilaadults [J].Cell, 1996, 86(6): 973-983.
Li G, Chen Q, Pang Y. Studies of artificial diets for the beet armyworm,Spodopteraexigua[J].Actascientiaecircumstantiae、HuanjingKexueXuebao, 1998, 37: 1-5.
Lemaitre B, Hoffmann J. The host defense ofDrosophilamelanogaster[J].Annu.Rev.Immunol., 2007, 25(1): 697-743.
Li M, Pang Z, Xiao W,etal. A transcriptome analysis suggests apoptosis-related signaling pathways in hemocytes ofSpodopteralituraafter parasitization byMicroplitisbicoloratus[J].PLoSONE, 2014, 9(10): e110967.
Liu JJ, Liu WD, Yang HZ,etal. Inactivation of PI3k/Akt signaling pathway and activation of caspase-3 are involved in tanshinone I-induced apoptosis in myeloid leukemia cells in vitro [J].AnnalsofHematology, 2010, 89(11): 1089-1097.
Liu T, Li M, Zhang Y,etal. A role for innexin2 and innexin3 proteins fromSpodopteraliturain apoptosis [J].PLoSONE, 2013, 8(7): e70456.
Liu T, Luo KJ. Immunity-related domains of Toll and IMD signaling pathways inDrosophila[J].JournalofEnvironmentalEntomology, 33(3): 388-395. [刘甜, 罗开珺, 果蝇Toll和IMD信号通路中的功能结构[J]. 环境昆虫学报, 2011, 33(3): 388-395]
Liu X, Luo KJ. Molecular cloning and construction of expression vector of innexin1,innexin4 fromSpodopteralitura[J].JournalofEnvironmentalEntomology, 37(5): 970-978. [刘信毅, 罗开珺. 斜纹夜蛾inx1,inx4基因的克隆及表达载体构建[J]. 环境昆虫学报, 2015, 37(5): 970-978]
Lu XM, Ye GG. The NF-κB signal pathway of insects [J].ChineseJournalofCellBiolog, 2006, 28: 561-565. [卢新民, 叶恭银. 昆虫的NF-kB信号通路[J]. 细胞生物学杂志, 2006, 28:561-565 ]
Luo K, Pang Y. Disruption effect ofMicroplitisbicoloratuspolydnavirus EGF-like protein, MbCRP, on actin cytoskeleton in lepidopteran insect hemocytes [J].ActaBiochimicaetBiophysicaSinica, 2006, 38(8): 577-585.
Luo K, Pang Y.Spodopteralituramulticapsid nucleopolyhedrovirus inhibitsMicroplitisbicoloratuspolydnavirus-induced host granulocytes apoptosis [J].JournalofInsectPhysiol, 2006, 52(8): 795-806.
Luo K, Trumble J, Pang Y. Development ofMicroplitisbicoloratusonSpodopteralituraand implications for biological control [J].BioControl, 2006, 52(3): 309-321.
Nicolas E, Reichhar J, Hoffmann J,etal. In vivo regulation of the IκB homologuecactus during the immune response ofDrosophila[J].JournalofBiologicalChemistry, 1998, 273(17): 10463-10469.
Pan X, Zhou G, Wu J,etal.Wolbachiainduces reactive oxygen species(ROS) -dependent activation of the Toll pathway to control dengue virus in the mosquitoAedesaegypti[J].ProceedingsoftheNationalAcademyofSciencesoftheUSA, 2012, 109(1): E23-31.
Robert RG, Li G, Anja C,etal. A new insect cell line fromTrichoplusiani(BTI-Tn-5B1-4) susceptible toTrichoplusianisingle enveloped nuclear polyhedrosis virus [J].JournalofInvertebratePathology, 1994, 64(3): 260-266.
Rutschmann S, Kilinc A, Ferrandon D. Cutting Edge: TheTollpathway is required for resistance to gram-positive bacterial infections inDrosophila[J].TheJournalofImmunology, 2002, 168(4): 1542-1546.
Sankar Ghosh, Michael J. May, Kopp. EB. NF-κB and Rel proteins: Evolutionarily conserved mediators of immune responses [J].Annu.Rev.Immunol, 1998, 16(1): 225-260.
Shubha Govind. Control of development and immunity by Rel transcription factors inDrosophila[J].DepartmentofBiology, 1999, 18(49): 6875-6887.
Stoven S, Ando I, Kadalayil L,etal. Activation of theDrosophilaNF-kB factor Relish by rapid endoproteolytic cleavage [J].EMBOReports, 2000, 1(4): 347-352.
Stoven, Silverman N, Junell A,etal. Caspase-mediated processing of theDrosophilaNF-kappaB factor Relish [J].ProceedingsoftheNationalAcademyofSciencesoftheUSA, 2003, 100(10): 5991-5996.
Tianzhu Z, Shumin W. Esculin inhibits the inflammation of LPS-induced acute lung injury in mice via regulation of TLR/NF-kappaB pathways [J].Inflammation, 2015, 38(4): 1529-1536.
Vaughn JL, Goodwin RH, Tompkins GJ,etal. The establishment of two cell lines from the insectSpodopterafrugiperda(lepidoptera; noctuidae) [J].InVitroCellular&DevelopmentalBiology-Plant, 1977, 13(4): 213-217.
Whitfield JB. Parasitoids, polydnaviruses and endosymbiosis [J].ParasitolToday, 1990, 6(12): 381.
Yanase T, Yasunaga C, Kawarabata T. Replication ofSpodopteraexiguanucleopolyhedrovirus in permissive and non-permissive lepidopteran cell lines [J].ActaVirologica, 1998, 42(5): 293-298.
Yu DS, Chen YB, Li M,etal. A polydnaviral genome of fMicroplitisbicoloratusbracovirus and molecular interactions between host and virus with respect to NF-κB singal [J].ArchivesofVirology, 2016, 161(11): 3095-3124.
MbBVregulateshostcell’sNF-κBsignalpathway
XU Sha, LIU Yue-Tong, LUO Kai-Jun*
(Yunnan Province Key Laboratory for University Zoological Genetic Diversity and Evolution, School of Biosciences, Yunnan University, Kunming 650091, China)
Polydnaviruses(PDVs) are symbiotic virus of parasitoid wasps. It has been reported that PDVs can infected and specifically express on the host hemocytes. However, which virus DNA segments can enter the host cell and participate in the regulation of NF-κB signal pathway remain unclear. Our preliminary research results showed thatMicroplitisbicoloratusbracovirus(MbBV) can induce cells apoptosis after infected 24 h. MbBV-vank86,vank92,ptp109 segments were detected in insect cells(Spli221, Sf9, High Five) after infected with MbBV, but there were differences on transcription levels. Further more, We explore the relationship between three genes and downstream of NF-κB signal pathway antibacterial peptide(attacin,defensin) and immune gene prophenolosidase-activating enzyme(ppA3): When MbBV infected Spli221, Sf9, High Five 24 hours, we detect transcription level ofattacin,defensin,ppA3. We findattacindown-regulation extremely. Vank86, Vank92, PTP109 over-expression were detected in Spli221, attacin,defensin, ppA3 mRNA level have no significant difference after LPS stimulated. These results suggested that MbBV can regulate NF-κB signal pathway in Spli221 cell, but single virul protein cann’t inhibit NF-κB signal pathway. The results of this study could offer a reliable experiment basis for exploringmultiple genes function together and insect pests biological control in the future.
Polydnaviruses; lipopolysaccharide; NF-κB; antibacterial peptide; prophenolosidase-activating enzyme
徐沙,刘樾彤,罗开珺.茧蜂病毒调控寄主细胞的NF-κB信号通路[J].环境昆虫学报,2017,39(5):1090-1099.
Q963;S476
A
1674-0858(2017)05-1090-10
国家自然科学基金项目(31060251,31260448,31471823);云南省应用基础研究计划重点项目(2013FA003)
徐沙,女,1991年生,云南宣威人,硕士,主要从事昆虫的先天免疫研究
*通讯作者Author for correspondence, E-mail: kaijun_luo@ynu.edu.cn
Received: 2016-08-02;接受日期Accepted: 2016-12-08
