酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼生长和主要代谢酶活力的影响
2017-11-07李学丽王际英宋志东孙永智张利民
李学丽,王际英,宋志东,谭 青,孙永智,张利民
酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼生长和主要代谢酶活力的影响
李学丽1,2,王际英2,宋志东2,谭 青1,2,孙永智2,张利民2
(1.上海海洋大学水产与生命学院,上海 201306;2.山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,烟台 264006)
用酶解豆粕替代基础饲料中0、20%、40%、60%和80%的鱼粉,配制5种等氮等能的饲料(HSM0、HSM20、HSM40、HSM60、HSM80,其中 HSM0为对照组)。研究了酶解豆粕替代鱼粉对珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)幼鱼生长、体组成、消化和代谢的影响。结果显示:1)HSM40组幼鱼的增重率和特定生长率显著提高(P<0.05),HSM80组增重率、特定生长率和蛋白质效率显著降低(P<0.05),酶解豆粕替代40%以上时显著提高了幼鱼的摄食率。2)HSM40组肌肉粗蛋白含量显著升高(P<0.05),HSM40~HSM80组全鱼和肌肉粗脂肪含量显著低于其余组(P<0.05),HSM40和HSM60组全鱼粗灰分含量显著高于其余组(P<0.05),各试验组肌肉氨基酸含量差异不显著(P>0.05)。3)HSM80组胃蛋白酶和胰蛋白酶活力显著降低(P<0.05);脂肪酶活力在替代量大于60%时显著降低(P<0.05),各组淀粉酶活力无显著差异(P>0.05)。4)各试验组谷草转氨酶活力与对照组无显著差异(P>0.05),HSM80组谷丙转氨酶、脂肪酸合成酶活力显著降低(P<0.05),HSM20和HSM40组葡萄糖-6-磷酸酶活力显著升高(P<0.05)。综合考虑,酶解豆粕可替代60%的鱼粉而不降低珍珠龙胆石斑鱼幼鱼的生长,在替代量为40%时促进生长。
珍珠龙胆石斑鱼;酶解豆粕;鱼粉替代;生长;体组成;消化酶;代谢酶
鱼粉作为水产饲料中最重要的蛋白源,具有抗营养因子少、氨基酸组成平衡及适口性好等诸多优点。但近年来由于渔业资源衰退以及水产养殖规模的增长,鱼粉的供需矛盾导致其价格不断上涨。因此寻找可以部分或完全替代鱼粉的蛋白源成为当前水产养殖产业可持续发展的重要课题。
豆粕蛋白质含量高、来源稳定,是当前水产饲料中使用最为广泛的植物性蛋白源。然而豆粕中含有胰蛋白酶抑制剂等抗营养因子,过量添加会导致鱼体生长速度降低、饲料系数升高[1-2]、蛋白质利用率降低[3]、消化酶活性降低[4]、以及肝脏、肠道组织病变[5]等,从而制约了其在饲料中的添加比例。采用发酵、酶解、热处理等技术可在一定程度上去除豆粕中的抗营养因子,提高豆粕的使用效率[6]。酶解豆粕是豆粕经酶水解后,得到的一种由少量游离氨基酸、小肽和多肽组成的混合物[7]。与豆粕相比,酶解豆粕含有大量分子量较小的肽段,具有更好的理化性质和生理活性[8]。宋志东等[9]用酶解大豆蛋白替代鱼粉在对星斑川鲽(Platichthys stellatus)的研究中发现,适宜的替代比例能提高幼鱼的生长性能和饲料利用,并对体组织脂肪蓄积有一定的改善作用。对海参(Apostichopus japonicus)的研究表明,酶解豆粕替代适量的藻粉能促进海参的生长,提高饲料利用,促进矿物质的沉积[10]。
珍珠龙胆石斑鱼(Epinephelus fuscoguttatus♀×Epinephelus lanceolatus♂)是棕点石斑鱼(Epinephelus fuscoguttatus,俗称老虎斑,母本)与鞍带石斑鱼(Epinephelus lanceolatus,俗称龙胆斑,父本)杂交培育的新品种,因其具有肉质细腻、营养丰富、生长速度快、抗病性能强等特点而成为石斑鱼养殖的新宠。本研究以珍珠龙胆石斑鱼为实验对象,研究用酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼的生长、体组成、消化和代谢的影响,以期为大豆蛋白源的高效利用提供理论参考。
1 材料与方法
1.1 实验饲料
实验用的酶解豆粕根据SONG等[7]的方法酶解制成:用包含中性蛋白酶(100 000 U·g-1)、风味酶(50 000 U·g-1)和非淀粉多糖酶 (木聚糖酶,8 000 U·g-1;β-葡聚糖酶,2 000 U·g-1;β-甘露聚糖酶,150 U·g-1;纤维素酶,300 U·g-1)的复合酶(武汉新华扬生物科技有限公司)酶解豆粕。反应体系中豆粕占15%,加入占豆粕比例为1.5%的复合酶,50℃酶解6 h,然后冻干粉碎过80筛,制成酶解豆粕。根据MAMAUAG等[11]的方法测定蛋白质溶解度为49.0% (pH 7.0,22℃),水溶性氮由中国广州分析测试中心(广州)分析测定,分子量分布见表1。

表1 酶解豆粕水溶性氮的分子量分布Tab.1 Information of hydrolyzed soybean meal(HSBM)
设置鱼粉含量为53%的基础饲料,用酶解豆粕分别替代0、20%、40%、60%和80%的鱼粉蛋白,配制成5组等氮等能的实验饲料:HSM0、HSM20、HSM40、HSM60、HSM80,其中 HSM0为对照组。在各试验组饲料中分别添加晶体蛋氨酸和赖氨酸以满足幼鱼生长需要,各组饲料组成及营养水平见表2。所有原料粉碎过80目筛,依据饲料配方,称重并采用逐级扩大法混合均匀,加入鱼油和适量的蒸馏水二次混合均匀,挤压制成直径为4 mm和6 mm的颗粒饲料,烘干冷却后装袋备用。
1.2 实验鱼及饲养管理
实验所用珍珠龙胆石斑鱼购自山东莱州明波水产有限公司,养殖实验在山东省海洋资源与环境研究院东营基地的全封闭循环水系统中进行。实验开始前投喂基础饲料,驯养两周后进行分组。选取大小均匀、健康无病的珍珠龙胆石斑鱼幼鱼[(47.18±0.45)g],随机放养于15个直径70 cm、高80 cm的圆柱形养殖桶内,每桶30 ind,控制水深在50 cm左右,每组设3个平行。实验期间每天在08∶30和16∶30饱食投喂两次,投喂30 min后排残饵并记录残饵数。实验期间,控制水温在(26.5±0.5)℃,溶氧 >5 mg·L-1,盐度在23~26,pH 7.8~8.0,亚硝酸氮和氨氮含量均 <0.1 mg·L-1,实验周期为 8周。
1.3 样品采集
实验鱼取样前禁食24 h,记录每桶鱼的总重及尾数,然后每桶随机取10 ind,测定体重体长,其中3 ind作为全鱼样品用于体成分分析,其余7 ind解剖分离内脏和肝脏并称重,取胃和前肠用于胃肠道消化酶活力测定;取肝脏用于代谢酶活力测定;取背肌用于常规成分及氨基酸测定。以上取样操作均在冰盘中进行,取样结束后将所有样品保存在-70℃冰箱中冷藏待测。
1.4 测定指标与方法
1.4.1 生长性能
增重率(WGR,%)=(实验末均重-实验初均重)/实验初均重×100;
特定生长率(SGR,%·d-1)=(ln实验末均重-ln实验初均重)/养殖天数×100;
饲料系数(FCR)=摄食干饲料质量/(实验末总重-实验初总重);
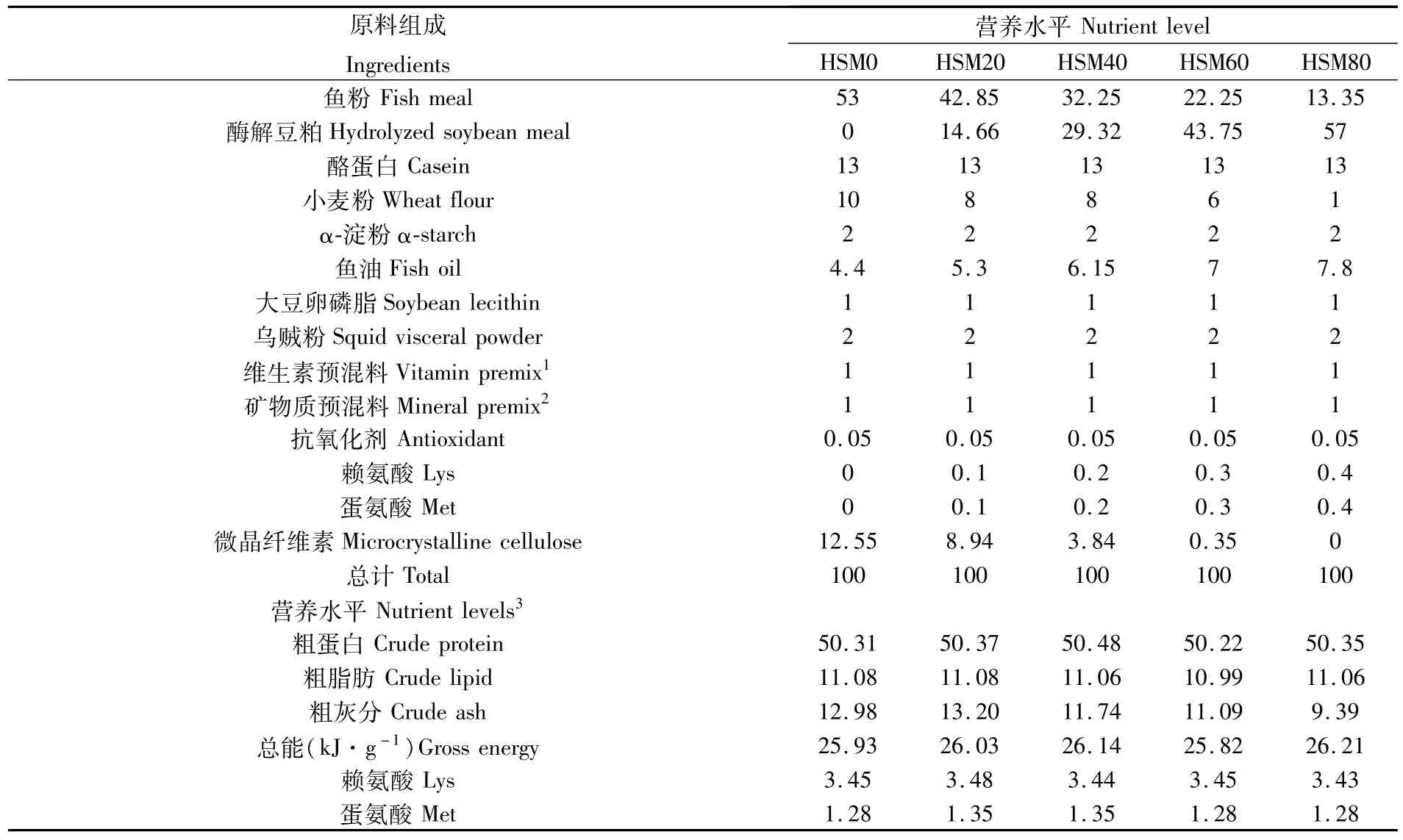
表2 实验饲料组成及营养水平(干物质基础)Tab.2 Composition and nutrient levels of experimental diets(DM basis)
蛋白质效率(PER,%)=(实验末总重-实验初总重)/(摄食干饲料质量×饲料粗蛋白含量)×100;
摄食率(DFI,%·d-1)=摄食干饲料质量/[(实验初总重+实验末总重)/2×养殖天数]×100;
肝体比(HSI,%)=肝脏质量/体质量 ×100;
脏体比(VSI,%)=内脏质量/体质量 ×100;
肥满度(CF,g·cm-3)=体质量/体长3×100。
1.4.2 实验饲料和鱼体营养成分测定
水分测定采用105℃烘干恒重法(GB/T6435-2006);粗蛋白质测定采用杜马斯燃烧法(LECO FP-528,USA);粗脂肪测定采用索氏抽提法(GB/T6433-1994);灰分测定采用马弗炉550℃灼烧法(GB/T6438-2007);能量测定采用燃烧法(IKA,C6000,GERMANY);氨基酸测定参照魏佳丽[12]的方法。
1.4.3 胃、肠道及肝脏组织粗酶液的制备
组织样品冰上自然解冻,用4℃的生理盐水冲洗表面后用滤纸吸干表面水分,称取约1 g干净无血的组织,剪碎放入小烧杯中,加入其9倍体积的预冷的匀浆介质或生理盐水,冰浴匀浆后4℃下4 000 r·min-1离心10 min,取上清4℃保存并于24 h内完成测定。
1.4.4 胃肠道消化酶活力的测定
胃蛋白酶(Pepsin)、肠道胰蛋白酶(Trypsin)、脂肪酶(Lipase)和淀粉酶(Amylase)活性采用试剂盒测定,所用试剂盒购自南京建成生物工程研究所。
1.4.5 肝脏代谢酶活力的测定
肝脏中谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspertate aminotransferase,AST)活性采用日立自动生化分析仪(HITACHI-7020,JAPAN)测定,所用试剂盒购自四川迈克生化技术有限公司;脂肪酸合成酶(Fatty acid synthase,FAS)和葡萄糖-6-磷酸酶(Glucose-6-phosphatase,G6PC)均采用 Elisa试剂盒进行测定,所用试剂盒购自上海酶联生物技术有限公司。
1.5 数据统计分析
应用软件SPSS 17.0对实验数据进行单因素方差分析(one-way ANOVA),差异显著时再进行Duncan氏多重比较,P<0.05为差异显著。数据以平均值±标准差(Mean±SD)的形式表示。
2 结果与分析
2.1 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼生长和饲料利用的影响
由表3可知,随着酶解豆粕替代鱼粉比例的增加,幼鱼的增重率和特定生长率呈现先升高后降低的趋势,替代40%时显著高于对照组(P<0.05),替代80%时显著低于对照组(P<0.05);替代60%以上鱼粉显著降低了蛋白质效率(P<0.05),替代80%时显著提高了饲料系数(P<0.05);幼鱼的摄食率随酶解豆粕替代比例的增加而升高,替代 40%以上时显著升高(P<0.05);替代40%和60%鱼粉显著提高了幼鱼的肝体比(P<0.05);各试验组幼鱼的存活率、肥满度和脏体比不受酶解豆粕替代鱼粉的的影响,各组间无显著差异(P>0.05)。
2.2 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼体组成的影响
如表4所示,酶解豆粕替代鱼粉对全鱼水分和粗蛋白含量无显著影响(P>0.05);全鱼的粗脂肪含量随酶解豆粕替代鱼粉比例的增加而逐渐降低,当替代量达到40%及以上时显著降低(P<0.05);替代40%和60%时全鱼粗灰分含量显著升高(P<0.05)。随着替代比例的增加,肌肉的粗蛋白含量先升高后降低,其中替代40%时显著升高(P<0.05),肌肉粗脂肪含量呈下降趋势,替代40%以上时显著降低(P<0.05)。各组肌肉的粗灰分含量没有显著差异(P>0.05)。
酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼肌肉氨基酸组成的影响见表5。在测出的17种氨基酸中,各试验组幼鱼肌肉的必需氨基酸和非必需氨基酸的含量与对照组均没有显著差异(P>0.05)。
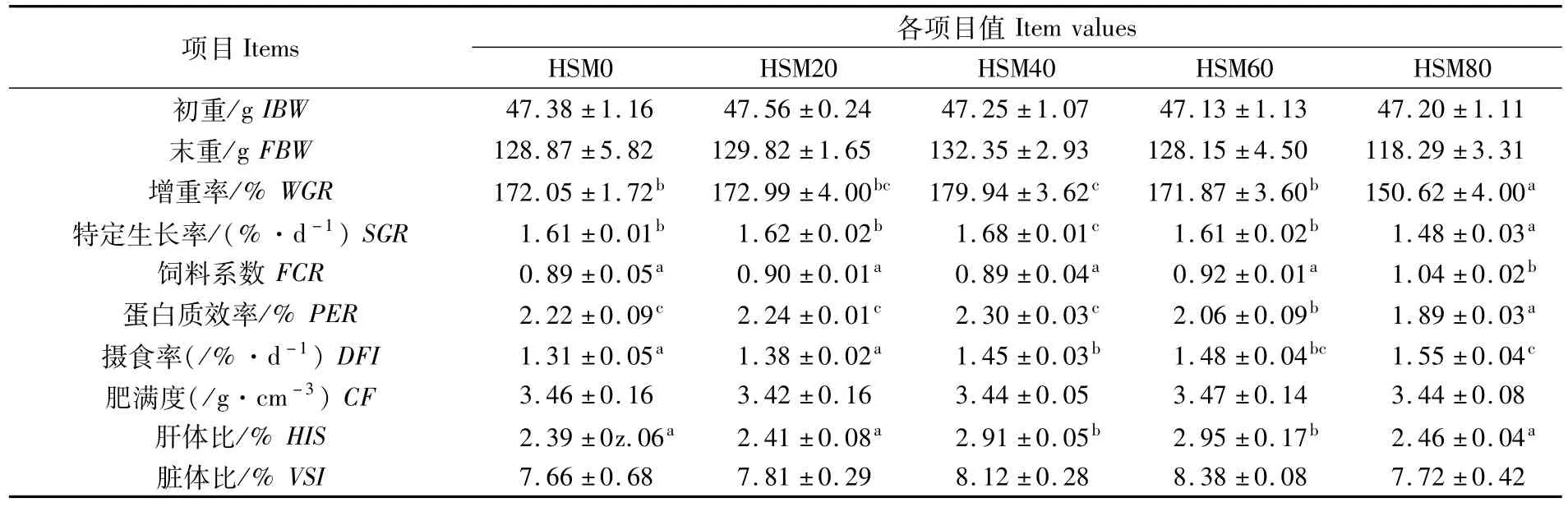
表3 酶解豆粕和豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼生长和饲料利用的影响Tab.3 Effects of fishmeal replacement by HSM on growth performance and feed utilization of Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂

表4 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼体组成的影响(湿重基础)Tab.4 Effects of fishmeal replacement by HSM on body composition of Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂(wet weight basis)
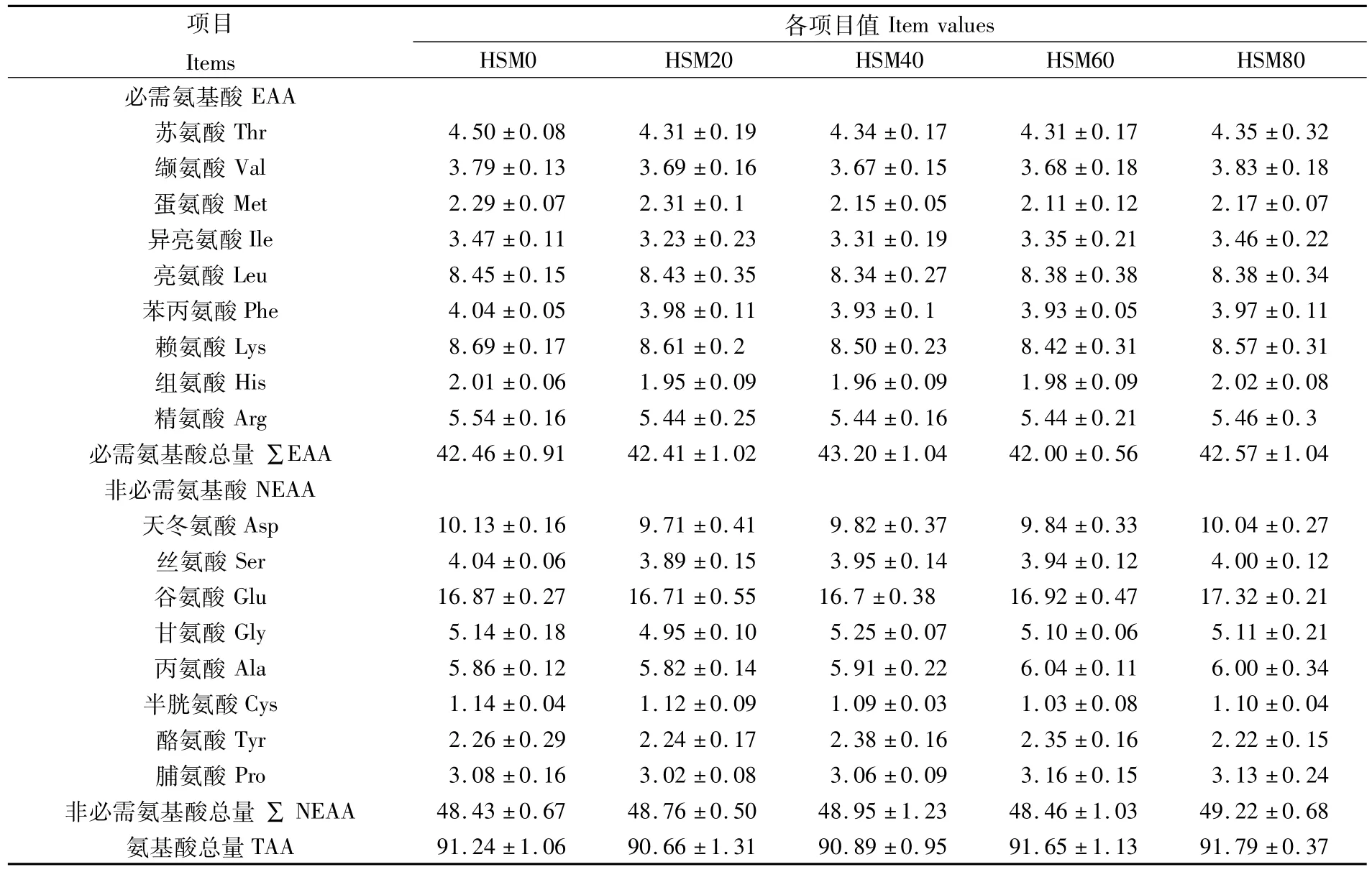
表5 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼肌肉氨基酸组成的影响(干物质基础)Tab.5 Effects of fishmeal replacement by HSM on muscular amino acid composition of Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂(DM basis)
2.3 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼胃肠道消化酶活力的影响
由表6可以看出,随酶解豆粕替代比例的增加,胃蛋白酶和胰蛋白酶活力呈现先升高后降低的趋势,胃蛋白酶活力在80%替代组显著降低(P<0.05);胰蛋白酶活力在替代量达到60%以上时显著降低(P<0.05),其它各组与对照组无显著差异(P>0.05);脂肪酶活力随替代比例的增加而降低,替代60%以上时显著降低(P<0.05);各试验组肠道淀粉酶活力与对照组差异不显著(P>0.05)。
2.4 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼肝脏代谢酶活力的影响
如表7所示,随着替代比例的增加,谷草转氨酶活力呈先升高后降低的趋势,但差异不显著(P>0.05),谷丙转氨酶活力在替代量为80%时显著降低(P<0.05),其它各组与对照组无显著差异(P>0.05);随着替代量的增加,脂肪酸合成酶活力呈降低趋势,在替代量为80%时显著降低(P<0.05);G6PC活力在20%和40%替代组显著高于对照组(P<0.05)。
3 讨论
3.1 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼生长和饲料利用的影响
本实验结果显示,酶解豆粕替代40%的鱼粉时显著促进了珍珠龙胆石斑鱼幼鱼的生长。关于酶解植物蛋白对水生动物的促生长作用已经有不少研究,刘文斌等[13]研究发现,在异育银鲫(Carassius auratus gibelio)中用酶解饼粕蛋白替代鱼粉可促进其生长和饲料利用率。许合金等[14]研究表明,在饲料中添加适量的酶解小麦蛋白能提高凡纳滨对虾(Penaeus vannamei)的增重率和特定生长率。宋志东等[10]在海参中用酶解豆粕替代藻粉,可显著提高海参的生长性能和饲料利用。酶解植物蛋白对水生生物的促生长作用可能与其富含生物活性小肽有关。研究发现,小肽在满足动物对氨基酸的需求中有重要的作用,供给动物一定量的小肽可使其达到更大的生产性能。经测定,本实验酶解豆粕中小于1 000 Da的小肽含量为21.81%,约占可溶性氮的1/2。小肽在消化道内可被直接吸收,从而节约了分解蛋白质所消耗的能量用于生长[15]。此外与游离氨基酸相比,小肽具有吸收速度快、耗能低、载体不易饱和等优势,并且能消除游离氨基酸的吸收竞争[16],加快蛋白质的合成从而促进生长。其二,有些功能类肽可促进细胞分裂,加快体组织的生长速度。饲料中过量的酶解植物蛋白会对幼鱼的生长产生不利影响,在本实验中80%替代组幼鱼的生长显著降低,可能是因为摄入了过量的小肽,ZAMBONINO等[17]研究发现饲料中高水平的小肽会显著影响胰岛素的合成和分泌,从而抑制鱼体生长。

表6 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼胃肠道消化酶活力的影响Tab.6 Effects of fishmeal replacement by HSM on activities of digestive enzymes of Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂

表7 酶解豆粕和豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼肝脏代谢酶活力的影响Tab.7 Effects of fishmeal replacement by HSM on activities of metabolic enzymes of Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂
本实验中酶解豆粕替代鱼粉可显著提高幼鱼的摄食率,可能与所选用的风味酶有关,风味酶不仅可以降低酶解产物的苦味,还可以释放具有诱食作用的游离氨基酸[18],改善饲料的适口性从而提高摄食率。HSM80组幼鱼摄食率显著提高,可能是因为营养得不到满足。
3.2 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼体组成的影响
在本实验中用酶解豆粕替代鱼粉没有降低全鱼的粗蛋白含量,肌肉的粗蛋白含量在一定范围内有升高趋势,替代40%组显著高于对照组。豆粕经酶解后,各种有害物质降低,并且酶解产生的小肽可以被完整吸收,直接参与蛋白质的合成,并对氨基酸的转运也有促进作用,从而有利于蛋白质的高效利用,提高蛋白质在鱼体内的沉积[19]。随酶解豆粕替代比例的增加,全鱼和肌肉的粗脂肪含量呈降低趋势,这与宋志东等[9]在星斑川鲽中用酶解大豆蛋白替代鱼粉的结果类似。研究发现,大豆肽能刺激交感神经,阻止脂肪的吸收和促进脂质的分解代谢,此外大豆肽还能刺激产生热能的褐色脂肪组织(BAT)的活性,提高甲状腺素在血液中的浓度,从而提高基础代谢水平,促进体内多余脂肪的消耗,以此来达到减肥降脂的作用[20]。酶解豆粕替代40%和60%鱼粉组全鱼的粗灰分含量显著增加,肌肉的粗灰分含量也有上升趋势。一般认为,鱼体粗灰分含量与矿物质的沉积密切相关,因为大豆肽能与金属元素结合生成螯合物,增加了钙、铁、铜、锌等金属离子的可溶性,促进其吸收和转运速度,从而促进了鱼体对矿物质的吸收利用和鱼体粗灰分含量上升[21]。INFANTE等[22]研究证明在舌齿鲈(Dicentrarchus labrax)鱼苗的饲料中添加大豆小分子肽后,能增强骨骼的正常发育并且能有效减少骨骼的畸形发生,其原因是大豆小分子肽能与金属离子有效结合,而促进钙、铁、铜和锌的有效转运和在体内的储存。
通过对鱼体肌肉氨基酸的分析,表明用酶解豆粕替代鱼粉对幼鱼肌肉中各种氨基酸的含量没有显著影响。研究发现小肽对氨基酸的吸收有一定的促进作用,小肽独特的吸收机制可使氨基酸被迅速吸收,同时小肽可提高二肽酶和氨基酸载体的数目,增加机体对氨基酸的吸收并沉积在肌肉中[23];此外,小肽是肠道的吸收底物,而氨基酸的吸收受到肠腔中吸收底物浓度的影响,小肽含量高则氨基酸吸收快[24]。本实验酶解豆粕中小肽含量约占可溶性氮的1/2,因此对氨基酸的吸收累积没有造成不利影响。
3.3 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼胃肠道消化酶活力的影响
胃肠道消化酶活力的高低反映了鱼类对进入机体内的营养物质的消化吸收能力,进而决定鱼类的生长发育速度。本实验中用酶解豆粕替代鱼粉,在促生长的替代范围内胃蛋白酶和胰蛋白酶的活力也有相应的提高,表明酶解豆粕可能通过提高消化酶活性等功能来促进鱼类生长[25]。酶解豆粕提高蛋白酶的活力可能是因为豆粕经酶解后,抗营养因子被部分或完全消除,投喂幼鱼后保证了其肠道健康,从而提高了消化酶活力[26];此外,豆粕酶解后产生了大豆肽,大豆肽能有效刺激和诱导消化酶的合成分泌[31]。高比例的酶解豆粕替代鱼粉造成消化酶活力的降低,这与CAHU等[27]在舌齿鲈的研究结果一致,这可能是因为大量酶解豆粕的摄入增加了肠道内部小肽和游离氨基酸的含量,消化酶所作用的底物减少从而降低了内源酶的需要量,以此反馈调节消化酶的表达量[25]。
3.4 酶解豆粕替代鱼粉对珍珠龙胆石斑鱼幼鱼肝脏代谢酶活力的影响
肝脏ALT和AST活力的高低一定程度上反映了机体对蛋白质的合成和分解能力。AST活力升高则蛋白质合成代谢加强,分解代谢减弱,这有利于机体进行氮的积累;ALT活力升高则说明机体加快尿素的生成,以减少氨基酸代谢废物对机体的毒害[28]。本实验中各试验组AST活力与对照组相比无显著差异,说明在一定程度上酶解豆粕替代鱼粉对幼鱼蛋白质的合成没有造成不利影响。FAS在机体脂肪沉积中起关键作用,动物的体脂沉积所需要的脂肪酸大多是由FAS催化乙酰CoA和丙二酸单酰CoA合成的。本实验中,各酶解豆粕替代组全鱼和肌肉的粗脂肪含量呈下降趋势,相应的FAS的活力也降低,因此推测粗脂肪含量降低一部分原因可能是由于FAS的活力受到抑制。研究发现,大豆肽能提高血液中甲状腺素的浓度,而FAS的表达调控受激素的影响,其中甲状腺素能在转录水平对FAS基因的表达起到调控作用从而抑制其活性[29]。在本实验中各替代组幼鱼摄食含有大豆肽的饲料从而降低了FAS的活力。
[1] 刘襄河,叶继丹,王子甲,等.饲料中豆粕替代鱼粉比例对牙鲆生长性能及生化指标的影响[J].水产学报,2010,34(3):450-459.
LIU X H,YE J D,WANG Z J,et al.Partial replacement of fish meal by soybean meal in diets for juvenile Japanese flounder(Paralichthys olivaceus)[J].Journal of Fisheries of China,2010,34(3):450-459.
[2] 高荣兵,庄 平,章龙珍,等.豆粕替代鱼粉对点篮子鱼生长性能的影响[J].水产学报,2010,34(10):1534-1540.
GAO R B,ZHUANG P,ZHANG L Z,et al.Effects of replacement of fish meal by soybean meal on growth characters of Siganidae(Siganus guttatus)[J].Journal of Fisheries of China,2010,34(10):1534-1540.
[3] REFSTIE S,KORSOENØJ,STOREBAKKEN T,et al.Differing nutritional responses to dietary soybean meal in rainbow trout(Oncorhynchus mykiss)and Atlantic salmon(Salmo salar)[J].Aquaculture,2000,190(1):49-63.
[4] 刘 勇,冷向军,李小勤,等.豆粕替代鱼粉对奥尼罗非鱼生长、表观消化率及血清非特异性免疫的影响[J].中国粮油学报,2009,24(12):95-100.
LIU Y,LENG X J,LI X Q,et al.Effects of replacing fish meal with soybean meal on growth,digestibility and immunity of Tilapia(Oreochromis niloticus×O.aureus)[J].Journal of the Chinese Cereals and Oils Association,2009,24(12):95-100.
[5] 张 帆,张文兵,麦康森,等.饲料中豆粕替代鱼粉对大黄鱼生长、消化酶活性和消化道组织学的影响[J].中国海洋大学学报(自然科学版),2012,42(S1):75-82.
ZHANG F,ZHANG W B,MAI K S,et al.Effects of replacement of dietary fish meal by soybean meal on growth,digestive enzyme activity and digestive tract histology of Juvenile large yellow croaker,Pseudosciaena crocea R[J].Periodical of Ocean University of China(Notural Scince Edition),2012,42(S1):75-82.
[6] EGOUNLETY M,AWORH O C.Effect of soaking,dehulling,cooking and fermentation with Rhizopus oligosporus on the oligosaccharides,trypsin inhibitor,phytic acid and tannins of soybean(Gycin emax Merr.), cowpea (Vigna unguiculata L.Walp) and groundbean (Macrotyloma geocarpa Harms)[J].Journal of Food Engineering,2003,56(2):249-254.
[7] SONG Z,LI H,WANG J,et al.Effects of fishmeal replacement with soy protein hydrolysates on growth performance, blood biochemistry, gastrointestinal digestion and muscle composition of juvenile starry flounder(Platichthys stellatus)[J].Aquaculture,2014(426):96-104.
[8] HRCKOVA M,RUSNAKOVA M,ZEMANOVIC J.Enzymatic hydrolysis of defatted soy flour by three different proteases and their effect on the functional properties of resulting protein hydrolysates[J].Czech Journal of Food Sciences,2002,20(1):7-14.
[9] 宋志东,王际英,李培玉,等.酶解大豆蛋白替代鱼粉对星斑川鲽幼鱼生长、血液生化和体组成的影响[J].水生生物学报,2016,40(1):165-172.
SONG Z D,WANG J Y,LI P Y,et al.Effects of replacement fish meal with soybean meal hydrolysates on growth,blood biochemistry,body composition of juvenile starry flounder Platichthys stellatus[J].Acta Hydrobiologica Sinica,2016,40(1):165-172.
[10] SONG Z,LI P,WANG J,et al.Effects of seaweed replacement by hydrolyzed soybean meal on growth,metabolism,oxidation resistance and body composition of sea cucumber Apostichopus japonicus[J].Aquaculture,2016(463):135-144.
[11] MAMAUAG R E P,KOSHIO S,ISHIKAWA M,et al.Soy peptide inclusion levels influence the growth performance,proteolytic enzyme activities, blood biochemical parameters and body composition of Japanese flounder, Paralichthys olivaceus[J].Aquaculture,2011,321(3):252-258.
[12] 魏佳丽.磷虾粉在星斑川鲽和珍珠龙胆石斑鱼幼鱼饲料中的应用研究[D].上海:上海海洋大学,2015.
WEI JL.Application effects of krill meal in feeds for juvenile starry flounder(Platichthys stellatus)and pearl gentian grouper(Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatu♂)[D].Shanghai:Shanghai Ocean University,2015.
[13] 刘文斌,詹玉春,王 恬.四种饼粕酶解蛋白对异育银鲫的营养作用研究[J].中国粮油学报,2007,22(5):108-112.
LIU W B,ZHAN Y C,WANG T.Nutritional value of plant protein hydrolysates for alloggnogeuetic Crucian Carp[J].Journal of the Chinese Cereals and Oils Association,2007,22(5):108-112.
[14] 许合金,冯 幼,王修启.日粮中添加酶解小麦蛋白对南美白对虾生长及非特异性免疫功能的影响[J].华南农业大学学报,2011,32(4):86-90.
XU H J,FENG Y,WANG X Q.Effects of dietary hydrolyzed wheat gluten supplement on growth performance and nonspecific immunity of Litopenaeus vannamei[J].Journal of South China Agricultural University,2011,32(4):86-90.
[15] WEBB K E.Intestinal absorption of protein hydrolysis products:A review[J].Journal of Animal Science,1990,68(9):3011-3022.
[16] 蒋金津,陈立祥.小肽的营养特性及其在动物生产中的应用[J].中国畜牧兽医,2010,37(6):17-20.
JIANG JJ,CHEN L X.The progress of research into small peptide’s nutrition and application in animal production[J]. China Animal Husbandry &Veterinary Medicine,2010,37(6):17-20.
[17] ZAMBONINO L J,CAHU C,PERES A.Partial substitutionof di-and tripetides for native proteins in sea bass diets improves Dicentrarchus labrax larval development[J].Nutrition,1997(127):608-614.
[18] MA Y S,WANG L T,SUN X H,et al.Study on hydrolysis conditions of flavourzyme in soybean polypeptide alcalase hydrolysate[J].Advanced Materials Research,2013(652-654):435-438.
[19] 陆 烝,应朝阳,郑 斌,等.植物肽的生理功能及其在饲料中的应用研究进展[J].中国饲料,2015(12):30-32,36.
LU Z,YING C Y,ZHENG B.The metabolic mechanism and physiological function of plant peptide and its application in feed[J].China Feed,2015(12):30-32,36.
[20] 侯 丽.大豆多肽与运动医学研究进展[J].甘肃医药,2012,31(12):907-909.
HOU L.Research progress of soybean peptide and sports medicine[J].Gansu Medical Journal,2012,31(12):907-909.
[21] IWASAKI H,EMI M,EZURA Y,et al.Association of a Trp16Ser variation in the gonadotropin releasing hormone signal peptide with bone mineral density,revealed by SNP-dependent PCR typing[J].Bone,2003,32(2):185-190.
[22] INFANTE J L Z,CAHU C L,PERES A.Partial substitution of di-and tripeptides for native proteins in sea bass diet improves Dicentrarchus labrax larval development[J].The Journal of Nutrition,1997,127(4):608-614.
[23] BAMBA T,FUSE K,OBATA H,et al.Effects of small peptides as intraluminal substrates on transport carriers for amino acids and peptides[J].Journal of Clinical Biochemistry and Nutrition,1993,15(1):33-42.
[24] 蒋步国,冯 健,黄 钧,等.酪蛋白小肽和氨基酸对草鱼血液循环和组织蛋白质合成的影响[J].海洋与湖沼,2010,41(1):75-79.
JIANG B G,FENG J,HUANG J,et al.Effects of small peptides and amino acid on peptide circulation and tissue protein synthesis in grass carp Ctenopharyngodon idella[J]. Oceanologia Et Limnologia Sinica,2010,41(1):75-79.
[25] 刘文斌,王 恬.棉粕蛋白酶解物对异育银鲫(Carassius auratus gibelio)消化、生长和胰蛋白酶mRNA表达量的影响[J].海洋与湖沼,2006,37(6):568-574.
LIU WB,WANGT.Effect of hydroly sates of cotton seed meal protein on the digestibility,growth and expression level of trypsinogen mRNA of carp Carassius auratus gibelio[J]. Oceanologia Et Limnologia Sinica,2006,37(6):568-574.
[26] 郑 裴,吕 峰,徐玉霞,等.植物乳杆菌发酵豆粕及其抗营养因子的研究[J].安徽农学通报(下半月刊),2009(10):63-64,137.
ZHENG P,LV F,XU Y X,et al.Research of soybean meal lactic by acid bacteria fermentation and anti-nutritional factor[J]. Anhui Agricultural Science Bulletin,2009(10):63-64,137.
[27] CAHU C L,INFANTE J L Z,QUAZUGUEL P,et al.Protein hydrolysate vs.fishmeal in compound diets for 10-day old sea bass Dicentrarchus labrax larvae[J].Aquaculture,1999,71(1):109-119.
[28] 施永海,张根玉,张海明,等.配合饲料和活饵料对刀鲚幼鱼生长、存活和消化酶、非特异性免疫酶、代谢酶及抗氧化酶活性的影响[J].水产学报,2014,(12):2029-2038.
SHI Y H,ZHANG G Y,ZHANG H M,et al.Effects of compound feed and live feed on the growth,survival,and the activities of digestive enzyme,nonspecific immunity enzyme,metabolic enzyme and antioxidant enzyme of young fish Coilia nasus[J].Journal of Fisheries of China,2014,(12):2029-2038.
[29] 马慧敏,刘昌奇.脂肪酸合成酶(FAS)基因的研究进展以及日粮成分对其表达的调控[J].饲料工业,2007,28(22):59-64.
MA H M,LIU C Q.Advances in fatty acid synthase(FAS)gene and regulation of its expression by dietary compositions[J].Feed Industry,2007,28(22):59-64.
Effects of fishmeal replacement by hydrolyzed soybean meal on growth,body composition,digestive and metabolic enzyme activities of juvenile Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂
LI Xue-li1,2,WANG Ji-ying2,SONG Zhi-dong2,TAN Qing1,2,SUN Yong-zhi2,ZHANG Li-min2(1.College of Fisheries and Life,Shanghai Ocean University,Shanghai 201306;2.Key Laboratory for Shandong Marine Ecological Restoration,
Shandong Marine Resource and Environment Research Institute,Yantai 264006)
An 8-week feeding experiment was conducted to evaluate the effects of fishmeal replacement by hydrolyzed soybean meal(HSM)on growth performance,body composition,digestion and metabolism of juvenile hybrid grouper(♀Epinephelus fuscoguttatus×♂Epinephelus lanceolatus).Five isonitrogenous and isoenergetic diets were formulated by replacing 0,20%,40%,60%,80%of fishmeal protein with hydrolyzed soybean meal(HSM0-80)respectively.A total of 450 juvenile hybrid grouper with an average body weight of(47.18±0.45)g were randomly assigned into 5 groups with 3 replicates per group and 30 fish per replicate.Results showed as follows:1)The weight gain rate(WGR)and specific growth rate(SGR)of the juveniles increased significantly in group HSM40 while the WGR,SGR,protein efficiency ratio(PER)in group HSM80 were significantly lower than that of other groups(P<0.05).When dietary hydrolyzed soybean meal content was more than 40%,the DFI of the juveniles significantly increased(P<0.05);2)With the increasing of dietary hydrolyzed soybean meal content,the crude lipid content in whole body and muscle decreased and the values of group HSM40 to group HSM80 were significantly lower than that of other groups(P<0.05),the crude ash content in whole body was significantly higher in group HSM40 and group HSM60(P<0.05),there was no significant difference in the content of amino acids of muscle among the replacement groups(P>0.05);3)With the increasing of dietary hydrolyzed soybean meal content the pepsin and trypsin activities increased and then decreased and were significantly lower in group HSM80(P<0.05),the activity of lipase was significantly lower when dietary hydrolyzed soybean meal content was more than 60%;4)The activities of alanine transaminase(ALT)decreased significantly in group HSM80(P<0.05),with the increasing of dietary hydrolyzed soybean meal content,the activity of fatty acid synthase(FAS)decreased and was significantly lower in group HSM80(P<0.05).The activity of G6PC was significantly higher in group HSM20 and group HSM40.In conclusion,replacing up to 60%of dietary fishmeal with hydrolyzed soybean meal does not reduce the growth of juvenile hybrid grouper and the optimal replacement level is 40%.
Epinephelus fuscoguttatus♀ ×Epinephelus lanceolatus♂;hydrolyzed soybean meal;fishmeal replacement;growth;body composition;digestive enzymes;metabolic enzymes
S 963
A
1004-2490(2017)05-0529-10
2017-03-17
国家海洋生物产业水生动物营养与饲料研发创新示范平台(201702001);山东省重点研发计划(2016GSF005005);山东省自然科学基金(ZR2015CQ023)
李学丽(1991-),女,山东济南人,硕士研究生,从事动物营养与饲料科学研究。
E-mail:lixueli1226@126.com
张利民,研究员。E-mail:zhanglimin@126.com
