多溴联苯醚污染土壤的新型强化修复技术
2017-11-07殷梦菲王翠苹孙红文
殷梦菲,李 静,王翠苹,孙红文
多溴联苯醚污染土壤的新型强化修复技术
殷梦菲,李 静,王翠苹*,孙红文
(南开大学环境科学与工程学院,环境污染过程及基准教育部重点实验室,天津市环境修复和控制实验室,天津 300350)
为建立表面活性剂和营养盐强化电气石类芬顿联合微生物对PBDEs污染的高效土壤修复技术,分别选择两种氮源营养盐——氯化铵和硝酸铵,两种表面活性剂——TW-80和TX-100,考察它们的剂量及类型对电气石类芬顿去除土壤PBDEs效果及土壤真菌的影响.结果表明,高剂量的营养盐更能促进电气石类芬顿辅助微生物对PBDEs的降解,且修复效率最高可达75%;两种表面活性剂均能够促进电气石类芬顿辅助微生物对PBDEs的降解,降解效率最高可达76%.并且针对不同单体BDE,营养盐和表面活性剂均对促进低溴代联苯醚降解程度更高.氯化铵比硝酸铵更有利于土壤中微生物生长,且高浓度的营养盐促进土壤中真菌的生长和活性效果明显;TW-80比TX-100更有利于微生物生长,且较低浓度的表面活性剂促进土壤中真菌活性的效果更为明显.因此,不同类型营养盐和表面活性剂能够有效地强化电气石类芬顿联合微生物对PBDEs污染的土壤修复技术.
PBDEs;电气石类芬顿;营养盐;表面活性剂;微生物修复;土壤
多溴联苯醚(PBDEs)是一种溴代阻燃剂类化合物[1],存在于大气、水体、沉积物和土壤等环境介质中,具有POPs的特性,会对生物体产生负面生理效应,包括内分泌失调、影响甲状腺分泌激素、干扰神经行为发育等[2],对环境和人类有危害[3].
土壤是PBDEs累积的一个重要介质,PBDEs与土壤颗粒的不同微观结构相互作用后其结合状态会发生高度分化,单一微生物对土壤进行修复仍存在着很大的局限性[4].在众多的非生物修复方法中,由过氧化氢和铁催化剂组成的Fenton氧化法具有费用低的优点,在国际上受到广泛关注,实验证明在石油烃污染土壤中利用芬顿联合微生物可将多环芳烃去除率提高到75%[5],裴晓哲[6]研究表明,芬顿氧化法可以修复敌百虫污染的土壤,金学锋[7]研究表明,类芬顿试剂的加入可以提高芬顿反应的反应效率,目前,关于矿物类芬顿联合微生物对土壤中PBDEs污染修复的研究尚未深入[8].电气石(Tourmaline)是一种典型的高温气成硅酸盐矿物,可持续发生直流静电,释放矿物质和微量元素,可以促进土壤微生物繁殖[9],调节土壤理化性质以及土壤生物学性质,起到土壤改良剂的作用[10].文献[8]报道了电气石类芬顿联合微生物修复PBDEs新型技术.
为了进一步提高PBDEs污染土壤实际修复效率,使用营养盐和表面活性剂对这一技术进行强化.营养盐强化微生物去除土壤中疏水性有机污染物是一种重要的修复技术[11];表面活性剂可以通过增加污染物的溶解性和迁移性,促进疏水性有机污染物从土壤颗粒中解吸,提高生物有效性[12],研究表明,表面活性剂可以促进白腐真菌对土壤中有机农药的降解[13].而营养盐和表面活性剂剂量和类型对土壤修复效率有着重要的影响,优化二者的类型和剂量是建立营养盐和表面活性剂强化电气石类芬顿强化微生物修复土壤PBDEs新型技术的重要环节.营养盐和表面活性剂影响土壤微生物繁殖[14].麦角固醇是真菌和一些藻类细胞膜中的主要固醇类物质[15],可作为土壤真菌数量的指标[16-17],其含量与土壤真菌生物量呈显著正相关[18].然而,目前关于营养盐和表面活性剂对土壤真菌麦角固醇含量的影响未有详细报道.
本文分别选择两种氮源营养盐氯化铵和硝酸铵,表面活性剂TW-80和TX-100,考察它们的剂量及类型对电气石类芬顿联合微生物去除PBDEs效果的影响,并探究营养盐和表面活性剂对土壤真菌的影响.旨在建立由营养盐和表面活性剂强化的电气石类芬顿联合微生物对土壤PBDEs污染修复的新型技术,同时分析土壤真菌生物量变化,探讨营养盐和表面活性剂强化修复机理,为实际PBDEs污染土壤强化修复技术提供技术支持和理论依据.
1 材料和方法
1.1 实验材料
1.1.1 供试土壤 实验土壤采于天津市静海县电线拆解厂(116°46′30.07″E,38°49′22.55″N)附近表层土(0~20cm),自然风干,过2mm筛去除杂质均一化,贮存在阴凉干燥处备用.
1.1.2 化学试剂 TW-80,(分析纯,天津光复精细化工研究所),TX-100(分析纯,上海天莲精细化工有限公司),氯化铵(分析纯,天津江天化工技术有限公司),硝酸铵(分析纯,天津江天化工技术有限公司).
1.2 实验设计
1.2.1 电气石类芬顿联合微生物对PBDEs降解的影响 取500g土置于1000mL的三角瓶中,将2%电气石和10%过氧化氢(TCFR)以及0.1g/mL的菌悬液(P)依次加入,作为电气石类芬顿联合微生物组.另外设置了只加(P)和只加2%电气石和10%过氧化氢(TCFR)的实验组来说明微生物和电气石催化类芬顿反应各自的作用.空白组只加500g土壤(CK).各组中加入无菌蒸馏水使土壤含水量为60%左右,隔一天搅拌一次,每组做3个平行,在25℃恒温箱中培养,实验条件下同.分别在0,10,20,30,50,70d取样待测PBDEs以及土壤真菌麦角固醇含量.
1.2.2 营养盐强化电气石类芬顿联合微生物对PBDEs降解的影响 营养盐强化电气石类芬顿联合白腐真菌—黄孢毛皮革菌()对PBDEs降解实验:称取500g土壤置于1000mL的三角瓶中,将2%电气石和10%过氧化氢(TCFR)以及0.1g/mL的菌悬液(P)依次加入,并分别添加营养盐氯化铵(NH4Cl-NCl)和硝酸铵(HNO3- NN).分别在0,10,20,30,50,70d取样待测PBDEs以及土壤真菌麦角固醇含量.
1.2.3 表面活性剂强化电气石类芬顿联合微生物对PBDEs降解的影响 表面活性剂强化电气石类芬顿联合对PBDEs降解实验:称取500g土壤置于1000mL的三角瓶中,将2%电气石和10%过氧化氢(TCFR)以及0.1g/mL的菌悬液(P)依次加入,并分别添加TW-80和TX-100.分别在0, 10, 20, 30, 50, 70d取样待测PBDEs以及土壤真菌麦角固醇含量.具体实验方案见表1.
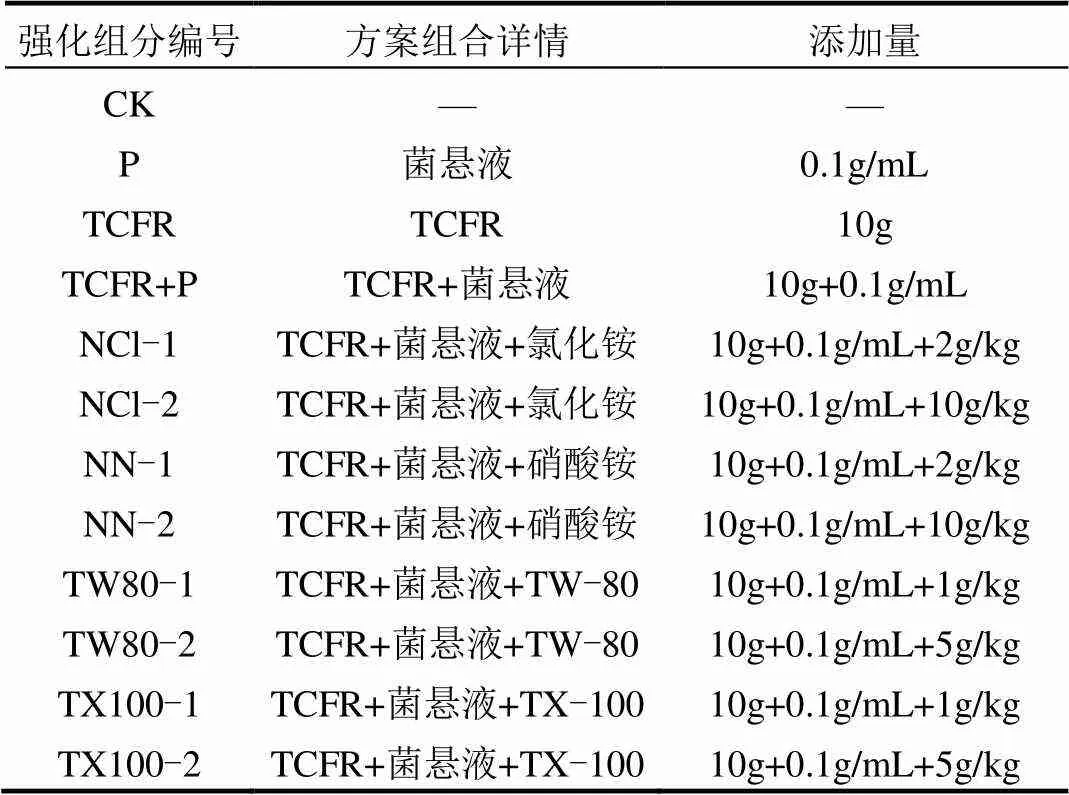
表1 土壤强化修复技术实验方案
1.3 实验方法
1.3.1 土壤理化性质的测定 土壤有机质含量:重铬酸钾氧化-分光光度法[19].土壤pH值:称取10g已过2mm筛的土壤,置于烧杯中,加入25mL 0.01mol/L CaCl2溶液,摇床振荡2min后静置, 30min后用pH计测定.有效氮、磷、钾:送往天津市农业资源与环境研究所测定.土壤机械组成:采用比重计法测定[20].经测定,所采集土壤理化性质见表2.
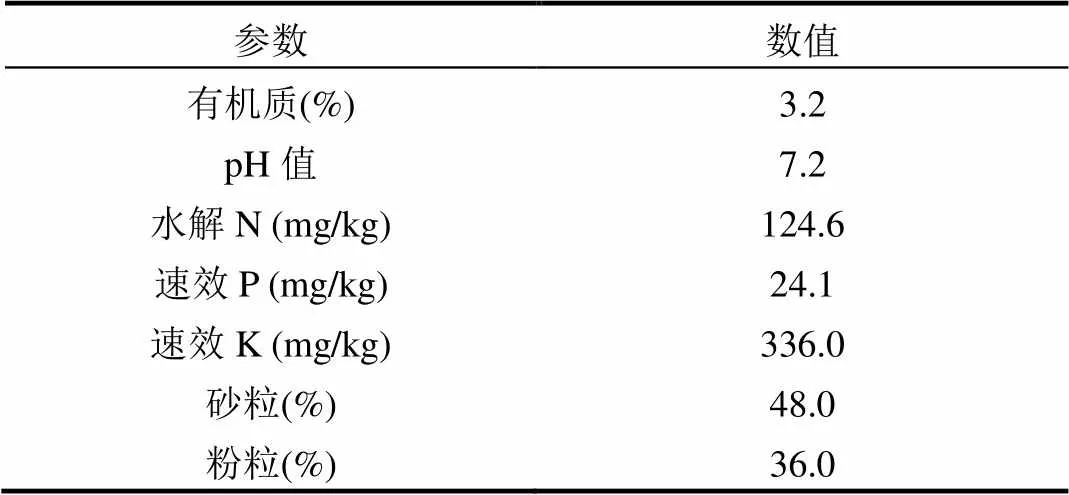
表2 土壤样品理化性质
1.3.2 土壤中PBDEs的提取与测定 PBDEs前处理及柱层析见文献[8],简单描述为,称取5g样品,5g无水硫酸钠,加入回收率指示物,用120mL二氯甲烷索氏提取24h,加活性铜粉静置过夜除硫.将提取液旋转蒸发至约1mL,加入10mL正己烷进行溶剂置换后再浓缩为1mL.上述浓缩液经过自制硅胶复合层析柱净化,分别用正已烷、二氯甲烷/正己烷(1:1)混合液淋洗,收集第二组淋洗液并浓缩至约1mL,转移至样品瓶,在柔和高纯氮气流下吹干,用色谱纯正己烷定容为0.25mL,待GC-MS分析.
PBDEs测定:使用Agilent 7890气相色谱-质谱联用仪(GC/MS),NCI离子源,70eV, SIM模式,/79、81用于检测BDE-28, BDE-47, BDE-99, BDE-100, BDE-153, BDE-154, BDE-183,/79、81、486、488用于测定BDE-209.仪器条件:使用DA-5MS色谱柱,高纯氦气为载气,甲烷气为反应气,进样口温度、离子源温度和气质传输线温度分别为280℃、250℃和300℃,进样量1μL,无分流自动进样.色谱升温程序为:初始温度50℃保持1min,以30℃/min速率升温至280℃,然后再以5℃/min的速率升温至310℃保留7min.
1.3.3 表征土壤真菌生物量的麦角固醇含量测定 土壤麦角固醇的提取参考Klamera等[21]的方法,略有改动.称取2g土于40mL棕色玻璃瓶中,加入10% KOH醇溶液(10g KOH,25mL甲醇,75mL乙醇),拧紧瓶盖超声30min,85℃水浴,冷却后加入2mL去离子水,用正己烷萃取目标物3次,振荡离心(2500r/min,5min),取出的正己烷合并于梨形瓶中旋蒸至2mL,然后转移到样品瓶中柔和氮气吹干,1mL色谱纯甲醇定容,0.45μm的滤膜过滤后转移到进样瓶中用HPLC分析.
1.3.4 质量保证与质量控制 利用混合标样为BDE-28, BDE-47, BDE-99, BDE-100, BDE-153, BDE-154, BDE-183和BDE-209, 作为萃取与柱分离的检验方法标样,PBDEs的回收率为84.66%~116.28%.实验全程准备方法空白、加标空白、基质空白、基质加标平行样进行质控.
土壤麦角固醇的提取方法中,测定样品中麦角固醇的回收率为91.22%.
1.4 数据处理方法
数据分析使用SPSS17.0.0软件,作图用Origin8.5软件.
2 结果与讨论
2.1 营养盐强化电气石类芬顿辅助微生物对土壤中PBDEs污染修复
表3显示了电气石类芬顿联合微生物以及不同含量的NH4Cl和NH4NO3强化电气石类芬顿联合微生物对PBDEs修复的影响情况.第70d当微生物单独作用时,PBDEs的总降解率较空白组有所提高,达到(22.59±3.09)%;电气石类芬顿试剂的添加使微生物修复PBDEs的效率提高至(43.10±0.41)%.
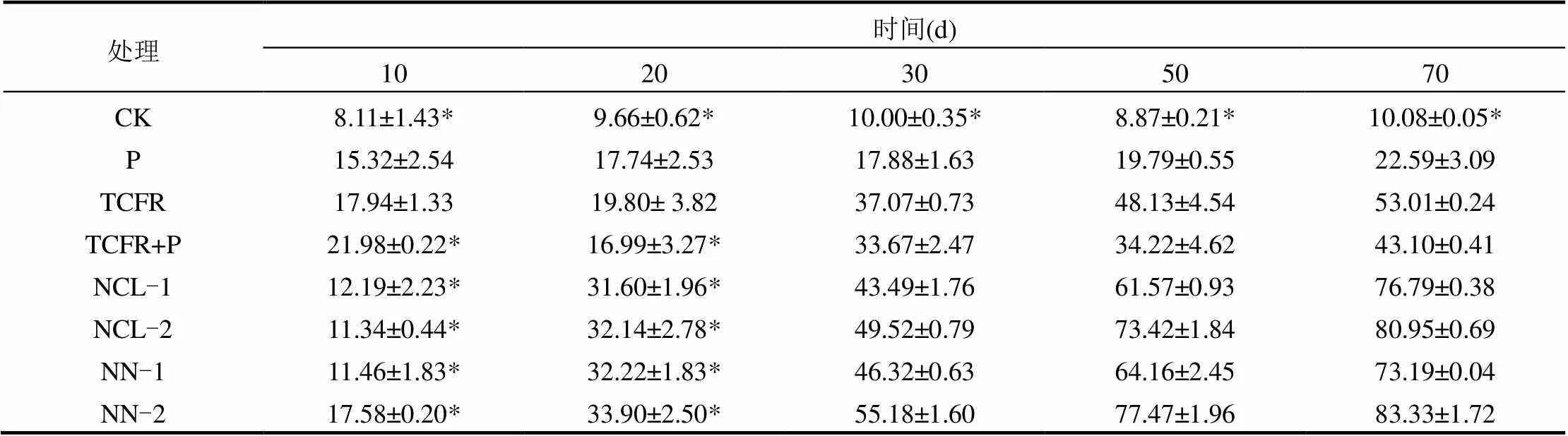
表3 不同种类和剂量营养盐对电气石类芬顿联合微生物修复PBDEs总降解率(a)和单一PBDE同类物降解率(b)的影响(%)
(b)
注:数据后*表示差异显著(<0.05),下同.
当NH4Cl添加量分别为2g/kg(NCL-1)和10g/kg(NCL-2)时,电气石类芬顿联合微生物对PBDEs总去除率分别提高至(76.79±0.38)%和(80.95±0.69)%;当NH4NO3添加量分别为2g/kg(NN-1)和10g/kg(NN-2)时,将电气石类芬顿联合微生物对PBDEs总去除率分别提高至(73.19±0.04)%和(83.33±1.72)%.对比未添加营养盐的空白组、电气石类芬顿和微生物单独及联合作用组,可以看出,营养盐的添加进一步提高了PBDEs的降解率.因此,NH4Cl和NH4NO3都提高了电气石类芬顿辅助微生物对PBDEs的修复效率,且高浓度的营养盐效果更明显,而10g/kg土的用量仅是我们前期用的营养盐辅助单一微生物修复时剂量的1/5[9].因此,可以说明营养盐强化电气石类芬顿技术在辅助微生物降解PBDEs方面较为有效.
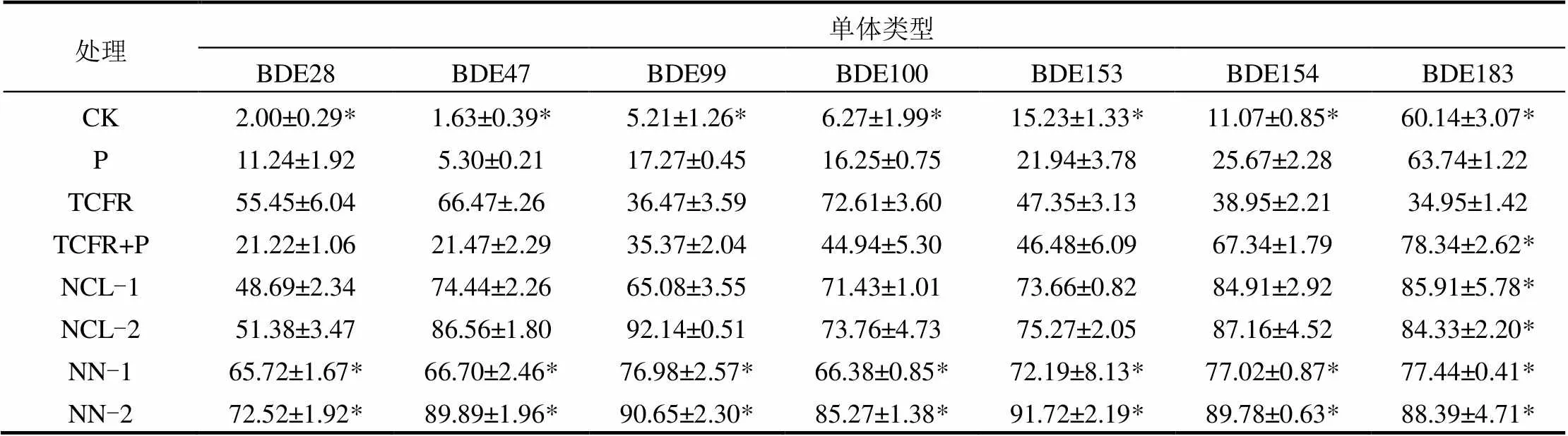
针对单体BDE,对于BDE-28, BDE- 47, BDE-99, BDE-100, BDE-153, BDE- 154和BDE-183,电气石类芬顿试剂的加入使微生物降解的去除率得到提高.营养盐在最佳剂量的情况下,如NH4Cl剂量为10g/kg时, BDE-28, BDE-47, BDE-99, BDE-100去除率较未添加营养盐前分别提高了30%, 65%, 57%和29%;而对BDE-153, BDE-154和BDE-183的去除率分别提高了45%, 22%和10%.当NH4NO3剂量为10g/kg土时,它将电气石类芬顿联合对BDE-28, BDE-47, BDE-99和BDE-100去除率较未添加营养盐前分别提高了51%, 68%, 55%和41%;而对BDE-153, BDE-154和BDE-183去除率分别提高了45%, 22%和10%.
因此,电气石类芬顿试剂的加入总体上提高了微生物修复的效率营养盐能强化电气石类芬顿联合微生物对低溴BDE化合物的降解,两种营养盐都提高了电气石类芬顿联合微生物对土壤PBDEs去除,且种类和用量不同,强化去除效果不同,在高剂量时强化效果更明显,特别是对土壤中低溴BDE——四溴和五溴代醚如BDE-28, BDE-47, BDE-99和BDE-100效果更佳.
2.2 表面活性剂强化电气石类芬顿辅助微生物降解土壤中PBDEs
使用不同种类和剂量的表面活性剂TW-80和TX-100强化电气石类芬顿联合微生物对PBDEs修复的影响结果见表4.当TW-80添加量分别为1g/kg和5g/kg时,第70d对PBDEs总降解率分别提高至(66.56±1.77)%和(70.86±0.02)%;当TX-100添加量分别为1g/kg和5g/kg时,使电气石类芬顿联合微生物对PBDEs总降解率分别提高至(75.58±1.79)%和(71.41±1.50)%.
对比未添加表面活性剂情况下,TCFR+P对PBDEs的最高去除效率为(43.10±0.41)%.因此, TW-80和TX-100分别将电气石类芬顿辅助微生物对PBDEs降解最高能提高27%和33%.通常认为,表面活性剂提高疏水性有机污染物的微生物降解效率是因为其提高疏水性有机污染物的增溶作用,其次,对微生物提供碳源作用[22],但对微生物促进或抑制作用依靠表面活性剂浓度而定.
针对单体BDE,TW-80最佳剂量为5/kg土,它将电气石类芬顿联合对BDE-28, BDE-47, BDE-99, BDE-100去除率较未添加表面活性剂前分别提高了22%, 63%, 42%和13%;而对BDE-153, BDE-154和BDE-183去除率分别提高了36%, 6%和11%.TX-100最佳剂量为1g/kg土,它将电气石类芬顿联合对BDE-28, BDE-47, BDE-99, BDE-100去除率较未添加表面活性剂前分别提高了20%, 43%, 51%和40%;而对BDE-153, BDE-154和BDE-183去除率分别提高了37%, 10%和11%.因此,两种表面活性剂均能强化电气石类芬顿联合微生物对PBDEs污染修复,且种类和用量不同,强化去除效果不同.TW-80是在高剂量效果明显,TX-100在低剂量时效果更佳,且TX-100效果略优越于TW-80;且对不同单体BDE提高程度不同,对低溴三溴BDE-99和BDE-100以及六溴BDE-153效果尤为明显.
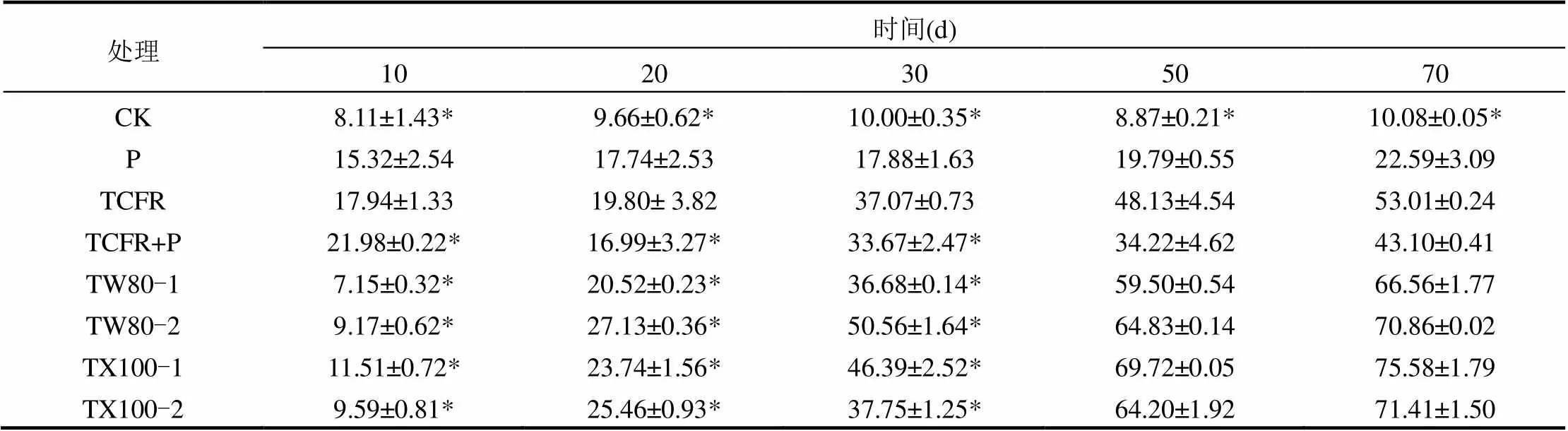
表4 不同剂量表面活性剂对电气石类芬顿联合微生物降解PBDEs总降解率(a)和个体PBDE降解率(b)影响
2.3 添加营养盐对土壤真菌生物量的影响
图1显示了加入不同种类和剂量的营养盐后土壤中真菌含量的变化.
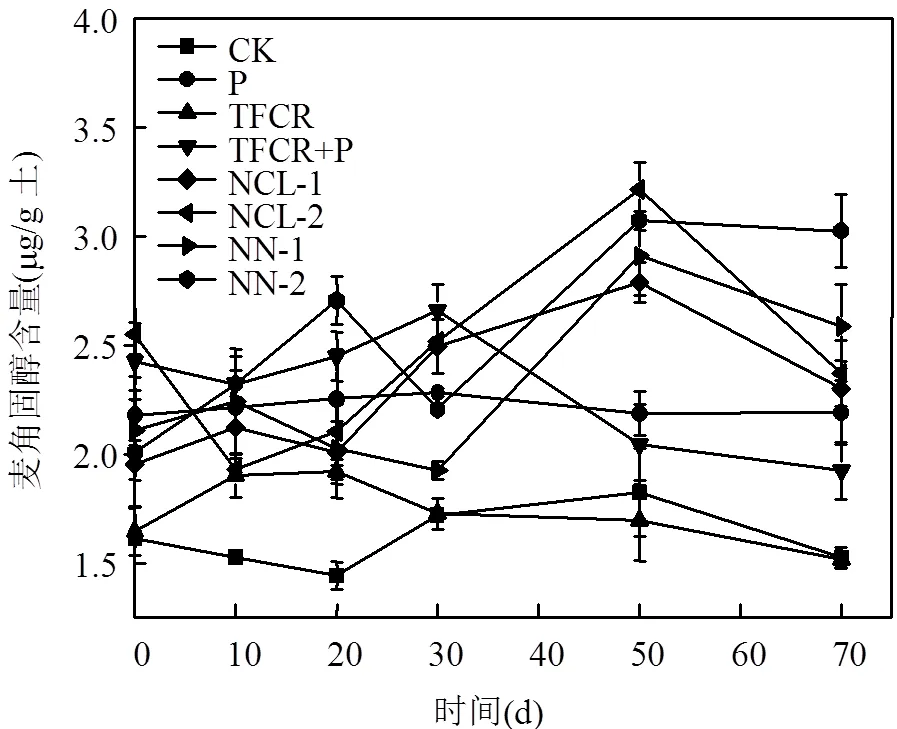
图1 加入不同营养盐后土壤中麦角固醇含量的变化
空白土壤中在0d麦角固醇含量为(1.62± 0.03)μg/g土壤,这表明该土壤中含有土著真菌.相比而言,针对加入微生物的土壤,麦角固醇含量在第30d达最大,为(2.28±0.02)μg/g土壤,70d后减少.对于TCFR处理土壤,麦角固醇的最大含量是在20d时(1.92±0.03)μg/g土壤,之后逐渐减少.对于TCFR+P处理的土壤中,真菌的最大数量在30d时达最大值(2.66±0.12)μg/g土壤,高于其它处理组中的含量.加入氯化铵的实验组, 在前20d加入NCL-2组真菌活性比NCL-1组略低,之后前者中的真菌活性比后者的真菌活性明显提高,且麦角固醇含量在第50d都达到最高值,70d后含量降低,空白组也在50d达到最大值;加入硝酸铵的土壤中, NN-2和NN-1组中麦角固醇含量在第50d达最高值,到第70d略有降低.
以上数据表明,各组中麦角固醇含量最高值依次为NCL-2组> NN-2组> NN-1组> NCl-1组> TCFR+P组> P组> TCFR组> 空白组.所以证明高浓度的营养盐有利于促进土壤中真菌繁殖,进而提高了土壤中PBDEs的修复效率,同时,营养盐对真菌促进程度不仅与营养盐含量有关,且与种类有关.
2.4 添加表面活性剂对土壤真菌生物量的影响
表面活性剂剂量不合适会具有一定毒性,一旦其剂量过高,会对微生物产生毒性,抑制繁殖[23],合适的剂量促进微生物繁殖[24].图2显示了加入不同种类和剂量的表面活性剂后土壤中真菌含量的变化.
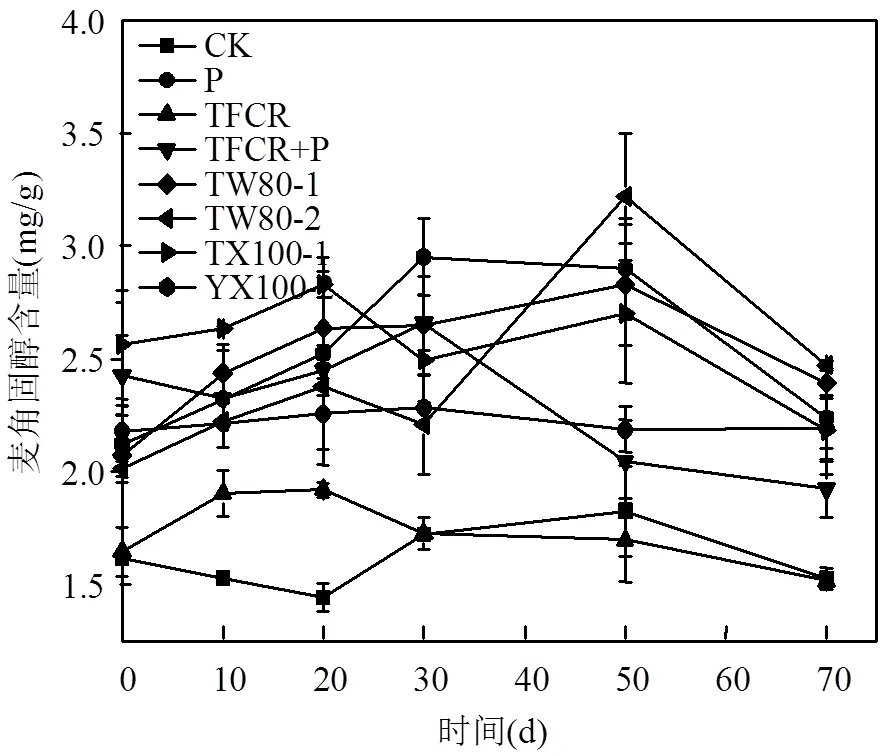
图2 加入不同表面活性剂后土壤中麦角固醇含量的变化
由图可知,表面活性剂剂量不合适会具有一定毒性,一旦其剂量过高,会对微生物产生毒性,抑制繁殖[23],合适的剂量促进微生物繁殖[24].图2表明,表面活性剂对真菌生长起到促进作用.真菌含量变化分两个阶段,修复初期,TW80-2组比TW80-1组中真菌含量稍低,之后前者中的真菌含量高于后者,最大值在第50d时取得,TW80-2和TW80-1组中分别为(3.22±0.28)μg/g土壤、(2.83±0.27)μg/g土壤,到第70d都有所降低.加入不同剂量的TX-100后,开始阶段TX100-2组比TX100-1组中真菌含量略低,之后TX100-2组中的真菌含量更高,最大值为(2.95±0.17)μg/g土壤,TX100-1组中麦角固醇含量最大值为(2.83± 0.06)μg/g,70d后TX100-2和TX100-1中的麦角固醇含量也有所降低.测定结果表明,加入表面活性剂后各组中麦角固醇含量最大值的高低顺序为TW80-2组>TX100-2组> TW80-1组>TX100-1组>TCFR+P组>P组>TCFR组>空白组.表面活性剂之所以提高土壤麦角固醇含量,即提高土壤真菌数量,可能原因之一为加入表面活性剂为微生物提供了碳源等,促进微生物的繁殖,进而提高了土壤PBDEs修复效率.
3 结论
3.1 电气石类芬顿联合微生物进行修复可以使土壤中PBDEs的降解率提高,且营养盐和表面活性剂的加入从整体上提高了降解PBDEs的效率.电气石类芬顿辅助微生物对土壤中PBDEs去除率随营养盐剂量增加而增加.当营养盐剂量为10g/kg土壤时,对电气石类芬顿联合微生物对PBDEs总降解率提高至最大值.同时,针对个体BDE, NCL-2组对低溴代联苯醚中的BDE-99降解率最高, NN-2组对高溴代中的BDE-153降解率最高.不同类型及剂量表面活性剂对电气石类芬顿联合微生物修复土壤PBDEs的强化结果有所差异,当TW-80添加量5g/kg土壤时,电气石类芬顿联合微生物对PBDEs总降解率较大;当TX-100添加量为1g/kg土壤时,电气石类芬顿联合微生物对PBDEs总降解率较大;针对单体BDE,两者促进低溴代联苯醚降解程度更高.
3.2 加入营养盐和表面活性剂均能促进真菌麦角固醇含量,且最高值排列顺序为NCL-2组> NN-2组> NN-1组> NCl-1组> TCFR+P组> P组>TCFR组>空白组,氯化铵比硝酸铵更有利于微生物生长,高浓度的营养盐促进土壤中真菌的生长;加入表面活性剂后各组中麦角固醇含量最高值大小顺序为TW80-2组>TX100-2组>TW80-1组>TX100-1组>TCFR+P组>P组>TCFR组>空白组.因此,所加入表面活性剂浓度适宜可为微生物提供碳源.
综上所述,本研究建立了表面活性剂和营养盐强化电气石类芬顿联合微生物新型修复技术,为土壤修复提供了参考依据.
[1] 任金亮.多溴联苯醚环境行为的特征与研究进展[J]. 化工进展, 2006,25(10):1152-1157.
[2] Eguchi A, Isobe T, Ramu K, et al. Soil contamination by brominated flame retardants in open waste dumping sites in Asian developing countries [J]. Chemosphere, 2013,90(9):2365-2371.
[3] 洪 伟.多溴联苯醚的环境危害及处理技术研究进展[J]. 化学工程与装备, 2012,(12):150-152.
[4] Wania F, Dugani C B. Assessing the long-range transport potential of polybrominated diphenyl ethers: A comparison of four multimedia models [J]. Environmental Toxicology and Chemistry, 2003,22(6):1252-1261.
[5] Valderrama C, Alessandri R, Aunola T, et al. Oxidation by Fenton's reagent combined with biological treatment applied to a creosote-comtaminated soil [J]. Journal of Hazardous Materials, 2009,166(2/3):594-602.
[6] 裴晓哲,刘守清.芬顿氧化法修复敌百虫污染土壤的研究[J]. 苏州科技学院学报(自然科学版), 2014,(3):29-32+42.
[7] 金学锋,张国华,乔昌明,等.类芬顿试剂应用于地下水石油烃污染修复的实践[J]. 中国资源综合利用, 2017,(2):15-17.
[8] Li J, Wang C P, Wang D, et al. A novel technology for remediation of PBDEs contaminated soils using tourmaline- catalyzed Fenton-like oxidation combined with[J]. Chemical Engineering Journal, 2016,296:319-328.
[9] Wang C P, Yu L, Zhang Z Y, et al. Tourmaline combined withto remediate agricultural soil contaminated with PAHs and OCPs [J]. Journal of Hazardous Materials, 2014,264:439-448.
[10] 李 平,王兴祥,郎 漫,等.改良剂对Cu、Cd污染土壤重金属形态转化的影响[J]. 中国环境科学, 2012,32(7):1241-1249.
[11] Wang C P, Yu L, Zhang ZY, et al. Enhanced bioremediation of field agricultural soils contaminated with PAHs and OCPs [J]. International Journal of Environmental Research, 2014,8(4): 1271-1278.
[12] 黄录峰.土壤有机污染的表面活性剂修复技术[J]. 绿色科技, 2013,(5):163-167.
[13] 肖鹏飞,李玉文,Kondo Ryuichiro,等.Tween60和SDS强化白腐真菌修复DDT污染土壤[J]. 中国环境科学, 2015,35(12): 3737-3743.
[14] 钱欣平,阳永荣,孟 琴.生物表面活性剂对微生物生长和代谢的影响[J]. 微生物学通报, 2002,29(3):75-78.
[15] 乔 洁.红壤性水稻土麦角固醇测定方法及其在表征施肥与水分管理对微生物群落影响中的应用[D]. 南京:南京农业大学, 2006.
[16] Engelkinga B, Flessab H, Joergensen RG, et al. Formation and use of microbial residues after adding sugarcane sucrose to a heated soil devoid of soil organic matter [J]. Soil Biology and Biochemistry, 2008,40(1):97-105.
[17] Montgomery H J, Monreal C M, Young J C, et al. Determinination of soil fungal biomass from soil ergosterol analyses [J]. Soil Biology and Biochemistry, 2000,32(8/9): 1207-1217.
[18] Aceves M B, Hassan M, Tinoco R, et al. Effect of pollutants on the ergosterol content as indicator of fungal biomass [J]. Journal of Microbiological Methods, 2002,50(3):227-236.
[19] HJ615-2011 土壤有机碳的测定重铬酸钾氧化分光光度法[S].
[20] Klute A. Methods of soil analysis. Part 1. Physical and mineralogical methods [C]//American Society of Agronomy, 1986,146(2):413-423.
[21] Klamera M. Baath E. Estimation of conversion factors for fungal biomass determination in compost using ergosterol and PLFA 18:2ω6,9 [J]. Soil Biology and Biochemistry, 2004,36(1):57-65.
[22] 丁 娟,罗 坤,周 娟,等.表面活性剂Tween80和β-环糊精对白腐菌降解多环芳烃的影响[J]. 南京大学学报(自然科学版), 2007,43(5):561- 566.
[23] 王宝辉,张学佳,纪 巍,等.表面活性剂环境危害性分析[J]. 化工进展, 2007, 26(9):1263-1268.
[24] 朱 青.非离子表面活性剂对微生物降解多环芳烃的影响[D]. 北京:中国地质大学, 2012.
A novel technology for enhanced remediation of soils contaminated by PBDEs.
YIN Meng-fei, LI Jing, WANG Cui-ping*, SUN Hong-wen
(Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin Key Laboratory of Environmental Remediation and Pollution Control, College of Environmental Science and Engineering, Nankai University, Tianjin 300350, China)., 2017,37(10):3853~3860
The main object in the present study was to establish the efficient technology for remediation of PBDEs contaminated soil using surfactants and nutrients enhanced tourmaline-catalyzed Fenton-like oxidation combined with microorganisms. Two kinds of nutrient salts including ammonium chloride and ammonium nitrate, and two types of surfactants such as Tween 80 and Triton 100, were selected to investigate effects of their different doses and types on the removal of PBDEs from soil and soil fungi. The results showed that high-dose nutrient promoted the degradation of PBDEs using tourmaline-catalyzed Fenton-like oxidation combined with microorganisms, and the removal efficiency was up to 75%. Both of surfactants could promote the degradation of PBDEs using tourmaline-catalyzed Fenton-like oxidation combined with microorganisms, and the degradation efficiency was up to 76%. For different individual BDEs, nutrients and surfactants could significantly enhance degradation of low brominated diphenyl ethers. Ammonium chloride was more beneficial to growth of soil microorganisms than ammonium nitrate, and high concentration of nutrients more obviously promoted growth of fungi in soil than their low concentration. TW-80 was more beneficial to microbial growth than TX-100, and lower concentration of surfactants was more effective in promoting fungal activities in soil. Therefore, the different types of nutrients and surfactants obviously enhanced the removal efficiency of PBDEs in soils using the technology of tourmaline-catalyzed Fenton-like oxidation combined with microorganisms.
PBDEs;tourmaline Fenton-like reaction;nutrients;surfactant;bioremediation;soil.
X53
A
1000-6923(2017)10-3853-08
殷梦菲(1993-),女,山东高密人,南开大学环境科学与工程学院硕士研究生,主要从事环境污染物控制与修复研究.
2017-03-19
国家自然科学基金资助项目(41673104);天津市重点项目(17JCZDJC39600);国家“973”项目(2014CB441104)
* 责任作者,教授, wangcp@nankai.edu.cn
