热,碱和Fe3O4激活过硫酸钠降解二恶烷的对比研究
2017-11-07张丽娜张俊涛田亚灵刘智峰曾光明
张丽娜,钟 华,2*,张俊涛,崔 朋,田亚灵,刘智峰,曾光明
热,碱和Fe3O4激活过硫酸钠降解二恶烷的对比研究
张丽娜1,钟 华1,2*,张俊涛1,崔 朋1,田亚灵1,刘智峰1,曾光明1
(1.湖南大学环境科学与工程学院,湖南 长沙410082;2.武汉大学水资源与水电工程科学国家重点实验室,湖北武汉430072)
研究对比了热,碱和Fe3O43种方法激活过硫酸钠对二恶烷的降解情况.结果表明,加碱且反应液pH值不超过12h,过硫酸钠对二恶烷的降解受到了抑制.加热可以有效激活过硫酸钠降解二恶烷,在40℃、过硫酸钠与二恶烷的物质的量比为20:1的条件下,反应48h时二恶烷的降解率达98%,降解反应的准一级反应速率常数为68.1×10-6h-1.非均相体系中,Fe3O4也可显著激活过硫酸钠降解二恶烷,过硫酸钠与二恶烷的物质的量比为80:1,Fe3O4与混合溶液固液比仅为1:100时,二恶烷降解的准一级反应速率常数为61.1×10-6h-1,接近上述加热激活的水平.Fe3O4激活过硫酸根降解二恶烷时,由于过硫酸根优先与二恶烷反应而不是Fe3O4发生反应,因此在二恶烷降解完成之前溶解态Fe产生量低、Fe3O4消耗少.该研究结果反映出应用Fe3O4激活过硫酸盐的方法修复有机污染地下水的较大潜力.
过硫酸钠;二恶烷;激活;高级氧化;地下水修复
二恶烷,学名1,4-二氧杂环己烷(1,4-dioxane),是一种环状有机化合物,在染料,石油,柴油,聚乙烯多聚物等物质的工业生产过程中有广泛的应用[1],也常被用做稳定剂来防止生产过程中氯代溶剂的分解[2].因此,氯代溶剂污染的地下水中,常伴有二恶烷的出现[3].而且,在乙二醇或环氧己烷的生产过程中,二恶烷会以副产物的形式产生[4].二恶烷在水中的溶解度很高,这就使得其易于进入环境中造成地下水的污染,在氯代烃污染源区可高达数十毫克每升.
有研究表明,二恶烷的存在会在一定程度上影响性激素的分泌[5],并且会损伤肝脏,造成肾功能衰竭,被认为是引起人类致病的一种潜在的有机污染物.美国环保局已经将二恶烷列入潜在致癌物名录,并且截止2007年,已经有超过31个地区把二恶烷列入优先控制污染物名录[6].

过硫酸盐是一种强氧化剂,其分解产生的硫酸根自由基有很强的氧化性[8-10].过硫酸盐作为氧化剂相比于过氧化氢具有稳定性好、安全性能高、在水中作用时间长的优点;相比于高锰酸盐,过硫酸盐能降解更多的难降解有机污染物,因此过硫酸盐作为一种新型的原位化学氧化剂得到日益广泛的应用.但要过硫酸盐快速充分地发挥作用,需要将它激活产自由基.因此如何有效激活过硫酸盐对有机污染物进行降解,以及相应的激活机理受到越来越多的关注.在地下水原位化学氧化修复实践中,已知常用的激活过硫酸盐的方法有热激活[11],碱激活[12-13],过渡金属激活[14]等3种.
热激活有能耗高的天然劣势.碱激活容易受到土壤介质缓冲作用的影响.过渡金属中,铁及其化合物的激活作用效果最为明显.亚铁离子作为均相激活剂对过硫酸盐的激活已经得到了充分的研究[15-17],但由于它本身能与过硫酸盐快速反应,因而有作用范围小、原料消耗量大、易产生大量铁泥等问题,并且它无法用于原位可渗透反应墙,在地下水原位修复应用中存在不足.近来的研究结果表明,在非均相系统中,零价铁也能有效激活过硫酸盐使之降解二恶烷.但该过程中过硫酸盐和零价铁反应剧烈,因而有原料消耗量大、溶解态铁产生量大、污染物完全降解耗时长等问题[15].铁的氧化物如Fe3O4也表现出较强的激活过硫酸钠的能力,例如Zhong等[18]的研究表明Fe3O4激活过硫酸钠降解地下水中的垃圾渗滤液有机物有较好的效果.
本研究旨在考察Fe3O4激活过硫酸钠对二恶烷的降解效果,并将其与热激活和碱激活方法进行对比,为衡量Fe3O4非均相激活过硫酸盐的方法处理地下水中难降解有机物的有效性提供依据.
1 材料和方法
1.1 实验材料和仪器
二恶烷(³99.7%)购于上海麦考林生化科技有限公司,四氧化三铁(Fe3O4,³98%)购于阿拉丁公司(上海),过硫酸钠(³98%),碘化钾,碳酸氢钠,氢氧化钠等试剂(分析纯)购于国药集团化学试剂有限公司.其他试剂均为分析纯,购于本地.
所用仪器包括哈希分光光度计(DR2800, Loveland, CO, USA),气相色谱分析仪(Agilent 6890GC, USA),实验室pH计(PHS-3C,雷磁-上海仪电科学仪器股份有限公司),数显恒温水浴锅(HH-8,江苏实验仪器厂),恒温震荡水浴箱(SHA- 2江苏东鹏仪器制造有限公司)等.
1.2 实验方法
过硫酸钠对二恶烷的降解实验在加热,加碱,加Fe3O4等3种条件下进行,并且设置了非激活条件的空白对照组.实验过程中所用溶液未特别说明,采用纯水配制而成.
均相反应组(加热、加碱和非激活对照组)所用的反应器为10mL的柱状螺口玻璃瓶.在对照组中,将1mmol/L的二恶烷溶液和20mmol/L的过硫酸钠溶液各5mL加入到反应瓶中并充分混合,使得反应瓶中二恶烷的浓度为0.5mmol/L,过硫酸钠的浓度为10mmol/L,且液体几乎充满瓶体空间,再用带有聚四氟乙烯内垫的瓶盖将玻璃瓶密封.快速制取多个这样的反应瓶,并将它们至于温度为25℃的带盖恒温水浴箱中开始反应.在设定好的时间点采用牺牲反应瓶的方式用来取样.首先将取样的反应瓶置于冰水浴中,显著降低反应速率后,迅速测定反应液中的二恶烷,过硫酸根,硫酸根,以及反应液的pH值.该组中还包括一个无氧化剂的空白组,其样品制作时20mmol/L的过硫酸钠溶液用纯水代替.在加热实验组中,恒温水浴箱的温度设置为40℃,其余条件与对照组相同.加碱实验组中(pH值为8.9和11.7两个条件)二恶烷储备液用氢氧化钠溶液配制而成,其余条件与对照实验组相同.所有反应中每个取样点至少取两个平行样.
加有Fe3O4非均相反应实验组中,为了使得Fe3O4与混合溶液充分接触,反应在添加了玻璃珠的10mL锥形瓶中进行.反应液的配制仍采用二恶烷溶液和过硫酸钠溶液等体积(各5mL)混合的方法,然后再在瓶中加入Fe3O4粉末(平均粒径<2μm),最后瓶子用包有聚四氟乙烯膜的橡胶塞密封,瓶中几乎不存在气体空间.上述过程迅速完成后,反应瓶置于温度为25℃、转速为200r/min的带盖恒温水浴震荡箱中开始反应.在设定好的时间点采用牺牲反应瓶的方式用来取样,冰水浴显著降低反应速率后,采用0.22µm的玻璃纤维滤膜将溶液和Fe3O4固体颗粒分离,测定滤液中的二恶烷,过硫酸根,硫酸根,溶解性总铁以及反应溶液的pH值.所有反应中每个取样点至少取两个平行样.该非均相反应实验设两个条件:①二恶烷和过硫酸钠的浓度分别为0.5mmol/L和10mmol/L,Fe3O4与反应液的固液比为1:50(/);②二恶烷和过硫酸钠的浓度分别为0.5mmol/ L和40mmol/L时,固液比为1:100(/).在该实验组中,还做了硫酸对Fe3O4的溶解态铁的浸出对比实验,即配置初始pH值与上述非均相反应实验组反应液相同的硫酸溶液,取10mL与0.2g Fe3O4粉末混合,其他反应条件与上述非均相反应实验组相同,测定反应过程中的溶解态总铁及pH随时间变化.
1.3 分析方法
样品中二恶烷的浓度用安捷伦6890GC气相色谱仪测定,采用火焰离子检测器检测,载气为氦气,进样口温度为200℃,检测器温度为250℃,升温程序是以10℃/min从50℃升到110℃,二恶烷的出峰时间约为4.25min.
过硫酸根浓度采用Zhong等[18]中的碘化钾-碳酸氢钠分光光度计法进行测定.将碘化钾溶于5g/L的碳酸氢钠溶液中制成100g/L的碘化钾溶液.测样时,将9.5mL的碘化钾溶液加入到0.5mL样品中,显色20min后,用HACH DR2800分光光度计在400nm下测定吸光度.过硫酸根的浓度.硫酸根、亚铁离子和总铁浓度均用哈希DR2800分光光度计测定,具体引用Zhong[19]中提到的方法.样品溶液pH值用实验室pH计(PHS-3C,雷磁-上海仪电科学仪器股份有限公司)测定.
该研究中用准一级反应动力学分析不同激活方式下二恶烷的反应速率,准一级反应动力学方程为d/d=-,其中为时间(h),=()为时刻系统中二恶烷的浓度(mol/L),比例系数为反应速率常数(h-1).应用边界条件后的解析式为=0e-kt,或ln(/0)=-(0为二恶烷的初始浓度(mol/L)),对ln(/0)和进行线性拟合得到.
2 结果与讨论
2.1 碱激活
二恶烷不同初始pH值(3.3、8.9、11.7)条件下,过硫酸钠降解二恶烷的结果如图1a所示.二恶烷单独存在时,其浓度随时间基本不变,说明系统中无其他因素致使二恶烷分解.当存在过硫酸钠时,二恶烷浓度的基本变化趋势是随时间增加而降低,并且在不加碱的条件下(初始pH值为3.3),二恶烷的降解效果最好,反应96h时,其降解率达48%,高于pH值为8.9时的20%和pH值为11.7时的13%.而在3个初始pH条件下,反应液的pH均未发生明显变化(图1b).反应过程中过硫酸根和硫酸根的浓度变化如图1c所示.该过程中仅在pH为3.3的条件下,过硫酸根的浓度明显降低并伴随硫酸根浓度的升高.整个过程中总硫的浓度基本保持初始浓度不变(/0=1),说明硫酸根是过硫酸根的唯一反应产物.该结果表明,在酸性条件下,过硫酸钠对二恶烷的降解效果最好.赵进英等[20]的研究结果显示,反应温度为50℃,溶液pH值为4.0时,反应6h后,4-氯苯酚的降解率达80%,而当pH值为10.0时,反应6h后,4-氯苯酚的降解率为42.8%.我们的研究结果与之类似.但该结果与一般认为的碱能激活过硫酸盐的结论不一致,原因可能是碱激活过硫酸盐要在碱浓度很高的条件下才能实现,例如Furman等[13]的研究中NaOH浓度在1mol/L以上,其对应机理为:
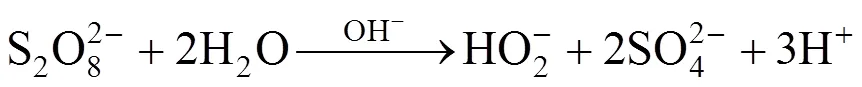
(a)二恶烷浓度随时间的变化情况;(b)pH值随时间的变化情况;(c)硫酸根,过硫酸根和总硫的过硫酸根当量浓度随时间的变化情况. DX为二恶烷,PS为过硫酸根,S为硫酸根,TS为过硫酸根与硫酸根之和
然而原位修复过程中,土壤介质通常有很强的缓冲作用,可能对激活效果产生影响[21].本研究结果则反映出,若土壤介质的缓冲作用使得施加碱液的pH值降低至12以下,将使碱激活的效率显著降低.
2.2 热激活
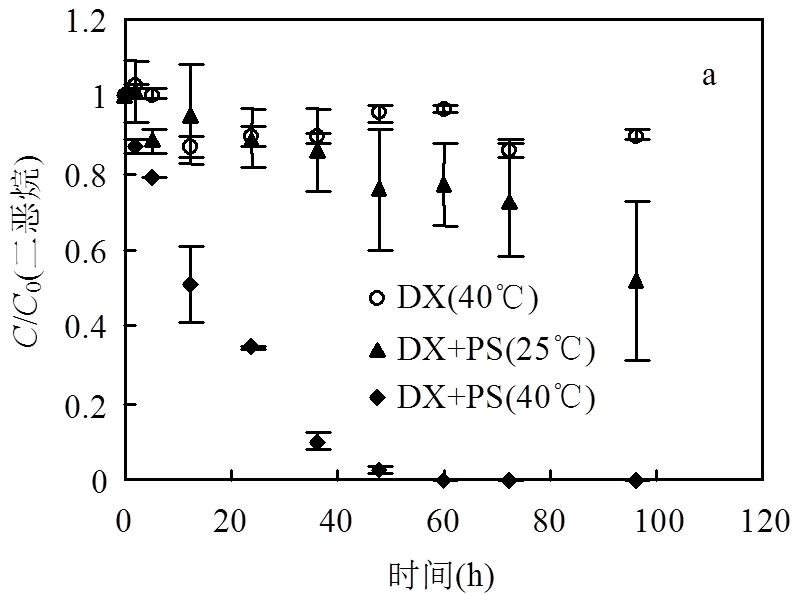
(a)二恶烷浓度随时间的变化;(b)硫酸根,过硫酸根和总硫的过硫酸根当量浓度随时间的变化.DX为二恶烷,PS为过硫酸根,S为硫酸根,TS为过硫酸根与硫酸根之和
二恶烷加热条件下过硫酸钠对二恶烷的降解结果见图2.温度为25℃时二恶烷的降解数据亦置于图2中,作为对比.在加热条件下(40℃),二恶烷单独存在时,整个反应过程中,二恶烷浓度无显著变化,表明仅加热无法使二恶烷降解.当存在过硫酸钠时,二恶烷迅速降解并在48h时降解率达98%,且该过程明显快于25℃二恶烷的降解.表1为各条件下二恶烷降解的准一级反应速率常数.可以看出,反应温度为40℃时,二恶烷的准一级反应速率常数(68.1×10-6h-1)是25℃时(4.7×10-6h-1)的14.5倍,同时图2(b)显示,40℃时过硫酸根分解速率和硫酸根的生成速率均比25℃时显著增加.整个过程中反应液的pH值维持在3左右(数据未显示).这表明,加热可以有效激活过硫酸根,从而使二恶烷得以快速降解.这是由于加热能使得过硫酸根运动更剧烈,使得更多过硫酸根中的过氧键断裂产生硫酸根自由基[20,22].
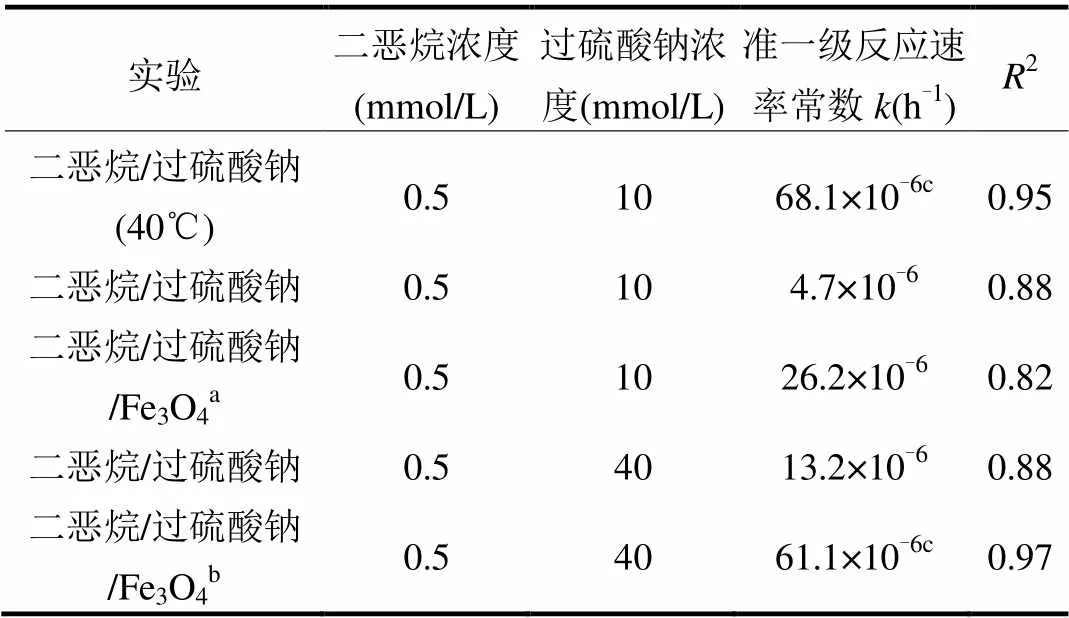
表1 不同反应条件下二恶烷降解的准一级反应速率常数
注:a该反应系统中Fe3O4与反应溶液的质量比为1:50;b该反应系统中Fe3O4与反应溶液的质量比为1:100;c准一级反应速率常数在48h内测得.
2.3 Fe3O4激活
Fe3O4激活过硫酸盐降解二恶烷的结果如图3a所示.不论过硫酸钠的初始浓度是10mmol/L或40mmol/L,Fe3O4的存在,都使得二恶烷的降解速率明显提高.由表1也可以看出,存在Fe3O4时,对于两个过硫酸钠初始浓度(10mmol/L与40mmol/L,过硫酸根与二恶烷物质的量比20:1与80:1),二恶烷的准一级反应速率常数均远高于无Fe3O4的情况(均为5倍左右).这说明,Fe3O4能够显著增强过硫酸钠对二恶烷的降解能力.值得一提的是,当过硫酸钠和二恶烷的物质的量比为20:1,Fe3O4与混合溶液的固液质量比为1:50时,二恶烷的降解速率也明显高于过硫酸钠和二恶烷物质的量比为80:1时二恶烷的降解速率,表明对于二恶烷的降解,加入Fe3O4颗粒作为激活剂比提高过硫酸钠的浓度效果要好.而过硫酸根和硫酸根浓度变化结果表明,存在Fe3O4时,硫酸根的产生量相对于无Fe3O4时显著增加.以上结果表明,Fe3O4能有效激活过硫酸钠并显著提高二恶烷的降解速率.当过硫酸根与二恶烷物质的量比为80:1并且仅存在少量Fe3O4(固液比1:100)的条件下,二恶烷的降解速率常数达到61.1× 10-6h-1,这与硫酸根与二恶烷物质的量比为20:1且加热条件下的降解速率常数(68.1×10-6h-1)已非常接近,说明通过适当提高过硫酸钠浓度和添加Fe3O4可以使二恶烷的降解速率达到与加热相当的水平.
过硫酸盐、二恶烷和Fe3O4的反应体系中,pH和总溶解态Fe浓度的变化如图3c所示.体系中pH是缓慢降低的,这是由于过硫酸根对二恶烷的氧化反应产生H+的缘故.总溶解态Fe浓度在前60h增加非常缓慢(产生速率0.014mg/ (L·h)).60h后,二恶烷基本降解完全,此时总溶解性铁的产生速率(0.258mg/(L·h))明显增加.该结果表明,在Fe3O4激活过硫酸钠降解二恶烷的反应过程中,二恶烷相对于Fe3O4优先与被激活的过硫酸钠发生反应.在硫酸与四氧化三铁的反应体系中,初始pH与过硫酸盐、二恶烷和Fe3O4的反应体系相同,但随着反应的进行,pH值逐渐升高,这是由于四氧化三铁和硫酸反应消耗H+所致.尽管整个过程中pH值更高, 溶解性总铁的产生速率(0.047mg/(L·h)却远高于过硫酸盐、二恶烷和Fe3O4的反应体系中前60h的溶解性总铁的产生速率(0.014mg/(L·h)).该结果表明,在过硫酸盐、二恶烷和Fe3O4的反应体系中,激活过硫酸根降解二恶烷,并非通过溶出溶解态的铁的途径而实现.而很有可能是通过Fe3O4的表面激活反应.多个相关研究持类似观点,即Fe3O4激活过硫酸盐的反应类似于类Fenton反应,是一个表面反应过程[23-24]:
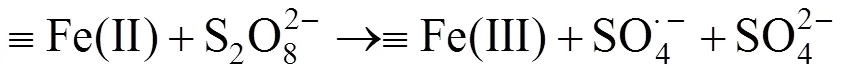
并且Yan等[23]的研究指出纳米四氧化三铁颗粒能够激活过硫酸根产生硫酸根自由基和羟基自由基.该结果暗示着,实际应用过程中Fe3O4的消耗量将很小,因此在原料消耗方面相对于亚铁或零价铁激活过硫酸钠的方法存在巨大优势.
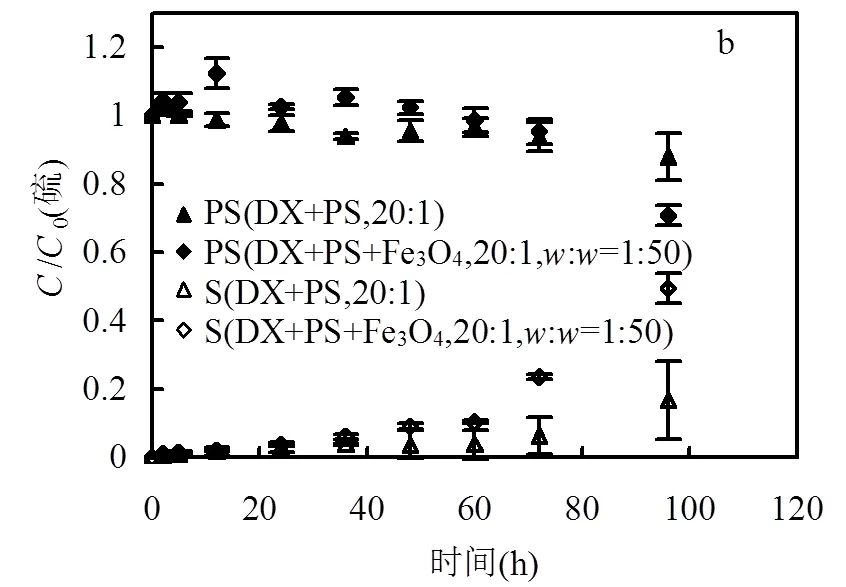
(a)二恶烷浓度随时间的变化;(b)硫酸根,过硫酸根浓度随时间的变化.(c)溶解性总铁和pH随时间的变化.DX为二恶烷,PS为过硫酸根,S为硫酸根
3 结论
3.1 在加热,加碱,加Fe3O4三种条件下,过硫酸钠对二恶烷有不同的降解效果.若未使系统pH超过12,加碱使二恶烷的降解受到抑制.加热可以有效激活过硫酸钠,从而使二恶烷迅速分解.Fe3O4非均相激活过硫酸钠亦能显著提高二恶烷的降解速率,并且在适当提高过硫酸盐浓度的条件下可提高到与加热(40℃)相当的水平.
3.2 Fe3O4作为激活剂不会优先与过硫酸根反应,本身的消耗量很小.这些方面的优势使得Fe3O4有很大的潜力应用于受二恶烷污染地下水的修复,例如利用过硫酸盐-Fe3O4的可渗透反应墙系统处理浅层地下水,以及注入纳米Fe3O4形成过硫酸盐的激活反应区原位处理深层地下水.
3.3 Fe3O4激活过硫酸盐的反应机理则值得进一步研究.
[1] Adams C D, Scanlan P A, and Secrist N D. Oxidation and biodegradability enhancement of 1,4-dioxane using hydrogen peroxide and ozone [J]. Environmental Science & Technology, 1994, 28(11):1812-1818.
[2] Coleman H M, Vimonses V, Leslie G, et al. Degradation of 1,4- dioxane in water using TiO2based photocatalytic and H2O2/UV processes. Journal of Hazardous Materials, 2007,146(3):496-501.
[3] Adamson David T, Mahendra Shaily Jr, Kenneth L Walker,et al. A multisite survey to identify the scale of the 1,4-dioxane problem at contaminated groundwater sites [J]. Environ. sci. Technol. Lett, 2014,1(5):254-258.
[4] Popoola, A.V. Mechanism of the reaction involving the formation of dioxane byproduct during the production of poly(ethylene terephthalate) [J]. Journal of Applied Polymer Science, 1991, 43(10):1875-1877.
[5] Stepanov M G, Arutiunian A V, and Aĭlamazian E K. Disruption of central regulation of reproductive function under the effect of unfavorable environmental factors [J]. Voprosy Medit͡sinskoĭ Khimii, 1995,41(5):33-35.
[6] US EPA, O., Oaa, Ffrro, Technical Fact Sheet – 1,4-Dioxane.
[7] Ware, G.W. p –Dioxane, 1988:113-121.
[8] Neta P H, Huie R E, and Ross A B, Rate constants for reactions of inorganic radicals in aqueous solution. Journal of Physical and Chemical Reference Data, 1988,17(3):1027-1284.
[9] 朱思瑞,高乃云,鲁 仙,等.热激活过硫酸盐氧化降解水中双酚A [J]. 中国环境科学, 2017,37(1):188-194.
[10] 刘佳露,卢 伟,张凤君,等.活化过硫酸盐氧化地下水中苯酚的动力学研究 [J]. 中国环境科学, 2015,35(9):2677-2681.
[11] Tsitonaki A, Smets B F, and Bjerg P L. Effects of heat-activated persulfate oxidation on soil microorganisms [J]. Water Research, 2008,42(4/5):1013-1022.
[12] Guo Yaoguang, Zhou Jun, Lou Xiaoyi, et al. Enhanced degradation of Tetrabromobisphenol A in water by a UV/base/ persulfate system: Kinetics and intermediates [J]. Chemical Engineering Journal, 2014,254(20):538-544.
[13] Furman, O.S., A.L. Teel, and R.J. Watts, Mechanism of base activation of persulfate [J]. Environmental Science & Technology, 2010,44(16):6423-6428.
[14] Liang, C., et al., Persulfate oxidation of trichloroethylene with and without iron activation in porous media [J]. Chemosphere, 2008,70(3):426-435.
[15] Asha T T, Gandhimathi, Ramesh, S,T,et al. Treatment of Stabilized Leachate by Ferrous-Activated Persulfate Oxidative System [J]. Journal of Hazardous Toxic & Radioactive Waste, 2016: 04016012.
[16] Liang C, Bruell C J, Marley M C et al. Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple [J]. Chemosphere, 2004,55(9):1213-1223.
[17] Shi Yafei, Yang Jiakuan, Mao Wei, et al. Influence of Fe2+- sodium persulfate on extracellular polymeric substances and dewaterability of sewage sludge [J]. Desalination & Water Treatment, 2013,53(10):1-9.
[18] Zhong Hua, Tian Yaling, Yang Qi, et al. Degradation of landfill leachate compounds by persulfate for groundwater remediation [J]. Chemical Engineering Journal, 2016,307:399-407.
[19] Zhong Hua, Brusseau M L, Wang Y, et al. In-situ activation of persulfate by iron filings and degradation of 1, 4-dioxane [J]. Water research, 2015,83:104-111.
[20] 赵进英,张耀斌,全 燮等.加热和亚铁离子活化过硫酸钠氧化降解4-CP的研究 [J]. 环境科学, 2010,31(5):1233-1238.
[21] Petri Benjamin. In Situ Chemical Oxidation of Contaminated Soil and Groundwater Using Persulfate: A Review [J]. Critical Reviews in Environmental Science and Technology, 2010,40(1): 55-91.
[22] Waldemer Rachel H, Tratnyek Paul G, Richard L Johnson, et al. Oxidation of Chlorinated Ethenes by Heat-Activated Persulfate: Kinetics and Products [J]. Environmental Science & Technology, 2007,41(3):1010-1015.
[23] Yan J, Gao W, Dong M, et al. Degradation of trichloroethylene by activated persulfate using a reduced graphene oxide supported magnetite nanoparticle [J]. Chemical Engineering Journal, 2016, 295:309-316.
[24] Leng Y, Guo W, Shi X, et al. Degradation of Rhodamine B by persulfate activated with Fe3O4: Effect of polyhydroquinone serving as an electron shuttle [J]. Chemical Engineering Journal, 2014,240(6):338–343.
A comparative study on activation of persulfate by heat, base and Fe3O4for degradation of 1,4-dioxane.
ZHANG Li-na1, ZHONG Hua1,2*, ZHANG Jun-tao1, CUI Peng1, TIAN Ya-ling1, LIU Zhi-feng1, ZENG Guang-ming1
(1.College of Environmental Science and Engineering, Hunan University, Changsha, 410082, China;2.State Key Laboratory of Water Resources and Hydropower Engineering Science, Wuhan University, Wuhan, 430072, China)., 2017,37(10):3741~3747
In this studyactivation of persulfate by heat, base, and magnetic oxide (Fe3O4) for degradation of 1.4-dioxane was investigated and compared. The results showed that degradation of 1,4-dioxane was inhibited in the base-activation system with pH low than 12. Heat was effective for persulfate activation to degrade 1,4-dioxane. When the temperature was 40℃ and the molar ratio of persulfate and 1,4-dioxane was 20:1, the percentage of 1,4-dioxane removal reached 98% in 48h and the pseudo-first-order reaction rate constant was 68.1×10-6h-1. Degradation of 1,4-dioxane was also significant in the heterogeneous system with Fe3O4as the activator. When the molar ratio of persulfate and 1,4-dioxane was 80:1 and the solid-liquid ratio between Fe3O4and solution was 1:100, the pseudo-first-order reaction rate constant for 1,4-dioxane removal was 61.1×10-6h-1, which was close to that obtained with heating (40℃) as the activation method. In this Fe3O4-based heterogeneous activation system, production of soluble Fe and consumption of Fe3O4were minimal before depletion of 1,4-dioxane, which is due to preference of the reaction between persulfate and 1.4-dioxane to the reaction between persulfate and Fe3O4. The results of this study indicated the potential of application of the Fe3O4-based method for persulfate activation for remediation of groundwater contaminated by organic compounds.
sodium persulfate;1,4-dioxane;activation;advanced oxidation;groundwater remediation
X703.5
A
1000-6923(2017)10-3741-07
张丽娜(1991-),女,河南焦作人,湖南大学硕士研究生,主要从事受污染土壤及地下水的修复研究..
2017-02-04
国家自然科学基金(51378192,51679085)
* 责任作者, 教授, zhonghua@email.arizona.edu
