离子注入突变藻株在城市污水中的产油特性
2017-11-07涂仁杰金文标韩松芳陈洪一
涂仁杰,金文标,韩松芳,周 旭,陈洪一
离子注入突变藻株在城市污水中的产油特性
涂仁杰,金文标*,韩松芳,周 旭,陈洪一
(哈尔滨工业大学深圳研究生院,深圳微藻生物能源工程实验室,广东深圳 518055)
考察了蛋白核小球藻出发株及其离子注入突变株在实际城市污水中的生长情况和产脂性能,以及对污染物的去除能力.结果表明,突变藻株在污水中油脂产率为32.5mg/(L·d),相比于出发株分别显著提高了23.81%(<0.05).通过对生成的脂肪酸甲酯进行气相色谱分析,结果显示离子注入诱变并未改变小球藻脂肪酸成分,但提升了单不饱和脂肪酸的含量,有利于改善所得生物柴油的品质.培养结束后出水水质可达到一级A排放标准,相较于出发株,突变株对污水中污染物具有更好的降解效果.利用扫描电镜观察可以发现出发株和突变株藻细胞形态差异较小,元素含量分析发现突变株H/C值相比出发株有所下降,系统发育树构建说明突变株与出发株属于同种变异.
离子注入;城市污水;小球藻;油脂产量
随着能源危机与环境污染的加剧,微藻生物柴油越来越受到研究者的关注[1-3].微藻培养是其中一个重要环节,在微藻培养过程中,利用淡水培养需消耗大量淡水资源,有悖于当前淡水资源紧缺的背景.同时,营养物质的投加进一步提高了微藻的培养成本[4-5].微藻生长需要消耗大量无机氮、磷等营养物质,城市生活污水中又有大量氮、磷需要去除,利用城市污水培养微藻可以将二者有机结合起来.微藻通过光合作用能够产生较高浓度的O2,可用于污水处理厂曝气池曝气,为活性污泥中微生物的呼吸作用提供O2,而微生物的呼吸作用又能够产生较高浓度的CO2,可为微藻生长提供无机碳源[6].研究表明利用微藻可以净化污水,污水也可以用来培养微藻[7-9].
由于城市污水成分复杂,含有大量的微生物,微藻与细菌之间存在着互生、拮抗等复杂的相互关系[10].不同藻种对环境需求不同,对污水的耐受性也不同[11-12].随着微藻生物能源的快速发展,迫切需要利用技术手段,对自然环境中筛选分离的产油藻种,进行诱变处理以获取品质更加优良的藻种.因此,前期通过离子注入法对蛋白核小球藻进行了诱变,本研究将通过考察小球藻出发株及其离子注入突变株在实际城市污水中的生长情况和产脂性能,以及对污染物的去除效果,以确定突变藻株对实际污水的适应性,为利用城市污水规模化培养能源微藻的研究与技术开发提供实验基础.
1 材料与方法
1.1 试验藻种及培养
实验所用微藻为课题组前期经离子注入法诱变筛选的蛋白核小球藻诱变株(CVM)[13],藻种采用BG11培养基[14]进行传代培养保藏.实验所用城市污水取自深圳大学城市政污水井,经潜污泵抽取后使用,污水水质如下:COD、NH4+-N、TN和TP的浓度分别为140~200mg/L、20~ 40mg/L、20~45mg/L和5.0~6.5mg/L.以BG11培养基培养处于对数生长期的蛋白核小球藻种子液,接种于600mL城市污水中,于气泡柱式光生物反应器(直径5cm、高50cm、容积约为1L)培养,以相应未加小球藻的城市污水为空白对照,使扣除空白后藻液初始吸光度680=0.1,于培养温度为(25±1)℃,光照强度为100mmol/(m2·s).光暗比为12h:12h条件下,连续通气培养(空气流速为120mL/min,由底部通入).取培养达到稳定期的藻液测定藻细胞的干重和油脂产量.每组实验各设3个平行.
1.2 微藻干重的测定
接种初期藻液的干重为0(g/L),培养一定时间(d)后,取稳定期藻液10mL经0.45µm微孔滤膜(1)过滤、洗涤,于105℃下烘至恒重(2/g),微藻干重DW (g/(L·d))的计算公式如下:
DW=[(2-1)/0.01-0]/
1.3 微藻油脂产量与脂肪酸组成的测定
微藻油脂提取采用氯仿甲醇共溶剂提取法[15].待提取结束后,收集氯仿相,转移至预称重的锡纸盘中,待有机溶剂挥发完全后,于80℃烘箱中烘至恒重,前后重量差即微藻油脂产量,微藻细胞油脂含量为油脂产量与微藻干重的百分比.
微藻脂肪酸分析,首先对提取的油脂进行甲酯化[16],将5mL藻液中脂肪酸转化成相对应的脂肪酸甲酯.采用赛里安456-GC气相色谱仪进行分析,色谱柱为BR-2560柱,100m´0.25mm(内径)´0.20µm(膜厚),FID检测器,分流方式进样,分流比为30:1,进样量为1µL.
1.4 常规水质指标测定
污水水质采用国标法[17]测定,取微藻培养结束后的藻液于8000r/min离心10min,收集上清液测定.污水中COD、NH4+-N、TN和TP的分别按照GB 11914-89、GB 7479-87、GB 11894-89和GB 11893-89进行测定[18-21].
1.5 藻细胞的扫描电镜观察
样品前处理使用0.1mol/L磷酸缓冲液离心漂洗3次.1%锇酸固定90min,0.1mol/L磷酸缓冲液漂洗离心漂洗3次,0.2µm微孔滤膜过滤.酒精梯度脱水,在30%、50%、70%、80%、100%依次脱水,其中100%酒精2次,每次10min.乙酸异戊脂置换,50%1次,100%2次.Eiko公司XD-1型二氧化碳临界点干燥器干燥,Eiko公司IB-3型离子镀金仪喷金镀膜,JEOL公司JSM-6390LV扫描电镜观察.
1.6 数据分析方法
数据采用统计软件SPSS21.0进行单因素方差分析(one-way ANOVA),采用LSD法进行统计检验(<0.05).
2 结果与讨论
2.1 突变藻株在污水中的性能考察
2.1.1 突变藻株在污水中的生长情况 将突变株和出发株按照藻液初始吸光度680=0.1接种到城市污水中,每天取样测定扣除空白后藻液的680以监测藻细胞生长情况(图1).从图1可知,小球藻出发株和突变株在城市污水中的生长符合典型的微生物生长曲线.从第1d开始进入对数生长期,第6d进入稳定期生长阶段,稳定期持续4d,第9d开始呈现下降趋势.突变株的比生长速率为0.26,680最高可达2.2,而出发株的比生长速率为0.2,680最高可达1.7.可见,通过离子注入诱变可以提高小球藻在城市污水中的生长速率.但由于实际污水水质的不稳定性,小球藻在不同批次污水中生长情况不尽相同,因此,用实际污水培养小球藻时,选择收集培养达到稳定期的藻液进行后续实验.
2.1.2 突变藻株在污水中的产脂情况 相同培养条件下,取稳定期的藻液测其微藻生物质和油脂产率,并计算得到油脂含量,如图2所示.从图2中可以看出,稳定期生物质产量和油脂产率分别为109.5mg/(L·d)和32.5mg/(L·d),相比于出发株分别显著提高了35.47%和23.81% (<0.05),油脂含量略有降低,但无显著性差异.更快的生长速率和更高的油脂产率,是利用微藻生产生物柴油的重要要求.结果说明离子注入诱变可以提高小球藻对污水适应性以及产油能力.
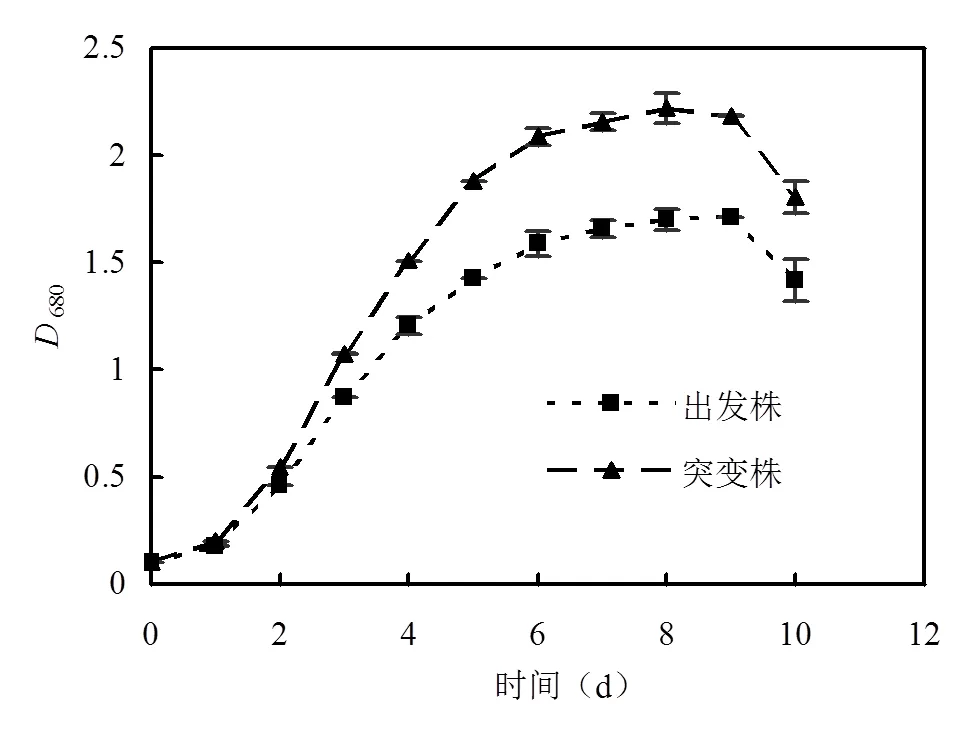
图1 出发株和突变株在城市污水中的生长情况

图2 出发株和突变株在城市污水中的产脂情况
微藻的油脂产量是判定藻种作为生物柴油原料优劣的重要指标,微藻的油脂产量由干重和微藻油脂含量共同决定.在适宜生长的环境条件下,微藻会大量繁殖并积累数目可观的生物量,此时油脂积累量相对较低,仅占生物量干重的5%~ 20%.在不利或胁迫环境下,微藻的油脂含量显著升高,可占生物量干重的20%~50%.许多微藻在受到环境条件胁迫时,会减缓甚至停止细胞分裂,同时加速油脂或其他次级代谢物的合成与积累以应对胁迫环境.在胁迫环境下,油脂的合成可能是微藻应对环境逆境的一种自我保护机制.从本质上讲,微藻生物量增加和油脂合成是相互竞争光合作用所产生的能量、还原力以及中间代谢物的两个过程[22].结果中突变藻株生物量显著上升,虽然油脂含量略有降低,但最终油脂产量是上升的,可以为生物柴油的制备提供更多原料.此外,微藻生物量越高,藻液浓度越高,有利于藻体采收,可以降低微藻收获成本.因此,通过离子注入诱变促进微藻产脂这一思路是可行的.

表1 出发株和突变株脂肪酸分析
注:nd-未检测出.
利用气相色谱仪分析污水中小球藻出发株和突变株脂肪酸甲酯的组成,以进一步确定二者的油脂品质,结果如表1所示.由表1可知,小球藻出发株和突变株的脂肪酸组成均以C16:0、C18:0、C18:2和C18:3为主,为绿藻中常见脂肪酸[23-24].研究表明,适合制备生物柴油的原料应含有较多C16~C18脂肪酸[25-26].突变株中总饱和脂肪酸的比例低于出发株,而单不饱和脂肪酸和多不饱和脂肪酸含量高于出发株.高品位的生物柴油应含有较多的单不饱和脂肪酸,以改善其十六烷值、低温流动性、氧化安定性、运动粘度等性能[27-29].可见,突变藻株具备制备高品位生物柴油的潜质.
2.1.3 突变藻株对污染物去除能力考察 微藻培养结束后取适量藻液,离心后测上清液中COD、NH4+-N、TN和TP的浓度,结果如表2所示.由表2可以看出,出发株和突变株都能将污水中的COD、NH4+-N、TN和TP降解到符合 (GB18918-2002)一级A标准[30], 而且突变株对污水中污染物降解效果更好.由于培养过程中水环境呈弱碱性, 部分氨氮变成氨气,在吹脱作用下从水中去除,导致培养结束后已检测不到.

表2 城市污水培养微藻前后水质
2.2 突变藻株藻细胞扫描电镜和元素分析
2.2.1 扫描电镜观察 利用扫描电镜观察藻细胞的形态差异,结果如图3所示.
(a)出发株
(b)突变株
图3 出发株和突变株表观结构对比
Fig.3 Apparent structure comparison of wild strain and mutant strain
由图3可以看出,突变株和出发株的细胞形态差异较小,但突变株藻细胞更接近球体.对比藻细胞胞外物质的情况,可以发现出发株藻细胞之间黏附着许多不定型物质,导致多个藻细胞聚集在一起.而突变株胞外的不定型物质较少,多以单个细胞形式存在,有利于细胞与环境营养物质的接触吸收.
2.2.2 元素含量分析 相同条件下培养至稳定期后,将藻液离心烘干制成藻粉,测定微藻细胞的元素成分,结果见表3.由表3可以看出,突变株和出发株在N、C、H元素百分比含量上有显著性差异(<0.05).突变株的氮元素含量降低,可能是由于藻体油脂积累较多导致蛋白质合成较少.另外,分析藻株的H/C值发现,出发株的H/C值为1.83,而突变株的H/C值为1.75.突变株H/C值相比出发株有所下降,且H/C值小于2,推断是因为突变株中不饱和度增加,与前述突变株中不饱和脂肪酸增加的结果相一致.

表3 出发株和突变株元素含量分析
2.3 突变藻株的分子生物学鉴定
2.3.1 藻种DNA提取结果 用DNA试剂盒分别提取突变株和出发株的总DNA,利用Nanodrop 2000检测DNA浓度和纯度,结果如表4所示,突变株和出发株提取的DNA浓度合格.凝胶电泳结果如图4所示,提取的DNA条带较清晰,表明总DNA 提取质量较好,可以用于PCR 扩增.

表4 总DNA浓度和纯度检测结果

图4 出发株和突变株的DNA凝胶电泳
2.3.2 18S rDNA基因序列的克隆 以小球藻基因组DNA 为模板,PCR 扩增18S rDNA 基因序列,得到的PCR 产物,电泳结果如图5所示. PCR 产物只出现一条明亮主带,表明PCR 效果较好,其大小为1 700bp 左右.
图5 PCR扩增小球藻18S rDNA基因片段
2.3.3 系统发育树构建 将GenBank中获得相似度最高的序列与测序获得序列结合,利用MEGA 5.10构建系统发育树,构建邻位N-J tree, Replicate设定为1000.18S克隆序列的系统发育树如图6所示.突变株(CVM)和出发株(CVW)在发育树上的位置很接近,表明亲缘关系很近,节点上的Bootstrap检验值为100(>95),说明构建进化树的可信度很高,而且突变株与出发株属于同种变异.

图6 系统发育树构建
3 结论
3.1 离子注入诱变可以提高小球藻在城市污水中的生长速率,小球藻突变株在污水中的适应性良好,油脂产率为32.5mg/(L·d),相比于出发株显著提高了23.81% (<0.05).
3.2 突变藻株中总饱和脂肪酸的比例低于出发株,而单不饱和脂肪酸和多不饱和脂肪酸含量高于出发株,适宜作为制备生物柴油的原料.培养结束后污水中的COD、NH4+-N、TN和TP符合 (GB18918-2002)一级A标准, 而且突变株对污水中污染物降解效果更好.
3.3 扫描电镜结果显示突变株和出发株的细胞形态差异较小,但突变株藻细胞更接近球体.而且突变株藻细胞多以单个形式存在,有利于细胞与环境营养物质的接触吸收.元素含量分析发现突变株的H/C值相比出发株有所下降,且H/C值小于2,说明藻株中不饱和碳氢键增加.突变株与出发株在系统发育树上的位置很接近,表明亲缘关系很近,节点上的Bootstrap检验值为100(>95),说明突变株与出发株属于同种变异.
[1] Chisti Y. Constraints to commercialization of algal fuels [J]. Journal of Biotechnology, 2013,167(3):201-214.
[2] Han S F, Jin W B, Tu R J, et al. Biofuel production from microalgae as feedstock: current status and potential [J]. Critical Reviews in Biotechnology, 2015,35(2):255-268.
[3] Abomohra A E, Jin W B, Tu R J, et al. Microalgal biomass production as a sustainable feedstock for biodiesel: current status andperspectives [J]. Renewable & Sustainable Energy Reviews, 2016,64(64):596-606.
[4] Yang J, Xu M, Zhang M X, et al. Life-cycle analysis on biodiesel production from microalgae: water footprint and nutrients balance [J]. Bioresource Technology, 2011,102:159-165.
[5] Morales-Amaral M d M, Gómez-Serrano C, Acién F G, et al. Production of microalgae using centrate from anaerobic digestion as the nutrient source [J]. Algal Research, 2015,9:297-305.
[6] 巫小丹,阮榕生,王 辉,等.菌藻共生系统处理废水研究现状及发展前景[J]. 环境工程, 2014,3:35-36.
[7] Ramsundar P, Guldhe A, Singh P, et al. Assessment of municipal wastewaters at various stages of treatment process as potential growth media forunder different modes of cultivation [J]. Bioresource Technology, 2017,227:82-92.
[8] Mahapatra D M, Chanakya H N, Ramachandra T V. Bioremediation and lipid synthesis through mixotrophic algal consortia in municipal wastewater [J]. Bioresource Technology, 2014,168:142-150.
[9] Ryu B G, Kim E J, Kim H S, et al. Simultaneous treatment of municipal wastewater and biodiesel production by cultivation ofwith indigenous wastewater bacteria [J]. Biotechnology and Bioprocess Engineering, 2014,19(2):201-210.
[10] Muñoz R, Guieysse B. Algal-bacterial processes for the treatment of hazardous contaminants: a review [J]. Water Research, 2006, 40:2799-2815.
[11] Abdelaziz A E M, Leite G B, Belhaj M A, et al. Screening microalgae native to Quebec for wastewater treatment and biodiesel production [J]. Bioresource Technology, 2014,157: 140-148.
[12] Massimi R, Kirkwood A E. Screening microalgae isolated from urban storm and wastewater systems as feedstock for biofuel [J]. PeerJ, 2016,4:e2396.
[13] Tu R J, Jin W B, Wang M, et al. Improving of lipid productivity of the biodiesel promising green microalgavia low-energy ion implantation [J]. Journal of Applied Phycology, 2016,28(4):2159-2166.
[14] Stainier R Y, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order) [J]. Bacteriology Reviews, 1971,35(2):171-205.
[15] Folch J, Lees M, Stanley G H S. A simple method for the isolation and purification of total lipids from animal tissues [J]. Journal of Biological Chemistry, 1957,226:497-509.
[16] Kaczmarzyk D, Fulda M. Fatty acid activation in cyanobacteria mediated by acyl-acyl carrier protein synthetase enables fatty acid recycling [J]. Plant Physiology, 2010,152(3):1598-1610.
[17] 国家环保总局.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002.
[18] GB 11914-89 水质化学需氧量的测定重铬酸盐法[S].
[19] GB 7479-87 水质铵的测定纳氏试剂比色法[S].
[20] GB 11894-89 水质总氮的测定碱性过硫酸钾消解紫外分光光度法[S].
[21] GB 11893-89 水质总磷的测定钼酸铵分光光度法[S].
[22] Sharma K K, Schuhmann H, Schenk P M. High lipid induction in microalgae for biodiesel production [J]. Energies, 2012,5(5): 1532-1553.
[23] 刘林林,黄旭雄,危立坤,等.15株微藻对猪场养殖污水中氮磷的净化及其细胞营养分析 [J]. 环境科学学报, 2014,34(8):1986- 1994.
[24] Vidyashankar S, VenuGopal K S, Swarnalatha G V, et al. Characterization of fatty acids and hydrocarbons of chlorophycean microalgae towards their use as biofuel source [J]. Biomass & Bioenergy, 2015,77:75-91.
[25] Song M, Pei H, Hu W, et al. Evaluation of the potential of 10microalgal strains for biodiesel production [J]. Bioresource Technology, 2013,141:245-251.
[26] Ma Y, Wang Z, Yu C, et al. Evaluation of the potential of 9strains for biodiesel production [J]. Bioresource Technology, 2014,167:503-509.
[27] Stansell G R, Gray V M, Sym S D. Microalgal fatty acid composition: implications for biodiesel quality [J]. Journal of Applied Phycology, 2012,24(4):791-801.
[28] 方利国,林 璟.脂肪酸甲酯对生物柴油十六烷值影响的研究[J]. 化工新型材料, 2008,36(11):94-96.
[29] Hoekman S K, Broch A, Robbins C, et al. Review of biodiesel composition, properties, and specifications [J]. Renewable & Sustainable Energy Reviews, 2012,16:143–169.
[30] GB18918-2002 城镇污水处理厂污染物排放标准一级A标准 [S].
The characteristics of lipid production ofmutant by ion implantation through municipal wastewater cultivation.
TU Ren-jie, JIN Wen-biao*, HAN Song-fang, ZHOU Xu, CHEN Hong-yi
(Shenzhen Engineering Laboratory of Microalgal Bioenergy, Harbin Institute of Technology Shenzhen Graduate School, Shenzhen 518055, China)., 2017,37(10):3735~3740
The growth and lipid productivity of originaland its ion implantation mutant strains were studied. The results showed that the lipid productivity of the mutant strain was 32.5mg/(L·d), 23.81% higher than that of the original strain. According to the fatty acid methyl ester analysis by gas chromatography, ion implantation did not change the composition of fatty acid, but enhanced the content of monounsaturated fatty acids, which was conducive to the enhancement of biodiesel quality. After cultivation, the effluent quality was also found to reach the emission standard of first level A, and the mutant showed better degradation ability than the original strain. Phylogenetic tree showed that the mutant and the original strains were belonged to interspecific variation.
ion implantation;municipal wastewater;;lipid production
X172
A
1000-6923(2017)10-3735-06
涂仁杰(1985-),男,湖北汉川人,哈尔滨工业大学深圳研究生院博士研究生,主要从事微藻生物质能源与污水资源化研究.发表论文8篇.
2017-03-29
深圳市科技计划资助项目(JCYJ20150529114024234)
* 责任作者, 教授, jinwb@hit.edu.cn
