EGCG强化Fe2+/过硫酸盐体系降解金橙G的研究
2017-11-07周石庆卜令君
毕 晨,施 周*,周石庆,卜令君
EGCG强化Fe2+/过硫酸盐体系降解金橙G的研究
毕 晨1,2,施 周1,2*,周石庆1,2,卜令君1,2
(湖南大学土木工程学院,湖南长沙410082;2.湖南大学建筑安全与节能教育部重点实验室,湖南长沙410082)
通过向亚铁-过硫酸盐(Fe2+/PDS)体系中引入具有还原性及络合性的绿茶提取物EGCG,促进Fe3+/Fe2+循环,增强其对偶氮类染料金橙G(OG)的降解.实验考察了PDS投加量、OG初始浓度、溶液初始pH、Fe2+投加量、EGCG投加量以及溶液中共存阴离子对该体系降解OG的影响.结果表明:单独投加Fe2+、EGCG、PDS以及投加EGCG/PDS、Fe2+/EGCG均不能有效地降解OG;EGCG的引入使得Fe2+/PDS体系对OG的降解有了显著的提升,从30.89%上升到83.71%;OG的降解效率随着PDS及Fe2+投加量的增大而增大、随着OG初始浓度的增大而减小;当EGGC投加量在10~40μmol/L时,降解效率随着其投加量的增大而增大,而当EGCG投加量大于40μmol/L时,降解效率随着其投加量的增大有一定程度的降低;与Fe2+/PDS体系相比,EGCG的引入使得该体系在pH为2.0~7.0范围内均能取得较好的去除效果;体系中共存阴离子对OG的降解效率有着不同程度的抑制作用,其中PO43->CO32->Cl-.另外,通过分别加入淬灭剂甲醇和叔丁醇,证明了体系中存在着硫酸根自由基以及羟基自由基,且硫酸根自由基占主导地位.
Fe2+/EGCG/PDS;自由基;铁循环;络合;还原
染料产品广泛应用于纺织、油漆、颜料、皮革、食品等领域.随着我国与染料有关行业的大力发展,染料的需求量急剧增加,同时也导致含染料废水的排放量急剧增长.据统计,我国染料的生产量居世界首位,占世界染料总量的60%[1];在生产和使用过程中,10%~20%的染料以废水的形式排放[2].由于染料具有高色度、高生物毒性以及难降解等特点[3],常规工艺较难处理.染料废水若不经过有效处理而直接排放,势必对生态环境造成严重的污染.当前,染料废水一般通过吸附、离子交换、膜分离、电化学、化学氧化等工艺去除.在诸多化学氧化工艺中,高级氧化工艺(AOPs)以其对有机污染物高效的氧化降解效率而愈来愈广泛地应用于水处理工艺当中.高级氧化技术可以产生具有强氧化能力的自由基,使大分子难降解有机物氧化成低毒或无毒的小分子物质甚至直接氧化为CO2.传统高级氧化技术一般基于羟基自由基(HO•),如Fenton反应、UV/H2O2等.近些年来,基于硫酸根自由基(SO4•−)的高级氧化技术开始逐渐兴起并应用于实践中[4-5]. SO4•−的氧化还原电位为2.5~3.1V[6],与HO•相当(2.8V).目前普遍采用加热、光催化、投加过渡金属以及碱催化等方法来激发过硫酸盐(PDS)或过硫酸氢盐(PMS)产生SO4•−.其中加热激活需要的额外能量较高;光催化PDS不仅需要外加能量,而且对反应条件要求较严苛;而碱催化则要求溶液有较高的pH;相比之下,利用过渡金属活化PDS、PMS产生SO4•−比较节能且易行.在诸多过渡金属中,Fe2+具有价格低廉、易于去除、催化效果良好等优势,因而被广泛的研究[7].
一次性投加Fe2+亦存在着一些不足之处:若一次性加入Fe2+过少,不能持续地产生SO4•−,有机污染物难以有效降解;一次性加入Fe2+过多,则会造成Fe2+消耗过快、产生SO4•−过多、自我淬灭,从而不能得到有效利用,如式(2)~(3)所示[8].为解决上述问题,一些提高Fe2+使用效率的物质被加入体系中,如提高Fe2+稳定性的络合物以及能将Fe3+重新还原为Fe2+的还原性物质等[9-11].
绿茶提取物表没食子儿茶素没食子酸酯(EGCG)是一种天然茶多酚,环境友好,对人体健康有益,同时具有还原性和络合性.茶多酚在绿茶叶中的含量较高,可占干重的25%到35%[12], EGCG则是其中含量最为丰富的茶多酚之一[13]. EGCG分子能与Fe3+络合,并将其还原为Fe2+;理论上,单个EGCG分子可以还原4分子Fe3+[14].
本研究将EGCG引入到Fe2+/PDS体系中,利用EGCG的还原性及络合性,建立稳定的Fe3+/Fe2+循环,以期提高体系对污染物的氧化降解效率.本研究以偶氮类染料金橙G (OG)为目标污染物,分别探讨了PDS投加量、Fe2+投加量、金橙G初始浓度、EGCG投加量、溶液初始pH、水中共存阴离子等因素对Fe2+/EGCG/PDS体系降解金橙G效率的影响.
1 材料与方法
1.1 试验材料与仪器
EGCG(上海国药集团化学试剂公司,³98%),硫酸亚铁(上海国药集团化学试剂公司, FeSO4·7H2O,分析纯),金橙G(上海国药集团化学试剂有限公司,BS),过硫酸钠(上海国药集团化学试剂有限公司,Na2S2O8,分析纯),氢氧化钠(天津大茂化学试剂厂,NaOH,分析纯),浓硫酸(上海国药集团化学试剂有限公司,H2SO4,分析纯),甲醇(天津大茂化学试剂厂,CH3OH,分析纯),叔丁醇(上海国药集团化学试剂有限公司,(CH3)3COH,分析纯).实验所需溶液采用超纯水配制.如无说明,实验中所用其他药品均为分析纯.
主要仪器设备: pH计(868型,北京奥立龙仪器有限公司)、水浴恒温振荡器(THZ-82,北京中兴伟业仪器有限公司)、紫外可见光分光光度计(U-3900,日本HITACHI).
1.2 试验方法
实验所用反应容器为玻璃锥形瓶,反应溶液体积为100mL;反应开始前,首先将定量Fe2+、EGCG加入溶液中,用稀H2SO4和NaOH调节pH至所需值,再加入定量PDS,以开始反应.锥形瓶被置于水浴恒温振荡箱中(=25℃)反应.每隔一定时间取一次样,将其迅速加入事先装有过量甲醇的离心管终止反应,再将所取样品通过0.45μm滤膜过滤,收集滤液,以待后续测定.通过下式计算OG的去除率:
CR(%) = (0-C)/0(1)
式中:0为OG初始浓度,μmol/L;C为OG反应时刻初始浓度,μmol/L;CR为OG去除率.
1.3 分析方法
金橙G的浓度采用紫外-可见光分光光度计(U-3900, Hitachi)于波长478nm处测得;亚铁离子浓度采用邻菲罗啉分光光度法检测;溶液pH值由雷磁PHS-3G pH计测定.
2 结果与讨论
2.1 不同体系对OG去除效果对比
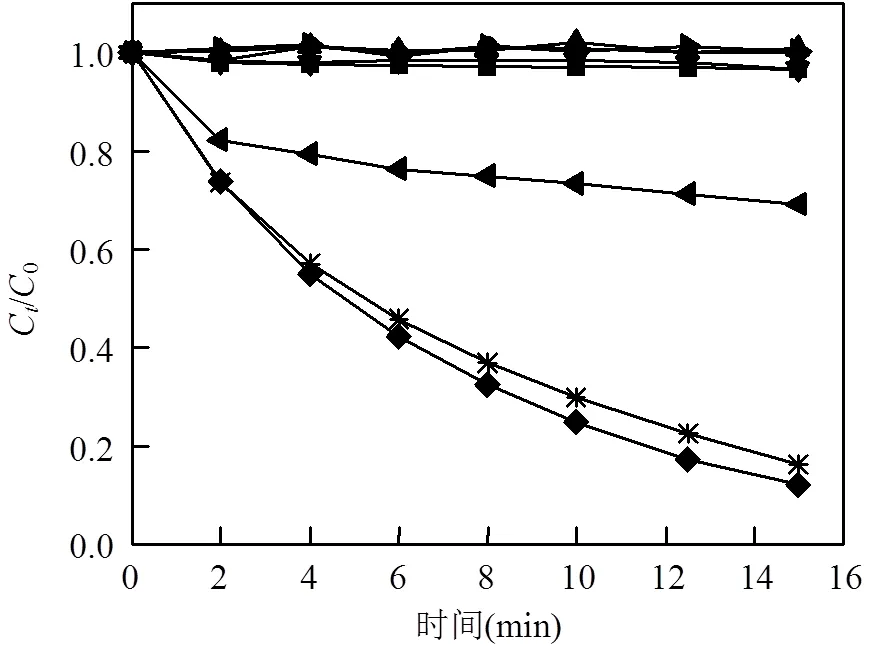
图1 不同工艺对OG降解效率的比较
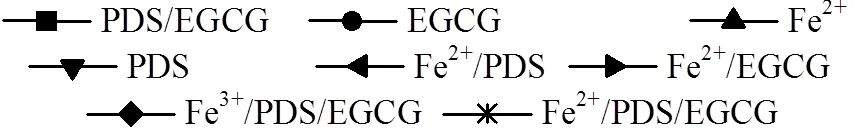
在相同实验条件下([EGCG] = 20μmol/L, [Fe2+] = [Fe3+] = 60μmol/L,[PDS] = 3mmol/L,[OG] = 60μmol/L,pH0= 4,反应时间=15min),比较了单独投加Fe2+、单独投加PDS、单独投加EGCG以及Fe2+/PDS、EGCG/PDS、Fe2+/EGCG、Fe2+/EGCG/PDS、Fe3+/EGCG/PDS等工艺对OG的降解情况,实验结果如图1所示.可以看出:单独投加Fe2+、EGCG或PDS,都不会对OG产生明显的降解;当采用EGCG/PDS、Fe2+/EGCG组合时,由于没有自由基的产生,亦对OG没有可观的去除效果;Fe2+/PDS工艺有着一定的去除效果: 15min内有30.89%的OG被降解;相比之下,随着EGCG的加入,Fe2+/EGCG/PDS体系对OG的降解效率有着显著的提升:15min内有83.71%的OG被降解.这是由于EGCG将反应中生成的Fe3+迅速络合并还原,生成了Fe2+,并在该体系中形成稳定的Fe3+/Fe2+循环,使得体系中始终保持着一定的Fe2+浓度.而Fe3+/EGCG/PDS体系也有着与前者相当的降解能力,这进一步证实了EGCG在体系中扮演着还原剂这一角色. Fe2+/ EGCG/PDS体系中反应机理大致如下[4,8,14]:
Fe2++ SO4•-→ Fe3++ SO42-(2)
SO4•-+ SO4•-→ S2O82-(3)
Fe2++ S2O82-→ SO4•-+ Fe3++ SO42-(4)
SO4•-+ OG→降解产物 (5)
EGCG + 4Fe3+→ EGCG氧化产物+ 4Fe2+(6)
SO4•-+ EGCG→ EGCG氧化产物 (7)
为进一步探究Fe2+/EGCG/PDS工艺对OG的降解情况,对各时间点所取的待测样进行UV/VIS紫外可见光全波段扫描(300~700nm),如图2所示.在扫描范围内,OG最大吸收波长在478nm处;OG的吸收峰随着时间的增长而逐渐地变小,并没有出现吸收峰的红移或蓝移,说明Fe2+/EGCG/PDS工艺将OG降解成易于生物降解的小分子有机物或CO2,而不是发生了某些变色反应.
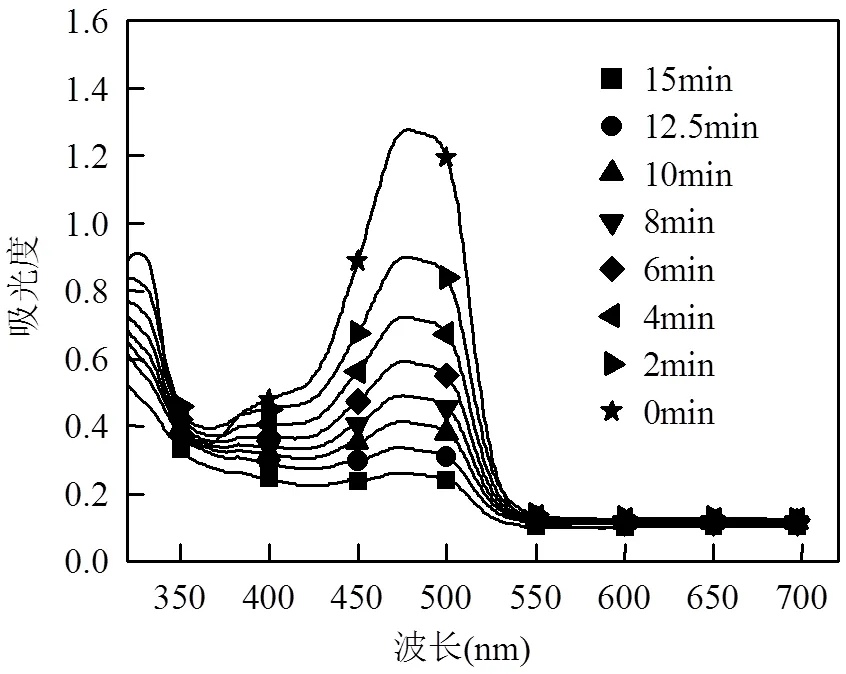
图2 各个时间点OG吸光度全波长扫描
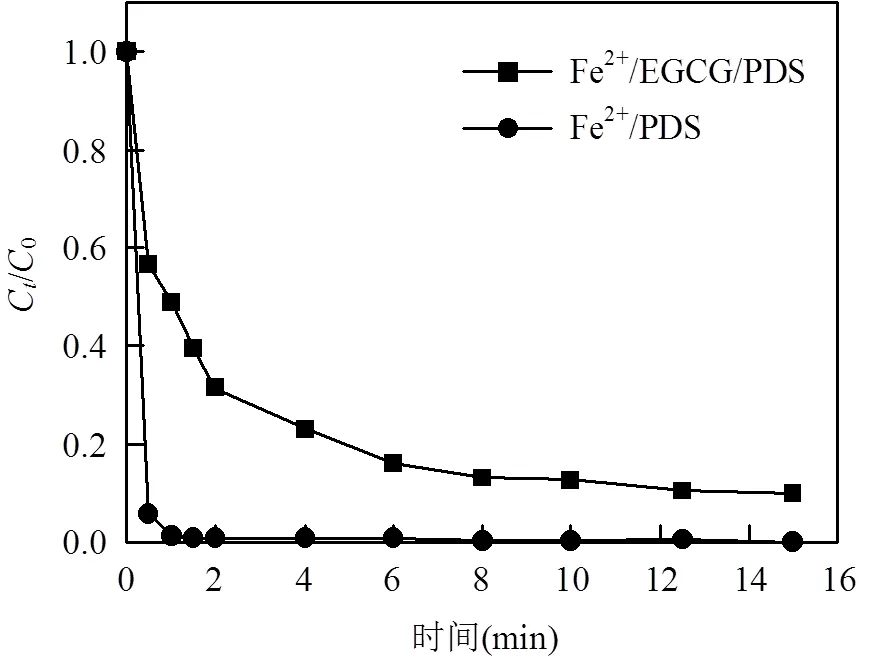
图3 Fe2+/PDS和Fe2+/EGCG/PDS体系中亚铁离子浓度变化情况
另外,为验证EGCG的存在促进了Fe2+/Fe3+的循环,本文研究了两种体系中亚铁离子浓度随时间的变化.如图3所示,在Fe2+/PDS体系中,亚铁浓度迅速下降并在1min内降至0,该现象可归因为亚铁和PDS的快速反应以及Fe3+与Fe2+之间缓慢的转化速度;相反,在EGCG存在的情况下,当反应进行到6min时,仍有15%的亚铁离子存在,且在之后的9min里下降缓慢,几乎达到了动态平衡,这也证明了EGCG的存在可以加速Fe2+/Fe3+之间的转换和循环.
2.2 EGCG浓度对OG去除率的影响
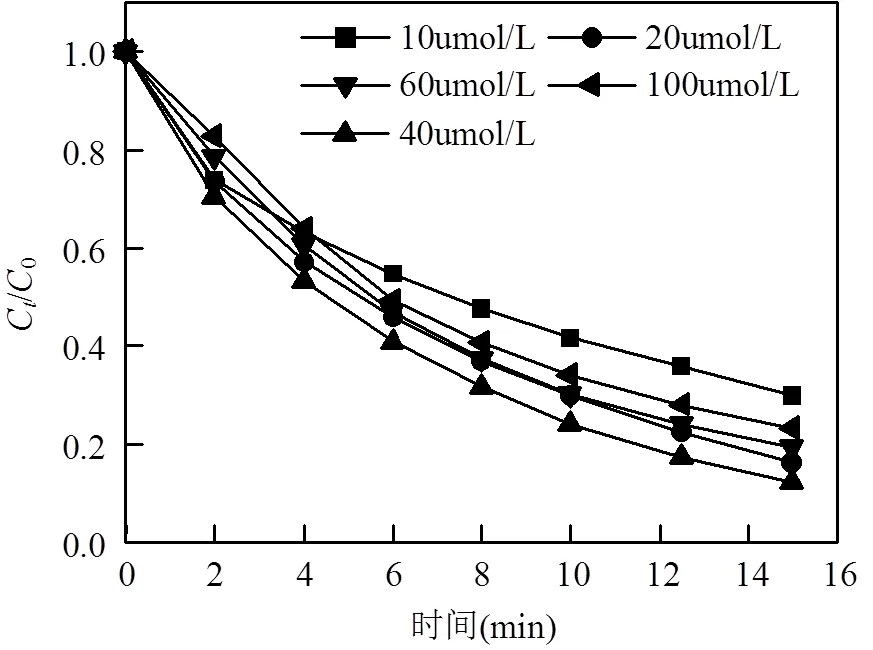
图4 EGCG浓度对OG降解效率的影响
本文分别考察了[EGCG]=10、20、40、60、100μmol/L时体系对OG的降解能力.如图4所示,当EGCG浓度在10~40μmol/L时,随着EGCG浓度的增加,OG的去除效果亦相应地提升,去除率从70.03%逐渐提升到87.69%;而当EGCG浓度大于40μmol/L时,EGCG浓度的增加反而抑制了体系对OG的去除效果,[EGCG]=100μmol/L时的去除效果已下降到76.57%.该现象应归因于EGCG是一种良好的自由基捕获剂,能够捕获人体内的ROS(reactive oxygen species),因此它会与SO4•-、HO•等自由基反应,即会与目标污染物OG形成竞争关系.因此,当EGCG浓度在一定范围内时,其投加量的增加并不会强烈地影响OG的氧化历程,却有效地促进了Fe3+/Fe2+循环;而当EGCG超出该范围时,其浓度的增加对Fe3+/Fe2+循环的贡献已不能弥补其对OG氧化的负面作用,故而造成OG降解效率相对于较低投加量时有所下滑.因此,对于Fe2+/EGCG/PDS体系的降解能力而言,存在着一个最佳EGCG投加量.但在研究范围内,任一EGCG投加量下该体系对OG的去除率都远大于传统Fe2+/PDS体系.
2.3 初始pH对OG去除率的影响
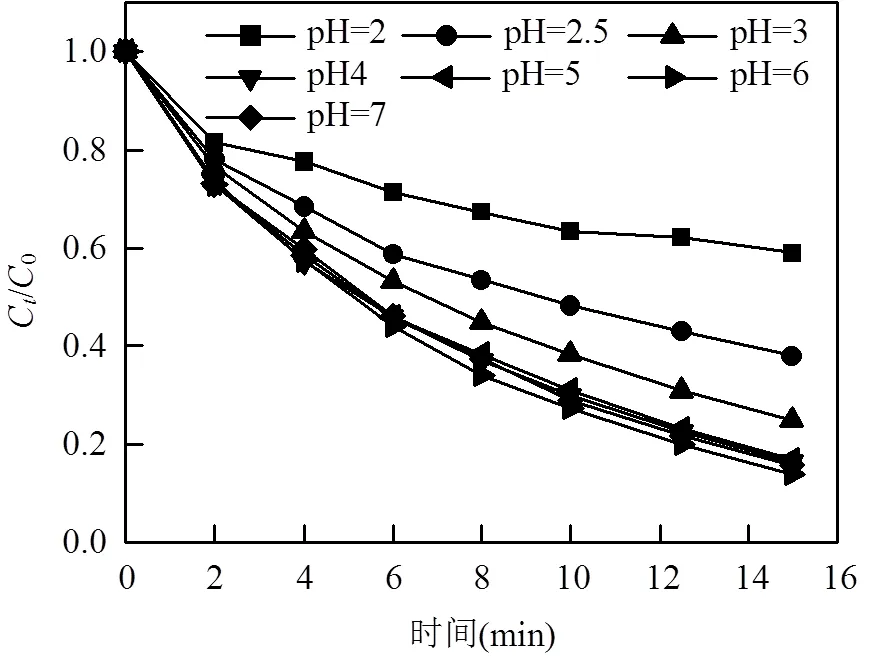
图5 初始pH值对OG降解效率的影响
溶液pH值是影响反应速率的一个重要因素,它直接或间接地影响了体系中某些反应的速率.实验考察了相同条件下不同初始pH(pH0=2~7)对本体系中OG降解效率的影响,结果如图5所示.当pH0=4~7时,传统Fe2+/PDS体系的去除率随着pH0的上升而急剧下降[4];相比之下,在此pH范围内,Fe2+/EGCG/PDS体系对OG的去除效率始终保持在较高的水平(83%左右),这归功于EGCG的强络合作用:络合剂的引入能降低pH对芬顿体系的影响,因为EGCG可以保证亚铁离子在较高的pH值下不形成沉淀从而维持溶液中有效溶解铁[15].而当pH0=3时,OG去除率有一定程度的降低,降至75.03%;当pH0继续减小至2.5和2.0时,OG去除率进一步降低至62.09%和41.16%.该现象可从两方面解释:首先,根据Ryan等[14]的研究,在pH=1~3时,EGCG络合及还原Fe3+的能力随着pH的降低而降低;其次,当pH较小时,H+浓度较高,亚铁多以(Fe2+(H2O))2+的形态存在,而有文献表明[16](Fe2+(H2O))2+在Fenton体系中与过氧化氢反应较慢,意味着它可能在类Fenton反应中扮演着同样的角色.综上所述,当pH0小于3时,体系的去除效果随着pH的降低而降低.
2.4 PDS和Fe2+投加量对OG去除率的影响
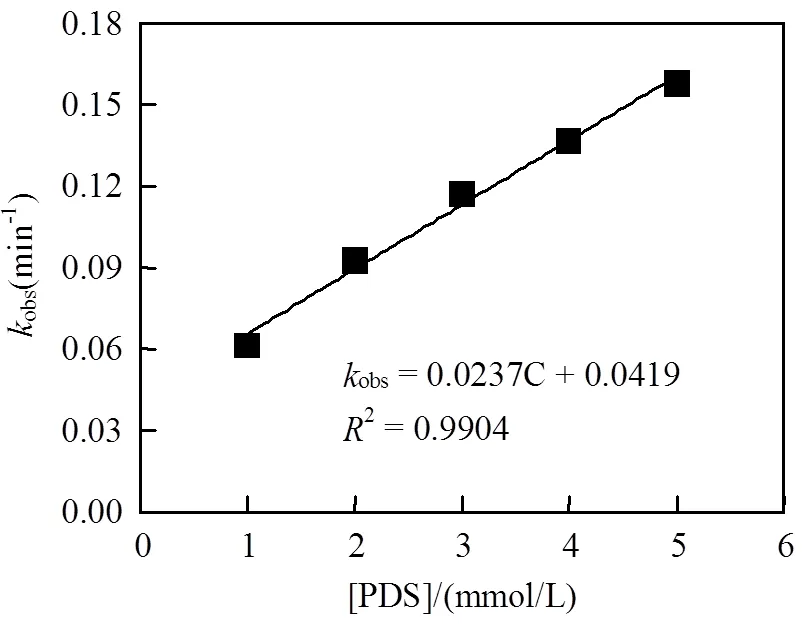
在Fe2+/EGCG/PDS体系中,改变PDS的投加量,OG的去除率如图6所示.PDS投加量在1~ 5mmol/L之间变化.经拟合,发现该反应符合伪一级反应动力学(图6).随着PDS投加量的增大,OG的去除率也随之增大,从60.96%逐渐上升到91.56%;伪一级反应速率常数亦相应地从0.0612min-1增加至0.1578min-1.在研究范围内,伪一级反应速率常数obs与PDS投加量呈正比例关系,obs=0.0237+0.0419,²=0.9904.PDS对体系降解效率的促进作用主要是由于随着PDS的增大,式(4)反应将向正方向进行,单位时间内体系中将会产生更多的SO4•-,促进式(5)反应的进行,从而提高了OG去除率.
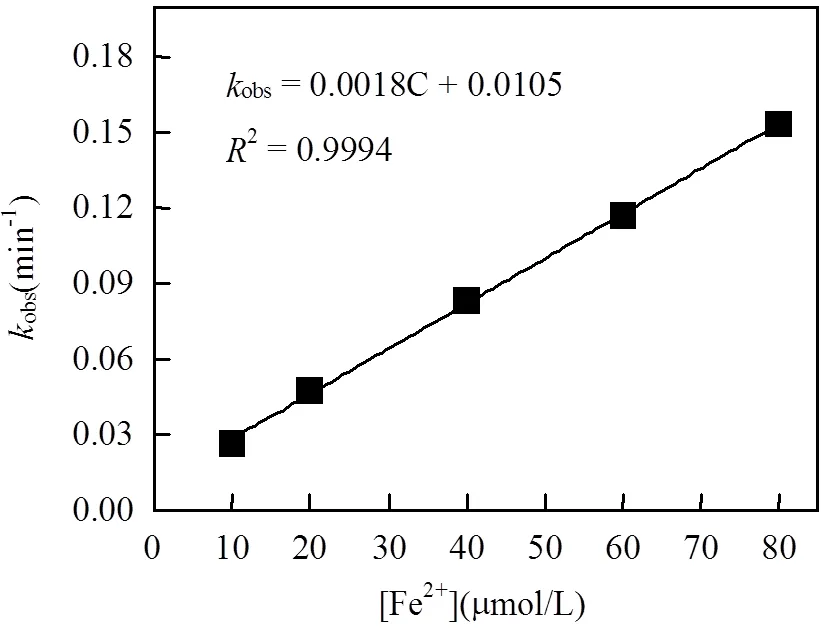
另外,本研究还考察了不同Fe2+投量([Fe2+]= 10~80μmol/L)对OG去除率的影响.实验结果如图7所示.Fe2+浓度的增加对体系的降解能力有明显促进作用:随着Fe2+投加量的增加,OG去除率从33%逐渐上升到90.95%.反应服从伪一级反应动力学,其伪一级反应速率常数相应地从0.0267min-1增加至0.1533min-1;伪一级反应速率常数obs与Fe2+初始浓度呈很好的线性关系,obs=0.0018C+0.0105,²=0.9994.在实验范围内, Fe2+投量越大,产生的SO4•-越多,如式(4)所示,从而提高了OG的降解效果.
2.5 OG初始浓度对OG去除率的影响
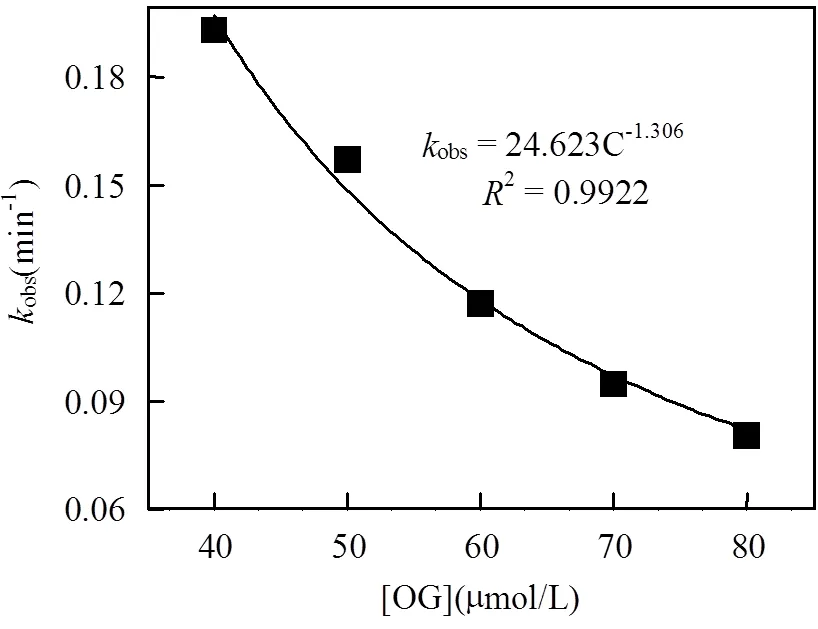
OG浓度范围控制在40~80μmol/L.实验结果如图8所示.当OG初始浓度升高时,OG自身降解速率逐渐下降,[OG]=40μmol/L时的去除率为94.88%,随着OG浓度的提高,当[OG]=80μmol/L时,去除率已降至70.63%;相应地,其伪一级反应速率常数也从0.193min-1下降至0.0802min-1.伪一级反应速率常数obs与OG初始浓度呈幂函数关系,obs=24.623C-1.306,²=0.9922.
2.6 共存阴离子的影响
为模拟该体系在环境水体中对OG的降解效率,实验考察了溶液中共存阴离子对体系降解速率的影响.相同实验条件下分别向体系中加入1mmol/L PO43-、CO32-、Cl-进行反应.实验结果如图9所示.可以看出,PO43-显著抑制了OG的降解速率,去除率从83.71%降至10.96%;CO32-、Cl-对降解有着轻微的抑制作用.这是由于Fe2+容易与PO43-、CO32-结合成沉淀,影响SO4•-的生成速率;此外,PO43-的水解产物HPO42-、H2PO4-与CO32-、HCO3-以及Cl-会与SO4•-发生副反应,如式(9)~(16)所示[8,18-19],减少了SO4•-有效浓度,进而影响了OG降解速率.




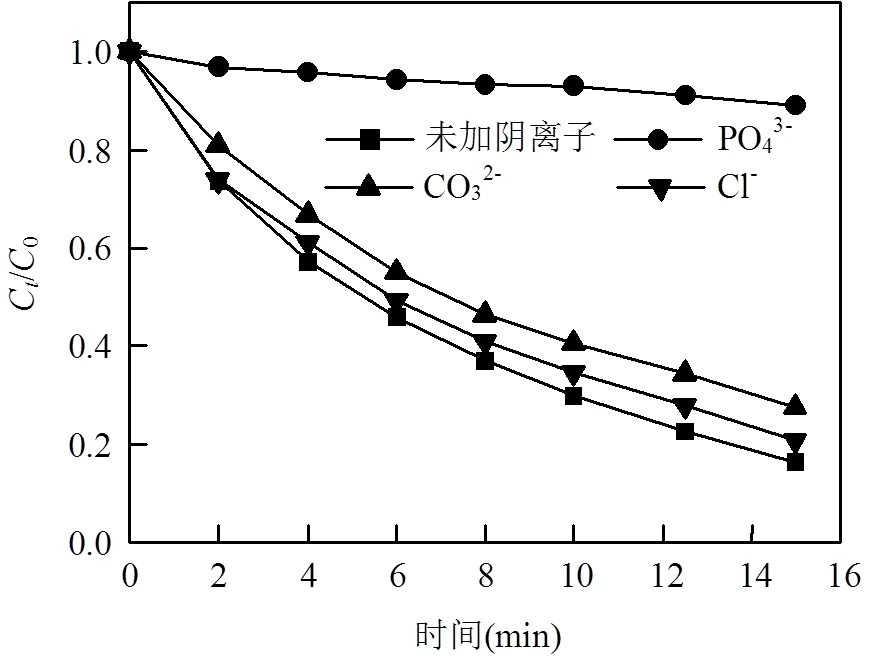
图9 不同阴离子对OG降解效率的影响
2.7 体系中自由基的鉴定
许多研究[7,11]已表明Fe2+/PDS体系中存在着SO4•-和HO•等活性自由基,且SO4•-占主导地位.鉴于Fe2+/EGCG/PDS体系中引入了有机物EGCG,可能对体系中存在的活性物质种类及占比有一定影响,因此,本实验向体系中分别加入不同的自由基淬灭剂(甲醇和叔丁醇),来判定存在的自由基种类及其各自的贡献[8,17].
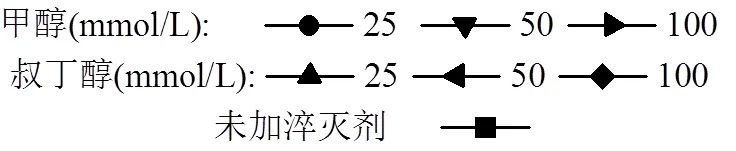
分别向该体系中加入25、50、100mmol/L甲醇和叔丁醇,观察它们对实验结果的影响.实验结果如图10所示.根据该图不难发现,甲醇对体系降解速率的抑制效果远远大于叔丁醇, 25mmol/L的甲醇投加量就足以使OG去除率从83.71%骤降至40.66%,投加100mmol/L甲醇时去除率更是下降到了15.71%,即下降了68个百分点;相比之下,反应体系在100mmol/L的叔丁醇投加量下仍有75.08%的去除率,仅下降了8个百分点.综上所述,在Fe2+/EGCG/PDS体系中, SO4•-起主要作用,而HO•作用很小,这有可能是因为反应体系pH呈酸性, SO4•-只能与水以极慢的反应速率产生HO•.
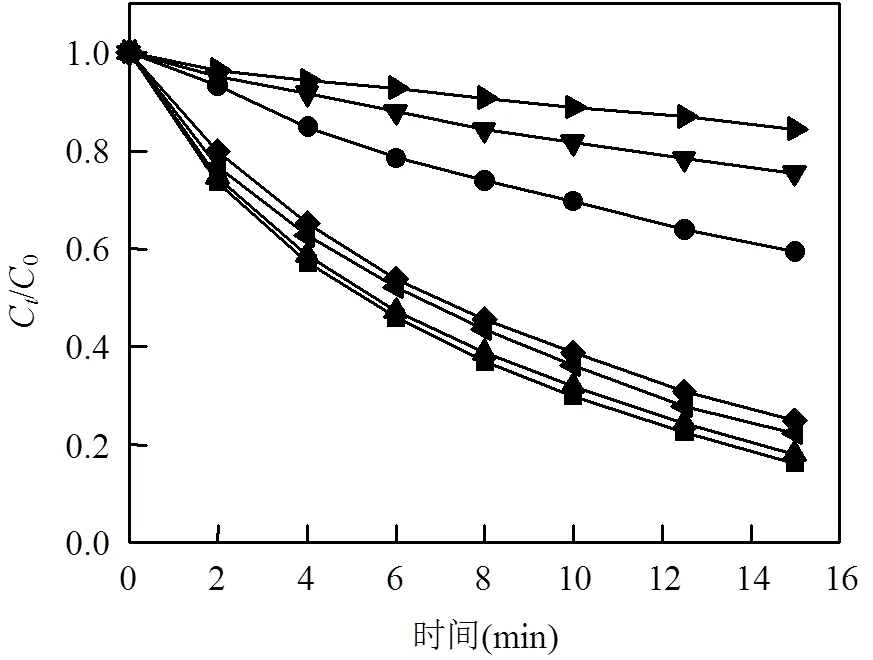
图10 甲醇和叔丁醇对OG降解效率的影响
3 结论
3.1 加入EGCG可促进Fe2+/PDS体系内Fe3+/Fe2+循环的建立,从而大幅提升了该体系对OG的降解速率.
3.2 OG降解速率随PDS及Fe2+投加量的增加而升高、随OG初始浓度的增加而降低、随着pH的增大呈先升高后基本不变的趋势.
3.3 OG的降解速率随着EGCG投加量的增加呈先升高后略微降低的趋势;常见共存阴离子对OG降解的抑制程度由高到低依次为PO43-> CO32->Cl-;体系中的有效自由基以SO4•-为主.
[1] 任南琪,周显娇,郭婉茜,等.染料废水处理技术研究进展 [J]. 化工学报, 2013,64(1):84-94.
[2] 王怡中,陈梅雪,胡 春.光催化氧化与生物氧化组合技术对染料化合物降解研究[J]. 环境科学学报, 2000,30(6):772-775.
[3] 岳 琳,王开红,郭建博,等.多金属氧酸盐电催化降解染料废水的研究[J]. 中国环境科学, 2013,33(1):88-94.
[4] Xu X, Li X. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion [J]. Separation & Purification Technology, 2010,72(1):105-111.
[5] Rao Y, Liang Q, Yang H, et al. Degradation of carbamazepine by Fe(II)-activated persulfate process [J]. Journal of Hazardous Materials, 2014,268c(6):23–32.
[6] Xie P, Ma J, Wei L, et al. Removal of 2-MIB and geosmin using UV/persulfate: Contributions of hydroxyl and sulfate radicals [J]. Water Research, 2015,69:223-233.
[7] Anipsitakis G P, Dionysiou D D. Radical generation by the interaction of transition metals with common oxidants [J]. Environmental Science & Technology, 2004,38(13):3705-3712.
[8] Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988,17(3):1027-1284.
[9] Liang C, Bruell C J, Marley M C, et al. Persulfate oxidation for in situ remediation of TCE. II. Activated by chelated ferrous ion [J]. Chemosphere, 2004,55(9):1225-1233.
[10] Zou J, Ma J, Chen L, et al. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(III)/Fe(II) cycle with hydroxylamine [J]. Environmental Science & Technology, 2013,47(20):11685-11691.
[11] Lei Y, Zhang H, Wang J, et al. Rapid and continuous oxidation of organic contaminants with ascorbic acid and a modified ferric/ persulfate system [J]. Chemical Engineering Journal, 2015,270:73-79.
[12] Sutherland B A, Rahman R M A, Appleton I. Mechanisms of action of green tea catechins, with a focus on ischemia [J]. Journal of Nutritional Biochemistry, 2006,17(5):291–306.
[13] Kimura M, Umegaki K, Kasuya Y, et al. The relation between single/double or repeated tea catechin ingestions and plasma antioxidant activity in humans [J]. European Journal of Clinical nutrition, 2002,56(12):1186-1193.
[14] Ryan P, Hynes M J. The kinetics and mechanisms of the complex formation and antioxidant behaviour of the polyphenols EGCg and ECG with iron(III) [J]. J. Inorganic Biochemistry, 2007, 101(4):585-93.
[15] Tan C, Gao N, Chu W, et al. Degradation of diuron by persulfate activated with ferrous ion [J]. Separation & Purification Technology, 2012,95:44-48.
[16] Masomboon N, Ratanatamskul C, Lu M. Chemical oxidation of 2, 6-dimethylaniline in the Fenton process [J]. Environmental Science & Technology, 2009,43(22):8629-8634.
[17] Buxton G V, Greenstock C L, Helman W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (⋅OH/O− in aqueous solution [J]. J. Physical and Chemical Reference Data, 1988,17(2):513-886.
[18] Stumm, Werner, Morgan, et al. Aquatic chemistry: chemical equilibria and rates in natural waters [J]. Cram101 Textbook Outlines to Accompany, 1996,179(11):A277.
[19] Zuo Z, Cai Z, Katsumura Y, et al. Reinvestigation of the acid–base equilibrium of the (bi) carbonate radical and pH dependence of its reactivity with inorganic reactants [J]. Radiation Physics and Chemistry, 1999,55(1):15-23.
Degradation of orange G by Fe2+/peroxydisulfate system with enhance of EGCG.
BI Chen1,2, SHI Zhou1,2*,ZHOU Shi-qing1,2, BU Ling-jun1,2
(1.College of Civil Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Building Safety and Energy Efficiency, Ministry of Education, Hunan University, Changsha 410082, China)., 2017,38(10):3722~3728
As a kind of green tea extract with reducing and chelating properties, epigallocatechin-3-gallate (EGCG) was introduced into Fe2+-activated peroxydisulfate (Fe2+/PDS) system to accelerate the transformation from Fe3+to Fe2+and enhance the degradation of orange G (OG). The effect of PDS dosage, initial concentration of OG, initial solution pH, Fe2+dosage, EGCG dosage, and co-existing anions on degradation of OG was investigated. The results demonstrated that Fe2+, EGCG, PDS alone, and EGCG/PDS, Fe2+/EGCG system showed poor effectiveness on degradation of OG, while the involvement of EGCG into Fe2+/PDS system enhanced OG degradation significantly: from 30.89% to 83.71%. Besides, the degradation efficiency of OG increased along with the dosage of PDS and Fe2+, and decreased with the increase of initial OG concentration. An optimum dosage of EGCG was found at 40 μmol/L and the degradation efficiency of OG performed well in a wide pH range of 2.0 ~ 7.0. The degree of inhibition from strong to weak follows the order of PO43−> CO32−> Cl−. Furthermore, by adding two typical radical scavengers (TBA and MeOH), hydroxyl radical and sulfate radical were identified to be responsible for OG degradation and SO4•-made the predominant contribution.
Fe2+/EGCG/PDS;radicals;iron cycle;chelating;reducing
X522
A
1000-6923(2017)10-3722-07
毕 晨(1992-),男,甘肃陇南人,湖南大学硕士研究生,从事水质净化与水污染控制研究.
2016-12-22
“十二五”国家科技支撑计划(2012BAJ24B03)
* 责任作者, 教授, zhous61@163.com
