食管癌根治术后辅助放化疗不良反应与临床因素的关系
2017-11-06魏成明
王 琳 陈 梅 明 智 魏成明
食管癌根治术后辅助放化疗不良反应与临床因素的关系
王 琳 陈 梅 明 智 魏成明
目的探讨食管癌根治性切除术患者术后辅助放化疗不良反应发生情况及其与临床因素的关系。方法
选择50例食管癌术后辅助放化疗患者作为研究对象,观察其放射性食道炎(RE)、放射性肺炎(RP)及骨髓抑制等不良反应发生情况,并针对≥2级不良反应进行Logistic法因素分析。结果RE:1级11例(22%)、2级19例(38%);RP:1级4例(8%)、2级7例(14%);骨髓抑制:1级16例(32%)、2级7例(14%)、3级1例(2%)。单因素分析结果显示:胸腔胃长度大小与≥2级RE相关(P<0.05),性别和胸腔胃体积大小与≥2级RP相关(P<0.05),是否接受了≥2个周期化疗与≥2级骨髓抑制相关(P<0.05)。多因素分析结果显示:胸腔胃长度大小是≥2级RE独立影响因素(P<0.05),胸腔胃体积大小是≥2级RP独立影响因素(P<0.05)。结论胸腔胃长度越长、体积越大发生≥2级RE、RP的风险越高,应在保证靶区照射剂量的同时密切注意患者不良反应发生情况,提高患者生存质量。
食管癌;术后辅助放化疗;放射性食道炎;放射性肺炎
(ThePracticalJournalofCancer,2017,32:1482~1485)
手术切除是食管癌的主要治疗方式之一,为减少食管癌术后患者局部复发或(和)远处转移的发生率,辅助性放化疗成为食管癌术后患者主要的治疗方式[1]。既往研究表明,对术后淋巴结阳性食管癌患者进行辅助性放疗可提高患者局部控制(LC)率,并进而提高总生存(OS)率[2-3]。然而,术后辅助性放化疗的实施不可避免地会引起相应的不良反应,而不良反应的发生会引起患者不同程度的治疗抗拒性,严重的可影响患者后续治疗、生活质量,甚至危及生命[4]。因此,预防放射性不良反应的发生具有临床意义。对此,本研究旨在探讨食管癌根治性切除术患者术后辅助放化疗不良反应发生情况及其与临床因素的关系,现报告如下。
1 资料与方法
1.1 一般资料
选择2010年1月至2015年12月我院收治的50例食管癌术后患者作为研究对象,入组标准:①首程治疗为在我院胸外科接受根治性手术切除术(R0术);②术后病理类型均为鳞状细胞癌,且切缘阴性;③手术与术后放疗间隔时间为3~4周;④术后患者恢复良好,可以耐受放化疗,功能状态评分(KPS)≥70分;⑤放疗前患者辅助检查均未见转移及复发征象;⑥获得患者知情同意,并均接受调强放疗(IMRT)。其中,男性36例、女性14例;年龄36~77岁;胸上段6例、胸中段38例、胸下段6例;肿瘤长度2~10 cm;淋巴结清扫个数4~28个;左侧开胸38例、右侧开胸12例;行食管胃弓上吻合术35例、颈部吻合术9例、食管胃弓下吻合术6例;胸腔胃41例、管状胃9例。依据2002年AJCC食管癌术后分期[5]:T1期5例、T2期9例、T3期36例,N0期11例、N1期39例,病理ⅡA期11例、ⅡB期13例、Ⅲ期26例。
1.2 方法
1.2.1 放疗 设备:GE Brilliance CT机,调强系统:Peacock PLATO.RTS Version2.7.4,医用电子直线加速器:Siemens PRIMVS-M。临床靶区(CTV)主要包括原瘤床区及相应淋巴引流区(依据美国胸科协会对胸部淋巴结的分组进行淋巴结引流区的勾画),其中胸上段淋巴结引流区包括双侧锁上、2区、4区、5区、6区、7区及8区,下界为气管隆突下2~3 cm,并包括吻合口;胸中段淋巴结引流区包括2区、4区、5区、6区、7区,下界为贲门淋巴结区;胸下段引流区包括4区、5区、6区、7区、贲门旁、胃小弯和胃左淋巴结区。勾画的靶区定义为CTV,在CTV基础上前后左右方向各外放0.3~0.5 cm,上下方向各外放0.5~1.0 cm为计划靶区(PTV),要求95% PTV接受剂量为45~54 Gy分25~28次5周完成,1.8~2.0 Gy/次,中位剂量50.4 Gy。同时利用TPS勾画胸腔胃、心脏、肺和脊髓等OAR。其中,胸腔胃长度为8.4~23.1 cm,平均(17.4±0.5)cm;体积为48.9~736.5 cm3,平均(222.9±14.9) cm3。胸腔胃V40≤45%;双肺Dmean≤13 Gy,肺V20≤30%,V30≤18%;心脏V40≤40%;脊髓Dmean<45 Gy。
1.2.2 化疗 全组50例患者中接受化疗14例,其中同步放化疗5例,序贯放化疗9例(术后化疗1~2个周期后术后放疗,放疗结束后再行化疗)。化疗疗程为1~6个周期,中位数3个周期。化疗方案以顺铂为基础,主要有LFP方案(亚叶酸钙200 mg/次,第1~5天,替加氟1 g/次,第1~5天;顺铂20 mg/次,第1~5天)和TP方案(紫杉醇240 mg/次,第1天;顺铂20 mg/次,第1~5天)。化疗期间辅助止吐、增强免疫力及扶正等支持治疗。同步放化疗方案以TP方案为主,序贯化疗方案以TP或LFP方案为主。
1.3 观察指标
依据2009年制定的CTCAE v4.0标准中对放射性食管损伤的评级标准[6]进行放射性食道炎(RE)评价,并评价放射性肺炎(RP)及骨髓抑制(主要为白细胞计数减低),评价时间为放疗开始至放疗后3个月,其中主要针对≥2级不良反应进行分析。
1.4 统计学方法
应用SPSS 19.0软件对组间计数资料行χ2检验,Logistic法进行因素分析(Forward:Wald筛选法),P<0.05为差异有统计学意义。
2 结果
2.1 不良反应情况
全组50例患者中,RE:1级11例(22%)、2级19例(38%),余20例(40%)无RE症状;RP:1级4例(8%)、2级7例(14%),余39例(78%)无RP症状;骨髓抑制:1级16例(32%)、2级7例(14%)、3级1例(2%),余26例(52%)无骨髓抑制。
2.2 不良反应单因素分析
单因素分析结果显示:胸腔胃长度大小与≥2级RE相关,性别和胸腔胃体积大小与≥2级RP相关,是否接受了≥2个周期化疗与≥2级骨髓抑制相关。见表1。
2.3 不良反应多因素分析
多因素分析结果显示:胸腔胃长度大小是≥2级RE独立影响因素,胸腔胃体积大小是≥2级RP独立影响因素。见表2。
3 讨论
随着放疗技术的进步及研究的深入,对术后淋巴结阴性食管癌患者,术后放疗显示了其有益性。相关报道表明,术后辅助性治疗能降低部分患者的局部复发(LR)率和远处转移(DM)率,从而提高了患者的长期OS率[7]。但是,术后辅助性放化疗在一定程度上也增加了患者不良反应发生率,更有甚者会引起患者不良后果,并影响下一步治疗,从而抵消了部分患者放化疗的益处[8]。随着适宜人群的扩大,既要保证患者靶区接受既定处方剂量照射的同时,周边正常组织又要得到较好的保护,将不良反应发生率最小化,这需要个体化治疗计划。本研究对我院收治的50例食管癌根治性切除术患者术后辅助放化疗出现的RE、RP及骨髓抑制情况及其与临床因素之间的关系进行了分析,结果显示患者不良反应的发生主要与患者胸腔胃长度、体积大小和是否接受化疗相关。
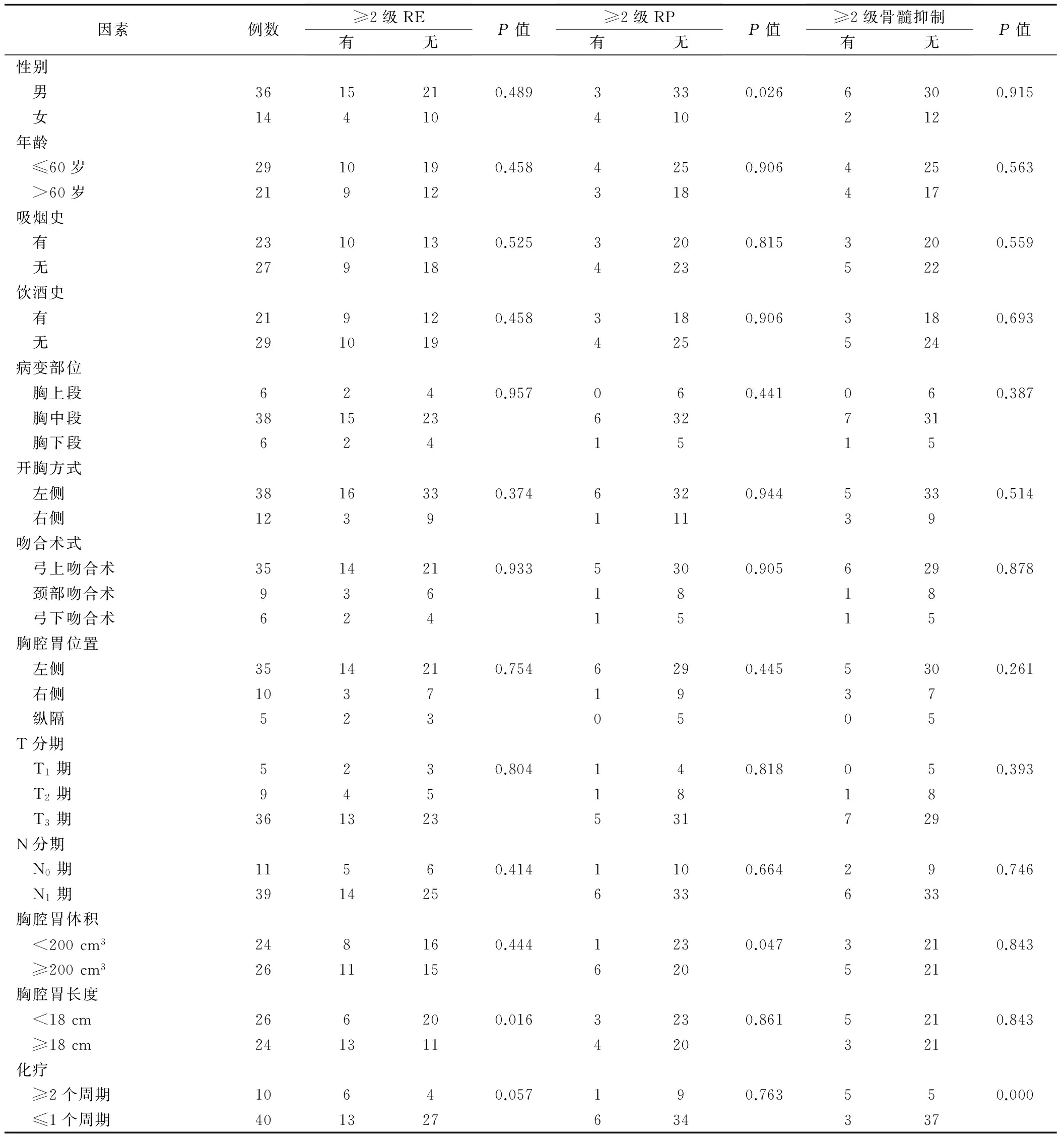
表1 不良反应单因素分析/例
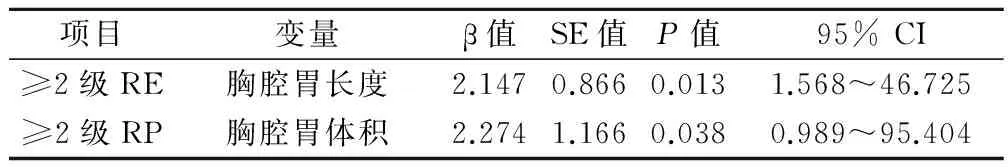
表2 不良反应多因素分析
食管癌术后辅助性放化疗患者出现RE的主要症状包括食欲下降、恶心、呕吐、吞咽疼痛及下咽困难等症状。在接受根治性手术后,由于解剖结构的改变,食管癌患者常因进食的摩擦及消化液的返流可能会进一步增加RE发生率及严重程度[9]。胃的大小、胃的位置、胃内容物的多少、胸腹部呼吸运动、患者的体型等都对胃的位置变化影响较大,且放疗过程中胃的形状、大小均不断变化,导致研究过程中不确定因素增多[10]。食管癌术后患者,胃被提至纵隔形成胸腔胃,当胸腔胃越长,其暴露于射线的概率也就越大[11]。本研究结果表明,胸腔胃越长则发生≥2级RE的比例越大,且为其独立影响因素。这与既往研究表明放疗不良反应的发生率与靶器官受照程度密切相关的研究结果相似[12]。因此,在临床上对胸腔胃较长的食管癌术后患者应提前做好预防RE的准备,并提前告知患者。
RP为接受胸部放疗患者较为常见的治疗不良反应之一,其发生受多种临床物理因素影响。既往研究表明RP发生与患者性别、年龄、肿瘤部位、靶体积大小、吸烟史及肺病史等多个临床因素相关[13]。本研究结果表明,胸腔胃体积大小与患者出现≥2级RP密切相关,且为其独立影响因素。随着胸腔胃体积增加,相应靶区即照射野面积也随之相应增加,导致正常肺组织受照体积增加;而较大体积的肺组织接受一定剂量照射时会导致肺功能单位丧失增多,从而引起急性放射性反应,甚至损伤[14]。单纯放疗患者出现骨髓抑制现象较为少见,其主要出现在接受放化疗患者中,提示我们在对食管癌术后患者进行联合放化疗是应该持谨慎态度,尤其是对接受了≥2个疗程化疗的患者应该注意提前预防白细胞计数减低的发生率。
综上所述,对胸腔胃长度较长、体积较大且接受放化疗的食管癌患者的治疗计划难度较大,应在保证靶区照射剂量的同时密切注意患者不良反应的发生情况,尽量将其控制在允许范围内,避免导致严重的不良反应的发生,致使患者生存质量下降。
[1] 张月峰,景绍武,王 军,等.食管癌根治性术后辅助放化疗临床疗效Meta分析〔J〕.中华肿瘤防治杂志,2015,22(9):713-718.
[2] 郦荣林.新辅助放化疗在局部晚期食管癌治疗中的应用研究〔J〕.浙江医学,2014,36(13):1172-1174.
[3] 杨 帆,钟世虎.新辅助化疗对中晚期食管癌患者临床疗效的影响〔J〕.四川医学,2011,32(4):495-497.
[4] 章文成,肖泽芬.食管癌根治术后预防性放疗应用的相关性研究(二)——食管癌术后失败模式和术后放疗〔J〕.中华放射肿瘤学杂志,2011,20(2):148-152.
[5] 沈文斌,祝淑钗.食管癌术后患者放化疗临床应用研究进展〔J〕.肿瘤防治研究,2015,42(6):535-540.
[6] 陈 超.食管癌术后放化疗患者营养状况、不良反应与治疗耐受性的关系分析〔J〕.中华全科医师杂志,2015,14(6):470-472.
[7] JT Martin,W Mathias,JB Zwischenberger,et al.The role of radiation therapy in resected T2 N0 esophageal cancer:a population-based analysis〔J〕.Ann Thorac Surg,2013,95(2):453-458.
[8] 方伟生,赖沛宝,王小艳,等.食管癌术后辅助治疗的临床价值〔J〕.国际肿瘤学杂志,2014,41(1):34-37.
[9] 陈炳光,黄晓波,刘图强,等.局部中晚期食管癌术后放射治疗的临床疗效〔J〕.广东医学,2013,34(12):1871-1874.
[10] 殷洪涛,鄂明艳,王牧宏,等.老年食管癌患者放疗疗效及相关临床因素分析〔J〕.实用肿瘤学杂志,2012,26(3):236-240.
[11] 吴 剑,陈恩乐,翁欣然,等.食管癌放疗中食管损伤的相关因素分析〔J〕.中华肿瘤杂志,2011,33(5):375-376.
[12] 沈文斌,高红梅,曹彦坤,等.食管癌根治性术后预防性IMRT所致放射性胃炎的剂量学研究〔J〕.中华放射肿瘤学杂志,2016,25(8):818-822.
[13] 李桂梅,关崇丹,郑响宁,等.食管癌放疗致放射性肺炎的临床分析〔J〕.癌症进展,2011,9(6):718-721.
[14] 宋志雨,马天江,张耀勇,等.老年食管癌放疗致放射性肺炎相关因素分析〔J〕.肿瘤基础与临床,2015,28(2):143-145.
(编辑:甘艳)
AnalysisoftheRelationshipbetweenAdverseReactionsandClinicalFactorsinPatientswithEsophagealCancerafterRadicalResection
WANGLin,CHENMei,MINGZhi,etal.
ZigongFirstPeople'sHospital,Zigong,643000
ObjectiveTo investigate the incidence of postoperative adjuvant radiotherapy and chemotherapy adverse reactions in patients with esophageal cancer and their relationship with clinical factors.Methods50 cases of esophageal cancer patients treated with adjuvant chemotherapy patients was the research object,RE,RP and the incidence of bone marrow suppression were observed,and analysis of logistic factors for ≥ 2 grade adverse reaction.ResultsRE:1 grade 11 cases (22%),2 grade 19 cases (38%);RP:1 grade 4 cases (8%),2 grade 7 cases (14%);Bone marrow suppression:1 grade 16 cases (32%),2 grade 7 cases (14%),3 grade 1 cases (2%).Single factor analysis showed that the size and length of gastric ≥ 2 grade RE (P<0.05),gender and gastric volume of gastric ≥ 2 RP (P<0.05),
≥ 2 cycles of chemotherapy with ≥ 2 grade myelosuppression related (P<0.05).Multivariate analysis showed that,the stomach size ≥ 2 grade RE independent factors (P<0.05),gastric volume ≥ 2 grade RP independent factors (P<0.05).ConclusionThe risk of intrathoracic stomach length is longer,the greater the volume occurred more than 2 RE,the higher the RP,ensure the target doses while paying close attention to the occurrence of adverse reactions in patients,improve the quality of life of patients.
Carcinoma of esophagus;Postoperative adjuvant radiotherapy and chemotherapy;Radioactive esophagitis;Radiation pneumonia
643000 四川省自贡市第一人民医院
10.3969/j.issn.1001-5930.2017.09.026
R735.1
A
1001-5930(2017)09-1482-04
2016-09-12
2017-03-23)
