UCA1、核因子、口腔菌群与口腔癌发生发展的相关性
2017-11-06张爱泓
刘 兵 张爱泓 张 贞
UCA1、核因子、口腔菌群与口腔癌发生发展的相关性
刘 兵 张爱泓 张 贞
目的探讨尿路上皮癌抗原1(urethral epithelium cancer antigen,UCA1)、核因子κB(nuclear factor kappa B,NF-κB)、口腔菌群与口腔癌发生发展的相关性。方法收集37例口腔癌患者临床资料,并与同期37例口腔癌前病变的临床资料对比。取口腔癌、癌前病变组织各1份,同时取口腔癌癌周正常组织1份,观察三者UCA1、NF-κB、口腔菌群变化情况。对口腔癌患者均规范治疗,观察治疗前后UCA1、NF-κB、口腔菌群变化。结果治疗前口腔癌UCA1mRNA为(0.94±0.24)、NF-κB阳性率为97.3%,口腔癌口腔菌群链球菌属、耐瑟菌属、葡萄球菌属、白色念珠菌等优势菌比率分别为89.19%、72.97%、54.05%、37.84%,均显著高于癌前病变组和口腔癌周正常组织组,和其他2组差异有统计学意义(P<0.05)。治疗后口腔癌UCA1mRNA为(0.18±0.12)、NF-κB阳性率为16.22%,口腔癌口腔菌群链球菌属、耐瑟菌属、葡萄球菌属、白色念珠菌等优势菌比率分别为16.22%、16.22%、10.81%、8.11%,无优势菌占83.78%,与治疗前比较,差异有统计学意义(P<0.05)。结论UCA1、NF-κB、口腔菌群水平变化能反映口腔癌的病情转归,临床价值高。
尿路上皮癌抗原1;核因子κB;口腔菌群;口腔癌;相关性
(ThePracticalJournalofCancer,2017,32:1423~1426)
口腔癌是口腔科常见恶性肿瘤,由于口腔内血液循环丰富,加上舌机械运动频繁,口腔内菌群分布多样,癌变后会造成口腔内感染,菌群失调,严重者会出现淋巴结转移。目前对口腔癌在诊断上主要结合临床表现、触诊和活检等为主,但这些方法会增加患者痛苦,造成肿瘤细胞扩散,而寻找一个无创伤性、高特异性、高敏感性的口腔癌标志物,对辅助和改善口腔癌的诊断方法有重要意义[1]。而长链非编码RNA表达失调和口腔肿瘤发生之间关系密切,UCA1就属于其中一个重要指标,NF-κB是核转录因子之一,被激活后从细胞质位转入核,能调控蛋白转录,其过度表达则和细胞癌变、肿瘤生物学行为有关。口腔菌群失调是口腔癌感染的独立危险因素。
1 材料与方法
1.1 临床资料
收集2010年5月至2015年4月共37例口腔癌患者临床资料,与同时期口腔癌前病变37例进行比较。口腔癌组男性22例,女性15例;年龄35~68(51.4±2.3)岁;文化程度:小学8例,初中19例,高中及以上10例。口腔癌前病变组37例,男性20例,女性17例;年龄36~70(51.6±2.5)岁;文化程度:小学10例,初中18例,高中及以上9例。2组患者在年龄、性别、文化程度上比较无差异性(P>0.05),具有可比性。口腔癌和癌前病变者受试前4周均未行任何治疗方法。排除严重肝肾功能损害者,排除受试前行相关治疗影响结果者;排除未签署知情同意书、未经医院伦理委员会同意者。
1.2 主要仪器和试剂
干燥箱、电热恒温培养箱、电子分析天平、显微照相仪、Olympus-BH-2显微镜等均购自上海恒一科学仪器有限公司。兔抗人NF-κB克隆抗体购自上海田源生物技术有限公司。低温离心机、2450分光光度仪、PCR仪均购自日本道镜公司。
1.3 方法
取口腔癌、癌前病变组织各1份,同时取口腔癌癌周正常组织1份,装入EP管中后送检进行RNA提取,切除取下组织后充分磨碎,UCA1检测则留置5 min后加入氯仿,充分混匀后在室温下放置3 min,3 000 r/min离心5 min,加入0.5 ml异丙醇,混匀,室温放置10 min,去除上层清液,沉淀在空气中后干燥5~10 min,加入去离子水溶解RNA,分光光度仪器检测260比值,根据试剂盒检测说明书进行反转录cDNA,后进行实时荧光定量PCR,检测UCA1mRNA在样本中表达量。NF-κB则采用二步法免疫组化试剂盒说明进行操作,NF-κB抗原采用微波热修复,其阳性判断标准为细胞中出现黄色或棕黄色着色或颗粒,由2名副主任医师以上职称双盲法观察。
口腔菌群标本采集则用1 cm长无菌纸对准口腔癌、癌前病变、口腔正常组织黏膜,浸湿喉放入1 ml硫代乙醇盐运送液中,再将采集标本用10倍系列稀释至10-1,接种在血琼脂培养基后置于厌氧培养箱中培养48 h,初代培养物进行菌落计数、菌落和菌细胞形态观察。根据细菌学鉴定系统鉴定细菌种属,计算细菌检出率。
对口腔癌患者均进行手术治疗,术后进行放化疗,观察治疗前后UCA1、NF-κB、口腔菌群变化情况。
1.4 统计学处理
应用SPSS 15.0统计软件进行统计学处理,组间比较采用χ2检验,计量资料采用t检验,或采用Fisher精确概率计算法,变量间相关性采用Spearman相关分析进行检验,检验水准为α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 三者UCA1、NF-κB情况比较
在UCA1含量和NF-κB阳性率上以口腔癌最高,与其他2组比较,差异有统计学意义(P<0.05);在口腔菌群分布上,口腔癌链球菌属、耐瑟菌属、葡萄球菌属、白色念珠菌等优势菌比率分别为89.19%、72.97%、54.05%、37.84%,显著高于其他2组者(P<0.05),见表1、2。
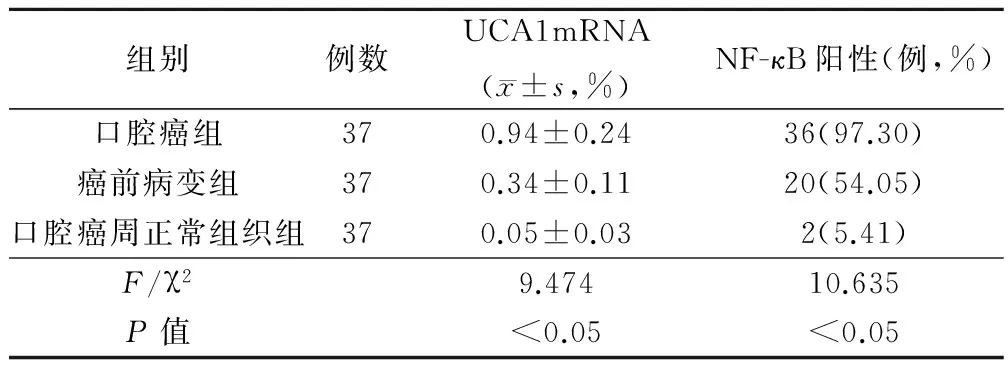
表1 三者UCA1、NF-κB情况比较
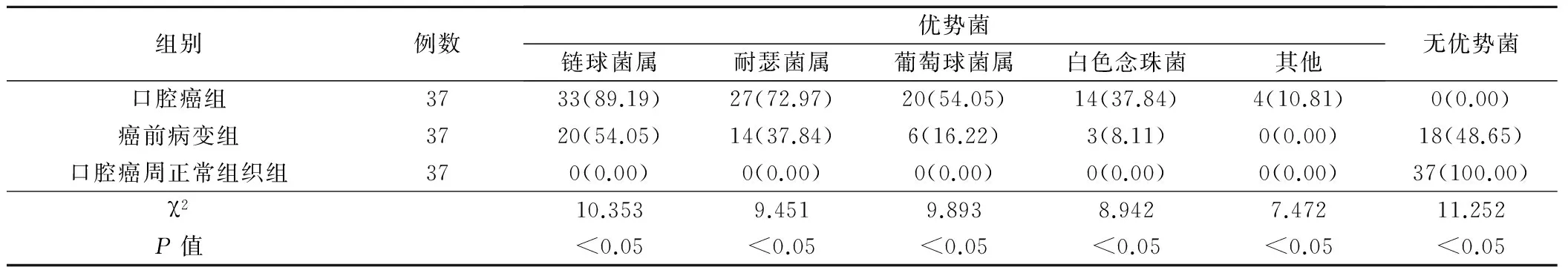
表2 三者口腔菌群分布情况比较(例,%)
2.2 口腔癌治疗前后UCA1、NF-κB、口腔菌群比较
口腔癌治疗后在UCA1含量和NF-κB阳性率显著低于治疗前,口腔菌群分布上也显著低于治疗前,治疗前后差异有统计学意义(P<0.05),见表3、4。
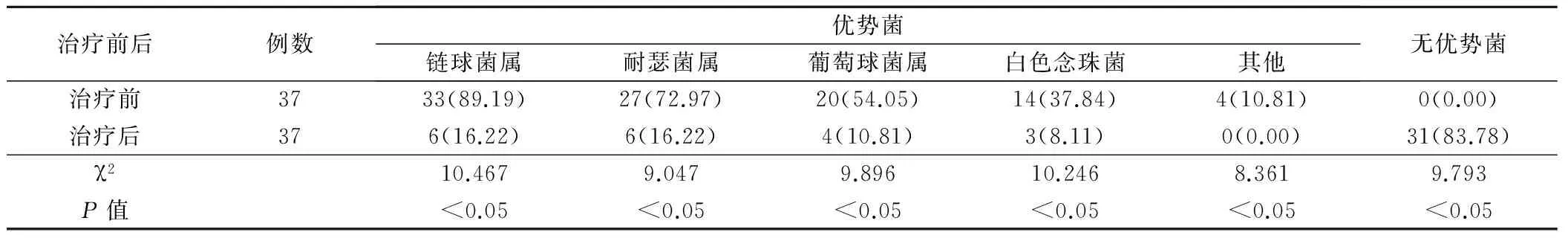
表3 口腔癌治疗前后口腔菌群分布情况比较(例,%)

表4 治疗前后UCA1、NF-κB情况比较
3 讨论
NF-κB是成熟B细胞和浆细胞中发现的一种广泛存在真核生物中转录因子,在正常情况下,其和IκB家族紧密结合形成三聚体从而抑制NF-κB活性并滞留在胞质内,促使NF-κB处于无活性状态。而当细胞受到白细胞介素-1、致癌基因、促癌剂等外界因素刺激后,细胞核内的κB就会和核内DNA特异序列相结合,从而发挥转录调控作用[2-3]。故抑制NF-κB活性过程,防止过度活化,对改善恶性肿瘤预后至关重要。报道称,NF-κB能通过调控与细胞生长增殖、抗凋亡、血管生成和转移等相关基因的表达,促进恶性肿瘤发展[4]。结果显示,NF-κB在口腔癌中阳性率最高,较口腔癌前病变NF-κB阳性率高,可见其有利于口腔癌的检出率,这可推测出该指标在口腔癌中普遍升高,且治疗后阳性率显著下降,这说明该指标对口腔癌预后有一定指导价值。
UCA1是一个非编码RNA,其在调节胚胎发育和癌症发生、发展和侵袭转移中有重要作用。研究[5-6]指出,UCA1不直接参与基因编码和蛋白合成,但在基因转录后的调控、剪切和修饰过程中发挥重要作用。报道[7]通过对UCA1口腔癌和癌周正常组织表达情况分析,发现低分化、临床分期中Ⅲ期、Ⅳ期患者,UCA1自身可嵌入基因启动子区域,会影响基因转录,且UCA1和肿瘤发生、发展密切相关,是肿瘤靶位点或早期诊断和预后分子标志物[8]。结果显示,UCA1mRNA表达在口腔癌患者中水平较高,且治疗后UCA1mRNA水平较治疗前显著下降,这说明该指标能判断口腔癌预后,可作为口腔癌临床发生发展的指标之一。
口腔癌患者口腔往往有溃疡,表面不光滑,多存在糜烂,黏膜机械屏障受损,糜烂坏死组织为细菌提供大量营养物质,加上溃疡腔隙降低了氧化还原电势,促使厌氧菌容易定植和生长[9-10]。同时癌症会造成全身抵抗力下降,吞噬细胞和T淋巴细胞功能下降显著,特异性和非特异性免疫因子缺乏后会造成黏膜表面缺乏特异性抗体屏障,为细菌的定植和生长提供良好环境。研究[11-12]指出,口腔癌患者表面有大量需氧菌和厌氧菌定植,多数是引起术后感染的致病菌,其表面需氧菌和厌氧菌数量高于正常黏膜。报道[13-14]称,口腔内局部组织破坏,黏膜屏障受损会造成口腔菌群失调,优势菌会发生改变,白色念珠菌等细菌定植,增加感染机会。结果显示,口腔癌链球菌属、耐瑟菌属、葡萄球菌属、白色念珠菌等优势菌比率明显偏高,这说明口腔癌患者菌群失调发生率高,故在治疗上对口腔癌患者要定期清洁口腔,主要防范口腔感染可能,同时治疗后无优势菌明显减少,这说明治疗后口腔菌群失调明显下降,故对口腔菌群进行研究对判断口腔癌预后有重要价值。
[1] 韩 晟,陈 衍,谢 诚,等.576例口腔癌患者的流行病危险因素研究〔J〕.实用口腔医学杂志,2012,28(1):74-78.
[2] 郭李柯,张超贤,史淑敏,等.吸烟和细胞色素P4501A1-MspⅠ、谷胱甘肽硫转移酶T1基因多态性与口腔癌的相关性研究〔J〕.华西口腔医学杂志,2012,30(2):187-191.
[3] 赵 湘,孙 正,葛化冰,等.口腔卫生习惯与口腔癌发生的相关性研究〔J〕.首都医科大学学报,2014,35(2):253-256.
[4] 林 洁,王 淼,吉 阳,等.脾络氨酸激酶-核因子κB调控口腔癌相关巨噬细胞中癌痛相关环氧化酶2的机制研究〔J〕.华西口腔医学杂志,2016,34(5):454-458.
[5] Brusevold IJ,Soland TM,Khuu C,et al.Nuclear and cytoplasmic expression of Met in oral squamous cell carcinoma and in an organotypic oral cancer model.〔J〕.Eur J Oral Sci,2010,118(4):342-349.
[6] Meric A,Ozucer B,Gedikli O,et al.Impact of smoking on p65 nuclear factor κB,p38 mitogen-activated protein kinase,and inducible nitric oxide synthase expression levels in oral mucosa〔J〕.J Craniofac Surg,2012,23(4):970-973.
[7] 王 霞,王培源,吴淑华,等.口腔癌肿瘤出芽与VEGF-C的表达及淋巴结转移的相关性研究〔J〕.实用口腔医学杂志,2012,28(5):610-613.
[8] 王 璇,黄锦叶,陈昌伟,等.NF-κB、COX-2在口腔扁平苔藓和口腔癌中的表达及意义〔J〕.海南医学院学报,2013,19(3):307-310.
[9] 邬腊梅,方征宇,杨宏宇,等.尿路上皮癌胚抗原1(UCA1)在舌鳞癌中的表达及意义〔J〕.中国口腔颌面外科杂志,2013,11(6):491-494.
[10] 杨勇涛,杨宏宇,王宇帆,等.尿路上皮癌胚抗原1对口腔癌细胞侵袭迁移及增殖影响的实验研究〔J〕.中华口腔医学杂志,2016,51(1):36-41.
[11] Fan Y,Shen B,Tan M,et al.Long non-coding RNA UCA1 increases chemoresistance ofbladder cancer cells by regulating Wnt signaling〔J〕.FEBS J,2014,281(7):1750-1758.
[12] Yang C,Li X,Wang Y,et al.Long non-coding RNA UCA1 regulated cell cycle distribution via CREB through PI3-K dependent pathway in bladder carcinoma cells〔J〕.Gene,2012,496(1):8-16.
[13] 赵洪波.复发性口腔溃疡患者口腔微生态菌群情的检验结果分析〔J〕.全科口腔医学电子杂志,2015,2(6):29-35.
[14] Stringer AM,Logan RM.The role of oral flora in the development of chemotherapy-induced oral mucositis〔J〕.J Oral Pathol Med,2015,44(2):81-87.
(编辑:甘艳)
StudyontheRelationshipbetweenUCA1,NuclearFactor,OralFloraandtheOccurrenceandDevelopmentofOralCancer
LIUBing,ZHANGAihong,ZHANGZhen.
AnyangSixthPeople'sHospital,Anyang,455000
ObjectiveTo investigate the correlation between the expression of UCA1,NF-kappa B,oral microflora and the occurrence and development of oral cancer.MethodsClinical data of 37 patients with oral cancer were collected and compared with the clinical data of 37 patients with oral precancerous lesions in the same period.1 case of oral cancer and precancerous lesions were collected,and 1 case of pericancerous tissue of oral cancer was collected.The changes of UCA1,NF-kappa B and oral flora were observed in the 3 groups.All the patients with oral cancer were treated with standard therapy,and the changes of UCA1,NF-kappa B and oral flora were observed before and after treatment.ResultsBefore the treatment,oral cancer UCA1mRNA (0.94±0.24),NF-kappa B positive rate was 97.3%,oral cancer oral bacteria Streptococcus,Neisseria spp,Staphylococcus aureus and Candida albicans bacteria ratios were 89.19%,72.97%,54.05%,37.84%,which were significantly higher than that of precancerous lesions and pericancerous tissues,there had statistical difference between the 2 groups (P<0.05).After the treatment of oral cancer UCA1mRNA (0.18±0.12),NF-kappa B positive rate was 16.22%,oral cancer oral bacteria Streptococcus,Neisseria spp.,Staphylococcus aureus and Candida albicans bacteria ratios were 16.22%,16.22%,10.81%,8.11%,no dominant bacteria accounted for 83.78%,compared with before treatment,there were statistically significant difference (P<0.05).ConclusionThe change of UCA1,NF-kappa B,oral flora can reflect the prognosis of oral cancer,and the clinical value is high.
UCA1;NF-kappa B;Oral microflora;Oral cancer;Correlation
455000 河南省安阳市第六人民医院口腔医院
10.3969/j.issn.1001-5930.2017.09.008
R739.8
A
1001-5930(2017)09-1423-04
2017-04-05
2017-07-10)
