肺腺癌EGFR、KRAS基因突变、ALK融合蛋白状态分析
2017-11-06董丹丹李芳华
董丹丹 徐 钢 李芳华 李 科 胥 颖
·基础研究·
肺腺癌EGFR、KRAS基因突变、ALK融合蛋白状态分析
董丹丹 徐 钢 李芳华 李 科 胥 颖
目的分析肺腺癌中EGFR、KRAS、ALK三种肿瘤驱动基因的突变状态及与其临床病理特征、肿瘤分期的关系。方法85例肺腺癌EGFR,KRAS基因突变采用ARMS法检测,ALK融合蛋白用特异性抗ALK单克隆抗体(克隆号:D5F3)采取免疫组织化学法检测。结果EGFR,KRAS,和ALK融合蛋白检测阳性率分别是62%,15%,和14%。EGFR基因突变更常见于女性。KRAS基因突变更常见于男性及有吸烟史患者。ALK融合蛋白更常见于年轻及肿瘤分期Ⅲ/Ⅳ患者。检测中发现了8例双突变病例。结论结果进一步证实了EGFR、KRAS基因突变与ALK融合蛋白并非完全互斥。对于肺腺癌患者进行全面的基因检测非常重要,在选择靶向治疗时更应考虑到多种变异同时存在的情况。
肺腺癌;EGFR;KRAS;ALK
(ThePracticalJournalofCancer,2017,32:1393~1397)
肺癌是全世界肿瘤致死的主要原因[1],中国每年大约有超过140万人死于肺癌[2]。传统的手术摘除联合放疗、化疗并未使肺癌的生存率有显著的提高[3],随着肿瘤治疗进入靶向治疗时代,与肺癌发生及治疗相关的基因包括EGFR基因[4]、KRAS基因[5]及ALK基因等[6],越来越受到关注。
4%的NSCLC患者中存在间变性淋巴瘤激酶ALK重排,这种变异可导致酪氨酸激酶激活,与肿瘤细胞的生长分化密切相关[7]。
研究显示非小细胞肺癌中存在KRAS和EGFR的双突变[8],但更多结果表明KRAS、EGFR突变和间变性淋巴瘤激酶(ALK)重排是互相排斥的[9]。可见肺癌多基因的协同表达研究结果还不是十分充分,也没有统一的结论。
肺腺癌是肺癌中最常见的组织学亚型[10],本研究检测85例肺腺癌4种肿瘤驱动基因EGFR、KRAS、ALK的突变状态,并与临床病理特征、肿瘤分期等之间的关系进行分析,旨在进一步揭示其相互关系,全面 了解肺腺癌的相关肿瘤驱动基因之间的内在联系,以指导临床治疗。
1 材料与方法
1.1 材料
选取2014年至2016年四川省人民医院病理科85例病理诊断为浸润性肺腺癌样本,所有病例均经两位病理医师独立阅片并诊断,其中男性37例(44%),女性41例(48%);中位年龄62.5,年龄<40岁的患者2例(2%),年龄40~49岁的患者9例(11%),年龄49~59岁的患者22例(26%),>60岁的患者47例(55%);44例(52%)患者无吸烟史,24例(28%)患者目前或以往吸烟。其中外科手术标本55例,穿刺活检标本30例。
1.2 ARMS法检测EGFR、KRAS、BRAF基因突变
5 μm厚的石蜡包埋组织切片38张,置于1.5 ml的EP管内。采用QIAGEN公司DNA抽提试剂盒,提取样本DNA,操作按说明书进行。DNA质量评估及浓度调整:用分光光度计(3100 pro 型,Amersham Biosciences)检测样本260 nm与280 nm波长吸光度值,以评价其纯度及含量。每例样本所提DNA均符合OD260/OD280在1.8~2.0,用双蒸水调整DNA浓度至1.5~3 ng/μl。采用厦门艾德ADx-ARMSTMEGFR基因突变检测试剂盒,检测18~21号外显子共21个突变位点。厦门艾德ADx-ARMSTMKRAS基因7种突变检测试剂盒,检测12号密码子和13号密码子上7种常见突变。反应体系在ABI 7500实时定量PCR仪中进行扩增及数据采集。
1.3 ARMS法结果判定
试剂盒采用8联PCR管设计,每一个8联PCR管检测一个样品,1~7号管内装有相应EGFR基因突变检测和内控试剂,突变探针由FAM信号指示,内控由HEX信号指示。内控作为对试剂、DNA质量及操作本身的质控,选择人类EGFR基因相对保守区段。待测样本的内控HEX信号升起,同时样本反应管中若有FAM信号升起,则判定相应的EGFR基因突变为阳性。
1.4 Ventana ALK IHC检测ALK融合蛋白
准备未染色并由FISH验证的ALK非小细胞肺癌患者组织切片,10%中性缓冲福尔马林液固定6~24 h,每例患者准备3张空白组织片:一张用于VENTANA ALK(D5F3) 抗体染色,一张用于兔单克隆阴性质控抗体染色,一张用于H&E染色。将ALK FISH(+)与ALK FISH(-)切片贴在同一正电荷载玻片上,烤片60度至少1 h。
1.5 Ventana ALK IHC结果判读
任何比例的NSCLC肿瘤细胞胞质呈现棕褐色颗粒状着色,视为ALK(D5F3)阳性。应当排除已知的非特异性染色,包括肺泡巨噬细胞中较淡的胞质着色,神经来源细胞(神经和神经节细胞)、腺上皮以及浸润的淋巴细胞及粘液等假阳性着色。另外非小细胞肺癌中正常粘膜(包括粘蛋白)内以及坏死组织区域内也可见到背景染色,应从临床评估中排除。NSCLC肿瘤细胞内不存在强颗粒状胞质染色,视为ALK(D5F3)抗体染色阴性。
肺腺癌组织学分类根据世界卫生组织(WHO)2015年版肺癌分类进行。
1.6 统计分析
统计学分析采用Fisher's精确检验或χ2检验(SPSS 10.0版)。
2 结果
2.1 EGFR、KRAS、ALK突变情况
85例肺腺癌患者中,EGFR、KRAS、ALK突变情况见表1。EGFR基因突变阳性病例中,19号外显子缺失突变最常见,共30例检出19外显子缺失,占EGFR突变总体的57%,占总病例数的35%;21号外显子突变次之,共23例,占EGFR突变总体的43%,占总病例数的27%;20号外显子(3例,占总病例数的4%)及18号外显子(2例,占总病例数的2%)突变少见,在EGFR突变总体中的比例<5%;另外5例双突变病例,占EGFR突变总体的9%,占总病例数的6%。KRAS基因突变阳性病例中,12号密码子G12C突变最常见,共6例,占KRAS突变总体的46%;G12V突变次之,共3例,占KRAS突变总体的23%。
2.2 肺腺癌患者是否吸烟与基因突变的关系(表1)
由表1可见,EGFR基因是否突变与患者吸烟(12/12)和不吸烟(29/15)无明显相关性(P=0.2001),KRAS基因突变与患者吸烟与不吸烟存在相关性(P=0.0044),ALK融合蛋白与患者吸烟(1/23)和不吸烟(6/38)无相关性(P=0.4177)。
2.3 性别与基因突变的关系
EGFR基因是否存在突变在女性(29/12)和男性(17/20)患者之间存在显著性差异(P=0.0263),见表1。KRAS基因突变在女性和男性患者之间也存在显著性差异(P=0.0084);ALK融合蛋白,在女性(5/36)和男性(6/31)患者之间却不存在显著性差异(P=0.748),见表1。
2.4 年龄与基因突变的关系(表1)
本组实验结果显示,EGFR基因突变率在老年患者与年轻患者之间无显著差异(P=0.2701),ALK融合蛋白阳性的患者的中位年龄为60岁,ALK融合蛋白阴性患者的中位年龄为63岁,而ALK融合基因则更多常见于年轻患者(P=0.0023)。采用Fisher's 精确检验,KRAS基因是否突变与患者年龄无显著相关性(P=0.3533)。
2.5 肿瘤直径与基因突变的关系(表1)
EGFR是否存在突变与肿瘤直径无显著相关性(P=0.7842)。KRAS基因突变也与肿瘤直径无显著相关性(P=0.7223),ALK融合蛋白同样与肿瘤直径无显著相关性(P=0.5637)。
2.6 基因突变与肿瘤分期的关系(表1)
由表1可见,EGFR基因是否突变与肿瘤分期不存在显著相关性(P=0.4413),与肿瘤分期也不存在显著相关性(P=0.3946)。然而ALK融合蛋白与肿瘤分期存在显著相关性(P=0.0043)。
2.7 肺腺癌组织学类型中黏液成分与基因突变的关系(表1)
EGFR是否存在突变与肺腺癌组织学类型中是否含有黏液成分无显著相关性(P=0.9025),KRAS基因是否突变与组织学类型中是否含有黏液成分无显著相关性(P=0.7261),ALK融合蛋白与肺腺癌组织学类型中是否含有黏液成分也不存在显著相关性(P=0.7116)。
2.8 肺腺癌组织学类型中微乳头成分与基因突变的关系(表1)
EGFR是否突变与肺腺癌组织学类型中是否含有微乳头成分无显著相关性((P=0.8703),同样KRAS基因突变与组织学类型中是否含有微乳头成分也显著相关性(P=0.2696),ALK融合蛋白与肺腺癌组织学类型中是否含有微乳头成分不存在显著相关性(P=0.6890)。
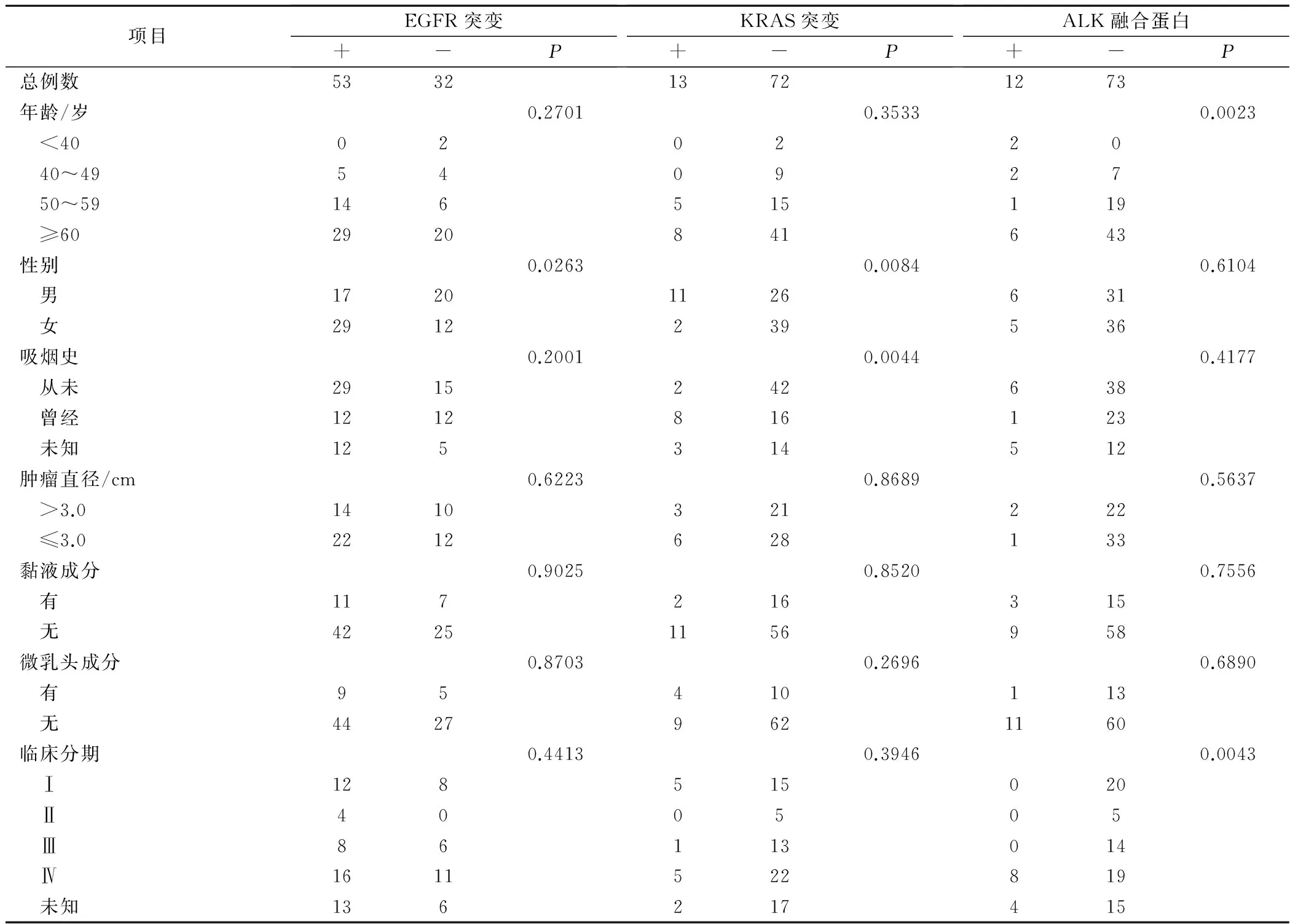
表1 EGFR、KRAS基因、ALK融合蛋白表达情况与肺腺癌临床病理特征的关系/例
2.9 EGFR、KRAS、ALK融合蛋白共同变异情况(表2)
85例肺腺癌病例中共检出8例共同变异病例,其中5例EGFR突变同时伴有ALK融合蛋白的占研究对象总体的5.88%(5/85),占EGFR突变患者的9.43%(5/53),占ALK融合蛋白阳性患者的41.67%(5/12);1例KRAS突变同时伴有ALK融合蛋白阳性的患者占研究对象总体的1.18%(1/85),占KRAS突变患者的7.69%(1/13),占ALK融合蛋白阳性患者的8.33%(1/12)。2例EGFR突变同时伴有KRAS突变的患者占研究对象总体的2.35%(2/85),占EGFR突变患者的3.77%(2/53),占KRAS突变患者的15.38%(2/13)。
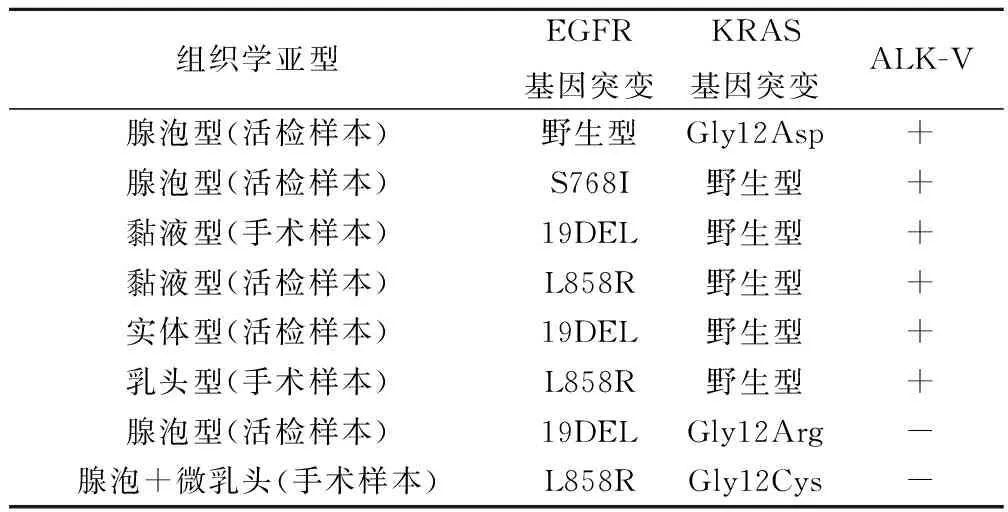
表2 85肺腺癌中8例EGFR、KRAS、ALK共同变异情况
3 讨论
EGFR基因突变最常发生于非吸烟、女性、亚裔、腺癌患者[11]。亚裔腺癌患者中,EGFR突变率高达30%~50%[12]。本组实验85例肺腺癌中,EGFR基因突变率为62%,稍高于文献报道,可能与检测方法的灵敏度不同有关。女性突变率(71%)高于男性(46%),二者之间差异具有显著性,与文献报道一致。本组实验中EGFR基因突变在吸烟患者中高达50%,提示亚裔肺腺癌有吸烟史的患者中,EGFR基因突变频率可能比先前报道的高。EGFR基因突变检测应该在亚裔肺腺癌患者中更广泛的开展。
本实验肺腺癌KRAS基因突变率为15%,吸烟患者突变率明显高于非吸烟患者(33% vs 6%,P<0.05),KRAS基因12号密码子发生的 G>T 易位导致Gly12Cys突变占50%,与Dogan等[13]的研究结果一致,说明KRAS基因状态的改变可能与烟草中的致癌物质有关。本组实验中男性KRAS基因突变(30%)明显高于女性(5%),可能是男性吸烟人数多于女性造成的。
ALK阳性肺癌在非小细胞肺癌中约占3%~6%[14]。本组实验ALK融合蛋白阳性检出率为14%,高于非小细胞肺癌患者阳性率,其中ALK融合蛋白阳性患者的中位年龄为63岁,且更常见于60岁以下及Ⅲ/Ⅳ期肺腺癌患者,与肿瘤大小无关。一些研究发现ALK基因重排阳性在含印戒细胞的粘液型或实性肺腺癌中更常见,高于其他类型的肺腺(46.2% vs 8%)。但本组研究中12例肺腺癌ALK融合蛋白阳性病例,实体性腺癌3例,腺泡型腺癌3例,黏液腺癌3例,乳头型腺癌3例,与是否含有黏液或微乳头成分无关。可见单纯依靠临床特征与病理分型选择ALK检测的适宜人群,存在漏检的风险。
一些研究显示,非小细胞肺癌中EGFR,KRAS和ALK基因的改变多数表现为互相排斥[15]。然而也有研究显示EGFR基因突变与ALK基因重排同时存在[16]。可见肺癌多基因的协同表达,研究还不十分充分,也没有统一的结论。
本研究分别检出5例EGFR突变伴ALK融合蛋白阳性,1例KRAS突变伴ALK融合蛋白阳性,2例EGFR突变伴KRAS突变。结果显示ALK融合蛋白阳性伴随有EGFR或KRAS突变的病例在肺腺癌中并不罕见。Gainor等研究西方人群非小细胞肺癌患者,发现ALK基因重排与EGFR和KRAS基因突变互相排斥[17],与本研究结果不同,说明不同人种基因状态存在差异。
本组研究中12例ALK融合蛋白阳性病例,5例(41.67%)伴随EGFR基因突变((19DEL,S768I,L858R),1例(8.33%)伴随KRAS基因突变(Gly12Asp)。EGFR突变伴随有ALK融合蛋白阳性,与KRAS突变伴随有ALK融合蛋白阳性在ALK融合蛋白阳性肺腺癌中谁更占优势,还需要更多的数据支持。
对于具有EGFR基因突变及ALK融合蛋白阳性的病例,多项研究显示,采用TKI治疗表现为临床获益,采用克唑替尼治疗也表现出良好的治疗反应性[18]。但也有体外实验研究发现,EGFR基因突变与ALK基因重排同时存在,可能导致分别针对EGFR和ALK两个靶点的单药TKI治疗相互耐药[19]。这可以可能是具有ALK融合基因的患者采用克唑替尼治疗约20%~30%的患者缺乏治疗反应性的原因。
本组实验检出2例EGFR突变伴随KRAS突变的肺腺癌病例,约占2.35%,在EGFR突变的肺腺癌患者中较罕见。文献报道此类患者从TKI的治疗中获益较小,并且显示出了不良预后[20]。
了解基因的协同作用及改变可以帮助我们理解肿瘤患者采用靶向治疗时出现的原发耐药机制,同时指导临床转换或调整针对ALK和EGFR、KRAS基因的靶向治疗方案,为临床采用多种靶向药物联合使用以达到阻断多条肿瘤信号通路的目的提供依据。多基因协调作用的肺癌患者的治疗方案的选择及效果的观察还需要更多的研究证实。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics〔J〕.CA Cancer J Clin,2011,61(2):69-90.
[2] Zhou C.Lung cancer molecular epidemiology in China:recent trends〔J〕.Transl Lung Cancer Res,2014,3(2):270-9.
[3] Schiller JH,Harrington D,Belani CP,et al.Eastern Cooperative Oncology Group:Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer〔J〕.N Engl J Med,2002,346:92-98.
[4] Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib〔J〕.N Engl J Med,2004,350:2129-2139.
[5] Santos E,Martin-Zanca D,Reddy EP,et al.Malignant activation of a K-ras oncogene in lung carcinoma but not in normal tissue of the same patient〔J〕.Science,1984,223(4637):661-664.
[6] Soda M,Choi YL,Enomoto M,et al.Identification of the transforming EML4 ALK fusion gene in non-small-cell lung cancer〔J〕.Nature,2007,448(7153):561-566.
[7] Choi YL,Takeuchi K,Soda M et al.Identification of novelisoforms of the EML4 ALK transforming gene in non small cell lung cancer〔J〕.Cancer Res,2008,68(13):4971-4976.
[8] Zhu CQ,Sants GC,Ding K,et al.Role of KRAS and EGFR as biomarkers of response to erlotinib in National Cancer institute of Canada Clinical Trial Group study BR.21〔J〕.Journal of Clinical Oncology,2008,26(26):4268-4275.
[9] Gainor JF,Varghese AM,Ou SH,et al.ALK rearrangements are mutually exclusive with mutations in EGFR and KRAS in non-small cell lung cancer〔J〕.Clin Cancer Res,2013,19(15):4273-81
[10] Devesa SS,Bray F,Vizcaino AP,et al.International lung cancer trends by histologic type:male:female differences diminishing and adenocarcinoma rates rising〔J〕.Int J Cancer,2005,117:294-299.
[11] Choi YH,Lee JK,Kang HJ,et al.Association between age at diagnosis and the presence of EGFR mutations in female patients with resected non-small cell lung cancer〔J〕.J Thorac Oncol,2010,5:1949-1952.
[12] Dearden S,Stevens J,Wu YL,et al.(2013) Mutation incidence and coincidence in non small-cell lung cancer:meta-analyses by ethnicity and histology (mutMap)〔J〕.Ann Oncol,2013,24(9):2371-2376.
[13] Dogan S,Shen R,Ang DC,et al.Molecular epidemiology of EGFR and KRAS mutations in 3,026 lung adenocarcinomas:higher susceptibility of women to smoking-related KRAS-mutant cancers〔J〕.Clin Cancer Res,2012,18(22):6169-6177.
[14] Thunnissen E,Bubendorf L,Dietel M,et al.EML4-ALK te-sting in non-small cell carcinomas of the lung:a review with recommendations〔J〕.Virchows Arch,2012,461(3):245-57.
[15] Pao W,Wang TY,Riely GJ,et al.KRAS mutations and primary resistance of lung adenocarcinomas to gefitinib or erlotinib〔J〕.PLoS Med,2005,2(1):e17.
[16] Kris M,Johnson B,Kwiatkowski D,et al.Identification of -driver mutations in tumor specimens from 1000 patients with lung adenocarcinoma:The NCI's Lung Cancer Mutation Consortium (LCMC)〔J〕.J Clin Oncol,2011,29(18 suppl):CRA7506.
[17] Justin F.Gainor,Anna M.Varghese,et al.ALK rearrangements are mutually exclusive with mutations in EGFR or KRAS:an analysis of 1,683 patients with non-small cell lung cancer〔J〕.Clin Cancer Res,2013,19(15):4273-4281.
[18] Baldi L,Mengoli MC,Bisagni A,et al.Concomitant EGFR mutation and ALK rearrangement in lung adenocarcinoma is more frequent than expected:report of a case and review of the literature with demonstration of genes alteration into the same tumor cells〔J〕.Lung Cancer,2014,86(2):291-295.
[19] Sasaki T,Koivunen J,Ogino A,et al.A novel ALK secondary mutation and EGFR signaling cause resistance to ALK kinase inhibitors〔J〕.Cancer Res,2011,71(18):6051-6060.
[20] Takeda M,Okamoto I,Fujita Y,et al.De novo resistance to epidermal growth factor receptor-tyrosine kinase inhibitors in EGFR mutation-positive patients with non-small cell lung cancer〔J〕.J Thorac Oncol,2010,5(3):399-400.
(编辑:吴小红)
InvestigationofEGFR、KRASMutationsandALKProteinFusionStatusinLungAdenocarcinomaPatients
DONGDandan,XUGang,LIFanghua,etal.
SichuanAcademyofMedicalSciences,SichuanProvincialPeople’sHospital,Chengdu,610072
ObjectiveTo evaluate the mutations of EGFR,KRAS,ALK fusion protein and their relations with clinical pathological features and stages of lung adenocarcinoma.MethodsIn a cohort of patients with lung adenocarcinoma (n=85),EGFR,KRAS mutations were detected by amplification refractory mutation system in multiple quantitative polymerase chain reaction (ARMSmultiq PCR).ALK fusion protein was screened using immunohistochemistry (IHC) conducted with an anti-ALK monoclonal antibody (clone D5F3,Ventana).ResultsThe mutation rate was 62%,15%,14% for EGFR,KRAS,ALK fusion protein in 85 lung adenocarcinoma cases,respectively.EGFR mutations were more frequently observed in female patients.KRAS mutations were more frequently detected in male patients,and smokers.ALK fusion protein was more frequently observed in younger patients,and 3/4 patients.8 cases of co-mutationswere detected.ConclusionWe have further confirmed that EGFR,KRAS mutations and ALK fusions are not mutually exclusive through the analysis of 85 lung adenocarcinoma cases.It is vital for a complete molecular analysis to be performed on all lung adenocarcinoma patients,and the possibility of multiple mutations must be taken into account when choosing targeted therapy.
Lung adenocarcinoma;EGFR;KRAS;ALK
四川省卫生厅课题基金项目(编号:120080)
610072 四川省医学科学院四川省人民医院
10.3969/j.issn.1001-5930.2017.09.001
R734.2
A
1001-5930(2017)09-1393-05
2016-09-08
2017-07-10)
