微波对骨折愈合过程中骨髓间充质干细胞迁移能力的影响
2017-11-06叶冬梅
叶冬梅,陈 琛,沈 梅
(1. 大连大学附属中山医院 康复医学科,辽宁 大连 116001;2. 大连大学医学院 解剖学教研室, 辽宁 大连 116622)
国家自然科学基金项目(81601982)
叶冬梅(1980-),女,主治医师。E-mail: shuiyan_1980@163.com
沈 梅,教授。E-mail: pyf0404@126.com
论著
10.11724/jdmu.2017.05.02
微波对骨折愈合过程中骨髓间充质干细胞迁移能力的影响
叶冬梅1,陈 琛2,沈 梅1
(1. 大连大学附属中山医院 康复医学科,辽宁 大连 116001;2. 大连大学医学院 解剖学教研室, 辽宁 大连 116622)
目的探讨微波电疗法对骨折愈合过程中骨髓间充质干细胞(BMSC)迁移能力的影响。方法将30只SD大鼠建骨折模型后随机分成两组(对照组、实验组各15只),实验组微波治疗30 d,对照组不予治疗,采用X线平片观察第10天及第30天两组大鼠骨折愈合的情况;另取3只SD大鼠分离BMSC体外培养,对照组正常培养,实验组进行0.5 W/cm2微波照射60 min,采用划痕实验、transwell小室实验评价两组BMSC的迁移能力;采用 Western-blot检测两组BMSC中HIF-1、VEGF、FGF、PDGF、IGF-1的表达。结果X线平片结果表明照射第10天对照组与实验组射线相对密度分别为(0.81±0.10)和(0.94±0.13),差异有统计学意义(P=0.02),而第30天两组分别为(0.96±0.12)和(0.99±0.09),差异无统计学意义。划痕实验对照组距离基线迁移距离(192±15)μm,实验组迁移距离(430±21)μm,差异具有统计学意义(P=0.01)。Transwell小室实验对照组迁移细胞数(68±18)个,实验组迁移细胞数(112±25)个,差异具有统计学意义(P=0.02)。Western blot结果表明,与对照组比较,实验组BMSC中HIF-1及VEGF表达显著升高(均P<0.05),而FGF、PDGF、IGF-1表达两组间差异不显著。结论微波可能通过促进骨髓间充质干细胞迁移而影响骨折愈合。
微波;骨髓间充质干细胞;缺氧诱导因子-1;骨折愈合
骨髓间充质干细胞(Bone Mesenchymal Stem cells, BMSC)是成体干细胞的一种,有自我更新及多向分化潜能[1]。现已证实骨折的修复过程中亦存在干细胞归巢[2]。微波电疗法被应用于促进骨折愈合的辅助手术及保守治疗中已有很长的历史,但缺乏对其机制的深入探讨。有研究表明脉冲电磁场可以提高细胞的定向迁移[3-4]。本研究拟观察微波对骨折愈合中BMSC迁移的影响。
1 材料和方法
1.1 动物模型建立
8周龄雄性SD大鼠30只,质量228~251 g,手术建立大鼠股骨干骨折模型。 3.5%的水合氯醛(1 mL/100 g)行腹腔麻醉,成功后剃毛、消毒、铺巾,取左下肢髌骨外侧缘纵行切口,逐层切开皮肤及部分股四头肌腱性组织,屈曲膝关节并向内侧脱位髌骨,清楚显露股骨髁间凹。利用1根5 mL注射器针头在股骨髁间凹处开口,逆行插入克氏针并沿髓腔穿至股骨粗隆间。剪断多余的克氏针,并将其远端埋于股骨髁间骨皮质下。碘伏及0.9%氯化钠溶液反复冲洗切口后,使用3-0丝线逐层缝合切口。将术毕大鼠转移到自制闭合骨折制备器载物台上,右大腿置于冲击台上,用 200 g 砝码从 17~20 cm 高处落下(根据大鼠体重适度调整),使该侧肢体股骨干骨折。全部实验大鼠于造模后立即行X线股骨正位平片评价骨折情况,确定模型建立成功。
1.2 分组与处理
将30只骨折建模大鼠随机分成两组(对照组和实验组各15只),根据既往研究[5],实验组给予2450 MHz 微波连续波型0.5 W /cm2照射,15 min/d,连续治疗30 d。对照组动物不给予微波治疗。于治疗第10天及30天,行X线评价骨折愈合情况。
1.3 BMSC分离、培养、鉴定及标记
另取正常雄性SD大鼠3只,断颈处死,取股骨和胫骨,用手术剪将股骨和胫骨的骨骺端剪掉,露出骨髓腔,用添加双抗DMEM/F12 培养基冲出骨髓,收集骨髓细胞悬液移入细胞培养瓶中。细胞培养于10%胎牛血清的DMEM/F12培养液中,定时换液并去掉未贴壁细胞。流式细胞术鉴定BMSC:CD90+、CD44+、CD45-。取生长良好的第3~7代BMSC细胞进行细胞学及分子生物学实验。
1.4 划痕实验
BMSC细胞接种于24孔板,约2×105个/孔,培养24 h长满后于细胞密集处用200 μL枪头划痕,用PBS缓冲液冲洗。根据既往研究[5],实验组给予0.5 W/cm2照射60 min,对照组不给予照射,观察并测量两组0 h及24 h后细胞迁移情况。
1.5 Transwell 小室实验
采用transwell 小室(膜孔0.8 μm),上室接种2×105个BMSC,接种后实验组给予0.5 W/cm2照射60 min,对照组不给予照射,24 h后取膜染色,200倍光镜下随机计数6个视野中细胞个数,求均值及标准差。
1.6 Western-blot检测归巢相关因子
实验组给予0.5 W/cm2照射60 min,对照组不给予照射。24 h后分别将对照组及实验组2×107细胞加入0.2 mL蛋白裂解液裂解30 min,4 ℃、3000 r/min离心20 min,取上清。BSA法测定总蛋白浓度,取等质量总蛋白(30 μg),95 °C变性10 min,经10%SDS-PAGE电泳分离蛋白质后在Bio-Rad湿转电泳槽中恒压100 V转膜70 min,5%脱脂奶粉中室温封闭1 h,一抗4 °C摇床过夜乏氧诱导因子-1α(hypoxia inducible factor 1α, HIF-1α)抗体1∶4000稀释(abcom),血管内皮生长因子(vascular endothelial growth factor, VEGF)抗体1∶2000稀释(abcom),成纤维细胞生长因子(fibroblast growth factor, FGF)抗体1∶2000稀释(Invitrogen),血小板源性生长因子(platelet-derived growth factor, PDGF)抗体1∶2000稀释(abcom),胰岛素样生长因子(insulin and insulin-like growth factor-1, IGF-1)抗体1∶3000稀释(abcom),TBS洗膜3次,每次5 min,二抗室温摇床2 h,TBS洗膜3次,每次5 min,ECL显影。以β-actin作为内参,抗体1∶4000稀释(Sigma),余步骤同上。
1.7 统计学方法

2 结 果
2.1 微波对骨折愈合的影响
照射第10天实验组骨折愈合处相对射线密度为 (0.94±0.13),与对照组(0.81±0.10)相比差异有统计学意义(P=0.02)。而第30天实验组骨折愈合处相对射线密度(0.99±0.09),与对照组(0.96±0.12)相比差异没有统计学意义(P=0.41)。见图1。
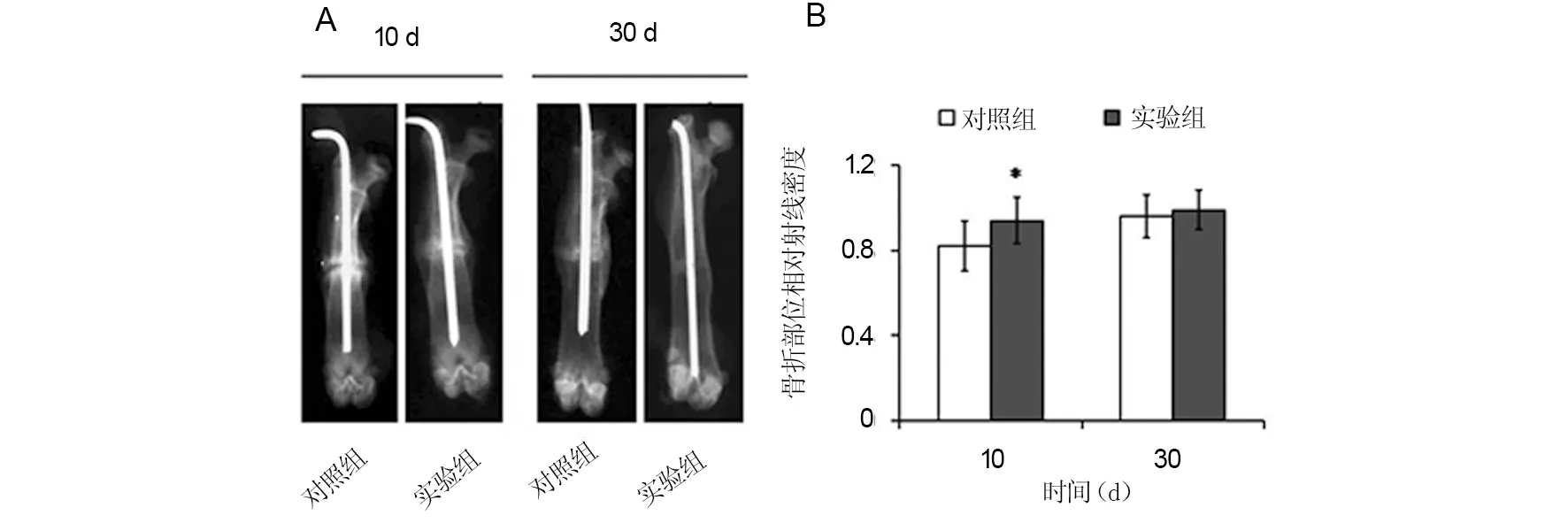
A:大鼠股骨干骨折X线股骨正位平片;B:X线摄片分析。*:与对照组比较,P<0.05图1 大鼠股骨干骨折X线摄片分析Fig 1 Radiographs of rat femur and the radiographs analysis
2.2 微波对BMSC体外迁移的影响
划痕实验24 h后计算迁移细胞数,对照组距离基线迁移距离(192±15)μm,实验组迁移距离(430±21)μm,差异具有统计学意义(P=0.01),见图2。Transwell 小室实验24 h后计算跨膜细胞数,对照组迁移细胞数(68±18)个,实验组迁移细胞数(112±25)个,差异具有统计学意义(P=0.02),见图3。
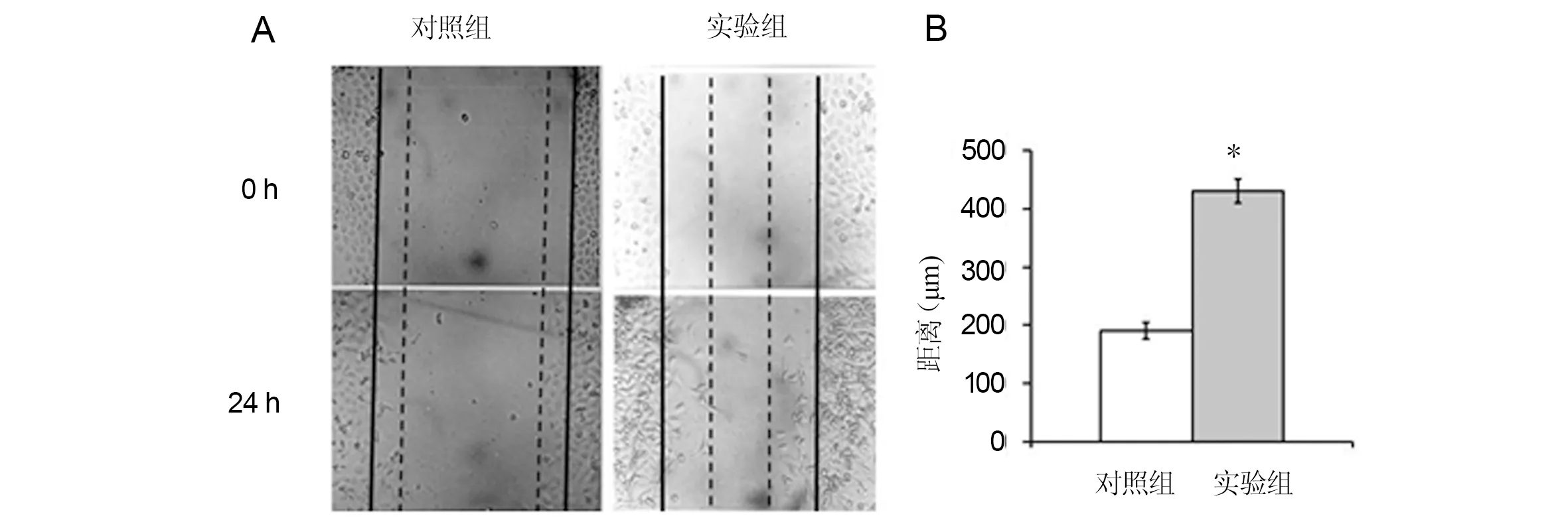
A:BMSC体外划痕实验光镜照片(×100);B:迁移距离统计分析。*:与对照组比较,P< 0.05图2 BMSC体外划痕实验Fig 2 In vitro scratch assay for BMSC
2.3 微波照射与BMSC因子表达
Western blot检测发现,与对照组比较,微波照射后BMSC中HIF-1及VEGF表达显著升高(均P<0.05)。而FGF、PDGF、IGF-1表达两组间差异无统计学意义。见图4。
3 讨 论
研究表明,在骨折修复过程中源于干细胞的骨组织修复超过15%,而骨髓则是骨缺损修复的干细胞的重要来源[6]。在局部微环境的诱导下,BMSC向某些特异性组织聚集、迁移,诱导分化成组织修复所需的细胞,促进损伤组织的修复,这一过程称为归巢[7]。骨修复过程需要在骨折处聚集足够数量的BMSC迁移至损伤处。研究表明,骨折发生后外周血中BMSC增多,3 d后达到高峰,表明动员全身各处的间充质干细胞归巢到骨折处也是骨折良好修复的早期事件。
微波疗法被应用于辅助手术及保守治疗促进骨折愈合。本研究结果表明,微波对骨愈合的促进作用在骨折愈合早期(10 d)作用较为明显。类似的结果在早前亦有报道[8]。而BMSC向骨损伤区域定向归巢是骨损伤修复过程的早期事件,因此推测微波通过影响BMSC募集、迁移而在骨折愈合早期发挥作用。
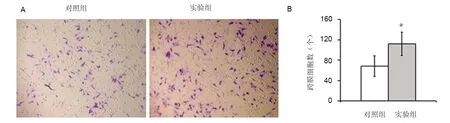
A:BMSC transwell 小室实验光镜照片(×200); B:跨膜细胞计数统计分析。*与对照组比较, P<0.05图3 BMSC transwell 小室实验Fig 3 Transwell assay for BMSC

A:BMSC骨折相关因子蛋白表达Western blot 检测结果;B:表达量统计分析。*:与对照组比较,P<0.05图4 Western blot 检测微波照射骨折愈合相关蛋白表达Fig 4 Western blot results of protein expression levels after microwave exposure
微波是一种高频电磁波,热效应是其对生物体治疗效应之一,但不合理的治疗剂量会导致热损伤。在前期研究中,为了确定微波对细胞及组织的照射安全剂量,我们采用抗干扰光纤测温仪测量不同功率微波照射细胞、局部组织温度变化,并采用光镜、电镜的方法评价照射局部组织热损伤,得出结论:低于0.5 W/cm2不会导致局部热损伤[5]。
为了验证微波是否可以影响BMSC迁移,本研究进行了划痕实验及transwell小室实验。两实验结果均表明,微波可以促进BMSC体外迁移能力。既往有研究表明脉冲电磁场可以提高卵巢癌细胞SKOV3的迁移能力[3],促进脑室底神经干细胞向白质损伤区域募集[4],促进巨噬细胞迁移至骨损伤局部[9],表明电磁场可影响细胞的定向迁移能力。
骨折愈合是一个复杂而连续的过程,从组织学和细胞学的变化,通常将其分为4个阶段:(1)血肿炎症机化期,骨折导致骨髓腔、骨膜下和周围组织血管破裂出血,血肿形成,局部逐渐清除血凝块、坏死软组织,而使血肿机化形成肉芽组织。在这个阶段成纤维细胞生长因子(fibroblast growth factor,FGF)在局部高表达,bFGF 与成骨细胞表面的受体结合后,能使其向成骨细胞转化[10]。初同伟等[11]发现VEGF在骨折愈合的早期表达量高,在骨折愈合过程中对于骨折断端的血管生成发挥了极大的作用。(2)纤维骨痂形成期,骨内、外膜增生,新生血管长入,成骨细胞大量增生,逐渐形成纤维骨痂。在这个时期,骨成型蛋白质(bone morphogenetic protein,BMP)及转化生长因子β(transforming growth factor β,TGF-β)表达逐渐达到高峰。研究发现,TGF-β能使BMP的骨诱导能力加强,能够诱导间充质细胞合成软骨特异性蛋白聚糖[12]。其中,TGF-β能抑制新的破骨细胞形成,使破骨细胞死亡,从而促进成骨细胞的增殖,刺激纤骨基质蛋白产生,刺激新骨质形成,刺激骨钙化[13]。(3)骨性骨痂形成期,成骨细胞合成并分泌骨基质,使骨折端内、外形成的骨样组织逐渐骨化,形成新骨,由骨内、外膜紧贴骨皮质内、外形成内骨痂和外骨痂,骨痂不断钙化加强,当其达到足以抵抗肌收缩及成角剪力和旋转力时,则骨折已达到临床愈合[10]。此期,骨保护素、I型胶原、骨钙素等基因表达上调,促进骨痂钙化[14]。(4)骨板形成塑形期,原始骨痂中新生骨小梁增粗,排列逐渐规则和致密,原始骨痂被板层骨所替代,使骨折部位形成坚强的骨性连接。这一过程是骨组织力学塑性的过程,随着肢体活动和负重,使多余的骨痂被吸收而清除,髄腔重新沟通,骨折回复正常骨结构[13]。本研究Western blot检测了骨折早期相关因子的表达,结果表明 HIF-1表达显著升高。研究表明,在缺氧条件下骨痂组织中包括成骨细胞在内可调节细胞缺氧反应的重要的转录因子HIF-1表达增多,从而促进其下游的多种因子(如SDF-1/CXCR4、ERK1/2等)上调[15]。HIF-1 是细胞在低氧条件下产生的核蛋白,它与靶基因结合,促进其转录。既往研究结果表明,微波辐射上调大鼠脑HIF-1α表达,可通过ERK及PI3K通路上调HIF-1的活性[16-17]。因此,微波可能通过HIF-1介导增加BMSC迁移能力而促进骨折愈合。
[1] Ross CL, Siriwardane M, Almeida-Porada G, et al. The effect of low-frequency electromagnetic field on human bone marrow stem/progenitor cell differentiation [J]. Stem Cell Res,2015,15(1): 96-108.
[2] Bi L, Wang G, Yang D, et al. Effects of autologous bone marrow-derived stem cell mobilization on acute tubular necrosis and cell apoptosis in rats [J]. Exp Ther Med, 2015, 10(3):581.
[3] Wang Q, Wu W, Chen X, et al. Effect of pulsed electromagnetic field with different frequencies on the proliferation, apoptosis and migration of human ovarian cancer cells [J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi,2012, 29(2):291-295.
[4] Sherafat MA, Heibatollahi M, Mongabadi S, et al. Electromagnetic field stimulation potentiates endogenous myelin repair by recruiting subventricular neural stem cells in an experimental model of white matter demyelination [J]. J Mol Neurosci, 2012, 48(1):144-153.
[5] Ye D, Xu Y, Fu T, et al. Low dose of continuous-wave microwave irradiation did not cause temperature increase in muscles tissue adjacent to titanium alloy implants—an animal study [J]. BMC Musculoskelet Disord, 2013, 23(14):364.
[6] Sharma S, Sapkota D, Xue Y, et al. Adenoviral Mediated Expression of BMP2 by Bone Marrow Stromal Cells Cultured in 3D Copolymer Scaffolds Enhances Bone Formation [J]. PLoS One,2016,25,11(1):e0147507.
[7] Sung LY, Chen CL, Lin SY, et al. Efficient gene delivery into cell lines and stem cells using baculovirus [J]. Nat Protoc, 2014, 9(8):1882-1899.
[8] Olchowik G, Gaweda R, Blacha J. The influence of microwave monochromatic radiation on bone fracture union in rabbits [J]. Chir Narzadow Ruchu Ortop Pol, 1992, 57(4-6): 297-300.
[9] Fan W, Qian F, Ma Q, et al. 50 Hz electromagnetic field exposure promotes proliferation and cytokine production of bone marrow mesenchymal stem cells [J]. Int J Clin Exp Med, 2015,15,8(5):7394-7404.
[10] Quan L, Xia L, Zhao LL. Improved Healing Effect of Mandibular Fracture by bFGF Delivery System[J]. J Or Sci Res, 2011, 27(12):1045-1048.
[11] 初同伟, 王正国, 朱佩芳,等. 骨折愈合过程中血管内皮生长因子及其受体的表达[J]. 中华创伤杂志, 2001, 17(6):344-346.
[12] Zhang Y, Shibi LU, Wang J. Experimental study of expression of BMP, TGF-β and bFGF in fracture healing[J]. Chinese J Traumatol, 2000.
[13] Einhorn TA, Gerstenfeld LC. Fracture healing: mechanisms and interventions[J]. Nat Rev Rheumatol, 2015, 11(1):45-54.
[14] 邓晔坤, 顾军, 周晓中,等. 低剂量照射促进骨痂矿化的机制[J]. 中华实验外科杂志, 2013, 30(7):1377-1379.
[15] Dong-Feng Z, Ting L, Cheng C, et al. Silencing HIF-1α reduces the adhesion and secretion functions of acute leukemia hBMSC [J]. Braz J Med Biol Res,2012,45(10):906-912.
[16] 王旭, 胡向军, 彭瑞云,等. 高功率微波辐射对大鼠脑HIF-1α 表达影响[J]. 中国公共卫生, 2007, 23(10):1161-1163.
[17] Zhao L, Yang YF, Gao YB, et al. Upregulation of HIF-1α via activation of ERK and PI3K pathway mediated protective response to microwave-induced mitochondrial injury in neuron-like cells [J]. Mol Neurobiol, 2014, 50 (3):1024-1034.
MicrowavetherapypromotingfracturehealingbyenhancingBMSCsmigration
YE Dongmei1, CHEN Chen2, SHEN Mei1
(1.DepartmentofRehabilitation,AffiliatedZhongshanHospitalofDalianUniversity,Dalian116001,China;2.DepartmentofAnatomy,MedicalCollegeofDalianUniversity,Dalian116622,China)
ObjectiveThe current studied aimed to study the effect of microwave to the migration of BMSC during the healing of fracture.MethodsThirty animals were divided into two groups (15 in each group). For the treatment group, it was provided a 30-day microwave therapy of (0.5 W/cm2, 60 min/d) , but not for the control group. The effect of microwave therapy on fracture repair in a rat femoral fracture model was evaluated by X-ray on the 10th and 30th day. To identify the influence of microwave on BMSCs migration, the scratch assay and transwell assay were employed in vitro. A preliminary study of factors expression by western blot including HIF-1, VEGF, FGF, PDGF and IGF-1.ResultsThe Radiographic density of the fracture gap were (0.81±0.10) for control group and (0.94±0.13) for treatment group. Radiographic assessments showed that fracture healing was accelerated especially on the 10th day of the microwave treatment (P=0.02) but not statistically significant at 30th day (0.96±0.12) and (0.99±0.09),P>0.05). In scratch test, the migration distance of BMSC was (192±15)μm in control group and (430±21)μm in treatment group (P=0.01). In transwell test, the number of transmembrane cells were (68±18) in control group and (112±25) in treatment group (P=0.02). The results of scratch and transwell assay indicated that the BMSCs migration was promoted by microwave. HIF-1 and VEGF protein expression levels increased after microwave exposure (eachP<0.05). But there was no significant difference in the expression of FGF, PDGF and IGF-1 with or without microwave exposure (eachP>0.05) .ConclusionMicrowave therapy promoting fracture healing by enhancing bmscs migration.
microwave;BMSC;HIF-1;fracture healing
R683.42
A
1671-7295(2017)05-0423-05
叶冬梅,陈琛,沈梅.微波对骨折愈合过程中骨髓间充质干细胞迁移能力的影响[J].大连医科大学学报,2017,39(5):423-427.
2016-12-04;
2017-09-20)
