3个中华鳖群体遗传多样性的微卫星标记分析
2017-11-03何吉祥吴本丽孙和权宋光同陈贵生王晓健
陈 静,何吉祥,黄 龙,吴本丽,孙和权,宋光同,陈贵生,王晓健
(1.安徽省农业科学院水产研究所,安徽 合肥 230031;2. 安庆市西江水产养殖股份有限公司,安徽 安庆 246053;3. 安徽省巢湖市柘皋镇农业综合服务站,安徽 合肥 238000;4.安徽省合肥市长丰县杜集乡农业综合服务站,安徽 合肥 231100)
3个中华鳖群体遗传多样性的微卫星标记分析
陈 静1,何吉祥1,黄 龙1,吴本丽1,孙和权2,宋光同1,陈贵生3,王晓健4
(1.安徽省农业科学院水产研究所,安徽 合肥 230031;2. 安庆市西江水产养殖股份有限公司,安徽 安庆 246053;3. 安徽省巢湖市柘皋镇农业综合服务站,安徽 合肥 238000;4.安徽省合肥市长丰县杜集乡农业综合服务站,安徽 合肥 231100)
为了给武昌湖中华鳖的遗传资源保护和利用提供较为准确的基础数据,利用微卫星标记技术,对中华鳖武昌湖野生群体和2个养殖群体进行遗传多样性分析。结果显示:武昌湖鳖群体、日本鳖群体、黄沙鳖群体的平均等位基因数(Na)分别为11.5、9.1、7.9,平均有效等位基因数(Ne)分别为6.3、3.7、3.1,平均观测杂合度(Ho )分别为 0.5667、0.5222、0.4462,平均期望杂合度(He)分别为0.6987、0.5953、0.5648,多态信息含量(PIC)分别为 0.6672、0.5551、0.5303,武昌湖群体遗传多样性较高。基于Nei’s遗传距离和遗传分化指数显示,目前武昌湖群体中华鳖种质资源保存较好。
中华鳖;武昌湖;荧光SSR;遗传多样性;遗传分化
中华鳖(Pelodiscus sinensis)蛋白质含量高,营养丰富,肉味鲜美,鳖甲、头、肉、血、胆等均可入药,具有较高的经济价值和药用价值,是食疗滋补的上品[1]。中华鳖产量由1993年0.44万t提高到2015年34.16万t,一度成为集约化程度最高、养殖效益最好的产业之一,在水产养殖业中具有重要地位。
遗传多样性是物种生存适应和发展进化的前提。一个居群或物种的遗传多样性越高或遗传变异越丰富,对环境变化的适应能力就越强。了解物种的遗传变异,有利于对其种质资源管理保护和开发利用[2]。随着中华鳖养殖业的迅猛发展,出现了种群混杂、种质退化等现象,严重影响其遗传多样性。
武昌湖位于安徽省西南部安庆市望江县东北部,湖泊水面广阔、资源丰富,是重要的水产基地之一,在2008年被确定为中华鳖国家级水产种质资源保护区,近年来采取了增殖、放养等措施保证野生中华鳖的数量。但由于缺乏管理措施和有效的鉴定手段,一些人工养殖的中华鳖混入武昌湖,两者的基因发生一定程度的交流,破坏野生中华鳖完整遗传信息的保留。刘阳等[2]、张至允等[3]对中华鳖的代表性群体黄河鳖、黄沙鳖、日本鳖、淮河鳖、洞庭湖鳖、鄱阳湖鳖、太湖鳖等群体进行了遗传变异的微卫星分析,尚未见对中华鳖武昌湖群体的遗传多样性研究。本研究以养殖日本鳖群体和黄沙鳖群体为参照,采用微卫星分子标记技术对武昌湖野生中华鳖进行遗传多样性分析,以期通过对武昌湖鳖的种质鉴定了解其遗传结构特征,为其遗传资源的保护和利用提供较为准确的相关信息和依据。
1 材料与方法
1.1 试验材料
2016年5月6日,于武昌湖采集野生中华鳖30只,在安庆市西江水产养殖股份有限公司采集日本鳖30只和黄沙鳖31只,剪取少许裙边,放在装有酒精的EP管中,带回实验室于-20℃贮存备用。
1.2 试验方法
1.2.1 基因组DNA提取 采用天根生化科技(北京)有限公司的组织基因组提取试剂盒(DP304)提取基因组 DNA,通过1%琼脂糖凝胶电泳检测完整性后,用紫外分光光度计检测DNA的纯度和浓度,并稀释至10 ng/μL,-20℃保存备用。
1.2.2 微卫星检测 从刘阳等[2]、张志允等[3]、张群英等[4]公开发表的中华鳖微卫星标记中选取12个,由生工生物工程(上海) 股份有限公司合成引物。各对引物的正向引物5′端分别带有FAM(蓝色)或HEX(绿色)的特异性荧光标记用于测算扩增目的条带大小。
PCR反应体系为15 μL,包括模板DNA 1 μL,10×buffer 1.5 μL,MgCl2(25 mmol/μL)1.5 μL,dNTPs (10 mmol/μL)各0.3 μL,上下游引物(10 pmol/μL)各 0.15 μL,TaqDNA 聚合酶(5 U/μL) 0.3 μL。PCR 反应程序为:94℃预变性 3 min;94℃ 30 s,55℃ 15 s,72℃ 30 s,35个循环;72℃延伸3 min。
将10倍稀释的PCR产物1.5 μL、ROX 500内标0.25 μL和超纯去离子甲酰胺12.5 μL充分混匀后,95℃变性5 min,迅速冰浴3 min,置ABI 3700XL测序仪进行毛细管电泳检测。
1.2.3 数据统计及分析 用 Genographer 软件根据分子量大小对扩增结果读带,统计每个引物在不同个体中的扩增情况。利用PopGene 32进行统计分析,计算各群体每个微卫星位点的等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、群体间遗传距离(Da)、遗传分化指数(Fst)。利用Picalc程序包计算各引物的多态信息含量(PIC)。基于Nei’s遗传距离利用MEGA 5软件进行UPGMA聚类分析。
2 结果与分析
2.1 微卫星引物扩增结果
供试的12对微卫星引物特征和扩增结果见表1。12个位点在3个中华鳖群体中表现出稳定的多态性,共检测到182个等位基因,其平均等位基因数(Na)、平均有效等位基因数(Ne)、平均观测杂合度(Ho)、平均期望杂合度(He)、多态信息含量(PIC)分别为9.5、4.38、0.5116、0.6196、0.5842。
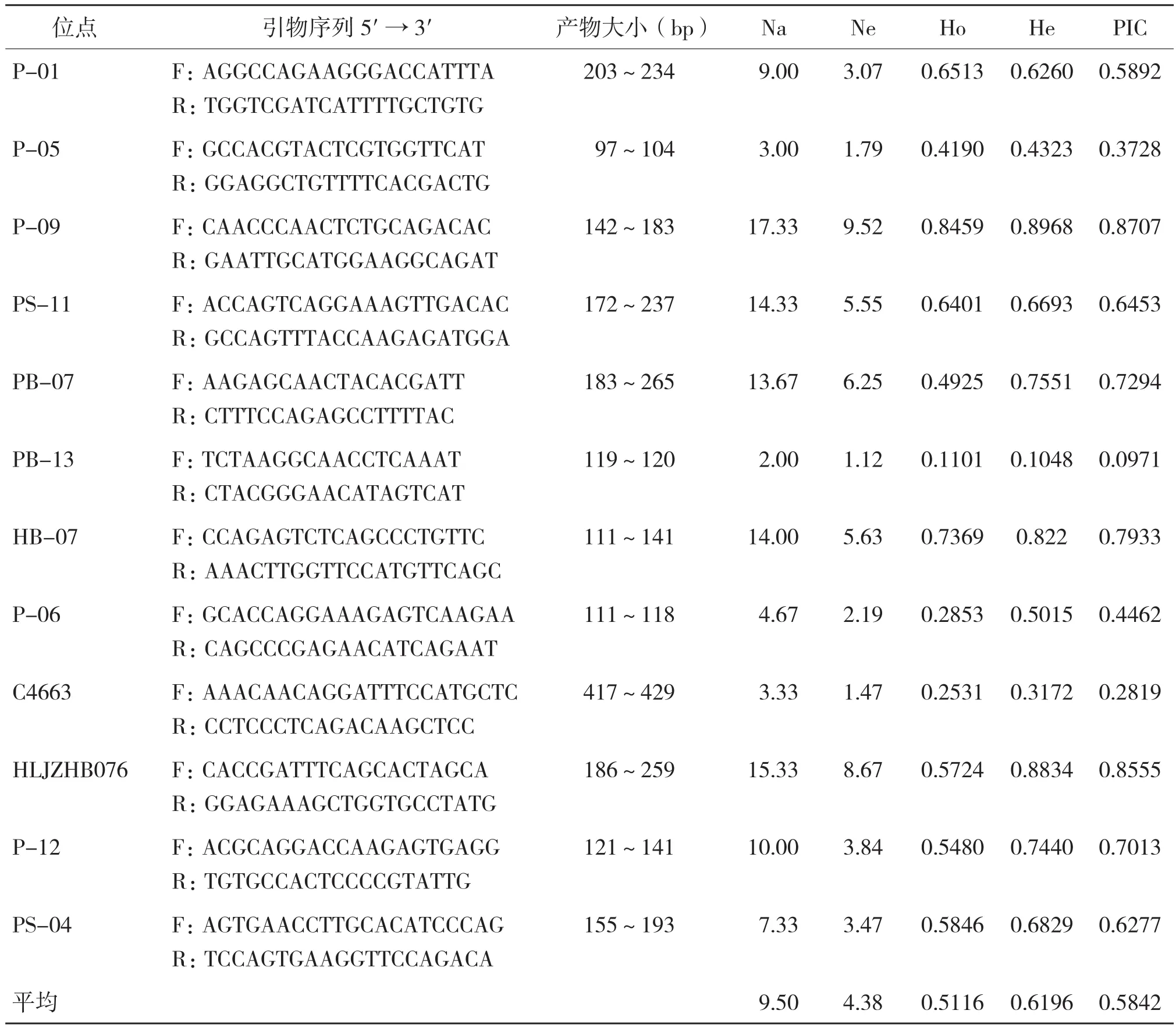
表1 12对微卫星引物扩增结果
2.2 遗传多样性分析
武昌湖鳖(WC)、日本鳖(RB)和黄沙鳖(HS)的遗传多样性参数见表2。3个群体平均等位基因数(Na)分别为11.5、9.08、7.92,平均有效等位基因数(Ne)分别为6.28、3.73、3.13,平均观测杂合度(Ho)分别为0.5667、0.5222、0.4462,平均期望杂合度(He)分别为0.6987、0.5953、0.5648,多态信息含量(PIC)分别为0.6672、0.5551、0.5303。
2.3 群体间的遗传变异
3个中华鳖群体间的遗传距离Da和遗传分化指数Fst见表3。日本鳖群体和黄沙鳖群体遗传距离最小(0.1417),武昌湖群体和黄沙鳖群体遗传距离最大(0.4760),遗传距离结果与Fst结果相符合。依据Nei’s遗传距离构建聚类图,结果(图1)表明,日本鳖群体和黄沙鳖群体首先聚为一支,然后再与武昌湖鳖群体聚为一支。

图1 基于遗传距离的3个中华鳖群体的UPGMA聚类图

表2 3个中华鳖群体的遗传多样性参数

表3 3群体中华鳖的遗传距离和遗传分化指数
2.4 Hardy-Weinberg 平衡分析
12个微卫星位点Hardy-Weinberg平衡χ2检验概率值P及遗传偏离指数D值见表4。36个群体位点组合中(3群体×12位点),18个位点为显著偏离,不符合Hardy-Weinberg平衡。36个群体位点组合中,25个群体位点组合D>0,表现为杂合子过剩,其余11个群体位点表现为杂合子缺失(D<0)。

表4 Hardy-Weinberg 平衡χ2 检验概率值(P)与遗传偏离指数(D)
3 讨论
3.1 荧光SSR分型更高效更准确
微卫星标记是分布于真核生物基因组中的简单重复序列(simple sequence repeats,SSRs),也称短串联重复序列(simple tandem repeats,STRs)。因其在基因组中分布广泛,具较高的多态性,呈共显性遗传等特点被广泛应用于水产生物种群遗传多样性分析、种质资源保护、遗传图谱建立和 QTL 定位等研究中[5-6]。传统的SSR片段分离采用聚丙烯酰胺凝胶电泳加银染或放射显影的方法,费时费力且分辨率较低。本研究利用目前被广泛采用的毛细管电泳技术,通过荧光标记的PCR引物扩增微卫星位点区域序列,利用ABI 遗传分析仪对荧光标记的DNA 片段进行毛细管电泳检测,结合分子量内标计算DNA片段长度,使SSR分型更高效与准确[7]。
3.2 中华鳖武昌湖群体遗传多样性较高
有效等位基因数(Ne)作为群体遗传变异的一个测度,反映某座位等位基因频率分布的均匀程度。各等位基因频率分布越均匀,群体整齐度和群体遗传一致性越高,遗传多样性就越低。本研究中武昌湖群体、日本鳖群体、黄沙鳖群体平均有效等位基因数分别为6.28、3.73、3.13,武昌湖群体有效等位基因数比其他两个群体略高,说明武昌湖群体遗传多样性高于日本鳖群体和黄沙鳖群体。
杂合度又称为基因多样度,一般被认为是度量群体遗传变异的最适参数。就相同的分子标记而言,群体平均杂合度的高低反映了群体的遗传一致性程度[8]。若群体平均杂合度高于0.5,表明该群体未受到高强度的选择,拥有丰富的遗传多样性;若群体平均杂合度低于0.5,表明该群体遗传多样性较低。该研究中,武昌湖群体、日本鳖群体、黄沙鳖群体平均期望杂合度(He)分别为 0.6987、0.5953、0.5648,日本鳖群体和黄沙鳖群体略低于武昌湖群体,日本鳖群体和黄沙鳖群体长期人工养殖定向选育有关。张志允等[3]分析得出黄河鳖、淮河鳖、洞庭湖鳖、鄱阳湖鳖、太湖鳖的平均期望杂合度分别为 0.618、0.5515、0.5997、0.5904、0.5796;刘阳等[2]得出洞庭湖鳖、黄河鳖、黄沙鳖、日本鳖的平均期望杂合度分别为0.5194、0.5121、0.4955、0.4278。综上比较而言,本研究中3个中华鳖群体的杂合度均具有较高水平,尤其是武昌湖鳖群体保持了较高的遗传多样性。
多态信息含量(PIC)是一个评价基因座位在群体中的多样性程度的标准,平均PIC是衡量等位基因片段多态性的理想指标。当PIC>0.5时,该位点为高度多态位点;当0.25<PIC<0.50时,为中度多态位点;当PIC<0.25时,为低度多态位点[9]。该研究中武昌湖群体、日本鳖群体、黄沙鳖群体的PIC分别为0.6672、0.5551、0.5303,表明3个中华鳖群体的多态性属于高度多态位点。张志允等[3]分析得出黄河鳖、淮河鳖、洞庭湖鳖、鄱阳湖鳖、太湖鳖的PIC分别为 0.5406、0.4872、0.5328、0.5206、0.5117;刘阳等[2]研究得出洞庭湖鳖、黄河鳖、黄沙鳖、日本鳖的PIC 分别为 0.456、0.423、0.43、0.402。总的来说,本研究中3个中华鳖群体的PIC值较高,遗传多样性较高。
3.3 3个中华鳖群体间的遗传变异
群体间的遗传关系一般表示为以等位基因频率计算的2个群体之间的遗传距离,2个群体之间的变异主要由分化时间的长短决定。Crawford 等[10]指出由微卫星得出的遗传距离更能反映分化时间的长短,群体间遗传距离越小,表示群体间的分化时间越短,群体间的遗传关系越近,群体间遗传变异性越低,相似系数就越大。遗传分化指数是检测群体间遗传分化程度的重要指标之一[11]。本研究中,武昌湖鳖群体与日本鳖群体、黄沙鳖群体的遗传距离分别为0.3522、0.4760,遗传距离较大,同时遗传分化指数也较大,说明武昌湖鳖和养殖的中华鳖遗传分化程度较大,遗传混杂少,种质保存较好。
3.4 基因型分布偏离Hardy-Weinberg平衡的原因
本研究所检测的36个位点当中,有18个位点的基因型分布偏离了Hardy-Weinberg 平衡,25个位点表现为杂合子过剩,11 个位点表现为杂合子缺失,表明群体内基因频率发生了较大改变。杂合子过剩现象一般出现在研究对象为相对小的群体或者封闭群体中,即一个养殖群体中的子代群体是由有限的亲本所产生,创造者效应和瓶颈效应会导致连锁不平衡现象,而在一个大的稳定群体中,连锁不平衡现象几乎为零[12],而杂合子缺失则可能与自然选择、种群内交、无效等位基因和稀有等位基因丢失等原因有关[13]。本研究中,日本鳖和黄沙鳖两个养殖群体经过若干代闭锁繁育和近亲繁殖,导致杂合子过剩和缺失现象,而武昌湖野生群体,也出现连锁不平衡现象,可能与种群近亲繁殖或少许养殖中华鳖混入有关,一些位点隐性有害基因纯合可致个体死亡,使纯合子的频率减少,杂合子的频率增加,从而在某些位点上产生了杂合子过剩的现象,而如果有些位点的隐性纯合子是存活的,这就增加了该位点纯合子的频率,减少了杂合子的频率,从而在该位点上产生了杂合子缺失的现象。因此,有必要进一步加强武昌湖自然保护区的中华鳖保护,防止瓶颈效应发生,保证其充足的亲本数量和较高的遗传多样性。
[1]杨振才,牛翠娟,孙儒永. 中华鳖生物学研究进展[J]. 动物学杂志,1999,34(6):41-44.
[2]刘阳,史燕,朱新平,等. 中华鳖5个群体遗传多样性的微卫星分析[J]. 基因组学与应用生物学,2012,31(2):141-146.
[3]张志允,谢中富,李亚根,等. 中华鳖黄河群体选育F3与大陆代表性群体遗传变异的微卫星分析[J]. 海洋渔业,2013,35(4):439-447.
[4]张群英,黄鹤忠,袁文成,等. 中华鳖(Pelodiscus sinensis)EST-SSR标记与生长性状相关性分析[J]. 海洋与湖沼,2013,44(6):1654-1660.
[5]Chauhan T,Rajiv K. Molecular markers and their applications in fisheries and aquaculture[J].Adv Biosci Biotechnol,2010,1(4):281-291.
[6]Bornman D M,Hester M E,Schuetter J M,et al.Short-read,high-throughput sequencing technology for STR gene typing[J]. Biotechniques,2012,4(1):1-6.
[7]孙成飞,叶星,董浚键,等. 罗氏沼虾6个养殖群体遗传多样性的微卫星分析[J].南方水产科学,2015,11(2):20-26.
[8]荣敏,杨福合,邢秀梅,等. 利用微卫星分析中国家兔的遗传多样性[J].遗传育种,2008,44(7):1-5.
[9]Bostein D,Wllite R L,Skolnick M,et al .Construction of a genetic linkage map in man using restriction fragment length polymorphism(Argopecten irradians)[J]. The American Journal of Human Genetics,1980,32:314-331.
[10]Crawford A M,Littlepohn R P. The use of DNA marker indeciding conservation priorities in sheep and other livestock[J]. Animal Genetic Resources Information,1998,23:21-26.
[11]曾滔,赵福平,王光凯,等. 基于群体分化指数FST的绵羊全基因组选择信号检测[J]. 畜牧兽医学报,2013,44(12):1891-1899.
[12]Sved J A. The stability of linked systems of loci with a small population size[J]. Genetics,1968,59:543-563.
[13]Suci A,Uthairat N N,Worawut K. Study of genetic diversity of orange spotted grouper,Epinephelus coioides,from Thailand and Indonesia using microsatellite markers[J].Marine Biotechnology,2005,8(1):1-10.
Microsatellite marker analysis of genetic diversity in three populations of Trionyx sinensis
CHEN Jing1,HE Ji-xiang1,HUANG Long1,WU Ben-li1,SUN He-quan2,SONG Guang-tong1,CHEN Gui-sheng3,WANG Xiao-jian4
(1. Fishery Research Institute,Anhui Academy of Agricultural Sciences,Hefei 230031,China;2. Anqing Xijiang Fishery Limited Corporation,Anqing 246053,China;3. Agricultural Comprehensive Service Station of Zhegao Town,Chaohu City,Anhui Province,Hefei 238000,China;4. Agricultural Comprehensive Service Station of Duji Countyside,Changfeng County,Hefei City,Anhui Province,Hefei 231100,China)
To provide more accurate basic data for the genetic resources ofTrionyx sinensisof Wuchang lake,and protect and utilize their germplasm resources,microsatellite marker technology was used to analyze the genetic diversity ofT. sinensisfrom wild population of Wuchang lake and two breeding populations as experimental objects. The results showed that the average number of alleles( Na)for the three populations were 11.5,9.1 and 7.9 respectively,average effective numbers of alleles( Ne) were 6.3,3.7 and 3.1 respectively,average observed heterozygosity ( Ho) were 0.5667,0.5222 and 0.4462 respectively,average expected heterozygosity( He) were 0.6987,0.5953 and 0.5648 respectively and the average polymorphism information content( PIC) were 0.6672,0.5551 and 0.5303 respectively,the genetic diversity of Wuchang Lake population was higher,the Nei’s genetic distance and genetic differentiation showed that the germplasm resources preservation of Wuchang Lake population was better now.
Trionyx sinensis;Wuchang Lake;fluorescent SSR marker;genetic diversity;genetic differentiation
S917.4
A
1004-874X(2017)07-0141-06
陈静,何吉祥,黄龙,等.3个中华鳖群体遗传多样性的微卫星标记分析[J].广东农业科学,2017,44(7):141-146.
2017-05-02
安徽省科技攻关项目(1604a0702018);安庆市科技计划项目;安徽省农业科学院成果推广项目(16E0505);安徽省水产产业技术体系( 皖农科[2016]84号)
陈静(1985-), 女, 硕士, 助理研究员, E-mail: chenjingok5@163.com
何吉祥(1975-), 男, 硕士, 副研究员, E-mail: hejixiang813@126.com
(责任编辑 崔建勋)
