黑果枸杞多糖对中波紫外线诱导HaCaT细胞光损伤的保护作用
2017-11-02任立汆加杨娥燕华玲王永郭砚哈筱梅朱世文王刚810000西宁青海大学附属医院皮肤科
任立汆 加杨娥 燕华玲 王永 郭砚 哈筱梅 朱世文 王刚810000西宁,青海大学附属医院皮肤科
·论著·
黑果枸杞多糖对中波紫外线诱导HaCaT细胞光损伤的保护作用
任立汆 加杨娥 燕华玲 王永 郭砚 哈筱梅 朱世文 王刚810000西宁,青海大学附属医院皮肤科
目的探讨黑果枸杞多糖对HaCaT细胞光损伤的预防作用及机制。方法采用超声辅助水提法提取柴达木黑果枸杞中的多糖成分。体外培养的HaCaT细胞分为3组,对照组:正常培养,不做其他处理;中波紫外线(UVB)组:30 mJ/cm2UVB照射;实验组:30 mJ/cm2UVB照射前6 h加入2 g/L黑果枸杞多糖溶液。照射1 h后继续培养12 h,倒置显微镜观察细胞形态,MTS法测定细胞增殖,流式细胞仪测定细胞凋亡率,酶标法检测细胞丙二醛和谷胱甘肽过氧化物酶含量、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力,ELISA法检测上清液和细胞中白细胞介素1(IL⁃1)和肿瘤坏死因子α(TNF⁃α)水平。结果与对照组相比,UVB组细胞形态模糊不清,出现死亡漂浮现象;实验组细胞肿胀,但形态尚清楚。MTS结果显示,3组间细胞增殖吸光度值差异有统计学意义(F=48.88,P<0.01),其中UVB组(1.72±0.12)显著低于对照组(2.34±0.11),实验组(2.11±0.10)又显著高于UVB组,差异均有统计学意义(P<0.05)。UVB组细胞凋亡率(82.41%±2.49%)显著高于对照组(3.98%±0.19%)和实验组(22.79%±0.97%),实验组细胞凋亡率明显高于对照组,各组间比较差异均有统计学意义(均P<0.05)。UVB组与对照组比较,丙二醛含量明显上升,SOD活性、谷胱甘肽过氧化物酶含量、CAT活性明显下降(均P<0.05)。同时,UVB组较对照组上清液中IL⁃1和TNF⁃α含量及细胞中TNF⁃α含量均明显升高(均P<0.05),但细胞中IL⁃1差异无统计学意义(P>0.05)。结论黑果枸杞多糖对HaCaT细胞的光损伤有保护作用,其保护机制可能与减少细胞炎症物质的合成和分泌及减少自由基有关。
枸杞;多糖类;角蛋白细胞;紫外线;氧化性应激;白细胞介素1;肿瘤坏死因子α
柴达木黑果枸杞生长于青海柴达木盆地海拔2 600~3 000 m沙漠地带,系茄科枸杞属,可食用可入药,《晶珠本草》中记载黑果枸杞用于治疗心脏病、停经等病症[1]。已有研究证实[2⁃6],黑果枸杞中富含花色素,可以消除自由基,抗氧化。黑果枸杞多糖是黑果枸杞果实中发挥生物学作用的重要成分之一,目前研究大多集中在降血糖、抗疲劳、调节免疫等方面,抗衰老、抗氧化方面研究较少。中波紫外线(UVB)是引起皮肤光老化的主要因素,我们探讨黑果枸杞多糖对UVB诱导HaCaT细胞光损伤的保护作用及其机制。
材料与方法
一、主要试剂及仪器
柴达木黑果枸杞(青海某茶行),HaCaT细胞(南京凯基生物科技发展有限公司)。胎牛血清、DMEM[英潍捷基(上海)贸易有限公司],双抗、胰酶、MTS比色法试剂盒(北京索莱宝科技有限公司),细胞丙二醛、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH⁃Px)、过氧化氢酶(CAT)测定试剂盒(南京建成生物工程研究所),肿瘤坏死因子α(TNF⁃α)试剂盒(武汉基因美生物科技有限公司),人白细胞介素1(IL⁃1)试剂盒(北京城林生物科技有限公司),X⁃Mark型BIO⁃RAD酶标仪(美国BIO⁃RAD公司),TL20W/12紫外线UVB灯管(荷兰Philips公司),UVB辐照度监示器(台湾路昌电子企业股份有限公司)。
二、实验方法
1.黑果枸杞多糖的提取:称取干燥后粉碎的黑果枸杞粉末50 g,加三氯甲烷∶甲醇(2∶1)500 ml,60℃回流脱脂2次,每次40 min;过滤后滤渣加入80%乙醇500 ml,70℃回流脱小分子糖、苷类物质及黄酮类物质2 h,重复2次;滤渣中加入蒸馏水(液固比20∶1),72 ℃、200 W超声30 min,重复3次,收集上清液;旋转减压浓缩上清液后加入95%乙醇至浓度为80%,搅拌,4℃过夜。6 000×g离心10 min,将沉淀再溶于蒸馏水中,即得粗多糖溶液。加入粗多糖溶液20%体积的Sevag试剂(三氯甲烷∶正丁醇=5∶1),振荡20 min,6 000 ×g离心10 min,收集上清液,重复3次。上清液旋转蒸发浓缩后冷冻干燥,获得枸杞多糖粉末。
2.黑果枸杞多糖含量测定:①制备对照品溶液:精密称取干燥至恒重的葡萄糖对照品50 mg,加蒸馏水至50 ml,摇匀,即得1 g/L的对照品溶液;②待测溶液的配制:精确称取黑果枸杞多糖粉末50 mg,加蒸馏水至50 ml,摇匀,即得待测溶液;③确定最大吸收波长:精确吸取对照品溶液和待测溶液各1.0 ml,加入5%苯酚溶液1 ml,摇匀,迅速加入浓硫酸5 ml,混匀,室温静置30 min待其冷却。以蒸馏水为空白组,在400~600 nm波长范围内使用酶标仪分别扫描对照品和待测溶液,确定最大吸收波长为485 nm;④绘制标准曲线:分别精确吸取对照品溶液1、2、3、4、5 ml,加双蒸水至50 ml,在485 nm波长下测各浓度葡萄糖的吸光度(A值),做葡萄糖标准曲线(y=5.96 x+0.1163,R2=0.9978);⑤测定多糖的含量:分别精确移取枸杞多糖溶液1 ml,蒸馏水定容于25 ml容量瓶,吸取1 ml枸杞多糖溶液,在485 nm下测A值,由回归方程计算多糖含量为0.3 mg,所得粉末中黑果枸杞多糖含量为30%。以含10%胎牛血清的DMEM培养基为溶剂配制黑果枸杞多糖溶液,并用0.22 μm孔径过滤器过滤,现配现用。
3.细胞培养及实验分组:以含10%胎牛血清的DMEM为培养基(含10 U/ml青霉素和10 U/ml链霉素),将HaCaT细胞接种于培养瓶后,置于37℃、5%CO2饱和湿度培养箱中,当细胞达90%融合时传代,取处于对数生长期的细胞用于实验。当HaCaT细胞达到85%~90%融合时,将培养瓶内的细胞按每孔1×106个细胞分别铺板到96孔板或6孔板中继续培养。当细胞达80%~90%融合时,将HaCaT细胞随机分为3组,即对照组(正常培养,不做其他处理)、UVB组(30 mJ/cm2UVB照射)和实验组(2 g/L黑果枸杞多糖溶液+30 mJ/cm2UVB照射)。实验组于UVB照射前6 h将2 g/L黑果枸杞多糖溶液加入细胞培养基中,对照组用锡纸包住置暗处。照射前,打开UVB组和实验组的细胞培养板盖,在预设好的UVB辐射仪中照射1 h,然后用无菌磷酸盐缓冲液(PBS)洗3遍,加入含10%胎牛血清的DMEM培养基。
UVB剂量选择:96孔板内HaCaT细胞达到80% ~90%融合时,在室温下,分别采用0、10、20、30、40、50、60、70、80、90 mJ/cm2UVB照射细胞,照射后均培养12 h,MTS检测细胞增殖率。以未照射组细胞增殖率为100%,计算各组细胞增殖率,增殖率 =[1-(A对照组-A照射组)/A对照组]× 100%,选择增殖率为50%的实验组的UVB照射剂量为实验剂量,即30 mJ/cm2。
黑果枸杞多糖溶液浓度选择:加入含不同浓度(0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8 g/L)黑果枸杞多糖的培养基6 h后,吸出各组培养基,用少量无菌PBS覆盖,在预设好的UVB辐射仪中照射1 h,然后用PBS洗3遍,加入DMEM培养基继续培养12 h后进行MTS法检测细胞增殖率,根据检测结果,选择最佳浓度1.6 g/L,此时增殖率最高。再用1、1.2、1.4、1.6、1.8、2、2.2、2.4 g/L黑果枸杞多糖重复上述试验,根据检测结果,选择增殖率最高的2 g/L作为实验浓度。
4.MTS法检测细胞增殖:96孔板内HaCaT细胞达到80%~90%融合时,将细胞进行如上分组处理,继续培养12 h,显微镜下观察。每孔加入MTS溶液20 μl,37 ℃、5%CO2培养箱继续孵育3 h。终止培养后,酶标仪上选择490 nm波长测定并记录各孔A值。每组单独重复6次。
5.流式细胞仪检测细胞凋亡:6孔板内HaCaT细胞达到80%~90%融合时,将细胞进行如上分组处理后,继续培养12 h,用不含乙二胺四乙酸(EDTA)的胰酶消化,提前预冷的PBS洗2次,将细胞重悬于100 μl缓冲液,加入5 μl膜联蛋白V⁃异硫氰酸荧光素和5 μl碘化丙锭(PI),轻轻混匀,避光室温反应15 min,加入400 μl缓冲液,1 h内用流式细胞仪检测。
6.酶标法检测丙二醛、SOD、GSH⁃Px和CAT:6孔板内HaCaT细胞达到80%~90%融合时,对各组细胞处理同上。培养12 h后,收集上清液及细胞,按照试剂盒测定说明检测SOD和CAT活性、GSH⁃Px和丙二醛含量。每组单独重复6次。
7.ELISA法检测IL⁃1和TNF⁃α:6孔板内HaCaT细胞达到80%~90%融合时,将细胞进行如上分组处理。培养12 h后,收集上清液,胰酶消化,PBS洗3次,离心收集细胞,分别按照试剂盒说明检测上清液及细胞中IL⁃1和TNF⁃α水平,每组单独重复6次。
三、统计学处理
采用SPSS20.0统计学软件,正态分布的计量资料以±s表示。采用单因素方差分析进行多组间比较,采用Student⁃Newman⁃Keuls(SNK)分析进行两两组间比较,P<0.05为差异有统计学意义。
结 果
一、黑果枸杞多糖预处理对UVB诱导的HaCaT细胞增殖抑制的影响
如图1所示,与对照组细胞相比,UVB组细胞形态模糊不清,出现死亡漂浮现象;实验组细胞肿胀,但形态尚清楚。3组间细胞增殖(A值)差异有统计学意义(F=48.88,P<0.01)。UVB组细胞增殖(A值)(1.72±0.12)显著低于对照组(2.34±0.11),差异有统计学意义(P<0.05),实验组(2.11±0.10)显著高于UVB组(P<0.05),但实验组与对照组间差异无统计学意义(P>0.05)。实验组细胞增殖率(90.38%±0.61%)显著高于UVB照射组(73.67%±2.25%),差异有统计学意义(t=17.55,P<0.05)。
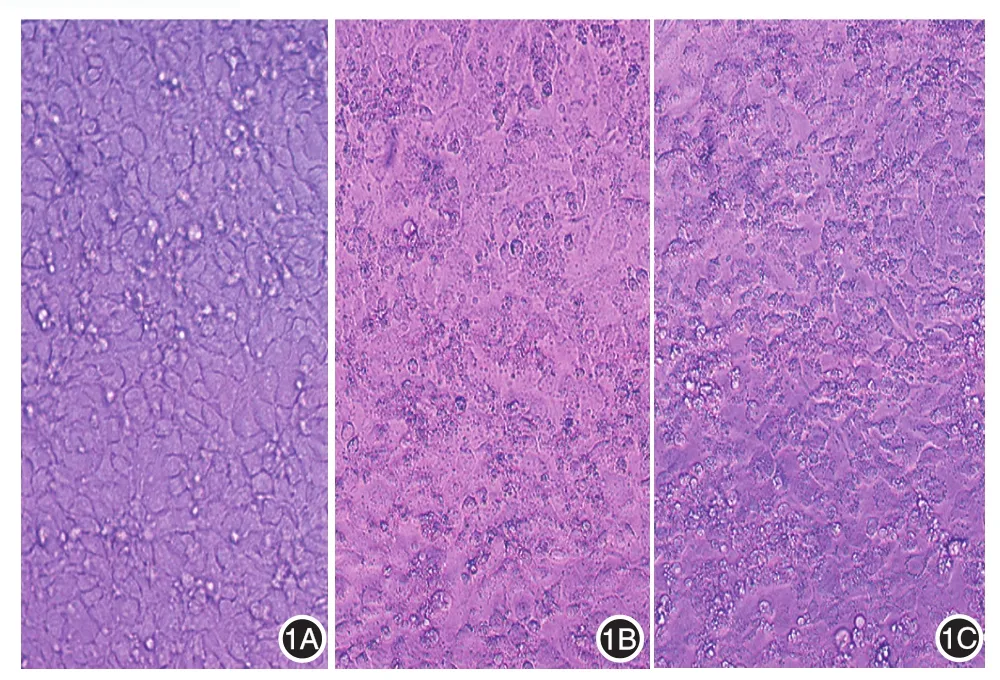
图1 倒置显微镜下观察黑果枸杞多糖和中波紫外线(UVB)对HaCaT细胞形态的影响(×400) 1A:对照组细胞贴壁生长,形态清楚;1B:UVB组细胞形态模糊不清,出现核固缩及死亡漂浮现象;1C:实验组细胞肿胀,但形态尚清楚
二、黑果枸杞多糖预处理对UVB诱导HaCaT细胞凋亡的影响
如图2所示,UVB组细胞凋亡明显高于对照组和实验组,3组间细胞凋亡率差异有统计学意义(F=4 526.48,P<0.01)。UVB组细胞凋亡率(82.41%±2.49%)显著高于对照组(3.98%±0.19%)和实验组(22.79%±0.97%),实验组细胞凋亡率明显高于对照组,各组间比较差异均有统计学意义(P< 0.05)。
三、黑果枸杞多糖预处理对UVB照射HaCaT细胞丙二醛、SOD、GSH⁃Px和CAT表达的影响
如表1所示,UVB组与对照组比较,丙二醛含量明显上升,SOD活性、GSH⁃Px含量、CAT活性明显下降(均P<0.05)。实验组与UVB组比较,丙二醛含量明显降低,SOD活性、GSH⁃Px含量、CAT活性明显升高(均P<0.05)。
四、黑果枸杞多糖预处理对UVB照射HaCaT细胞IL⁃1和TNF⁃α表达的影响
如表1所示,UVB组与对照组比较,上清液中IL⁃1和TNF⁃α含量及细胞中TNF⁃α含量均明显升高(均P<0.05),细胞中IL⁃1差异无统计学意义(P>0.05)。实验组与UVB组比较,上清液及细胞中TNF⁃α含量明显下降,细胞中IL⁃1升高(均P<0.05),上清液中IL⁃1差异无统计学意义(P>0.05)。
讨 论
枸杞多糖在黑果枸杞中含量较低,但相对分子量大、结构复杂,现研究分离纯化的多糖成分有水溶性多糖LRGP1、阿拉伯半乳聚糖蛋白(LRGP3)、LRGP4⁃A和免疫活性果胶(LRGP5),LRGP4⁃A1⁃4为中性多糖,LRGP5为酸性多糖[7]。Lv等[8]在黑果枸杞中分离出LRP4⁃A,后者主要由鼠李糖、阿拉伯糖、葡萄糖和半乳糖(1∶7.6∶0.5∶8.6)及微量的木糖构成。Gong等[1]研究显示,黑果枸杞多糖中的LRGP3可以恢复环磷酰胺处理的小鼠血清中IL⁃2、IL⁃6和TNF⁃α的水平及T细胞和B细胞的免疫应答,说明黑果枸杞多糖具有潜在的免疫作用。
细胞凋亡为细胞对外界损伤的重要防御机制。本研究显示,UVB辐射HaCaT细胞后,细胞形态模糊不清,可见死亡漂浮细胞,细胞增殖下降,细胞凋亡率明显升高。黑果枸杞多糖预处理后的实验组与未经处理的UVB照射组相比,HaCaT细胞形态明显恢复,细胞增殖率升高,凋亡率也明显降低。提示黑果枸杞多糖能保护HaCaT细胞抑制UVB诱导的细胞凋亡。

图2 流式细胞仪检测各组HaCaT细胞凋亡 UVB组(2B)细胞凋亡率明显高于对照组(2A)和实验组(2C)
表1 各组HaCaT细胞丙二醛含量、SOD活性、GSH⁃Px含量、CAT活性及IL⁃1和TNF⁃α水平比较(±s)

表1 各组HaCaT细胞丙二醛含量、SOD活性、GSH⁃Px含量、CAT活性及IL⁃1和TNF⁃α水平比较(±s)
注:n=6。a:UVB组与对照组比较,P < 0.05;b:实验组与UVB组比较,P < 0.05。SOD:超氧化物歧化酶;GSH⁃Px:谷胱甘肽过氧化物酶;CAT:过氧化氢酶;IL⁃1:白细胞介素1;TNF⁃α:肿瘤坏死因子α
组别对照组UVB组实验组F值P值丙二醛含量(nmol/g)2.13±0.32 4.01±0.28a 1.07±0.34b 131.93<0.01 SOD活性(U/mg)27.53±5.98 16.77±3.27a 25.53±5.17b 7.92<0.01 GSH⁃Px含量(μmol/g)30.03±4.23 14.25±2.48a 23.06±2.72b 35.83<0.01 CAT活性(U/ml)25.17±3.32 8.50±2.34a 16.93±2.57b 54.21<0.01 IL⁃1(ng/L)上清液11.67±1.76 21.62±2.69a 20.48±5.77 12.23<0.01细胞24.45±7.10 24.48±8.46 37.10±2.03b 7.61<0.01 TNF⁃α(ng/L)上清液13.36±1.84 21.21±2.78a 14.45±2.15b 20.62<0.01细胞4.30±1.07 11.47±0.96a 5.04±0.78b 104.03<0.01
UVB对皮肤的损伤主要与其产生的活性氧簇(ROS)造成的氧化应激有关。人体内酶类抗氧化系统主要由SOD、GSH⁃Px和CAT等体内自生的抗氧化酶组成。当紫外线过量照射时,SOD和CAT活力、GSH⁃Px含量均下降,细胞对ROS清除能力下降,皮肤内产生较多的ROS,体内的氧化与抗氧化系统平衡遭到破坏,多余ROS可引起皮肤组织内脂质、DNA、蛋白质等成分的损伤,破坏皮肤细胞结构及各种生物代谢功能,从而引起光老化、诱发皮肤癌等[9]。丙二醛是膜过氧化最重要的产物,它的产生还能加剧膜损伤,因此可作为膜受损程度的检测指标。ROS可触发线粒体内膜上的小孔道开放,水分子进入线粒体基质使之肿胀,导致外膜破裂,从而导致细胞凋亡[10]。本研究显示,UVB照射HaCaT细胞后,丙二醛含量明显上升,SOD活力、GSH⁃Px含量、CAT活力明显下降,说明UVB辐射后细胞出现氧化损伤。黑果枸杞多糖预处理后的实验组较未经处理的UVB照射组SOD活力、GSH⁃Px含量、CAT活力明显升高,丙二醛含量明显下降,提示黑果枸杞多糖可提高细胞清除氧自由基的能力,减轻ROS所致的细胞损伤,说明黑果枸杞多糖通过抗氧化作用保护HaCaT细胞,减轻UVB引起的光损伤。
本研究显示,UVB辐射细胞后,细胞内IL⁃1含量无明显变化,但上清液中IL⁃1、上清液及细胞中TNF⁃α含量明显升高。Marionnet研究显示[11],UVB照射对角质形成细胞内IL⁃1无影响,但可增加IL⁃1及TNF⁃α的释放,本研究结果与之相符。紫外线照射可使角质形成细胞释放IL⁃1和TNF⁃α,这些细胞因子具有介导炎症反应、调节免疫应答和诱导细胞凋亡等生物学作用[12]。IL⁃1诱导细胞的凋亡并通过激活JNK和p38MAPK途径抑制细胞分化[13]。TNF与细胞表面的死亡受体TNFR1结合,TNFR1与衔接蛋白肿瘤坏死因子受体1结合蛋白(TRADD)通过各自的死亡结构域(DD)结合,形成由TNF、TNFR1、TRADD组合的蛋白复合物,该复合物可结合其他衔接蛋白如Fas相关死亡结构域蛋白(FADD)、RIP缔合的ICH⁃1/ced⁃3同源死亡结构蛋白(RAIDD),最后RAIDD 激活 caspases⁃8和 caspases⁃2促进细胞凋亡[14]。本研究中,黑果枸杞多糖预处理的UVB照射组较未经处理的实验组HaCaT细胞及上清液中TNF⁃α含量均降低,细胞中IL⁃1含量升高,上清液中IL⁃1无明显变化。提示黑果枸杞多糖可通过降低HaCaT细胞TNF⁃α合成和释放及促进IL⁃1合成来减轻细胞凋亡,从而保护HaCaT细胞免受UVB引起的损伤。
综上所述,黑果枸杞多糖预处理可减轻UVB辐射对HaCaT细胞的氧化损伤及炎症反应,从而减少细胞凋亡。但我们未进行凋亡相关蛋白的检测,未证实黑果枸杞多糖具体通过何种途径发挥这种作用,这些尚需进一步研究。
[1]暴凤伟,郭武艳,邳馨,等.黑果枸杞的生物活性研究进展[J].中国执业药师,2014,11(7):31⁃34.DOI:10.3969/j.issn.1672⁃5433.2014.07.008
[2]汪建红,陈晓琴,张蔚佼.黑果枸杞果实多糖降血糖生物功效及其机制研究[J].食品科学,2009,30(5):244⁃248.DOI:10.3321/j.issn:1002⁃6630.2009.05.056.
[3]Ni W,Gao T,Wang H,et al.Anti⁃fatigue activity of polysac⁃charides from the fruits of four Tibetan plateau indigenous medicinal plants[J].J Ethnopharmacol,2013,150(2):529⁃535.DOI:10.1016/j.jep.2013.08.055.
[4]Gong Y,Wu J,Li ST.Immuno⁃enhancement effects ofLycium ruthenicumMurr.polysaccharide on cyclophosphamide⁃induced immunosuppression in mice[J].Int J Clin Exp Med,2015,8(11):20631⁃20637.
[5]Duan Y,Chen F,Yao X,et al.Protective effect ofLycium ruthenicum Murr.against radiation injury in mice[J].Int J Environ Res Public Health,2015,12(7):8332⁃8347.DOI:10.3390/ijerph120708332.
[6]艾则孜江·艾尔肯,田志浩,冯孟鑫,等.黑果枸杞质量标准研究[J].西北药学杂志,2015,(3):236⁃241.DOI:10.3969/j.issn.1004⁃2407.2015.03.006.
[7]夏园园,莫仁楠,曲玮,等.黑果枸杞化学成分研究进展[J].药学进展,2015,39(5):351⁃356.
[8]Lv X,Wang C,Cheng Y,et al.Isolation and structural characteri⁃zation of a polysaccharide LRP4⁃A fromLycium ruthenicum Murr[J].Carbohydr Res,2013,365:20 ⁃25.DOI:10.1016/j.carres.2012.10.013.
[9]Gęgotek A,Rybałtowska⁃Kawałko P,Skrzydlewska E.Rutin as a mediator of lipid metabolism and cellular signaling pathways interactions in fibroblasts altered by UVA and UVB radiation[J/OL].Oxid Med Cell Longev,2017,2017:4721352(2017⁃01⁃12)[2017⁃02⁃20].http://www.pubmedcentral.org.DOI:10.1155/2017/4721352.[Published online ahead of print Jan 12,2017]
[10]Nasu K,Nishida M,Kawano Y,et al.Aberrant expression of apoptosis⁃related molecules in endometriosis:a possible mecha⁃nism underlying the pathogenesis of endometriosis[J].Reprod Sci,2011,18(3):206⁃218.DOI:10.1177/1933719110392059.
[11]Marionnet AV,Chardonnet Y,Viac J,et al.Differences in responses of interleukin⁃1 and tumor necrosis factor alpha production and secretion to cyclosporin⁃A and ultraviolet B⁃irradiation by normal and transformed keratinocyte cultures[J].Exp Dermatol,1997,6(1):22⁃28.DOI:10.1111/j.1600⁃0625.1997.tb00141.x.
[12]Fan X,Duan Q,Ke C,et al.Cefradine blocks solar⁃ultraviolet induced skin inflammation through direct inhibition of T⁃LAK cell⁃originated protein kinase[J].Oncotarget,2016,7(17):24633 ⁃24645.DOI:10.18632/oncotarget.8260.
[13]Guo C,Yang XG,Wang F,et al.IL⁃1α induces apoptosis and inhibits the osteoblast differentiation of MC3T3⁃E1 cells through the JNK and p38 MAPK pathways[J].Int J Mol Med,2016,38(1):319⁃327.DOI:10.3892/ijmm.2016.2606.
[14]李敏,林俊.细胞凋亡途径及其机制[J].国际妇产科学杂志,2014,41(2):103⁃107.
Protective effect of polysaccharides from Lycium ruthenicum Murray against ultraviolet B radiation⁃induced photodamage in HaCaT cells
Ren Licuan,Jia Yang′e,Yan Hualing,Wang Yong,Guo Yan,Ha Xiaomei,Zhu Shiwen,Wang Gang
Department of Dermatology,Qinghai University Affiliated Hospital,Xining 810000,China
Yan Hualing,Email:yhlckw@163.com
ObjectiveTo evaluate preventive effect of polysaccharides fromLycium ruthenicumMurray against photodamage in HaCaT cells,and to explore its possible mechanism.MethodsUltrasound⁃assisted extraction was used to extract polysaccharides fromLycium ruthenicumMurray in Qaidam Basin.In vitrocultured HaCaT cells were randomly divided into 3 groups:control group receiving no treatment,ultraviolet B(UVB)group irradiated with 30 mJ/cm2UVB alone for 1 hour,experimental group pretreated with 2 g/LLycium ruthenicumpolysaccharide solution followed 6 hours later by 30 mJ/cm2UVB radiation for 1 hour.At twelve hours after UVB radiation,an inverted microscope was used to observe cell morphology.Then,MTS assay was performed to estimate cell proliferation,flow cytometry to detect cell apoptosis,an enzyme⁃labeled antigen method to detect levels of malondialdehyde(MDA)and glutathione peroxidase(GSH⁃Px),as well as to evaluate the activity of superoxide dismutase(SOD)and catalase(CAT),and enzyme⁃linked immunosorbent assay(ELISA)to measure levels of interleukin⁃1(IL⁃1)and tumor necrosis factor⁃alpha(TNF⁃α)in HaCaT cells and their culture supernatant.ResultsCompared with the control group,the UVB group showed obscure cell morphology,cell death and floating phenomenon,while cells became swollen but remained morphologically distinct in the experimental group.MTS assay revealed that the cell proliferative activity significantly differed among the above 3 groups(F=48.88,P< 0.01),and the cell proliferative activity was significantly lower in the UVB group(1.72 ± 0.12)than in the control group(2.34±0.11,P<0.05)and experimental group(2.11±0.10,P<0.05).Moreover,the apoptosis rate was significantly higher in the UVB group(82.41% ±2.49%)than in the control group(3.98% ±0.19%,P<0.05)and experimental group(22.79% ± 0.97%,P< 0.05),as well as higher in the experimental group than in the control group(P< 0.05).Compared with the control group,the UVB group showed significantly higher levels of MDA,supernatant levels of IL⁃1 and TNF⁃α,and intracellular levels of TNF⁃α,but significantly lower GSH⁃Px levels and activity of SOD and CAT(allP< 0.05).However,there was no signifi⁃cant difference in the intracellular level of TNF⁃α between the UVB group and control group(P> 0.05).ConclusionLycium ruthenicumpolysaccharide has protective effects against photodamage in HaCaT cells,likely by reducing the synthesis and secretion of inflammatory substances as well as free radicals.
Lycium barbarum;Polysaccharides;Keratinocytes;Ultraviolet rays;Oxidative stress;Interleukin⁃1;Tumor necrosis factor⁃alpha
燕华玲,Email:yhlckw@163.com
10.3760/cma.j.issn.0412⁃4030.2017.07.010
青海省科技计划项目(2014⁃ZJ⁃756)
Fund program:Science and Technology Planning Project of Qinghai Province of China(2014⁃ZJ⁃756)
2016⁃09⁃12)
(本文编辑:周良佳 颜艳)
