不同类型连接肽对β-甘露聚糖酶AuMan5A酶学性质的影响
2017-11-01王春娟唐诗涵邬敏辰董运海杭宜岭李剑芳
王春娟, 唐诗涵, 邬敏辰, 董运海, 杭宜岭, 李剑芳
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
不同类型连接肽对β-甘露聚糖酶AuMan5A酶学性质的影响
王春娟1, 唐诗涵1, 邬敏辰*2, 董运海1, 杭宜岭1, 李剑芳1
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
以柔性肽F(GGGGS)3或刚性肽R(EAAAK)3为连接肽,将海栖热胞菌27家族碳水化合物结合域(CBM27)与宇佐美曲霉5家族β-甘露聚糖酶(AuMan5A)的C末端融合,探讨不同类型连接肽对AuMan5A酶学性质的影响,获取具有优良酶学性质的融合酶。采用重叠PCR技术扩增融合酶基因Auman5A-F-cbm27和Auman5A-R-cbm27,分别将Auman5A和融合酶基因在毕赤酵母GS115中进行表达,分析表达产物reAuMan5A、reAuMan5A-F-C和reAuMan5A-R-C的酶学性质。结果表明:该3种β-甘露聚糖酶对角豆胶的Km值分别为1.7、1.9和0.9 mg/mL。3种酶的最适温度Topt分别为70、65和70℃;reAuMan5A-F-C和reAuMan5A-R-C在70℃的半衰期 t701/2分别为 36 min和 124 min,较 reAuMan5A的 (t701/2=9 min)延长了 3倍和12.8倍。reAuMan5A-R-C具有底物亲和力强、热稳定性高和pH稳定范围广等特点,在食品、饲料、医药和能源等领域有着巨大的应用潜力。
连接肽;β-甘露聚糖酶;融合酶;底物亲和力;热稳定性
自然界中多数蛋白质或酶由多个模块或结构域组成,各模块间的连接通常需要借助连接肽,以避免其互相干扰而影响整体结构的稳定及功能的发挥[1-2]。连接肽是指模块间存在的一段肽,其长度从几个到上百个氨基酸残基 (一般为5~25个)不等,常见的连接肽可分为柔性和刚性两大类[3]。柔性连接肽通常由多个非极性氨基酸 (如甘氨酸)残基和极性的丝氨酸和苏氨酸残基组成。在融合蛋白技术中最常用的柔性连接肽是由Huston等[4]提出的(GGGGS)n(n≤6)序列。刚性连接肽是由易形成稳定二级结构的氨基酸残基所组成,如许多天然的刚性连接肽形成α-螺旋结构[2]。最常用人工合成的α-螺旋刚性连接肽为(EAAAK)n(n≤6)[5]。 张献伟等[6]研究表明,当n=3时,连接肽能较好地维持酶蛋白的稳定性以及发挥其催化活性。
β-甘露聚糖酶是一种内切型水解酶 (endo-β-1,4-D-mannanases,EC 3.2.1.78), 随机切割甘露聚糖分子主链内部的β-1,4-D-甘露糖苷键,在诸多工业领域有着巨大的应用潜力[7-8]。然而,目前大多数商品化的β-甘露聚糖酶均存在催化效率低、酶学性质差和使用成本高等缺陷,严重制约了其工业化应用[9]。据文献报道,27家族碳水化合物结合域(CBM27)能特异性地结合甘露聚糖,并对β-甘露聚糖酶催化结构域具有一定的热保护作用[10]。因此,将CBM27与催化结构域融合能有效地改善β-甘露聚糖酶的酶学性质。
作者所在实验室克隆了宇佐美曲霉YL-01-78 5家族β-甘露聚糖酶基因Auman5A,由该基因编码的β-甘露聚糖酶AuMan5A是一种只含催化结构域的蛋白质[11]。作者选择柔性肽 F(GGGGS)3和刚性肽R(EAAAK)3为连接肽,构建融合β-甘露聚糖基因Auman5A-F-cbm27和Auman5A-R-cbm27。分别将Auman5A和融合酶基因在毕赤酵母GS115中表达,并分析CBM27融合前后以及不同类型连接肽对AuMan5A酶学性质的影响。结果显示,重组融合酶reAuMan5A-R-C具有优良的酶学性质,产该酶的重组酵母菌株有望用于β-甘露聚糖酶的工业化生产。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 大肠杆菌 (Escherichia coli)JM109和DH5α菌株、毕赤酵母 (Pichia pastoris)GS115菌株和表达质粒pPIC9K:购自Invitrogen公司;克隆质粒pUCm-T:购自上海Sangon公司;重组质 粒 pUCm-T-Auman5A、pUCm-T-cbm27 和pPIC9K-Auman5A:由作者所在实验室构建和保藏。1.1.2 主要试剂和培养基 限制性内切酶、rTaq DNA聚合酶、T4DNA连接酶、250 bp DNA Ladder Marker和低相对分子质量蛋白质Marker:购自大连TaKaRa公司;DNA胶回收试剂盒和Geneticin G418:购自上海Sangon公司;角豆胶和甘露糖:Sigma公司产品;DEAE Sepharose Fast Flow和Sephadex G-75:Amersham Pharmacia Biotech 公司产品;其它试剂均为分析纯。LB、MD、YPD、YPDG418、BMGY和BMMY培养基的配制参照Multi-Copy Pichia Expression Kit(Invitrogen公司) 操作手册。
1.2 方法
1.2.1 融合酶基因的扩增 根据Auman5A序列(GenBank:HQ839639) 及连接肽和 CBM27编码基因序列,设计扩增融合酶基因Auman5A-F-cbm27和Auman5A-R-cbm27所需的PCR引物,见表1,委托上海Sangon公司合成。
采用重叠PCR技术扩增Auman5A-F-cbm27和Auman5A-R-cbm27,具体流程见图1。将PCR扩增所获的融合酶基因分别与克隆质粒pUCm-T连接,分获重组质粒pUCm-T-Auman5A-F-cbm27和pUCm-T-Auman5A-R-cbm27,转化E.coli JM109,阳性转化子的测序结果与设计的一致。

表1 扩增融合酶基因Auman5A-F-cbm27和Auman5A-R-cbm27的PCR引物Table 1 PCR primers for the amplification of Auman5A-F-cbm27 and Auman5A-R-cbm27

图1 扩增融合酶基因Auman5A-F-cbm27和Auman5AR-cbm27的流程图Fig.1 Amplification of the fusion enzyme genes Auman5A-F-cbm27 and Auman5A-R-cbm27
1.2.2 重组表达质粒的构建 将pUCm-T-Auman5AF-cbm27和pUCm-T-Auman5A-R-cbm27分别用EcoRⅠ和NotⅠ双酶切,割胶回收目的条带,与经同样双酶切的pPIC9K连接,转化E.coli DH5α。经通用引物5′-AOX1和3′-AOX1 PCR筛选鉴定,送上海Sangon公司测序,测序正确的重组表达质粒分别命名为pPIC9K-Auman5A-F-cbm27和pPIC9KAuman5A-R-cbm27。
1.2.3 重组β-甘露聚糖酶的表达和纯化 分别将pPIC9K-Auman5A、pPIC9K-Auman5A-F-cbm27 和pPIC9K-Auman5A-R-cbm27用SalⅠ线性化,电转化P.pastoris GS115。重组毕赤酵母的鉴定、多拷贝筛选和诱导表达等参照Multi-Copy Pichia Expression Kit操作手册。诱导表达上清液用75%饱和度的(NH4)2SO4盐析,离心收集沉淀,溶于适量20
mmol/L NaH2PO4·Na2HPO4缓冲液(pH 7.0);经透析、超滤浓缩 (膜截留相对分子质量10 000,Millipore公司),上样DEAE Sepharose Fast Flow阴离子交换层析柱(2.0 cm×20 cm),用含 0.1~1.0 mol/L NaCl的上述磷酸缓冲液梯度洗脱,分步收集洗脱液;合并具有β-甘露聚糖酶活性的洗脱液,超滤浓缩至1.0 mL, 上样Sephadex G-75凝胶层析柱 (1.6 cm×80 cm)进行纯化。采用SDS-PAGE分析重组表达产物,Bradford法[12]测定蛋白质含量。
1.2.4 β-甘露聚糖酶活性的测定 酶活性测定参见文献[13]并略作修改。在2.4 mL 0.5 g/dL角豆胶溶液(pH 3.6、50 mmol/L柠檬酸-Na2HPO4缓冲液配制)中加入0.1 mL适当稀释的酶液,50℃反应15 min,加入2.5 mL DNS试剂,沸水浴显色7 min,测定OD540值。在上述反应条件下,1个β-甘露聚糖酶活性单位(U)定义为每分钟释放1 μmol还原糖(以甘露糖计)所需的酶量。
1.3 重组β-甘露聚糖酶酶学性质的分析
1.3.1 温度对酶活性的影响 在不同温度 (50~80℃)下,按1.2.4方法测定酶活性。最适温度Topt定义为最高酶活性(以相对酶活性100%计)所对应的温度。将酶液置于70℃下处理0~140 min,按1.2.4方法测定残余酶活性,未经处理酶液的酶活性以100%计。酶的半衰期t701/2定义为:经70℃处理残余酶活性为50%时所对应的时间。
1.3.2 pH对酶活性的影响 用pH 2.5~6的缓冲液配制0.5 g/dL角豆胶溶液,按1.2.4方法测定酶活性。最适pH定义为最高酶活性所对应的pH值。将酶液在pH 2~9.5、40℃处理60 min,按1.2.4方法测定残余酶活性。酶的pH稳定性定义为残余酶活性在85%以上所对应的pH范围。
1.3.3 酶动力学常数的测定 以1.0~10 mg/mL的角豆胶溶液(pH 3.6、50 mmol/L柠檬酸-Na2HPO4缓冲液配制)为底物,在酶各自的最适温度下按1.2.4方法测定其酶活性。采用Origin 8.0软件进行非线性拟合,计算β-甘露聚糖酶的Km和Vmax值。
2 结果与分析
2.1 重组表达质粒的构建
以 pUCm-T-cbm27为模板、F-cbm27-f和cbm27-r为引物,PCR扩增获长度约为550 bp的基因片段 Fc,见图 2泳道 1。同时以 pUCm-TAuman5A为模板、man5A-f和F-cbm27-r为引物,扩增获得长度约为1.1 kb的基因片段mF,见图2泳道2。最终采用重叠PCR技术,先以mF和Fc互为引物和模板合成完整的融合酶基因Auman5A-F-cbm27,再加入引物man5A-f和cbm27-r,扩增获得长度约为1.6 kb的Auman5A-F-cbm27,见图2泳道5。同理,采用3轮PCR扩增分别获得长度约为550 bp的 Rc、1.1 kb的 mR 和 1.6 kb的 Auman5AR-cbm27,见图2泳道3、4和6。测序结果表明,Auman5A-F-cbm27和Auman5A-R-cbm27长度均为1 610 bp,核苷酸序列与预期一致。将它们分别克隆至pPIC9K,获得重组表达质粒pPIC9KAuman5A-F-cbm27和 pPIC9K-Auman5A-R-cbm27。
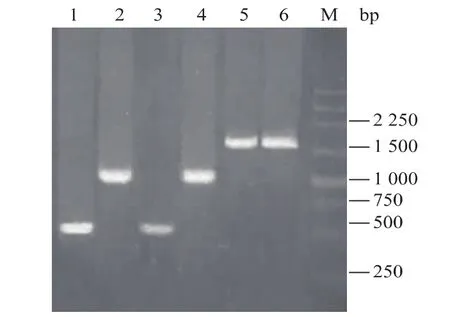
图2 PCR产物的琼脂糖凝胶电泳分析(1.0 g/dL)Fig.2 AnalysisofPCR productsby agarose gel electrophoresis(1.0 g/dL)
2.2 重组β-甘露聚糖酶的表达和纯化
挑选若干在YPD-G418(4.0 mg/mL)平板上生长良好的单菌落,按照Multi-Copy Pichia Expression Kit操作手册进行诱导表达 (30℃培养96 h,每隔24小时添加终体积分数1.0%的甲醇),按1.2.4方法测定上清液酶活性,分别筛选到3个产reAuMan5A、reAuMan5A-F-C 和 reAuMan5A-R-C活性最高的重组酵母 GS115/Auman5A、GS115/Auman5A-F-c和GS115/Auman5A-R-c,见图3泳道2~4,其表达上清液酶活性分别为33.8、29.5、18.2 U/mL,而在空白对照GS115/pPIC9K上清液中未检测到β-甘露聚糖酶活性,见图3泳道1。
分别取上述3个重组酵母的诱导表达上清液,采用(NH4)2SO4盐析、阴离子交换层析和凝胶层析进行纯化。SDS-PAGE分析显示,纯化的reAuMan5A、reAuMan5A-F-C 和 reAuMan5A-R-C分别约在49 800、58 400和58 400(表观相对分子质量)处呈现单一蛋白质条带,见图3泳道5~7。按1.2.4方法测得电泳纯酶的比活性分别为230.6、153.3、341.7 U/mg。

图3 诱导表达上清液和纯化酶的SDS-PAGE分析Fig.3 Analysisoftheexpression supernatantsand purified enzymesby SDS-PAGE
2.3 重组β-甘露聚糖酶酶学性质的分析
2.3.1 最适温度和热稳定性 按1.3.1方法分析了温度对3种β-甘露聚糖酶活性的影响,结果见图4。由图4a可见,reAuMan5A和reAuMan5A-R-C的最适温度Topt均为70℃;而reAuMan5A-F-C的Topt为65℃。由图4b可见,reAuMan5A-R-C的热稳定性最高,其t701/2长达124 min,分别是reAuMan5A-FC(t701/2=36 min)和 reAuMan5A(t701/2=9 min) 的 3.4倍和13.8倍。推测α-螺旋刚性连接肽R(EAAAK)3使得融合酶reAuMan5A-R-C的整体结构更加稳定。

图4 温度对3种重组β-甘露聚糖酶活性的影响Fig.4 Effects of temperature on the activities of three recombinant β-mannanases

图 5 pH对3种重组β-甘露聚糖酶活性的影响Fig.5 Effects of pH on the activities of three recombinant β-mannanases
2.3.2 最适pH和pH稳定性 按1.3.2方法分析了pH值对3种β-甘露聚糖酶活性的影响,结果见图5。由图5a可知,3种酶的最适pH均为4.0。由图5b可见,reAuMan5A-R-C的pH稳定范围最广(pH 2~9.5),reAuMan5A-F-C 的 次 之 (pH 2.5~8.0),reAuMan5A 的最窄(pH 2.5~7.5)。2.3.3 酶动力学常数的测定 在3种酶各自的Topt下按1.3.3方法测得reAuMan5A、reAuMan5A-F-C和reAuMan5A-R-C对角豆胶的Km值分别为1.7、1.9、0.9 mg/mL,Vmax值分别为 290.7、223.2、375.3 U/mg。与reAuMan5A相比,reAuMan5A-R-C的Km值降低了47%。推测α-螺旋刚性连接肽R较柔性连接肽F能更好地将各结构域分开并保持其独立的功能,使CBM27与底物更易结合,从而提高了酶的底物亲和力。
3 结语
融合酶在功能和应用方面有着众多的优势,如集多个功能域于一体的多功能酶;另外,在高效表达和纯化等方面融合酶也有优势[14]。构建融合酶最常用的方法有两种:直接的顺序融合和借助连接肽的顺序融合。前者将两种酶的编码基因首尾直接相连,在合适的宿主中表达[15]。然而,表达的多肽链其氨基酸残基之间的相互作用有时会影响融合酶各结构域的正确折叠,从而导致融合酶活性受损或完全丧失。研究证实,在两个结构域之间引入连接肽能弥补直接顺序融合的缺陷[3]。An等[16]将木聚糖酶XynX与葡聚糖酶Cel5Z融合,发现当XynX与Cel5Z直接顺序融合时没有酶活性,而当它们之间借助富含丝氨酸/苏氨酸的连接肽顺序融合时具有双重催化活性。连接肽的氨基酸组成、长度及是否糖基化都会影响融合酶的稳定性和功能。Guo等[17]采用不同长度的刚性连接肽(EAAAK)n(n=2~4) 将木聚糖酶和甘露聚糖酶融合,当n=3时,融合酶具有双重功能且催化效率最高。Lu等[18]研究表明,在融合酶β-葡聚糖酶-木聚糖酶(Glu-Xyl)中插入柔性 连 接 肽 (GGGGS)n(n≤3) 或 刚 性 连 接 肽(EAAAK)n(n≤3), 其活性得到明显改善, 其中(EAAAK)3使Glu和Xyl的催化效率分别高于亲本262%和31%。
作者选择 F(GGGGS)3和 R(EAAAK)3为连接肽,构建了融合酶基因Auman5A-F-cbm27和Auman5A-R-cbm27。分别将Auman5A和融合酶基因在毕赤酵母GS115中实施表达,并分析了CBM27融合前后以及两种类型连接肽对AuMan5A酶学性质的影响。结果表明,重组融合酶reAuMan5A-R-C具有底物亲和力强、热稳定性高和pH稳定范围广等特点,在食品、饲料、医药和能源等领域有着巨大的应用潜力,产该酶的重组酵母菌株有望用于β-甘 露聚糖酶的工业化生产。
[1]CHEN X,ZARO J L,SHEN WC.Fusion protein linkers:property,design and functionality[J].Advanced Drug Delivery Reviews,2013,65(10):1357-1369.
[2]GEORGE R A,HERINGA J.An analysis of protein domain linkers:their classification and role in protein folding[J].Protein Engineering,2003,15(11):871-879.
[3]HUANG Ziliang,ZHANG Chong,WU Xi,et al.Recentprogress in fusion enzyme design and applications[J].Chinese Journal of Biotechnology,2012,28(4):393-409.(in Chinese)
[4]HUSTON J S,LEVINSON D,MUDGETT-HUNTER M,et al.Protein engineering of antibody binding sites:recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli[J].Proceedings of the National Academy of Sciences of USA,1988,85(16):5879-5883.
[5]ARAI R,WRIGGERS W,NISHIKAWA Y,et al.Conformations of variably linked chimeric proteins evaluated by synchrotron X-ray small-angle scattering[J].Proteins,2004,57(4):829-838.
[6]ZHANG Xianwei,ZHANG Guanguan,WU Zhenfang,et al.Peptide linkers optimized recombinant enzyme gene of XynB-ManA and its co-expression in pK15 cells[J].Scientia Agricultura Sinica,2012,46(22):4774-4783.(in Chinese)
[7]YANG H,SHI P,LU H,et al.A thermophilic β-mannanase from Neosartorya fischeri P1 with broad pH stability and significant hydrolysis ability of various mannan polymers[J].Food Chemistry,2015,173:283-289.
[8]ALBRECHT S,VAN MUISWINKEL G C J,XU J,et al.Enzymatic production and characterization of konjac glucomannan oligosaccharides[J].Journal of Agricultural and Food Chemistry,2011,59(23):12658-12666.
[9]ZHANG Wei,WANG Yawei,CHEN Feng,et al.Gene synthesis,expression and characterization of a thermostable endo-β-1,4-mannanase[J].China Biotechnology,2014,34(8):41-46.(in Chinese)
[10]DOS SANTOS C R,PAIVA J H,MEZA A N,et al.Molecular insights into substrate specificity and thermal stability of a bacterial GH5-CBM27 endo-1,4-β-D-mannanase[J].Journal of Structural Biology,2012,177(2):469-476.
[11]TANG C,GUO J,WU M,et al.Cloning and bioinformatics analysis of a novel acidophilic β-mannanase gene,Auman5A,from Aspergillus usamii YL-01-78[J].World Journal of Microbiology and Biotechnology,2011,27(12):2921-2929.
[12]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[13]ZHAO Mei,WEI Xihuan,WANG Chunjuan,et al.Gene cloning and expression of a thermostable β-mannanase and its enzymatic properties[J].Journal of Food Science and Biotechnology,2014,33(6):590-596.(in Chinese)
[14]ZHOU B H,XING L,WU W,et al.Small surfactant-like peptides can drive soluble proteins into active aggregates[J].Microbial Cell Factories,2012,11:10.
[15]DOI N,YANAGAWA H.Design of generic biosensors based on green fluorescent proteins with allosteric sites by directed evolution[J].FEBS Letters,1999,453(3):305-307.
[16]AN J M,KIM Y K,LIM W J,et al.Evaluation of a novel bifunctional xylanase-cellulase constructed by gene fusion[J].Enzyme and Microbial Technology,2005,36(7):989-995.
[17]GUO N,ZHENG J,WU L,et al.Engineered bifunctional enzymes of endo-1,4-β-xylanase/endo-1,4-β-mannanase were constructed for synergistically hydrolyzing hemicellulose[J].Journal of Molecular Catalysis B:Enzymatic,2013,97:311-318.
[18]LU P,FENG M G.Bifunctional enhancement of a β-glucanase-xylanase fusion enzyme by optimization of peptide linkers[J].Applied Microbiologyand Biotechnology,2008,79(4):579-587.
Effects of Different Types of Peptide Linkers on the Enzymatic Properties of β-Mannanase
WANG Chunjuan1, TANG Shihan1, WU Minchen*2, DONG Yunhai1, HANGYiling1, LI Jianfang1
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi 214122,China)
A family 27 carbohydrate-binding module (CBM27)of Thermotoga maritima MSB8 was linked to the C-terminus of a glycoside hydrolase family 5 β-mannanaseof Aspergillus usamii YL-01-78 (AuMan5A) by using a flexible peptide linker F (GGGGS)3ora rigid peptide linker R(EAAAK)3.By overlapping PCR technique,twofusion enzyme genes,Auman5A-F-cbm27 and Auman5A-R-cbm27,was amplified.The gene Auman5A and two fusion genes were expressed in Pichia pastoris GS115,respectively.And then,the enzymatic properties of the recombinantβ-mannanases,reAuMan5A,reAuMan5A-F-C and reAuMan5A-R-C,were analyzed.As a result,the KmofreAuMan5A-R-C towards locust bean was 0.9 mg/mL,which was much smaller than those of reAuMan5A (1.7 mg/mL) and reAuMan5A-F-C (1.9 mg/mL).The temperature optimum (Topt) of reAuMan5A-F-C was 65℃ ,which was 5℃ lower than that(70℃ )of reAuMan5A or reAuMan5A-R-C.The half-lives at 70℃(t701/2) of reAuMan5A-F-C and reAuMan5A-R-C were 36 and 124 min,respectively,which were about 4-and 13.8 folds longer than that (t701/2=9 min) of reAuMan5A.In this study,the fusionenzymereAuMan5A-R-C was obtained with strong substrate affinity,high thermostability and wide range of pH stability.It will be a potential candidate for industrial processes,such as food,animal feed,energy,pharmaceuticals and so on.
peptide linker,β-Mannanase,fusion enzyme,substrate affinity,thermostability
TS 201.25
A
1673—1689(2017)09—0938—06
2015-04-30
国家自然科学基金项目(31271811);江苏省普通高校研究生科研创新计划项目(KYLX-1170)。
*通信作者:邬敏辰(1962—),男,江苏无锡人,理学博士,教授,博士研究生导师,主要从事酶工程与基因工程方面的研究。
E-mail:bioch@163.com
王春娟,唐诗涵,邬敏辰,等.不同类型连接肽对β-甘露聚糖酶AuMan5A酶学性质的影响[J].食品与生物技术学报,2017,36(09):938-943.
