miR-9过表达对鼻咽癌细胞迁移和侵袭的影响*
2017-11-01罗花南马思敬易春曦任晓勇
罗花南,马思敬,易春曦,高 滢,侯 瑾,闫 静,任晓勇Δ
1.西安交通大学第二附属医院(西安710004),2.西安市中心医院(西安710004)
miR-9过表达对鼻咽癌细胞迁移和侵袭的影响*
罗花南1,马思敬1,易春曦2,高 滢1,侯 瑾1,闫 静1,任晓勇1Δ
1.西安交通大学第二附属医院(西安710004),2.西安市中心医院(西安710004)
目的:探讨miR-9对鼻咽癌细胞迁移和侵袭能力的影响。方法:慢病毒悬液感染鼻咽癌C666-1细胞,流式细胞仪分选并鉴定,获得表达miR-9的C666-1细胞及对照细胞,应用体外划痕实验、Transwell侵袭实验分析miR-9对鼻咽癌C666-1细胞体外迁移、侵袭能力的影响。结果:制作划痕12 h后,穿越划痕的C666-1/miR-9细胞数(47.167±2.552)显著少于C666-1/PLVTHM细胞(95.917±3.118)(t=41.912,P<0.01);接种12 h 后,穿透基质胶的C666-1/miR-9细胞数(32.667±3.257)显著少于C666-1/PLVTHM细胞(81.833±4.366)(t=31.270,P<0.01)。结论:miR-9过表达能抑制鼻咽癌细胞的体外迁移和侵袭能力,在鼻咽癌中发挥抑癌作用。
鼻咽癌(Nasopharyngeal carcinoma,NPC)作为常见的头颈部恶性肿瘤之一,发病隐匿,且极易发生颈部淋巴结转移和远处转移。而一旦转移患者的中位生存时间则大大缩短,常不超过1年[1]。因此,探讨鼻咽癌恶性进展的分子机制,对指导鼻咽癌患者的诊疗有较大临床意义。微小RNA(microRNA,miRNA)是一类大小为22nt左右的单链非编码核糖核酸,与其靶基因mRNA的3′端非编码区互补结合后可调控靶基因的转录或翻译。目前,已有多位学者研究不同miRNA分子在鼻咽癌发病中的作用及分子机制:鼻咽癌中miR-185低表达,致WNT2B过表达,从而促进鼻咽癌的侵袭和转移[2];miR-101通过下调ITGA3的表达抑制鼻咽癌的侵袭和血管新生[3]。miR-9作为一种常见的microRNA分子,其在肿瘤的作用仍不明确。本研究前期发现miR-9的表达与鼻咽癌的发生、发展密切相关,但miR-9在鼻咽癌中的具体作用仍不清楚。因此,本研究通过慢病毒感染筛选表达miR-9的鼻咽癌细胞,明确miR-9过表达对鼻咽癌细胞恶性潜能的影响。
材料与方法
1 细胞与试剂 C666-1为常见的人鼻咽癌细胞株,由我科实验室保存。RPMI1640、胎牛血清购自美国Hyclone公司。miRNA 提取试剂盒购自美国Ambion公司,miRNA逆转录试剂盒、内参U6和miR-9的特异性探针试剂盒均购自美国ABI公司。基质胶及Transwell小室购自美国BD公司。含有PLVTHM/miR-9载体及对照PLVTHM载体的慢病毒悬液为本实验室保存,用于后续的稳定株筛选。
2 稳定过表达miR-9的细胞株筛选 用含10%新生牛血清的RPMI1640完全培养基培养C666-1细胞。将C666-1细胞接种至6孔培养板(2×105/孔),继续培养至细胞密度达40%左右,每孔中加入1 ml PLVTHM/miR-9和PLVTHM慢病毒悬液,感染12 h后更换培养基,48~72 h后在荧光显微镜下观察绿色荧光(GFP)并拍照,计算感染效率。采用流式细胞仪分选获得GFP+细胞,并继续扩大培养,使用荧光定量PCR法检测miR-9的表达,以鉴定是否筛选成功。
3 体外划痕实验 待接种到6孔板中的细胞融合至90%以上时,用枪头在培养板中垂直划线(勿倾斜,每孔至少5条线,且相互平行)。吸干培养基,用PBS洗涤细胞3次,去除划下的细胞,加入无血清培养基后,放入37 ℃ 5%CO2培养箱中继续培养。按0、6、12 h取样,计数并拍照。
4 Transwell侵袭实验 在Transwell小室的上室(24孔板)内加入200 μl预温的无血清培养基,室温下静置10 min,使基质胶再水化。胰蛋白酶消化细胞制成单细胞悬液,PBS洗涤后计数,调整细胞浓度为2.0×104/ml。取细胞悬液200 μl加至Transwell小室的上室,下室内加入500 μl含FBS的完全培养基,常规培养12 h后取出小室,去除基底膜正面的细胞,并用亚甲蓝对穿透基质胶的细胞进行染色,PBS冲洗、风干后显微镜下计数。
5 统计学方法 所有数据均采用SPSS 17.0统计学软件进行分析,用独立样本的t检验比较两样本均数的差异,P<0.05表示差异有统计学意义。
结 果
1 筛选稳定过表达miR-9的C666-1细胞 将低温保存的两种慢病毒颗粒(慢病毒PLVTHM/miR-9其滴度为3.2×105TU/ml,对照慢病毒PLVTHM其滴度为4.9×105TU/ml)分别感染C666-1细胞,72 h后荧光显微镜下观察均发出GFP,遂用流式细胞仪分选获得C666-1/PLVTHM细胞(图1A)和C666-1/miR-9细胞(图1B),两者GFP表达率均达99%以上。接着,应用荧光定量PCR法检测两组细胞其miR-9的表达水平,经2-ΔΔCt法计算后发现C666-1/miR-9中miR-9的表达水平比对照组细胞C666-1/PLVTHM高3236倍(图1C),说明稳定过表达miR-9的C666-1/miR-9细胞筛选成功。
2 miR-9过表达对C666-1细胞体外迁移能力的影响 制作划痕12 h后,穿越划痕的C666-1/miR-9细胞数(47.167±2.552)显著少于对照细胞C666-1/PLVTHM(95.917±3.118)(图2)(t=41.912,P<0.01),说明miR-9过表达可削弱鼻咽癌细胞体外迁移能力。
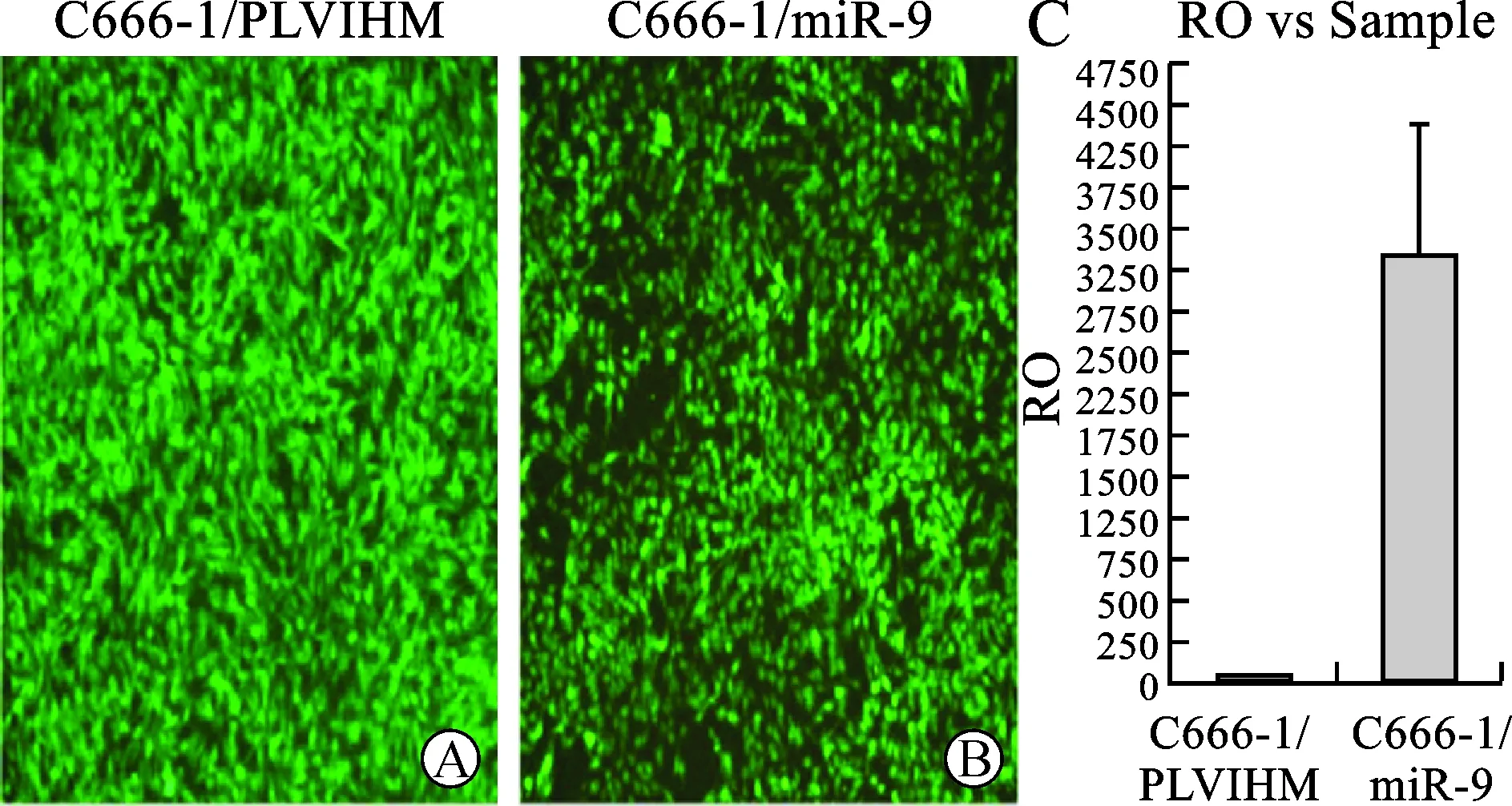
图1 稳定过表达miR-9的C666-1细胞及其对照细胞的筛选(×200)

图2 miR-9过表达对C666-1细胞体外迁移能力的影响(划痕实验)(×200)
3 miR-9过表达对C666-1细胞体外侵袭能力的影响 接种12 h后,穿透基质胶的C666-1/miR-9细胞数(32.667±3.257)显著少于对照细胞C666-1/PLVTHM(81.833±4.366)(图3)(t=31.270,P<0.01),说明miR-9过表达可削弱鼻咽癌细胞的体外侵袭能力。

图3 miR-9过表达对C666-1细胞体外侵袭能力的影响(Transwell侵袭实验)(×200)
讨 论
在肿瘤中研究miR-9作用的报道并不多见,所以关于miR-9的作用目前还存在较大争议:Sun等[4]认为miR-9可通过抑制KLF17的表达增强肝癌细胞的迁移和侵袭能力;Ma等[5]认为miR-9促进乳腺癌细胞迁移和侵袭的作用与通过β-catenin信号转导通路的活化,促进VEGF的表达和肿瘤血管的形成有关;Zheng等[6]认为miR-9可通过抑制cyclin D1和 Ets1的表达抑制胃癌细胞的增殖,而He等[7]认为miR-9通过靶向调控SDF-1/CXCR4抑制卵巢癌细胞的增殖。但是腺癌与鳞状细胞癌病理类型不同,故miR-9在上述肿瘤类型中的研究结果可能并不适用于鼻咽癌。本研究中通过细胞划痕实验和Transwell侵袭实验研究发现C666-1/miR-9细胞越过划痕区、穿过Matrigel基质胶的细胞数目较对照组C666-1/PLVTHM细胞显著减少,说明miR-9过表达可削弱鼻咽癌细胞的恶性潜能。
本研究还发现,过表达miR-9的C666-1细胞其细胞形态发生改变,由长梭形变成圆钝形,提示C666-1细胞可能发生了上皮-间质转化(EMT)。这与Ma等[5]的研究结果不同:在永生化的乳腺上皮细胞HMLE中过表达miR-9后可引起E-cadherin表达下调70%,间质标记Vimentin上调5倍,导致细胞的迁移和侵袭能力增强,相反在SUM149乳腺癌细胞中,miR-9过表达可下调E-cadherin的表达至50%,但不可诱导Vimentin和其他间质标记的表达,也不能诱导细胞纤维状形态的变化,说明miR-9对于本身不具有转移能力的正常乳腺上皮细胞,能赋予其从无到有的转移能力,而对已具有转移能力的乳腺癌细胞则无效,其具体机制还有待进一步探讨。本研究与Ma等[5]的研究结果不同可能是因为miR-9在不同的肿瘤中发挥不同的作用,但miR-9与EMT均密切相关则是两者的共同点,因此miR-9与EMT之间的相关性及其在鼻咽癌中的作用机制有待进一步明确。
[1] 王锋刚,王天昶,吴 磊,等.淋巴结转移对鼻咽癌预后的研究[J].陕西医学杂志,2016,45(4):474-477.
[2] Liu C,Li G,Ren S,etal.miR-185-3p regulates the invasion and metastasis of nasopharyngeal carcinoma by targeting WNT2B in vitro[J].Oncol Lett,2017,13(4):2631-2636.
[3] Tang XR,Wen X,He QM,etal.MicroRNA-101 inhibits invasion and angiogenesis through targeting ITGA3 and its systemic delivery inhibits lung metastasis in nasopharyngeal carcinoma[J].Cell Death Dis,2017,8(1):e2566.
[4] Sun Z,Han Q,Zhou N,etal. MicroRNA-9 enhances migration and invasion through KLF17 in hepatocellular carcinoma[J]. Mol Oncol,2013,7(5):884-894.
[5] Ma L,Young J,Prabhala H,etal. miR-9,a MYC/MYCN-activated microRNA,regulates E-cadherin and cancer metastasis[J]. Nat Cell Biol,2010,12(3):247-256.
[6] Zheng L,Qi T,Yang D,etal. microRNA-9 suppresses the proliferation,invasion and metastasis of gastric cancer cells through targeting cyclin D1 and Ets1[J].PLoS One.2013,8(1):e55719.
[7] He L,Zhang L,Wang M,etal. miR-9 functions as a tumor inhibitor of cell proliferation in epithelial ovarian cancer through targeting the SDF-1/CXCR4 pathway[J].Exp Ther Med,2017,13(4):1203-1208.
TheeffectsofmiR-9onmigrationandinvasionofnasopharyngealcarcinoma
Luo Huanan,Ma Sijing,Yi Chunxi,et al.
The Second Affiliated Hospital of Xi’an Jiaotong University(Xi’an 710004)
Objective: To investigate the effects of miR-9 on migration and invasion of nasopharyngeal carcinoma cells.Methods: After lentiviral infection in nasopharyngeal carcinoma C666-1 cell suspension,flow cytometry sorting and identification for obtaining stable overexpression of miR-9 cell lines,C666-1/miR-9 and control cells C666-1/PLVTHM were evaluated to analyze the effects of miR-9 on cell migration and invasion,using wound healing assay and transwell invasion in vitro.Results: After being made a scratch for 12h,the number of C666-1/miR-9 cells passing through the scratch(47.167±2.552) was significantly lower than that of C666-1/PLVTHM cells (95.917±3.118) (t=41.912,P<0.01); meanwhile,after being coated in the transwell champer,the number of C666-1/miR-9 cells penetrating through the Matrigel (32.667±3.257) was significantly less than that of C666-1/ PLVTHM cells (81.833±4.366) (t=31.270,P<0.01). Conclusion: Overexpression of miR-9 can inhibit the migration and invasion of nasopharyngeal carcinoma cells in vitro,indicating that miR-9 plays an important role in the inhibition of nasopharyngeal carcinoma cells.
Nasopharyngeal neoplasms Cell migration inhibition Neoplasm invasiveness @miR-9
*高等学校博士学科点专项基金资助项目(2012020110087)
陕西省社会发展科技攻关项目(2015SF044)
Δ通讯作者
鼻咽肿瘤 细胞迁移抑制 肿瘤侵润 @miR-9
R739.63
A
10.3969/j.issn.1000-7377.2017.10.004
(收稿:2017-04-04)
