钛合金表面铁氧化物膜层类Fenton催化剂制备及降解苯酚性能
2017-11-01姚忠平陈昌举王建康夏琦兴李春香姜兆华
姚忠平 陈昌举 王建康 夏琦兴 李春香,2 姜兆华
钛合金表面铁氧化物膜层类Fenton催化剂制备及降解苯酚性能
姚忠平*,1,2陈昌举1王建康1夏琦兴1李春香1,2姜兆华1
(1哈尔滨工业大学,城市水资源与环境国家重点实验室,化工与化学学院,哈尔滨 150001)(2哈尔滨工程大学,超轻材料与表面技术教育部重点实验室,哈尔滨 150001)
采用微弧氧化法在硅酸盐电解液体系中于钛合金表面成功制备了铁氧化物膜层类Fenton催化剂。采用SEM、XRD以及XPS对所得膜层的表面形貌、晶体结构及物相组成进行表征,发现膜层中含有金红石相TiO2(R-TiO2),和非晶态的铁氧化物Fe3O4;对膜层的表面形貌分析发现电解液中加入铁氰化钾后表面粗糙度及平均孔尺寸增大。以苯酚作为目标降解物,研究了膜层类Fenton催化活性,同时研究了铁源含量、苯酚浓度、H2O2投料量以及pH值对膜层降解苯酚效率的影响,优化了降解条件,研究发现在 pH 3.0、温度 30℃、H2O26.0 mmol·L-1、苯酚 35 mg·L-1及铁氰化钾含量 10 g·L-1的条件下降解 90 min,苯酚降解效率可达90%。通过对不同温度下降解苯酚的反应动力学研究,利用阿伦尼乌斯方程得到了该膜层类Fenton降解苯酚的反应活化能Ea为96.9 kJ·mol-1。最后,评价了膜层的稳定性并分析了稳定性衰减的原因。
铁氧化膜层;类Fenton催化剂;钛合金;微弧氧化;苯酚
0 引 言
近几年,工业废水的排放量及排放种类日益增多,严重威胁着生态环境以及人类的身体健康。其中来源于石油化工、塑料、杀虫剂以及医药等行业的苯酚因其高毒性以及难生物降解特性已经被美国环保署列为优先考虑的环境污染物之一[1-4]。因此,非常有必要对废水中的苯酚污染物作排放前的降解处理。
目前,废水处理技术主要包括吸附[5]、凝絮[6]、生物法处理[7]以及高级氧化法[8]等。吸附及凝絮方法一般只是将污染物附着于材料表面,而无法将其彻底降解;尽管生物法可氧化处理有机污染物,但对于稳定性高、耐久性强的污染物如苯酚无法通过生物氧化法去除。而高级氧化法可利用反应中产生的强氧化性羟基自由基来氧化降解难生物降解的污染物而受到广泛的关注。其中,高级氧化法中的Fenton氧化法因其操作简单、设备简易、成本低廉、原料丰富而得到了国内外研究学者的广泛研究。
Fenton氧化法是利用均相二价铁离子作为均相催化剂,在一定的pH值条件下来催化H2O2产生羟基自由基以氧化降解有机污染物。然而,均相Fenton氧化法存在pH值适用范围窄(即在pH 3~4条件下降解效率高)、反应中有铁泥产生以及催化剂无法回收利用的缺点[9-10]。为了克服均相Fenton反应的缺点,在此基础上进一步发展了铁基类Fenton催化剂。目前,研究较多的铁基类Fenton催化剂包括含铁黏土[11]、含铁矿物[12-13]、负载零价铁或铁氧化物负载于沸石、二氧化硅、氧化铝以及碳材料表面的负载型催化剂[10,14-16]等,这些催化剂以粉体形式存在,类Fenton反应结束后需离心或过滤分离,存在回收复杂、耗时长以及回收过程中存在催化剂损失的缺点。因此,具有高催化活性、易于回收的铁氧化物膜层类Fenton催化剂对于解决传统类Fenton催化剂回收复杂的问题具有重要的意义,引起了人们的广泛关注。
膜层催化剂的制备方法包括原子层沉积[17]、化学气相沉积[18]、水热[19]等方法,其中近年逐渐发展起来的微弧氧化技术,通过改变电解液配方或电参数可以调控膜层组成和形貌,并且膜层表面的多孔结构使之具有高的比表面积,因此被广泛应用于各种功能化膜层的开发,如热控涂层[20]、耐腐蚀膜层、装饰性[21]及催化膜层[22]等。本课题组利用该技术在Q235碳钢上成功地制备了铁氧化物膜层类Fenton催化剂[23-24],并研究了其苯酚降解性能。在此基础上,本论文采用了耐蚀性好的钛合金作为基体,在硅酸盐电解液中微弧氧化制备铁氧化物膜层类Fenton催化剂,并研究了铁源含量、降解温度、溶液pH值、H2O2投料量以及苯酚浓度对苯酚降解效率的影响。
1 实验部分
1.1 实验材料
试剂:Na2SiO3·9H2O、NaH2PO2·H2O、[K3Fe(CN)6]·H2O均为分析纯,购自国药;原材料钛合金(TC4)来自东莞宏远模具钢材有限公司。
1.2 铁氧化物膜层类Fenton催化剂制备
钛合金表面前处理:依次采用500、1000、1500、2 000、2 500目砂纸打磨抛光钛合金表面(受处理面积10 cm2)至镜面,接着用去离子水、无水乙醇依次冲洗表面,最后用吹风机吹干表面,留待制备膜层时使用。
首先配制铝酸盐体系电解液,即在1 L去离子水中加入20 g Na2SiO3·9H2O,搅拌至完全溶解,接着加入1.0 g NaH2PO2·H2O,磁力搅拌至溶解均匀。将受处理面积为10 cm2的钛合金浸入电解液中,作为阳极,不锈钢电解槽作为阴极,采用哈尔滨工业大学自制的WH-1型恒流微弧氧化电源供电。反应前,通循环冷却水以便保持电解液温度在30℃,在电流密度0.06 A·cm-2下反应150 s,关闭电源。接着在电解液中加入一定量的[K3Fe(CN)6]·H2O,溶解后,在上述电流密度下反应20 min,接着用去离子水反复冲洗,最后用吹风机吹干,留待测试使用。
1.3 样品表征
催化剂晶体结构及物相分析采用日本RICOH公司生产的X-射线衍射仪(D/Max-2000)测试,使用Cu Kα靶,波长0.154 06 nm,加速电压40 kV,加速电流 150 mA,扫描角度 10°~90°, 扫描速度 10°·min-1。催化剂表面物相组成及价态采用美国物理生产的PHI 5400型XPS能谱仪分析,其中,采用单色Al Kα作为辐射光源(hν=1 486.6 eV,10.0 kV),以C1s结合能284.6 eV来校准各元素分谱。催化剂表面形貌分析采用美国FEI公司生产的NanoLab 600i型扫描电子显微镜完成,加速电压20 kV。类Fenton降解苯酚过程中苯酚相对浓度测定采用珀金埃尔默仪器有限公司生产的Lambda XLS+型紫外-可见分光光度计完成,测试波长范围200~900 nm。
1.4 降解苯酚实验
配制50 mL 35 mg·L-1的苯酚溶液,采用稀硫酸调节溶液pH值至4.0,将制得的铁氧化物膜层(面积10 cm2)浸入苯酚溶液中,接着加入6 mmol·L-1H2O2,类Fenton降解苯酚反应开始。降解过程中,每隔一段时间取出一定量的降解液,采用4-氨基安替比林分光光度法测试苯酚浓度变化情况;另外,总铁浓度测定采用1,10-菲咯啉分光光度法。
2 结果与讨论
2.1 铁氧化物膜层的XRD,XPS和SEM分析
采用微弧氧化电源在含10 g铁源下于硅酸盐体系中制备的铁氧化物膜层降解前的XRD图如图1所示。所得的XRD衍射峰与金属Ti和金红石TiO2(R-TiO2)的标准峰相对应,其中,金属Ti衍射峰来源于基体钛合金,而R-TiO2特征峰来源于膜层,说明膜层结晶相由R-TiO2构成,在XRD中并未发现铁氧化物的特性衍射峰,说明铁氧化物可能以非晶相存在或者其结晶相含量较少导致其衍射峰太弱,无法在XRD图中观察到铁氧化物的特征峰。
为了分析所得铁氧化物膜层的表面元素组成,对其作了XPS分析,其全谱及Fe2p图如图2所示。研究发现膜层表面含有 C、Si、Ti、O、Fe、Na 元素,其中C元素来源于外部环境污染,而Na、Si、Fe元素来源于电解液,Ti元素来源于基体。对Fe2p XPS图谱经分峰拟合发现Fe在表面以Fe2+和Fe3+两种价态存在,其中,711.0和724.3 eV对应于Fe2+的2p3/2和2p1/2结合能,而712.7和726.3 eV对应于Fe3+的2p3/2和2p1/2结合能[25-27]。因此,可知该膜层催化剂表面同时存在Fe2+和Fe3+,其中,Fe2+的产生可能是由于在微弧氧化过程中,在电极界面高温高压的环境下具有还原性的 NaH2PO2将 Fe3+还原为 Fe2+引起的。
在硅酸盐电解液中含有不同含量的铁源条件下所制备膜层的表面形貌如图3所示。研究发现当电解液中不含铁氰化钾时膜层表面有许多细小的颗粒附着于膜层表面,并且平均孔径以及表面粗糙度均明显低于其余样品;当电解液中加入铁氰化钾后膜层表面形貌明显不同于空白样品,表面分布有5μm左右的大孔,随着铁源含量增多,大孔数量降低,但表面产生了小尺寸的孔,导致膜层比表面积的增大,使得膜层表面具有更多的铁活性位,进而有利于其类Fenton催化活性。
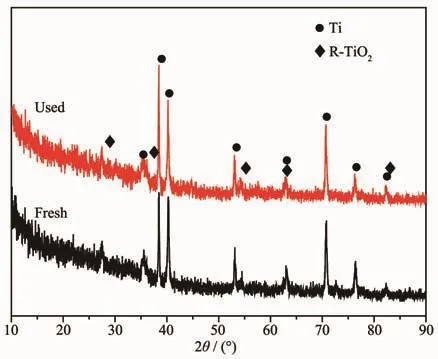
图1 在含10 g铁源下于硅酸盐体系中制备的铁氧化物膜层降解前后XRD图Fig.1 XRD patterns of the as-prepared iron oxide coatings prepared with 10 g iron source in silicate electrolyte before and after degradation

图2 在含10 g铁源下于硅酸盐体系中制备的铁氧化物膜层的XPS图谱:(a)全谱,(b)Fe2p XPS图谱Fig.2 XPSpatterns of the as-prepared iron oxide coatings prepared with 10 g iron source in silicate electrolyte:(a)full spectra,(b)Fe2p XPSpattern

图3 在含0 g(a)、5 g(b)、10 g(c)和15 g(d)铁源下于硅酸盐体系中制备的铁氧化物膜层的SEM图Fig.3 SEM images of the as-prepared iron oxide coatings prepared with different content iron source in silicate electrolyte:(a)0 g,(b)5.0 g,(c)10 g and(d)15.0 g
2.2 在各类降解体系中苯酚降解性能比较
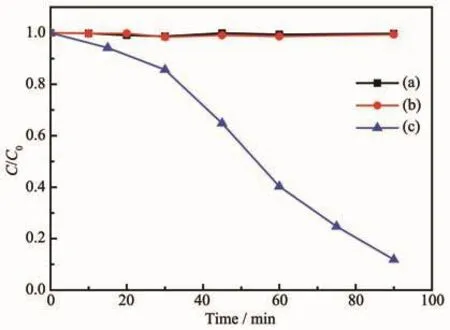
图4 不同降解体系中苯酚浓度随时间变化曲线(a)6 mmol·L-1 H2O2、(b)10 cm2铁氧化物膜层和(c)10 cm2铁氧化物膜层+6 mmol·L-1 H2O2 Fig.4 Relation curves of concentration to time degradation efficiency under various degradation systems:(a)6 mmol·L-1 H2O2,(b)10 cm2 iron oxide coating,(c)10 cm2 iron oxide coating+6 mmol·L-1 H2O2
在各类降解体系中苯酚降解性能如图4所示。研究发现在pH 3.0的50 mL 35 mg·L-1的苯酚溶液中仅仅加入6 mmol·L-1H2O2时无法引起苯酚相对浓度的变化,说明在pH 3.0的条件下H2O2的氧化能力较弱,无法引起苯酚浓度的变化;而在苯酚溶液中单独存在铁氧化物膜层时同样无法引起苯酚浓度的变化,说明该铁氧化物膜层对苯酚的吸附非常弱。而在相同条件下,苯酚溶液中同时存在6 mmol·L-1H2O2和铁氧化物膜层时,降解90 min,苯酚去除率可达90%,说明该膜层在pH 3.0的条件下可通过类Fenton反应来催化H2O2产生羟基自由基以氧化降解苯酚,即该膜层在此条件下表现出较好的类Fenton催化活性。
2.3 不同铁源含量下所制备的铁氧化物膜层类Fenton降解苯酚性能比较
为了研究硅酸盐电解液中不同铁氰化钾含量下所制备膜层的类Fenton降解苯酚的效率,在0、5、10以及15 g铁氰化钾下制备了铁氧化物膜层,在苯酚浓度 35 mg·L-1、H2O26.0 mmol·L-1及 pH 3.0条件下研究了各膜层的类Fenton降解苯酚效率,如图5a所示。类Fenton降解苯酚研究发现,当电解液中无铁氰化钾时所得膜层无法引起苯酚浓度的变化,即膜层无法催化H2O2来氧化降解苯酚。当铁氰化钾增至5 g时,所得膜层可在pH 3.0、H2O26 mmol·L-1、苯酚 35 mg·L-1的条件下引起苯酚浓度逐渐降低,降解120 min,苯酚去除率可达73%;进一步增加铁源含量,所得膜层的类Fenton降解苯酚效率逐渐增加,但15 g铁源下制备的膜层类Fenton降解苯酚效率与10 g铁源下制备的膜层相比改善效率并不太明显。因此,从成本与降解效率上综合考虑,选取10 g铁源为最佳含量。
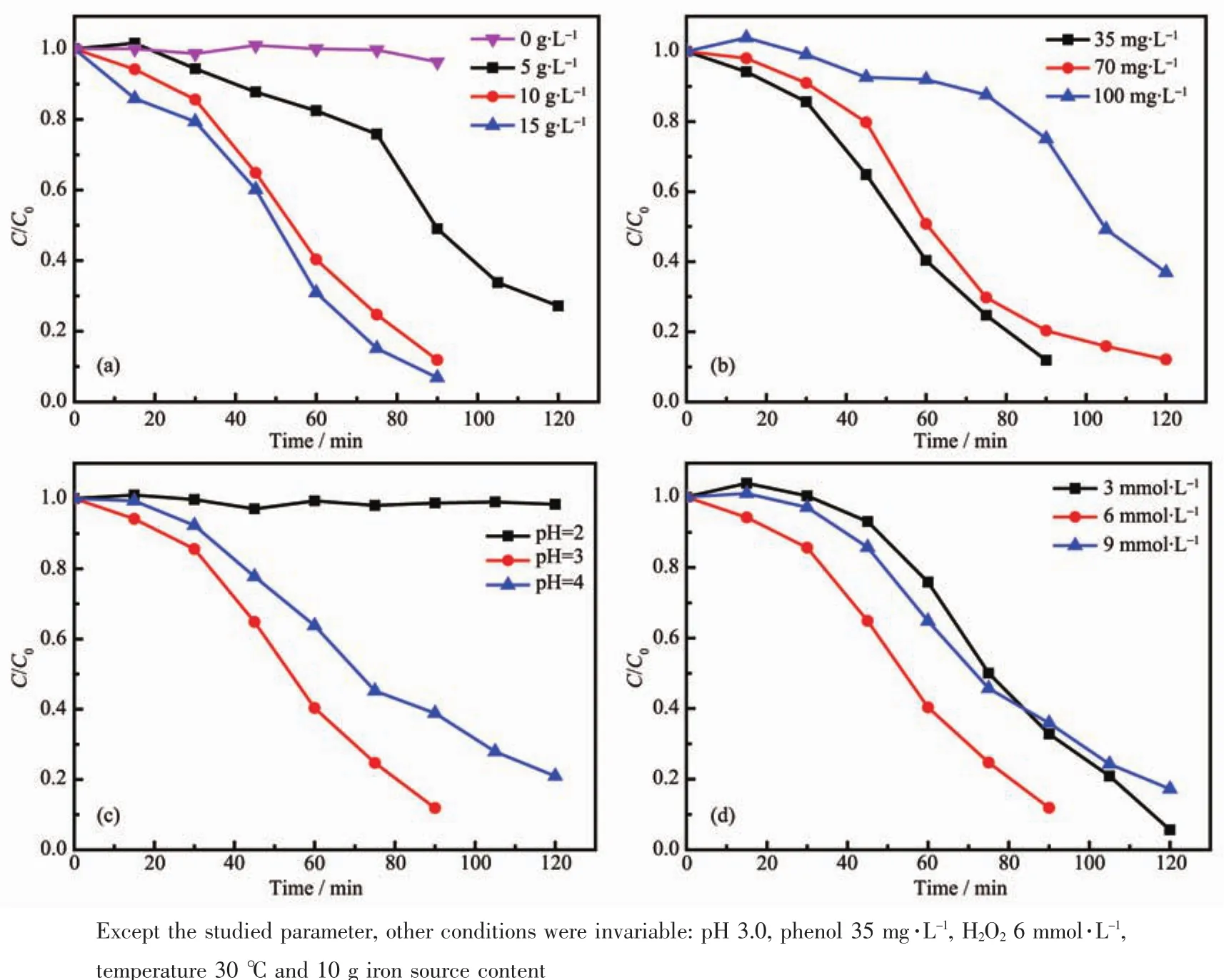
图5 铁源含量 (a)、pH(b)、苯酚初始浓度(c)以及H2O2投料量 (d)对所制备铁氧化物膜层类Fenton降解苯酚效率的影响Fig.5 Effects of iron source content(a),pH(b),phenol content(c)and H 2O2(d)on the phenol removal
2.4 pH值、苯酚浓度、H2O2投料量对铁氧化物膜层类Fenton降解苯酚性能的影响
为了确定降解条件对苯酚降解效率的影响规律,研究了pH值、苯酚浓度以及H2O2投料量对10 g铁源含量下所制备膜层苯酚降解效率的影响,所得结果如图5b、5c和5d所示。研究发现当pH值为2.0时,随着反应的进行苯酚浓度无变化,而当pH值由2.0增至4.0,苯酚降解效率先增加后降低,在pH 3.0下苯酚降解效率最大。当pH值过低即pH=2.0时,溶液中存在的质子H+会与类Fenton反应中产生的羟基自由基反应,而消耗羟基自由基,进而显著降低苯酚降解效率;在pH>3.0时,一方面在高pH值条件下羟基自由基的氧化能力降低,另一方面,催化剂的表面Fe向Fe的转化效率降低,进而导致苯酚降解效率降低[28-29]。因此,该铁氧化物膜层类Fenton降解苯酚的最适宜pH值为3.0。
苯酚浓度对铁氧化物膜层降解苯酚效率的影响如图5c所示。研究发现随着苯酚浓度由35 mg·L-1增至100 mg·L-1,所得膜层的类Fenton降解苯酚效率逐渐降低,这可能是由于在催化剂及H2O2含量固定的情况下产生的强氧化性羟基自由基数量有限,而在苯酚氧化过程中产生的中间产物也会与羟基自由基反应,消耗羟基自由基,进而导致苯酚降解效率的降低[30]。
H2O2投料量对铁氧化物膜层降解苯酚效率的影响如图5d所示,研究发现随着H2O2浓度由3.0 mmol·L-1增至 9.0 mmol·L-1, 苯酚降解效率先增加后降低,在H2O2浓度为6.0 mmol·L-1时苯酚降解效率最大。随着H2O2浓度的提高,产生的羟基自由基的量增多导致苯酚降解效率提高;而当H2O2浓度过高时,由于过量的H2O2会与产生的羟基自由基反应,从而消耗羟基自由基并生成具有弱氧化性的氢超氧自由基(HO2·),进而导致苯酚降解效率的降低,这与文献[25,31]报道的结果相一致。因此,H2O2的适宜浓度为 6.0 mmol·L-1。
2.5 反应温度对铁氧化物膜层类Fenton降解苯酚性能的影响
类Fenton降解反应的温度对苯酚降解效率的影响如图6所示。通过图6a可知随着反应温度由25℃提高至45℃,苯酚降解效率得到了极大的改善,在45℃下降解15 min,苯酚去除率可达96%。
由不同温度下的降解反应动力学曲线(图6b插图)可知,降解过程分为2个阶段,即前期的诱导期和后期的快速降解期,并且两阶段均遵循准一级反应动力学过程。在诱导期,苯酚降解速率非常缓慢,这是由于苯酚吸附于催化剂表面以及H2O2在催化剂表面铁活性位上的活化需要一定的时间,而在快速降解期,随着苯酚、H2O2在催化剂表面吸附量以及产生羟基自由基量的增多,苯酚降解速率也在增大[12,32]。随着反应温度的提高,诱导期逐渐缩短,最后趋于消失,而在快速降解期降解苯酚的反应速率常数由0.015 s-1增至0.207 s-1。类Fenton降解苯酚的反应活化能利用快速降解期的反应速率常数并通过阿伦尼乌斯方程k=A exp[-Ea/(RT)]得到,如图6b所示。通过线性拟合ln k与-1/T的关系可得该膜层类Fenton降解苯酚的活化能Ea=96.9 kJ·mol-1。
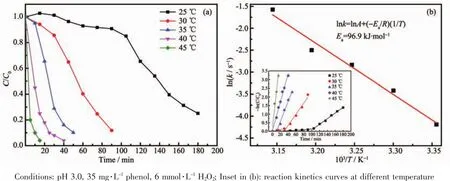
图6 反应温度对10 g铁源条件下所制备铁氧化物膜层类Fenton降解苯酚效率影响(a)和ln k与-1/T关系曲线Fig.6 Influence of reaction temperature on the Fenton-like degradation of phenol by iron oxide coating prepared with 10 g iron source(a)and the relation curve of ln k and-1/T
2.6 铁氧化物膜层类Fenton催化剂的稳定性研究
对于一种催化剂不仅要表现出优异的催化活性,而且也应具有良好的稳定性。基于此,对所制备铁氧化物膜层的稳定性作了进一步研究,如图7所示。结果表明该催化剂在第一次类Fenton降解苯酚过程中表现出较好的催化活性,即在pH 3.0条件下于90 min内可将90%以上的苯酚去除;然而,在第二次类Fenton降解苯酚过程中发现降解90 min苯酚浓度并未有明显变化,说明在第二次降解苯酚过程中催化剂活性发生明显降低。
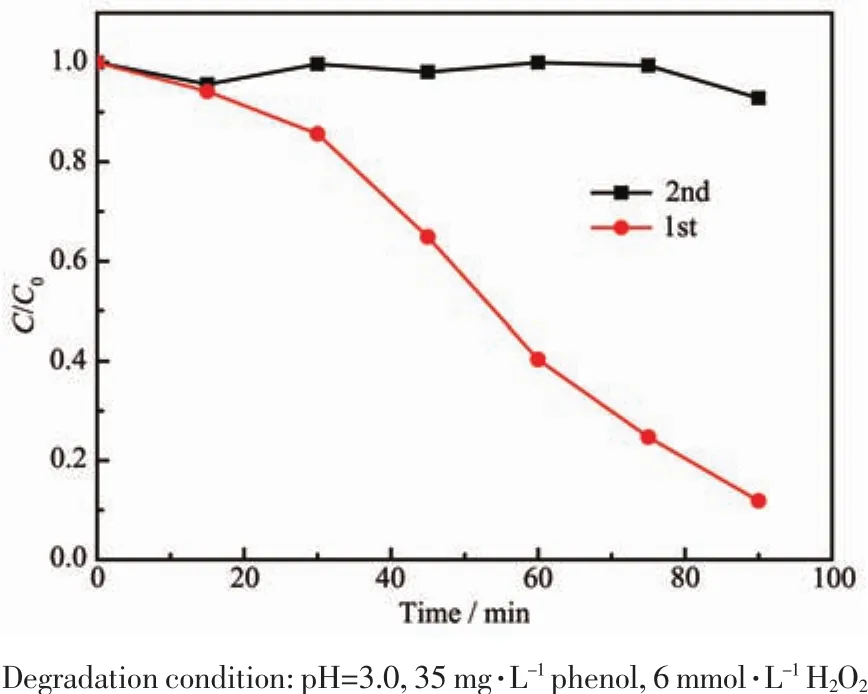
图7 10 g铁源下所制备膜层的稳定性Fig.7 Stability of the as-prepared coating prepared with 10 g iron source

图8 10 g铁源下所制备膜层降解前后的SEM图:(a)降解前(b)降解后Fig.8 SEM images of the as-prepared coating prepared with 10 g iron source before(a)and after(b)degradation
为了分析催化剂失活的原因,对降解前后铁氧化物膜层的物相组成、表面形貌以及表面铁的价态及含量作了进一步分析。降解前后的铁氧化物膜层的物相组成如图1所示,通过该XRD图发现与降解前的XRD图相比,降解后该膜层的衍射峰峰位并无明显变化,并且也无新的衍射峰产生,说明降解前后膜层的物相组成无明显变化。降解前后膜层的表面形貌如图8所示,研究发现降解后膜层表面平均孔径无明显变化,但表面附着的颗粒数量增多并且表面变得更加粗糙。
催化剂表面铁活性位的数量以及铁的价态直接影响类Fenton催化剂的催化活性,因此,本论文利用XPS对降解前后膜层的表面元素价态及含量作了进一步分析,如图9所示。通过该图发现降解后Fe2p XPS图谱的Fe2p3/2峰位向低结合能方向发生略微偏移,说明膜层表面Fe2+的相对含量增多,这是由于催化剂表面的Fe3+与H2O2反应,导致Fe2+在催化剂表面总铁中的含量增多,这从侧面验证了该膜层类Fenton催化剂降解苯酚过程主要发生于催化剂表面。然而,降解后,Fe2p3/2的峰强度降低,说明催化剂表面Fe含量降低,进而导致催化剂表面Fe活性位数量的降低。
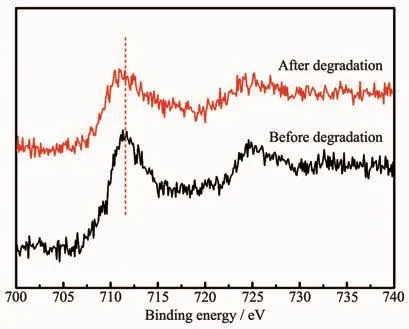
图9 10 g铁源下所制备膜层降解前后Fe2p XPS图谱Fig.9 Fe2p XPSpattern of the as-prepared coating prepared with 10 g iron source
通过XRD、SEM以及XPS对催化剂失活的原因分析发现,催化剂催化活性的降低主要是由于其表面铁含量降低引起活性位数量的减少,进而导致类Fenton降解苯酚效率大大降低。
3结 论
在钛合金表面利用微弧氧化法成功制备了含Fe3O4的固定化膜层类Fenton催化剂,所得膜层具有粗糙多孔的结构,膜层中Fe3O4以非晶相存在。以苯酚为目标降解物,优化了降解条件,研究发现在pH=3.0、6.0 mmol·L-1H2O2、35 mg·L-1苯酚、30 ℃及铁氰化钾含量10 g·L-1的条件下降解90 min,苯酚降解效率可达90%。苯酚降解效率随着反应温度的提高逐渐增大;另外,不同温度下的反应动力学分析发现该膜层类Fenton降解苯酚分为2个阶段即前期诱导期和后期的快速降解期,且均遵循一级反应动力学过程,通过阿伦尼乌斯方程线性拟合ln k与1/T的关系可得该膜层类Fenton降解苯酚的反应活化能Ea为96.9 kJ·mol-1。最后,膜层的稳定性研究表明,膜层的催化降解能力大大降低,这是表面铁含量降低,引起活性位数量的减少导致的。
[1]Massa A,Hernández S,Lamberti A,et al.Appl.Catal.B:Environ.,2017,203:270-281
[2]Prucek R,Hermanek M,Zborˇil R.Appl.Catal.A:Gen.,2009,366(2):325-332
[3]Yang GC,Long Y W.J.Hazard.Mater.,1999,69(3):259-271
[4]Saputra E,Muhammad S,Sun H,et al.Environ.Sci.Technol.,2013,47(11):5882-5887
[5]Indrawirawan S,Sun H,Duan X,etal.Appl.Catal.B:Environ.,2015,179:352-362
[6]Yang Z,Yang H,Jiang Z,et al.J.Hazard.Mater.,2013,254-255:36-45
[7]Hu Q Y,Li M,Wang C,et al.J.Hazard.Mater,2015,295:1-8
[8]Andreozzi R,Caprio V,Insola A,et al.Catal.Today,1999,53(1):51-59
[9]Brillas E,Sires I,Oturan M A.Chem.Rev.,2009,109(12):6570-6631
[10]Cihanoglu A,Gunduz G,Dukkanci M.Appl.Catal.B:Environ.,2015,165:687-699
[11]Hadjltaief H Bel,Costa PDa,PBeaunier,et al.Appl.Clay Sci.,2014,91-92:46-54
[12]Gordon T R,Marsh A L.Catal.Lett.,2009,132(3):349
[13]Zheng C,Cheng X,Chen P,et al.RSC Adv.,2015,5(51):40872-40883
[14]Wang M,Shu Z,Zhang L X,et al.Dalton Trans.,2014,43(24):9234-9241
[15]Luca C di,Ivorra F,Massa P,et al.Ind.Eng.Chem.Res.,2012,51(26):8979-8984
[16]Yao Y,Chen H,Qin J,et al.Water Res.,2016,101:281-291
[17]Buchalska M,SurówkaM,Hämäläinen J,et al.Catal.Today,2015,252:14-19
[18]Samad L,Cabán-Acevedo M,Shearer MJ,etal.Chem.Mater.,2015,27(8):3108-3114
[19]Sayed M,Fu P,Shah L A,et al.J.Phys.Chem.A,2016,120(1):118-127
[20]Yao Z,Hu B,Shen Q,et al.Surf.Coat.Technol.,2014,253:166-170
[21]Srinivasan P B,Liang J,Blawert C,et al.Surf.Eng.,2010,26(5):367-370
[22]Yao Z,Jia F,Tian S,et al.ACS Appl.Mater.Interfaces,2010,2(9):2617-2622
[23]Wang J,Yao Z,Wang Y,et al.Environ.Pollut.,2017,224:552-558
[24]Wang J,Yao Z,Xia Q,et al.J.Alloys Compd.,2017,711:278-286
[25]Hu X,Liu B,Deng Y,et al.Appl.Catal.B:Environ.,2011,107(3/4):274-283
[26]Yamashita T,Hayes P.Appl.Surf.Sci.,2008,254(8):2441-2449
[27]Hawn D D,DeKoven B M.Surf.Interface Anal.,1987,10(2/3):63-74
[28]Duan H,Liu Y,Yin X,et al.Chem.Eng.J.,2016,283:873-879
[29]Hsueh C L,Huang Y H,Wang C C,et al.Chemosphere,2005,58(10):1409-1414
[30]Zhang Y,Zhang K,Dai C,et al.Chem.Eng.J.,2014,244:438-445
[31]HU Long-Xing(胡龙兴),XU Dan-Dan(许丹丹),ZOU Lian-Pei(邹联沛),et al.Acta Phys.-Chim.Sin.(物理化学学报),2015,31(4):771-782
[32]Luo M,Bowden D,Brimblecombe P.Appl.Catal.B:Environ.,2009,85(3/4):201-206
Iron Oxide Coating Fenton-like Catalysts:Preparation and Degradation of Phenol
The iron oxide coating Fenton-like catalyst on Ti alloy was successfully prepared in silicate electrolyte via micro-arc oxidation.The surface morphology,crystal structure and phase composition were studied by SEM,XRDand XPS.The resultsindicated that the as-prepared coating included the rutile TiO2(R-TiO2),and amorphous Fe3O4which was analyzed by XPS.The SEM images suggested that after the addition of K3[Fe(CN)6]in the electrolyte,the surface roughness and average pore size of the as-prepared coating were increased.The Fentonlike catalytic activity of as-prepared coating was investigated by degradation of phenol.What′s more,the influences of K3[Fe(CN)6]content,phenol concentration,H2O2dosage and pH value on phenol degradation were also studied and finally the optimal degradation condition was confirmed.Under pH 3.0,30℃,H2O26.0 mmol·L-1,phenol 35 mg·L-1and K3[Fe(CN)6]10 g·L-1,90%phenol could be removed.The effect of degradation temperature on degradation efficiency was also evaluated and the reaction kinetics under different temperature were also studied.The activation energy of Fenton-like degradation of phenol through Arrhenius equation is 96.9 kJ·mol-1.Finally,the stability was studied and the stability degradation was also analyzed.
iron oxide coatings;Fenton-like catalyst;Ti alloy;micro-arc oxidation;phenol
O643
A
1001-4861(2017)10-1797-08
10.11862/CJIC.2017.197
YAOZhong-Ping*,1,2CHEN Chang-Ju1WANGJian-Kang1XIA Qi-Xing1LI Chun-Xiang1JIANGZhao-Hua1
(1State Key Laboratory of Urban Water Resource and Environment,School of Chemistry and Chemical Engineering,Harbin Institute of Technology,Harbin 150001,China)
(2Key Laboratory of Ultra-Light Materials and Surface Technology,Ministry of Education,Harbin Engineering University,Harbin 150001,China)
2017-05-31。收修改稿日期:2017-07-07。
国家自然科学基金(No.51571076)、城市水资源与水环境国家重点实验室2017年度开放基金(No.HCK201716)和超轻材料与表面技术教育部重点实验室资助项目。
*通信联系人。 E-mail:yaozhongping@hit.edu.cn
