包覆Zr O2锂离子筛的制备及其在盐湖卤水中的吸附性能
2017-11-01杨喜云尹周澜曹改芳
王 豪 杨喜云*,, 尹周澜 曹改芳 徐 徽
包覆Zr O2锂离子筛的制备及其在盐湖卤水中的吸附性能
王 豪1杨喜云*,1,2尹周澜2曹改芳1徐 徽1
(1中南大学冶金与环境学院,长沙 410083)
(2中南大学化学化工学院,长沙 410083)
采用水热法制备前驱体Li1.6Mn1.6O4,用液相沉淀法在其表面包覆ZrO2,再经酸洗转型为包覆ZrO2的锂离子筛H1.6Mn1.6O4。采用XRD、SEM、EDS和HRTEM对前驱体的结构、形貌和成分进行了表征。研究了ZrO2包覆量和焙烧温度对锰溶损率和锂吸附容量的影响。结果表明:当ZrO2包覆量为3%,焙烧温度为450℃时,在前驱体表面形成厚度约15 nm的ZrO2包覆层,首次锰溶损率从3.14%下降到2.65%,锂离子筛在盐湖卤水中锂吸附容量保持为29.4 mg·g-1。包覆ZrO2的锂离子筛经过10次循环吸附-脱附,锰溶损率降低至0.34%,锂吸附容量保持为24.4 mg·g-1,高于未包覆的锂离子筛(22.9 mg·g-1)。包覆ZrO2改善了锂离子筛的结构和吸附容量的循环稳定性。
锂离子筛;表面包覆;锰溶损率;锂吸附量
我国中西部盐湖众多,含有丰富的锂、钠、钾、镁等资源。据估计,青海柴达木盆地LiCl储量为18.16 Mt,新疆罗布泊盐湖 LiCl储量为 2.102 Mt,具有重大的经济价值[1]。然而,我国大部分盐湖资源的特点是镁含量高、锂含量低,镁、锂比高,提取分离困难。针对此问题,国内外研究者展开了积极的探索,提出了一系列处理方法如膜分离法[2-3]、溶剂萃取法[4-5]和离子交换吸附法[6-7]。在这些方法中,锰系锂离子筛吸附法显示出独特的优势,其主要原因在于该吸附剂选择性好、成本相对低廉、吸附容量大、不污染溶液,特别适合处理Li+浓度200 mg·L-1以下的卤水或海水[8]。但尖晶石锂锰氧化物在酸洗过程中锰有少量溶损,使尖晶石结构不稳定,循环性能下降[9]。因此,降低锰溶损率,提高尖晶石结构的稳定性是制备锂离子筛的关键所在。
尖晶石型锂锰氧化物包括LiMn2O4,Li1.33Mnl.67O4和 Lil.6Mnl.6O4。 LiMn2O4含有 Mn3+,在酸浸脱 Li+过程中Mn3+发生歧化反应而溶损,掺杂改性降低Mn3+含量是改善尖晶石型锂离子筛循环性能的有效途径[10-11]。对于 Li1.33Mnl.67O4和 Lil.6Mnl.6O4,具有相对高的锂含量和全部的Mn4+,无Mn3+歧化反应发生,理论上不会发生锰的溶损。最近研究发现,酸浸液腐蚀锂离子筛,锰在循环吸附和脱附过程中会溶损[12]。锂锰氧化物是锂离子电池正极材料,常采用表面包覆阻隔电解液与正极材料的接触来提高稳定性[13]。关于锂离子筛的研究多集中于制备方法及吸附容量的提升[14-15],对包覆改性鲜有研究报道。由于ZrO2属于惰性氧化物,耐酸腐蚀性较好,且为锂离子导体,已广泛应用于锂离子电池正极材料的表面改性[16]。本文对锂离子筛前驱体Li1.6Mn1.6O4表面包覆ZrO2。结果表明,表面包覆改性之后,前驱体的首次锰溶损率明显降低,锂离子筛的吸附性能变化不大,循环稳定性提高,结构更稳定。
1 实验部分
1.1 锂离子筛前驱体的制备
将电解MnO2在750℃下煅烧500 min生成Mn2O3,先将Mn2O3粉末与LiOH溶液以1∶4的物质的量之比混合,在600 r·min-1的转速下常温机械搅拌5 h,后将混合溶液加入高压釜在250℃下水热反应17 h得到LiMnO2,再将LiMnO2在450℃下焙烧 6 h制得 Li1.6Mn1.6O4。
1.2 包覆Zr O2锂离子筛前驱体的制备
固定包覆基体(前驱体)为2 g,根据ZrO2包覆量计算出五水合硝酸锆的质量,称取相应质量的五水合硝酸锆溶解于50 mL浓度为95%的乙醇溶液中,加入2 g前驱体,充分搅拌20 h,置于70℃恒温水浴中搅拌至乙醇完全挥发,然后在120℃下干燥2 h,在400~500℃下焙烧2 h得到包覆ZrO2的锂离子筛前驱体。
1.3 包覆Zr O2锂离子筛的制备
称取0.6 g包覆ZrO2锂离子筛前驱体加入到100 mL、0.5 mol·L-1的 HCl溶液中,在 30 ℃下酸浸4 h,经过滤、洗涤、干燥得到包覆ZrO2锂离子筛H1.6Mn1.6O4。
1.4 锂离子筛的吸附实验
称取包覆ZrO2的锂离子筛H1.6Mn1.6O40.3 g加入到100 mL罗布泊老卤卤水中,在30℃下吸附5 h,卤水中锂浓度为222.2 mg·L-1,其化学组成见表1。
1.5 锂离子筛前驱体中锰平均化合价的测定
采用氧化还原滴定和配位滴定法测定锰的平均化合价。以盐酸羟胺作还原剂,用0.015 mol·L-1EDTA标准溶液配位滴定前驱体中总锰量,同时用过量的0.05 mol·L-1草酸钠标准溶液还原前驱体中的锰,再用0.02 mol·L-1高锰酸钾标准溶液返滴定过量的草酸钠,求得试样中高价锰得到的总电子数,进一步计算得到锂离子筛前驱体中锰的平均化合价[17]。
1.6 锂离子筛的循环性能实验
分别称取16 g未包覆与包覆3%ZrO2的锂离子筛前驱体加入到 2.67 L、0.5 mol·L-1的 HCl溶液中,在30℃下酸浸4 h,经过滤,洗涤,干燥得到锂离子筛,称量记录质量,再将锂离子筛分别加入到罗布泊老卤卤水中,30℃下吸附5 h,经过滤、洗涤、干燥得到锂离子筛前驱体,再称量质量,分析锂吸附容量和锰溶损率,完成一个循环。再将此锂离子筛前驱体加入到0.5 mol·L-1的HCl溶液中酸浸,重复上述步骤,循环10次,每次循环保持酸洗液固比为 0.167 L·g-1,吸附锂时液固比为 0.333 L·g-1。
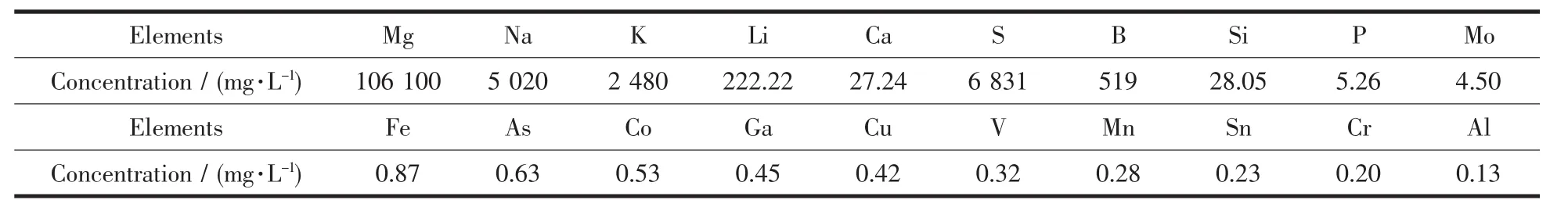
表1 所用盐湖卤水的化学成分Table 1 Chemical composition of salt lake brine
1.7 包覆后锂离子筛的表征及性能检测
采用X射线衍射仪(Rigaku-TTRⅢ型X射线衍射仪,辐射源 Cu Kα1,波长 λ=0.154 6 nm,管电压40 kV,管电流 250 mA,扫描速度 10°·min-1,步长0.02°,扫描范围 10°~80°)分析样品的物相组成。 采用扫描电子显微镜 (日本JEOL公司生产的JSM-6360LV型扫描电镜,工作电压20 kV)对包覆前后锂离子筛前驱体进行形貌分析。取适量3%包覆量的锂离子筛前驱体与无水乙醇混合,超声分散后滴入碳膜,干燥后采用透射电镜(Tecnai G12,200 kV)观察前驱体表面的包覆层厚度;称取0.6 g包覆后的锂离子筛前驱体加入到100 mL 0.5 mol·L-1的HCl溶液中酸浸4 h,离心分离,采用原子吸收分光光度计(TAS-990型)测量上清液锰离子的浓度,计算锰的溶损率。称取酸洗后的样品0.3 g加入到100 mL、含锂离子浓度为222.2 mg·L-1的卤水中吸附5 h,离心分离,采用同样的方法分析上清液锂离子浓度,计算锂吸附容量。
2 结果与讨论
2.1 Zr O2包覆量对前驱体结构和锂离子筛吸附性能的影响
控制焙烧温度为450℃,在锂离子筛前驱体表面包覆 1%、2%、3%、5%、7%、10%(w/w)ZrO2,其 XRD图如图1所示。由图1可以看出,表面包覆没有改变前驱体的物相组成,均得到了晶型良好、纯相的Li1.6Mn1.6O4。当包覆量为1%时,XRD图显示为单一的Li1.6Mn1.6O4的特征衍射峰;当包覆量为3%时,出现了ZrO2的特征峰;当包覆量为10%时,ZrO2的特征峰更加明显。使用Jade 6.0软件分析样品的晶胞参数,结果如表2所示。与纯相Li1.6Mn1.6O4相比,包覆ZrO2的晶胞参数略有变小,但变化量可以忽略不计。说明表面包覆没有影响前驱体的尖晶石结构,ZrO2成功包覆在Li1.6Mn1.6O4的表面,没有嵌入晶格中[16]。
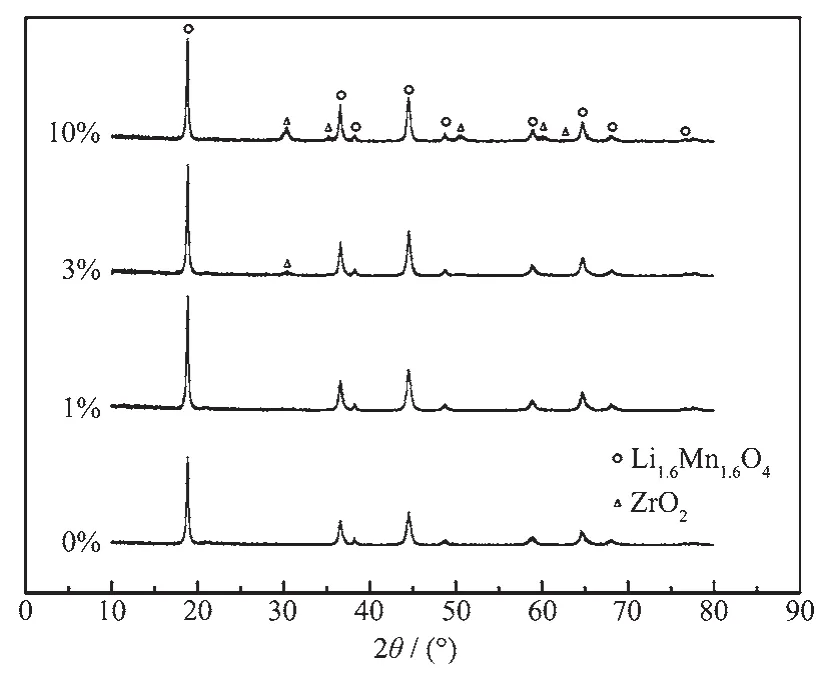
图1 包覆不同量ZrO2前驱体的XRD图Fig.1 XRD patterns of precursor coated ZrO2
包覆ZrO2前后前驱体的扫描电镜图如图2所示。由图2可以看出未包覆的前驱体颗粒较小,颗粒比较光滑,而包覆ZrO2的前驱体颗粒凹凸不平。在包覆量为3%的样品上取2点P1和P2分别做元素分析,得到相应的EDS能谱图。EDS能谱上可以明显看到Mn,O,Zr的衍射峰,由于包覆量小,Zr的衍射强度低;对于P1和P2两点,Zr元素的特征峰强度接近,说明前驱体表面Zr含量基本相同,ZrO2均匀包覆在Li1.6Mn1.6O4表面。
为了检测ZrO2在前驱体Li1.6Mn1.6O4表面上的包覆厚度,用高分辨透射电镜HRTEM对包覆量为3%的前驱体表面进行分析,结果如图3所示。从图中看出,在黑色基体Li1.6Mn1.6O4表面上有一层粗糙的灰色包覆层,厚度约15 nm,再次证明Li1.6Mn1.6O4表面成功包覆了ZrO2层。
将不同ZrO2包覆量的锂离子筛前驱体,采用0.5 mol·L-1盐酸脱附锂,测试其锰溶损率。将酸洗后得到的锂离子筛在盐湖卤水中吸附锂,测试锂吸附量,结果如图4所示。
由图4可知,未包覆ZrO2的前驱体锰溶损率为3.14%。包覆了ZrO2的前驱体锰溶损率明显降低,当ZrO2包覆量从1%增加到5%时,锰溶损率从2.98%降低到2.29%;当ZrO2包覆量超过5%时,锰溶损率变化不明显。锂离子筛表面包覆的一层ZrO2,减少了锂离子筛与盐酸的直接接触,抑制了盐酸对前驱体的腐蚀作用,随着包覆量增加,包覆层面积增大,厚度增加,锰溶损率减少,当包覆量超过5%后,前驱体表面形成一层致密的包覆层,因此锰溶损率变化小。未包覆ZrO2锂离子筛的吸附容量为30.8 mg·g-1;包覆了ZrO2的锂离子筛吸附容量普遍低于未包覆的样品,这是因为ZrO2是惰性物质,本身不含锂,无锂吸附容量,导致包覆后锂离子筛的锂吸附容量整体下降。若按照包覆量计算损失的锂吸附容量,不同包覆量的锂离子筛1%、2%、3%、5%、7%、10%的损失比容量应分别为 0.31、0.62、0.92、1.54、2.16、3.08 mg·g-1。 对比图 4 中的锂吸附容量可知,锂离子筛锂吸附容量的减少不仅仅是因为惰性物质ZrO2代替了部分锂离子筛,还可能因为锂离子筛表面包覆的ZrO2具有一定的厚度,导致锂离子的传输距离增加,在相同的吸附时间里,从卤水中吸附并嵌入锂离子筛晶格中的锂离子量减少,造成吸附量较未包覆的锂离子筛低。综合考虑锰溶损率和锂吸附量,选择最佳包覆量为3.0%,相应的锰溶损率为2.65%,锂吸附容量为29.4 mg·g-1。

表2 Zr O2包覆Li1.6Mn1.6O4的晶胞参数Table 2 Cell parameters of Zr O2-coated Li1.6Mn1.6O4
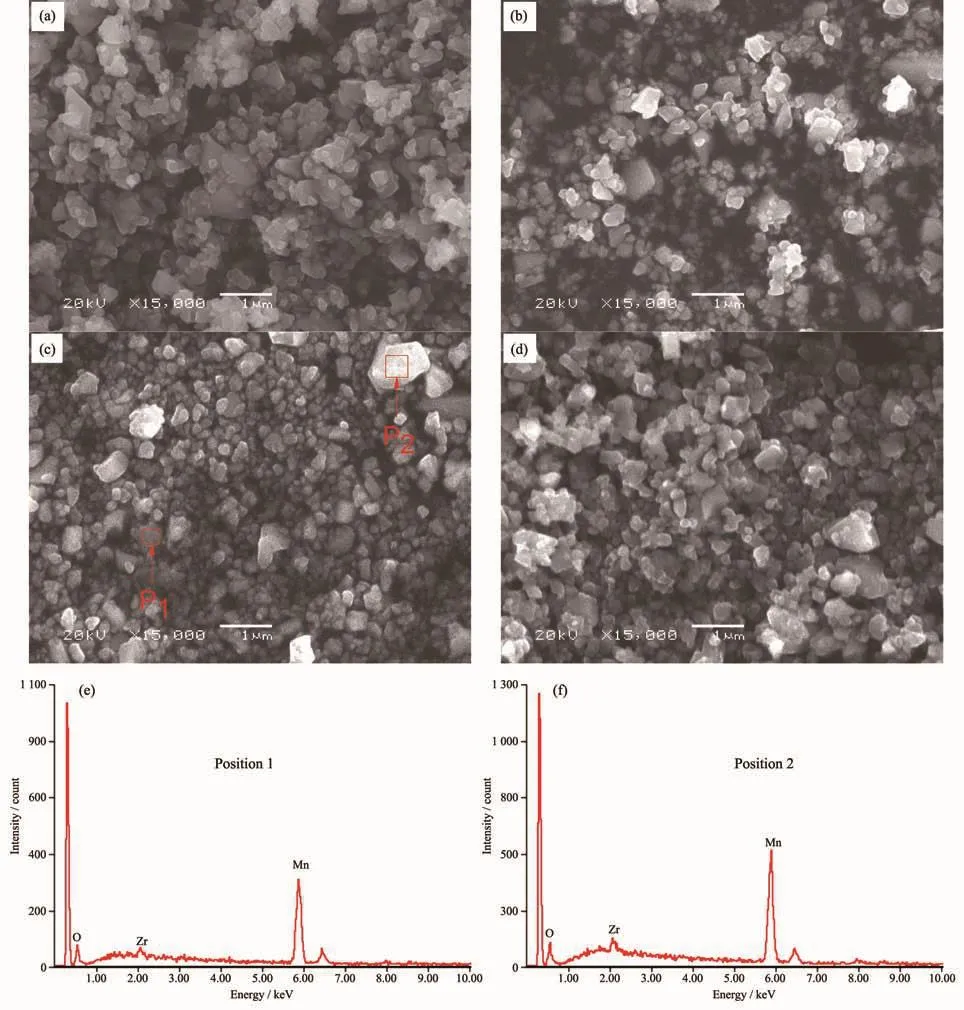
图2 包覆ZrO2前驱体的SEM及EDS能谱图(a)0%,(b)1%,(c)3%,(d)10%,(e,f)3%ZrO2前驱体的EDS能谱Fig.2 SEM images and EDSspectra for ZrO2 coated precursor(a)0%,(b)1%,(c)3%,(d)10%,(e,f)EDSfor 3%ZrO2 coated Li1.6Mn1.6O4

图3 包覆3%ZrO2锂离子筛前驱体的TEM图Fig.3 TEM image for precursor coated with 3%ZrO2

图4 包覆量对前驱体锰溶损率和锂离子筛锂吸附量的影响Fig.4 Effect of coating content on Mn dissolution loss and Li adsorption capacity
2.2 焙烧温度对前驱体结构和锂离子筛吸附性能的影响
前驱体表面包裹的Zr(NO3)4要经过焙烧才能转变为ZrO2,研究了焙烧温度对前驱体结构的影响。控制焙烧时间为2 h,不同温度所得前驱体的XRD图如图5所示。
由图5可以看出,随焙烧温度的升高,各个特征衍射峰的强度增加。当焙烧温度为400和450℃时,出现少量ZrO2的特征峰,而温度升到500℃时,ZrO2的特征峰消失,说明ZrO2掺杂嵌入到Li1.6Mn1.6O4晶格中,由于量少,对Li1.6Mn1.6O4衍射峰基本无影响。
图5 不同焙烧温度所得前驱体的XRD图Fig.5 XRD patterns for precursor roasted at different temperatures
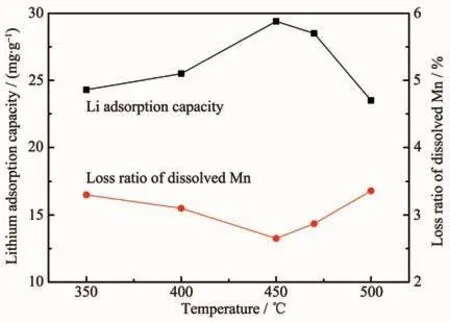
图6 焙烧温度对锰溶损率和锂吸附量的影响Fig.6 Effect of roasting temperature on Mn dissolution loss and lithium adsorption capacity
不同焙烧温度所得前驱体的锰溶损率和相应锂离子筛的锂吸附容量如图6所示。由图6可以看出,前驱体锰溶损率随着焙烧温度的升高先降低后升高,当焙烧温度为450℃时,锰溶损率达到最小值2.65%;锂离子筛的锂吸附容量随着焙烧温度的升高先升高后降低,当焙烧温度为450℃时达到最大值29.4 mg·g-1。随着焙烧温度的升高,Zr(NO3)4分解生成ZrO2的晶体结构变好,ZrO2与前驱体结合更紧密。焙烧温度过高时,XRD显示ZrO2掺杂进入前驱体,降低了对锂离子筛的保护;另外,前驱体的最佳合成温度为450℃,在500℃焙烧会导致前驱体自身性能下降,包覆后的锂离子筛性能也相应降低。因此确定最佳包覆焙烧温度为450℃。
2.3 锂离子筛的循环性能
根据以上研究结果,确定最佳包覆条件为ZrO2包覆量3%、焙烧温度450℃。测试未包覆和包覆ZrO2前驱体的锰溶损率和锂离子筛的锂吸附容量随循环次数的变化,结果如图7和图8所示。从图7可以看出,两种前驱体第1次循环锰溶损率比较高,分别为3.14%和2.65%。循环2次后,锰溶损率急剧下降并趋于稳定,经过10次循环后,包覆ZrO2和未包覆的前驱体锰溶损率分别下降至0.34%和0.48%。循环前,测试未包覆前驱体锰的化合价发现,锰的化合价为+3.87,循环10次后前驱体锰的化合价为+3.98,说明前驱体中存在少量的Mn3+,它在酸中不稳定,容易发生歧化反应生成Mn4+和Mn2+,Mn2+进入溶液产生锰溶损,导致首次锰溶损率比较高[18];表面包覆的ZrO2抑制了前驱体与酸的直接接触,即包覆层起到阻隔作用,减缓了Mn3+的溶解速度,也阻止了溶解的Mn2+进入溶液,所以包覆ZrO2前驱体锰溶损率低。由于Mn3+歧化反应不可逆,当循环次数超过2次,Mn3+溶解完全,锰溶损率就趋于稳定了。前驱体脱锂后形成H1.6Mn1.6O4(MnO2·0.5H2O),它在酸中发生如下反应 MnO2·0.5H2O+4HCl→MnCl2+Cl2+2.5H2O,使锰发生少量溶解。而包覆了 ZrO2的前驱体,ZrO2是 Li+、H+的优良导体,H+可以穿过ZrO2与前驱体接触,发生H+与Li+的离子交换反应,同时也使脱锂后的离子筛腐蚀,由于包覆层的阻碍作用,减缓了锰的溶解反应,增加了Mn2+向溶液扩散的阻力,导致包覆ZrO2的前驱体的锰溶损率低于未包覆的前驱体。与Shi等报道离子筛循环10次后锰溶损率为0.6%[19]相比,本文未包覆和包覆的锰溶损率分别为0.48%和0.34%,说明所制备的锂离子筛锰溶损率低,结构稳定,包覆ZrO2改善了前驱体的结构稳定性。
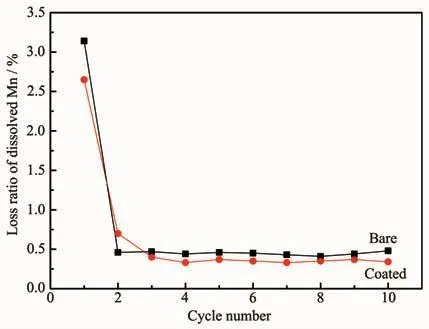
图7 锂离子筛前驱体循环过程中的锰溶损率Fig.7 Mn dissolution loss of lithium ion sieve in the cycling process
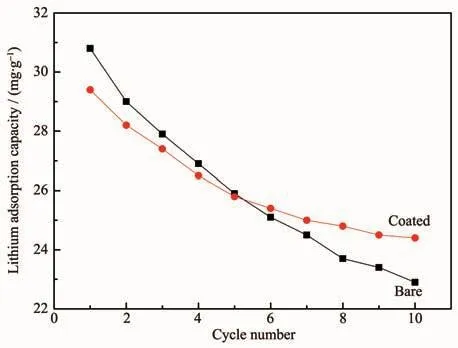
图8 锂离子筛循环过程的锂吸附容量Fig.8 Lithium adsorption capacity of lithium ion sieve in the cycling process
从图8可以看出,2种锂离子筛的锂吸附容量都随着循环次数的增加而下降。当循环次数小于5,由于吸附Li+反应主要是由传质和离子交换过程组成[9]。ZrO2形成致密包覆层,阻碍了Li+传质到锂离子筛表面并嵌入到晶格中,导致包覆ZrO2的锂离子筛的锂吸附容量低于未包覆的锂离子筛;当循环次数大于5次,包覆ZrO2的锂离子筛锂吸附容量超过了未包覆的锂离子筛,这是因为在酸的溶解和离子的交换作用下,包覆层致密性下降,阻隔作用下降,且ZrO2是离子导体,有利于Li+在锂离子筛中的扩散传质[20],因此减缓了锂离子筛锂吸附容量的衰减,稳定了锂离子筛的结构,改善了锂离子筛的循环稳定性。循环10次后,未包覆和包覆ZrO2锂离子筛的锂吸附容量分别为22.9与24.4 mg·g-1,分别与循环前的锂吸附容量30.8与29.4 mg·g-1相对比,说明锂离子筛表面包覆ZrO2后,锂吸附容量衰减量少,改善了其循环稳定性。Sun等[21]制备的锂离子筛H1.6Mn1.6O4在卤水中的锂吸附量为 3.88 mmol·g-1(26.9 mg·g-1),小于本文中的 30.8 mg·g-1,说明制备的锂离子筛吸附性能较为优良。
分析了未循环与循环10次后锂离子筛前驱体的XRD图,结果如图9所示。从图9可以看出,循环10次后,2种前驱体仍保持尖晶石结构。放大18.9°(111)特征峰,发现循环10次后,前驱体衍射峰均向高角度方向偏移,未包覆的偏移量Δθ1大于包覆的偏移量 Δθ2,结合布拉格方程 2d sinθ=nλ(其中,d为晶面间距,θ为入射X射线与相应晶面的夹角,λ为X射线的波长,n为衍射级数)可以得出,前驱体经10次循环,尖晶石骨架结构完整,但晶胞收缩,尺寸变小,包覆ZrO2的前驱体尺寸变化要小于未包覆的前驱体。即包覆后的前驱体比未包覆的前驱体结构更加稳定[22]。晶胞收缩,尺寸变小,增加了Li+嵌入和脱出晶格的阻力,这与锰溶损率和锂吸附容量的结论一致。
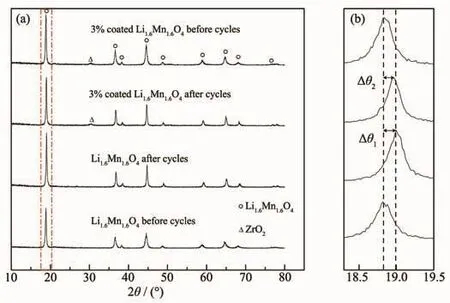
图9 (a)锂离子筛前驱体的XRD图,(b)对标记峰的局部放大图Fig.9 (a)XRD patterns for precursor of lithium ion sieve,(b)A partial magnification of the marker peak
3结 论
(1)采用水热法制备锂离子筛前驱体Li1.6Mn1.6O4,在其表面包覆ZrO2,通过酸洗转型得到包覆ZrO2的锂离子筛H1.6Mn1.6O4。
(2)ZrO2包覆量和焙烧温度影响锰溶损率和锂吸附容量。确定最佳包覆量为3%,最佳焙烧温度为450℃。此条件下前驱体锰溶损率为2.65%,在罗布泊老卤卤水中锂离子筛的锂吸附容量为29.4 mg·g-1,未包覆的前驱体锰溶损率为3.14%,锂离子筛的锂吸附容量为30.8 mg·g-1,包覆ZrO2降低了前驱体的锰溶损率。
(3)当ZrO2包覆量为3%,前驱体表面形成一层厚度约15 nm的ZrO2包覆层,包覆后前驱体晶体结构未变。
(4)包覆ZrO2的锂离子筛循环10次后,锰溶损率降低到0.34%,锂吸附量保持为24.4 mg·g-1,未包覆的锂离子筛循环10次后,锰溶损率为0.48%,锂吸附量为22.9 mg·g-1。包覆ZrO2的锂离子筛循环性能优异,晶胞收缩小,结构稳定。该研究结果为锂离子筛的研究提供了重要参考。
[1]MAPei-Hua(马培华).Adv.Earth Sci.(地球科学进展),2000,14(4):365-375
[2]Bi Q,Zhang Z,Zhao C,et al.Water Sci.Technol.,2014,70(10):1690-1694
[3]Xiang W,Liang S,Zhou Z,et al.Hydrometallurgy,2016,166:9-15
[4]Zhou Z,Qin W,Liu Y,et al.J.Chem.Eng.Data,2012,57(1):82-86
[5]Chitrakar R,Makita Y,Ooi K,et al.Chem.Lett.,2012,41(12):1647-1649
[6]Zandevakili S,Ranjbar M,Ehteshamzadeh M.Hydrometallurgy,2014,149:148-152
[7]Ooi K,Makita Y,Sonoda A,et al.Hydrometallurgy,2017,169:31-40
[8]Zhang Q,Li S,Sun S,et al.Chem.Eng.Sci.,2010,65(1):169-173
[9]MA Li-Wen(马立文),CHEN Bai-Zhen(陈白珍),SHI Xi-Chang(石西昌),et al.Chinese J.Inorg.Chem.(无机化学学报),2011,27(4):697-703
[10]Chitrakar R,Makita Y,Ooi K,et al.Bull.Chem.Soc.Jap.,2013,86(7):850-855
[11]Chitrakar R,Makita Y,Ooi K,et al.Ind.Eng.Chem.Res.,2014,53:3682-3688
[12]Li L,Qu W,Liu F,et al.Appl.Surf.Sci.,2014,315:59-65
[13]Li C,Zhang H P,Fu L J,et al.Electrochim.Acta,2006,51(19):3872-3883
[14]Chitrakar R,Kanoh H,Miyai Y,et al.Chem.Mater.,2000,12(10):3151-3157
[15]Zandevakili S,Ranjbar M,Ehteshamzadeh M.Hydrometallurgy,2014,149:148-152
[16]Hu SK,Cheng G H,Cheng M Y,et al.J.Power Sources,2009,188(2):564-569
[17]CHEN Yong-Xi(陈永熙),ZHOU Li-Juan(周立娟),GUO Li-Ping(郭丽萍),et al.J.Wuhan Univ.Technol.(武汉理工大学学报),2001,23(10):1-3
[18]MA Li-Wen(马立文),CHEN Bai-Zhen(陈白珍),SHI Xi-Chang(石西昌),et al.Chinese J.Inorg.Chem.(无机化学学报),2010,26(3):413-418
[19]Shi X C,Zhou D F,Zhang Z B,et al.Hydrometallurgy,2011,110(1):99-106
[20]Eichler A.Phys.Rev.B,2001,64(17):607-611
[21]Sun S Y,Xiao J L,Wang J,et al.Ind.Eng.Chem.Res.,2014,53(40):15517-15521
[22]Wang D,Li X H,Wang Z X,et al.Electrochim.Acta,2016,196:101-109
Synthesis and Adsorption Properties of Zr O2-Coated Lithium Ion-Sieve from Salt Lake Brine
ZrO2-coated H1.6Mn1.6O4was synthesized from Li1.6Mn1.6O4precursor prepared by a hydrothermal method.The liquid precipitation process followed by acid washing was utilized to coat ZrO2on the precursor.The structure,morphology and composition of the ZrO2-coated precursor were investigated by SEM,XRD,EDS and HRTEM analysis.The influences of coating content and roasting temperature on Mn dissolution loss ratio and Li adsorption capacity were discussed.The results indicate that a layer of ZrO2with 15 nm in thickness is coated on the precursor when ZrO2content is 3%and roasting temperature is 450℃.The Mn dissolution loss ratio decreases from 3.14%to 2.65%and Li adsorption capacity of the resulting ion sieve in the salt lake brine maintains 29.4 mg·g-1.After 10 cycles of adsorption and desorption,the corresponding Mn dissolution loss ratio and Li adsorption capacity is 0.34%and 24.4 mg·g-1,respectively.The adsorption capacity is higher than the bare lithium ion-sieve (22.9 mg·g-1).The results suggest that the structure and cycle stability of H1.6Mn1.6O4are improved by a ZrO2coating layer.
lithium ion-sieve;surface coating;Mn dissolution loss;Li adsorption capacity
O614.111;O647.3
A
1001-4861(2017)10-1775-07
10.11862/CJIC.2017.217
WANG Hao1YANG Xi-Yun*,1,2YIN Zhou-Lan2CAOGai-Fang1XU Hui1
(1School of Metallurgy and Environment,Central South University,Changsha 410083,China)
(2College of Chemistry and Chemical Engineering,Central South Universiyt,Changsha 410083,China)
2017-05-08。收修改稿日期:2017-08-22。
国家自然科学基金(No.51574286)、中国博士后基金(No.2016M592448)和中南大学博士后基金资助。*
。 E-mail:yxy7412@csu.edu.cn;会员登记号:。
