早期胃癌不同分化程度的临床病理学特征
2017-11-01孙东辉
周 琴,孙东辉,常 敏,汪 泳
1.兰州军区兰州总医院消化内科,甘肃 兰州 730050; 2.甘肃中医药大学
早期胃癌不同分化程度的临床病理学特征
周 琴1,2,孙东辉1,2,常 敏1,汪 泳1
1.兰州军区兰州总医院消化内科,甘肃 兰州 730050; 2.甘肃中医药大学
目的分析早期胃癌(early gastric cancer,EGC)不同分化程度的影响因素,为选择合适的治疗方案提供参考。方法回顾性分析兰州军区兰州总医院2011年1月-2016年1月收治资料齐全的EGC患者。分析EGC患者不同分化程度的病理因素,对年龄、性别、肿瘤部位、肿瘤大小、内镜分型、有无脉管浸润、浸润深度、淋巴结转移、地域特点及Her-2的表达情况与分化程度的关系进行单因素及多因素分析。结果254例EGC患者中,未分化型95例(37.4%)。Logistic回归多因素分析结果显示:年龄<60岁、女性、肿瘤部位靠下部、肿瘤>2 cm、内镜分型为Ⅲ型、黏膜下浸润、河西地区、有淋巴结转移是未分化型EGC的危险因素。有无脉管浸润、Her-2的表达情况与未分化型EGC无相关性。结论Logistic多因素分析显示,年龄、性别、肿瘤部位、内镜分型、浸润深度、地域特点是EGC分化程度的独立危险因素。
早期胃癌;分化类型;危险因素;临床特点
早期胃癌(early gastric cancer,EGC)是指肿瘤仅侵犯胃黏膜或黏膜下层,不考虑肿瘤大小及是否伴有淋巴结转移,该概念最早由日本学者提出[1]。EGC的治疗方法包括内镜下切除和外科手术。与传统外科手术相比,内镜下切除具有创伤小、并发症少、恢复快、费用低等优点,且两者疗效相当,5年生存率均可超过90%。因此,国际多项指南和共识均推荐内镜下切除作为EGC的首选治疗方式。目前国内较为公认的EGC内镜切除适应证:(1)绝对适应证:① 病灶大小≤2 cm、无合并溃疡的分化型黏膜内癌;② 胃黏膜高级别上皮内瘤变。(2)相对适应证:① 病灶大小>2 cm、无溃疡的分化型黏膜内癌;② 病灶大小≤3 cm、有溃疡的分化型黏膜内癌;③ 病灶大小≤2 cm、无溃疡的未分化型黏膜内癌;④ 病灶大小≤3 cm、无溃疡的分化型浅层黏膜下癌;⑤ 除外以上条件的EGC,伴有一般情况差、外科手术禁忌或拒绝外科手术者可视为ESD相对适应证[2]。所以,分化程度在选择相关治疗方案中至关重要。对EGC术前分期溃疡情况及病灶大小的研究已广受关注,但对分化程度的研究较少,本研究通过探讨EGC临床病理特征与分化程度的关系,以期为术前制定合理的治疗方式提供依据。
本研究通过对兰州军区兰州总医院2011年1月-2016年1月收治的254例EGC患者的临床和病理资料进行回顾性分析,探讨EGC不同分化程度的影响因素。此外,甘肃省是胃癌的高死亡率省份,从地区分布来看,甘肃省胃癌死亡率仍以河西地区武威市最高,全国第3次死因回顾抽样调查结果显示,甘肃省武威市胃癌死亡率全国最高,是全国平均水平的5.61倍[3]。本文根据患者的地域划分为河西及河东地区。
1 资料与方法
1.1一般资料收集兰州军区兰州总医院2011年1月-2016年1月行胃癌D2根治术的254例EGC患者。所有患者术前均行全腹及盆腔增强CT、胸片及胃镜检查,证实无远处转移及术前活检,男180例,女74例,年龄21~79岁,平均年龄56.9岁。部分EGC患者术前经过超声内镜及螺旋CT,明确无淋巴结转移。排除接受ESD/EMR治疗的患者;此外还需排除术前活检为EGC,术中探查无法切除者,术后病理为高级别上皮内瘤变者及进展期胃癌者。术后病理未描述分化程度者。符合纳入标准的254例EGC患者分为分化型组和未分化型组,其中分化型患者159例,未分化型患者95例。对比分析两组患者的临床病理资料。
1.2观察指标观察年龄、性别、肿瘤部位、肿瘤大小、内镜分型、淋巴结转移、有无脉管浸润、浸润深度、地域特点及Her-2的表达情况与分化程度的关系。依据WHO提出的年龄分段[4]将病例分为:年龄≤44岁的青年组、45~59岁的中年组及≥60岁的老年组;按照日本胃癌学会制定的《胃癌处理规约》第14版[5]将胃癌划分为3部分:胃上部癌、中部癌、下部癌;肿瘤大小以肿瘤最大径计算;参照2014年《日本胃癌规约(第4版)》将EGC大体类型分为隆起型、平坦型、凹陷型;胃癌常见的病理形态学分型根据WHO分型[6]分为分化型(differentiated carcinoma,DCA)(高分化腺癌、中分化腺癌、管状腺癌、乳头腺癌)和未分化型(undifferentiated carcinoma,UCA)(低分化腺癌、黏液腺癌、印戒细胞癌、未分化型)。浸润深度、淋巴结有无转移,根据术后病理结果确定。内镜分型按照2003年发表的食管、胃、结肠浅表性瘤样病变的巴黎分型[7]分为Ⅰ型(隆起型);Ⅱ型(浅表型),包括3个亚型:Ⅱa型(浅表隆起型)、Ⅱb型(浅表平坦型)、Ⅱc型(浅表凹陷型);Ⅲ型(凹陷型)。术前增强CT及术中探查情况决定是否有血行转移。甘肃河西地区包括酒泉、张掖、武威、金昌、嘉峪关5个地级市;甘肃河东地区包括9个地州市,分别是兰州市、天水市、庆阳市、平凉市、白银市、定西市、陇南市、临夏州、甘南州。
1.3统计学方法采用SPSS 19.0软件进行统计学分析。分化程度与临床病理因素的关系分析采用卡方检验,多因素分析采用二分类Logistic回归模型,P<0.05为差异有统计学意义。
2 结果
2.1临床表现两组患者最常见的临床表现均为腹部疼痛、胀痛、烧心、反酸、黑便,且未分化型EGC患者腹部胀痛发生率明显高于分化型。分化型EGC患者消瘦发生率明显高于分化型。烧心、反酸在未分化型EGC患者中发生率约为分化型EGC的1/2,呕血在未分化型EGC患者中发生率约为分化型EGC的1/2,但差异无统计学意义(P>0.05)。其他表现,如乏力、进食后不适、嗳气等症状在未分化型EGC和分化型EGC患者中发生率相似(见表1)。
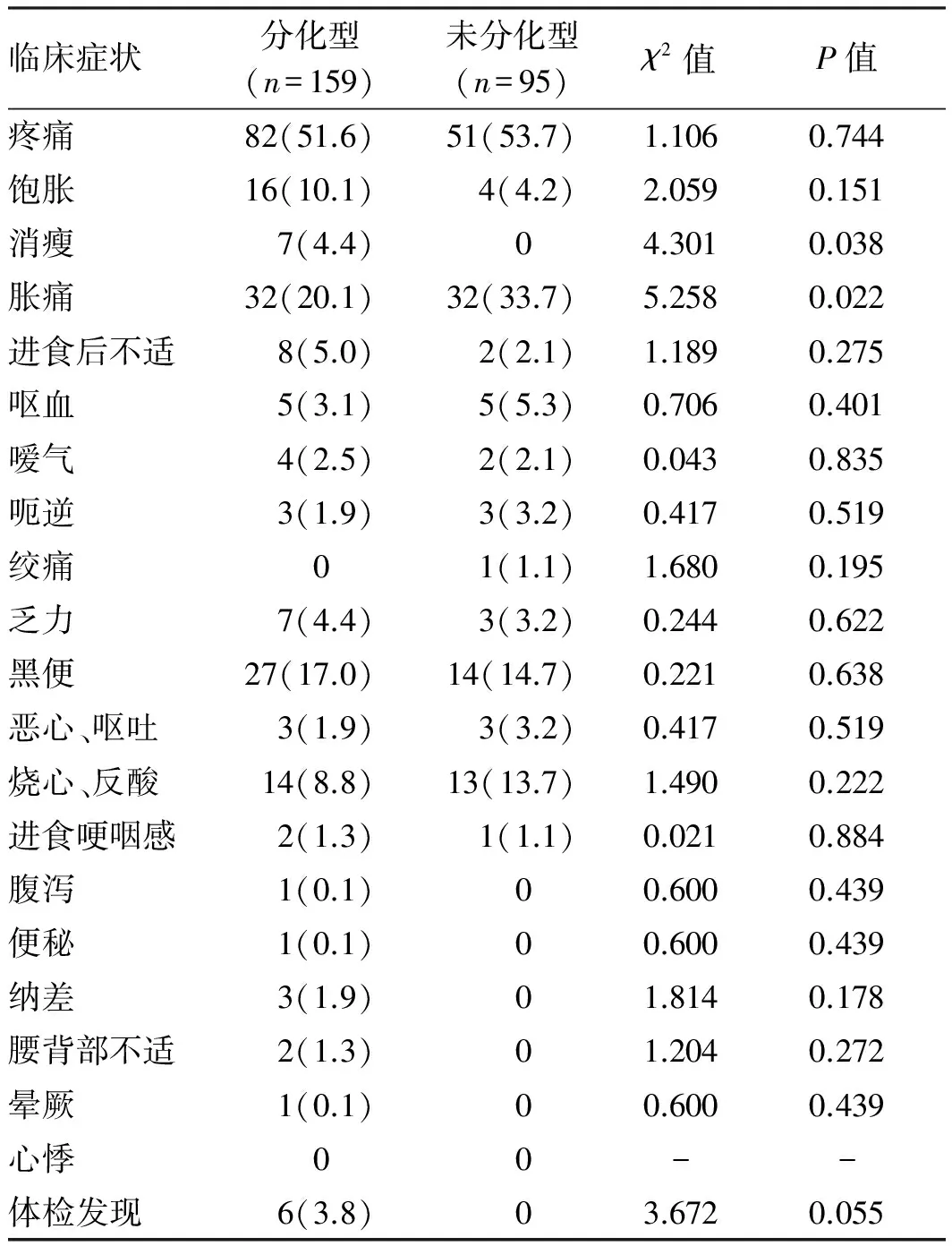
表1 不同分化程度的EGC患者的临床症状比较[例数(%)]
2.2EGC分化程度的单因素分析年龄、性别、肿瘤部位、肿瘤大小、内镜分型、浸润深度、地域特点、淋巴结转移与EGC分化程度相关(P<0.05)。有无脉管浸润、Her-2的表达情况与EGC分化程度无关(见表2)。

表2 不同分化程度的EGC患者的临床资料比较[例数(%)]
2.3EGC分化程度的多因素分析结果Logistic多因素回归分析显示,年龄、性别、肿瘤部位、内镜分型、浸润深度、地域特点是未分化型EGC的独立危险因素,其相对危险度分别为0.482、2.686、1.930、1.478、2.230、0.288(见表3)。
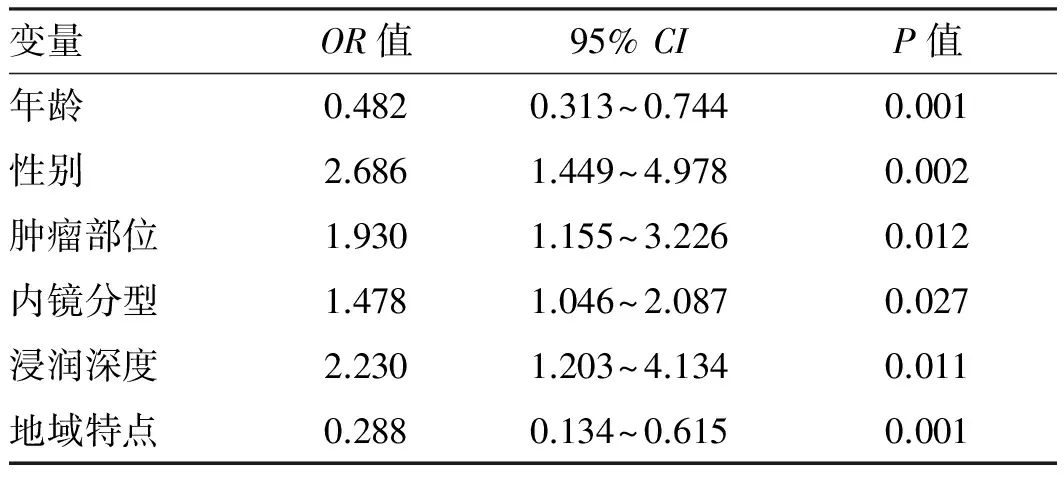
表3 Logistic多因素回归分析结果
3 讨论
与进展期胃癌相比,EGC远期生存时间存在显著优势,其5年存活率达90%,其中无淋巴结转移者5年存活率高达94.2%[8]。传统D2根治术疗效与内镜下治疗具有相同的生存期,而内镜下治疗具有创伤小、未破坏正常消化道结构、并发症小等优势,因此,严格适应证下内镜切除已经被广泛接受。随着EGC检出技术的提高,微创手术迅速发展,术前明确肿瘤分化程度可为患者选择合适的治疗方式。术前确定分化程度的方法有活检病理、共聚焦激光显微内镜等,然而准确率不尽人意。有研究[9]表明,术前活检与术后病理分化程度符合率为70%~90%。吴巍等[10]认为,术前、术后不符原因主要为:(1)活检标本小、数量小,挤压严重,癌组织分化类型不能代表整个癌灶的分化类型,即便其主要成分为未分化腺癌,由于取材的深度不一,其结果有差异;同时存在几种组织学类型,由于活检标本小,尚不易区分何种组织学类型占优势;(2)疾病处于动态发展中,若尚未表现出浸润性,在取材有限的活检中诊断为高级别上皮内瘤变是不矛盾的;(3)不同资历的内镜医师取材部位不一,高资历的内镜医师漏诊、误诊率低,取材部位较关键。隆起型病灶应取其顶部、基底部、糜烂粗糙处、色泽改变处;而平坦型病灶应在病灶周边薪膜皱璧中断处及中央处钳取;另外,溃疡样病灶不应在其病灶底部及表面取材,若在此处取材,常只能取到坏死及渗出组织,胃腺癌阳性率非常低,也易出血,故应在溃疡样病灶隆起边缘内侧处钳取。因此,明确术前肿瘤的分化程度显得较为重要[11]。
EGC以腺癌最为常见,分化型胃癌多于未分化型胃癌,本研究发现,年龄、性别、肿瘤部位、浸润深度、地域特点在EGC组织学分型中有差异。未分化型EGC常见于女性及青年患者,肿瘤多位于远端及黏膜层浸润,内镜分型多为Ⅲ型。分化型EGC常见于男性及老年患者,肿瘤多位于近端及黏膜下层浸润,内镜分型多为Ⅱ型。
就年龄而言,胃癌的发病高峰年龄段为50~70岁,未分化型EGC多见于<45岁的青年人,在本研究病理分型中,未分化癌在青年组中多见,青年未分化型癌的比例较中老年组明显升高,年龄是分化程度的独立危险因素。年龄越小,胃癌恶性程度越高,低分化型胃癌细胞蛋白代谢旺盛,分裂增殖能力强,肿瘤进展快[12]。Rona等[13]回顾性分析了121例青年EGC的临床病理学特征及生存时间,结果表明,青年EGC组比老年组更容易进展成Ⅲ期或Ⅳ期胃癌,病理学类型多为低分化腺癌和印戒细胞癌。Bao等[14]表明低分化腺癌易发生早期转移,也是发生异时转移的独立危险因素。此外,H.pylori感染可能是导致青年胃癌分化不良的重要因素之一,目前认为H.pylori感染主要作用于胃癌起始阶段,并在胃癌发生中可能起着辅助性的致癌作用。目前H.pylori感染作用及机制尚不明确,有学者[15]认为,H.pylori感染是青年胃癌和弥漫性胃癌发生的高危因素。但也有研究[16-17]表明,与其基因、蛋白分子水平的机制有关。
Zhou等[18]分析了年龄<40岁的胃癌患者的特点,与老年组相比,胃癌多见于年轻女性,且多为未分化型,具有胃癌家族史。有研究[19]认为,这与女性性激素分泌有关,雌激素可通过阻断细胞于核分裂中期,形成较多的非整倍体细胞而导致癌变。因此,在制定早期患者治疗方案时应考虑到年龄及性别的影响,在青年女性胃癌患者中应注重早期筛查,早期诊断、根治性手术。
EGC主要分布在胃窦、胃角和胃体小弯侧,尤以胃窦小弯侧居多。本研究表明,未分化型EGC好发于胃下部,随着发病部位的下移,未分化型EGC的比例有所增加,而分化型胃癌多位于胃上部,且差异有统计学意义,与Ichikawa等[20-22]报道结果一致。
本研究表明,内镜下分型为Ⅲ型在未分化型EGC中所占的比例比Ⅰ型及Ⅱ型高,且差异有统计学意义。Nakamura等[23]报道,Ⅲ型是淋巴结转移的危险因素,且Ⅲ型EGC易表现黏膜下浸润及淋巴结转移的比例比Ⅰ型高,提示Ⅲ型EGC具有较高的恶性潜能,虽然Ⅰ型EGC病变的平均大小大于Ⅲ型EGC,但Ⅰ型与Ⅲ型相比表现出较低的细胞增殖率和更高的细胞凋亡率。这些结果表明,Ⅲ型较Ⅰ型具有较高的恶性潜能。因此,即使肿瘤仅局限于黏膜内的Ⅲ型EGC,在选用EMR或ESD治疗时,需要仔细随访淋巴结转移和局部复发情况。此外,EMR或ESD建议用于Ⅰ型EGC,不建议用于Ⅲ型EGC[24]。
此外,还发现甘肃省河西地区未分化型胃癌多于河东地区,河西地区是未分化型EGC的独立危险因素。文献[3]表明,甘肃省是胃癌的高死亡率省份,从地区分布来看,甘肃省胃癌死亡率仍以河西地区为最高,虽然Her2在本组研究中表达差异无统计学意义,但其在胃癌的发生、发展中也起到了至关重要的作用,成为一个治疗胃癌的分子靶点,进而从分子水平阻断肿瘤恶性生物学行为[25]。
在临床表现上,两组均以腹痛、腹胀、腹部胀痛、呕血、黑便、烧心、反酸为主要表现,其中分化型还表现为消瘦、乏力、进食后不适、体检时发现,此外可有呃逆、恶心、呕吐,而未分化型EGC缺乏特异性表现,因此,我们认为应高度重视未分化型EGC的上述特征,做到早期发现、早期治疗。对于有肿瘤家族史的年轻女性患者,包括妊娠和哺乳期均应积极进行必要的筛查。青年患者有不明原因上腹痛、消瘦等,应加以胃镜排查,以发现胃癌及减少进展期胃癌的发生。目前国内对EGC的研究较少,且多为病例回顾性研究,以后需要进一步开展大样本、前瞻性随机对照试验,以便更加全面地反映我国EGC不同分化类型的临床病理特点,并为临床诊治提供依据。
[1] Yamada T, Sugiyama H, Ochi D, et al. Risk factors for submucosal and lymphovascular invasion in gastric cancer looking indicative for endoscopic submucoasl dissection [J]. Gastric Cancer, 2014, 17(4): 692-696.
[2] 廖专, 孙涛, 吴浩, 等. 中国早期胃癌筛查及内镜诊治共识意见(2014年4月·长沙)[J]. 胃肠病学, 2014, 19(7): 408-427.
[3] 刘玉琴, 禄韶华, 张小栋, 等. 甘肃省胃癌死亡率变化及近期预测[J]. 中国肿瘤, 2010, 19(5): 314-318.
Liu YQ, Lu SH, Zhang XD, et al. The trend of mortality and short term prediction of stomach cancer in Gansu province [J]. China Cancer, 2010, 19(5): 314-318.
[4] 人类年龄划分又有新标准[J]. 民俗研究, 2001, 17(3): 26.
[5] 日本胃癌学会编. 胃癌处理规约[M]. 14版. 东京: 金原出版, 2010.
Japan Gastric Cancer Society. Treatment of gastric cancer [M]. 14th ed. Tokyo: Jinyuan Press, 2010.
[6] 谢静, 方军, 金木兰, 等. 胃癌病理分型研究进展[J]. 中国实用内科杂志, 2014, 34(6): 626-630.
[7] Inoue H, Kashida H, Kudo S, et al. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002 [J]. Gastrointest Endosc, 2003, 58(6 Suppl): S3-S43.
[8] 尹杰, 蔡军, 张军, 等. 早期胃癌淋巴结转移相关危险因素研究[J]. 中国实用外科杂志, 2016, 36(1): 111-114.
Yin J, Cai J, Zhang J, et al. Study on related risk factors and prognosis for lymph node metastasis in patients with early gastric cancer [J]. Chinese Journal of Practical Surgery, 2016, 36(1): 111-114.
[9] 李玉强, 汤玉成, 孔德全, 等. 早期胃癌分化程度与临床病理因素的相关性分析[J]. 重庆医科大学学报, 2015, 40(5): 754-758.
Li YQ, Tang YC, Kong DQ, et al. Correlation between differentiation degree of early gastric cancer and clinical pathological factors [J]. Journal of Chongqing Medical University, 2015, 40(5): 754-758.
[10] 吴巍, 郭滟, 蔚青, 等. 胃黏膜活检高度上皮内瘤变的手术病理对比研究[J]. 中华消化杂志, 2007, 27(8): 505-508.
Wu W, Guo Y, Wei Q, et al. Comparison between biopsy-confirmed high grade intraepithelial neoplasia of gastric mucosa and corresponding surgical results [J]. Chin J Dig, 2007, 27(8): 505-508.
[11] 谢蕴, 赵填, 潘玉林, 等. 早期胃癌胃镜活组织检查与手术标本病理学诊断的差异及原因[J]. 内科理论与实践, 2010, 5(3): 246-247.
Xie Y, Zhao T, Pan YL, et al. Differences and reasons of pathologic diagnosis between endoscopic biopsy and operation specimen in early gastric adenocarcinoma [J]. J Intern Med Concepts Pract, 2010, 5(3): 246-247.
[12] 郭震, 王春祥, 王培林, 等. 胃癌患者血浆胆固醇、LDL与胃癌组织病理分型的相关性研究[J]. 山东大学学报(医学版), 2007, 45(2): 160-162, 167.
Guo Z, Wang CX, Wang PL, et al. Correlation among pathology grouping, serum cholesterol and LDL in patients with gastric cancer [J]. Journal of Shandong University (Health Sciences), 2007, 45(2): 160-162, 167.
[13] Rona KA, Schwameis K, Zehetner J, et al. Gastric cancer in the young: An advanced disease with poor prognostic features [J]. J Surg Oncol, 2017, 115(4): 371-375.
[14] Bao J, Qu G, Fu W, et al. Clinicopathological features of gastric adenocarcinoma patients with metachronous distant metastasis [J]. Tumour Biol, 2015, 36(8): 6375-6382.
[15] Haruma K, Komoto K, Kamada T, et al. Helicobacter pylori infection is a major risk factor for gastric carcinoma in young patients [J]. Scand J Gastroenterol, 2000, 35(3): 255-259.
[16] Hirahashi M, Yao T, Matsumoto T, et al. Intramucosal gastric adenocareinoma of poorly differentiated type in the young is characterized by Helicobacter pylori infection and antral lymphoid hyperplasia [J]. Mod Pathol, 2007, 20(1): 29-34.
[17] Tavares A, Gandra A, Viveiros F, et al. Analysis of clinicopathologie characteristics and prognosis of gastric cancer in young and older patients [J]. Pathol Oncol Res, 2013, 19(1): 111-117.
[18] Zhou F, Shi J, Fang C, et al. Gastric carcinomas in young (younger than 40 years) Chinese patients: clinicopathology, family history, and postresection survival [J]. Medicine (Baltimore), 2016, 95(9): e2873.
[19] Hong TS, Kriesel KJ, Hartig GK, et al. Parotid area lymph node metastases from cutaneous squamous cell carcinoma: implications for diagnosis, treatment, and prognosis [J]. Head Neck, 2005, 27(10): 851-856.
[20] Ichikawa D, Komatsu S, Kosuga T, et al. Clinicopathological characteristics of clinical early gastric cancer in the upper-third stomach [J]. World J Gastroenterol, 2015, 21(45): 12851-12856.
[21] 邓程伟, 申竑. 胃癌Lauren分型与其临床病理特点及预后的关系[J]. 实用癌症杂志, 2014, 29(4): 394-396.
Deng CW, Shen H. Clinical features and prognosis of Lauren classification of gastric cancer [J]. The Practical Journal of Cancer, 2014, 29(4): 394-396.
[22] Qiu MZ, Cai MY, Zhang DS, et al. Clinicopathological characteristics and prognostic analysis of Lauren classification in gastric adenocarcinoma in China [J]. J Transl Med, 2013, 11: 58.
[23] Nakamura T, Yao T, Kakeji Y, et al. Depressed type of intramucosal differentiated-type gastric cancer has high cell proliferation and reduced apoptosis compared with the elevated type [J]. Gastric Cancer, 2013, 16(1): 94-99.
[24] 孙洪鑫, 邹文斌, 廖专, 等. 中国EGC临床病理特点[J]. 中国实用内科杂志, 2014, 34(6): 631-634.
[25] Kunz PL, Mojtahed A, Fisher GA, et al. HER2 expression in gastric and gastroesophageal junction adenocarcinoma in a US population: clinicopathologic analysis with proposed approach to HER2 assessment [J]. Appl Immunohistochem Mol Morphol, 2012, 20(1): 13-24.
(责任编辑:王全楚)
Clinicopathologicalfeatureofearlygastriccancerwithdifferentdegreesofdifferentiation
ZHOU Qin1,2, SUN Donghui1,2, CHANG Min1, WANG Yong1
1.Department of Gastroenterology, Lanzhou General Hospital of Lanzhou Military Command, Lanzhou 730050; 2.School of Clinical Medicine, Graduate School, Gansu University of Chinese Medicine, China
ObjectiveTo analyze the influencing factors of different degrees of differentiation of early gastric cancer (EGC), and to provide reference for the selection of appropriate treatment.MethodsEGC patients were selected in Lanzhou General Hospital of Lanzhou Military Command from Jan. 2011 to Jan. 2016. Pathological factors of EGC patients with different degrees of differentiation were analyzed. Univariate and multivariate analysis showed the relationship of age, sex, tumor site, tumor size, endoscopic classification, invasion of lymphatic vessels, depth of invasion, regional characteristics and the expression of Her-2 with the degrees of differentiation.ResultsIn 254 cases of EGC, undifferentiated patients were 95 cases (37.4%). Logistic regression analysis showed that age less than 60 years old, female, tumor location down, tumor on the lower than 2 cm, endoscopic classification type (type Ⅲ), submucosal infiltration, Hexi region, lymph node metastasis were risk factors of undifferentiated EGC. Vascular invasion and Her-2 expression were not correlated with undifferentiated EGC.ConclusionLogistic multivariate analysis showed that age, sex, tumor site, endoscopic type, depth of invasion, and region are independent risk factors of differentiation of EGC.
Early gastric cancer; Differentiation type; Risk factors; Clinical features
R735.2
A
1006-5709(2017)10-1141-05
2017-02-03
周琴,硕士研究生,医师,研究方向:消化内科。E-mail:1255227954@qq.com
汪泳,硕士研究生,副主任医师,研究方向:消化道肿瘤。E-mail:wangyong1993@163.com
10.3969/j.issn.1006-5709.2017.10.019
