PM2.5对大鼠子宫组织形态及氧化应激效应的影响
2017-11-01张丰泉董恩恒王建强曹锦程郭旭东吴卫东
张丰泉,董恩恒*,王建强,曹锦程,郭旭东,吴卫东
(1. 新乡医学院公共卫生学院新乡市大气污染健康效应与干预重点实验室,新乡 453000; 2. 新乡医学院第三附属医院病理科,新乡 453000)
研究报告
PM2.5对大鼠子宫组织形态及氧化应激效应的影响
张丰泉1,董恩恒1*,王建强2,曹锦程1,郭旭东1,吴卫东1
(1. 新乡医学院公共卫生学院新乡市大气污染健康效应与干预重点实验室,新乡 453000; 2. 新乡医学院第三附属医院病理科,新乡 453000)
目的探究PM2.5对大鼠子宫组织生理及相关生化应激效应的影响。方法将30只SD雌鼠随机分为3个不同PM2.5暴露组(生理盐水对照组、1.5 mg/kg PM2.5低剂量组和37.5 mg/kg PM2.5高剂量组)。PM2.5暴露10 d后,将雌鼠处死,HE染色观察子宫组织病理变化,并检测子宫组织中SOD、GSH、MDA和LDH含量。结果与对照组相比,PM2.5暴露组雌鼠子宫组织结构异常,内膜上皮细胞变薄,排列混乱;固有层基质细胞和血管减少。氧化应激指标检测结果显示,高剂量组MDA和LDH含量分别为(6.53±1.24)nmol/mg prot和(265.62±24.65)U/g prot,明显高于对照组(P<0.05);高剂量组和低剂量组SOD和GSH含量均明显低于对照组(P<0.05)。结论PM2.5可对大鼠子宫组织形态造成破坏,并诱发子宫相关的氧化应激反应。
PM2.5;大鼠;子宫;氧化应激;组织形态
PM2.5是空气动力学直径小于2.5 μm的细颗粒物,能够进入肺泡毛细血管中,并沉积于肺泡,有50%的PM2.5不能排出,随血液进入体内[1],对人体造成持久性危害。流行病学调查发现,PM2.5是II型糖尿病[2]、心血管系统疾病[3]、呼吸系统疾病[4]等疾病的重要环境危害因子。即使短期急性的PM2.5暴露依然能够使心肌梗死[5]和呼吸系统疾病[6]的发病率明显升高。
2010年全球有270万早产儿与母亲的PM2.5暴露有关[7]。Schembari等[8]在研究空气污染物对新生儿的影响中发现,妊娠晚期孕妇暴露的PM2.5量相对增加5 μg/m3时,新生儿的头围、体重、股三头肌、肩胛下皮脂厚度均会降低。但因不同的研究在暴露评价标准、暴露污染物成分、研究设计、调查人群数量及人口特征等方面的差异性,PM2.5对妊娠的影响的结果有很大的差异性[9]。目前PM2.5对妊娠的影响还存在争议,且多数研究只是关注于PM2.5对妊娠结局的影响,鲜有PM2.5对生殖系统影响的相关研究报道。本研究将雌性大鼠作为受试对象暴露于不同浓度的PM2.5,观察PM2.5对雌鼠子宫的影响。
1 材料与方法
1.1材料
1.1.1 实验动物
4周龄清洁级SD雌性大鼠30只,体重80~100 g,购于北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】,大鼠饲养于河南省生物精神病学重点实验室【SYXK(豫)2014-0005】。实验符合新乡医学院实验动物福利和伦理委员会的要求。
1.1.2 实验仪器与试剂
大流量粉尘采样器(TE6070,美国Tisch Environmental);真空冷冻干燥机(2-4LD Plus,德国Marin Christ公司);酶标仪(Enspire,美国PerkinElmer公司);超声清洗器(KQ-500E,昆山市超声仪器有限公司);匀浆机(DY89-II,宁波新芝生物科技股份有限公司),氧化应激相关检测试剂盒(南京建成生物工程研究所),其他试剂均为分析纯。
1.2实验方法
1.2.1 PM2.5收集和悬液制备
用大流量粉尘采样器于新乡医学院高层建筑楼顶(采样点周边无明显遮挡物及污染源)将PM2.5收集在聚四氟乙烯滤膜上。采样时间:2015年12月1日— 2016年1月31日,每次连续采样24 h。采样结束后将滤膜取下并用锡纸包裹,置于干燥器中48 h。然后将滤膜剪成1 cm2左右的小块,放入含有50 mL超纯水的烧杯中,超声震荡30 min。重复2次,8层纱布过滤震荡液,将滤液置于真空冷冻干燥机中冻干。将收集到的PM2.5用生理盐水配置成不同浓度的PM2.5悬液(对照:生理盐水、低浓度:2 mg/mL和高浓度:50 mg/mL),4℃保存,用前摇匀。
1.2.2 实验动物分组
适应性喂养1 周后,将30只雌鼠随机分为对照组(生理盐水)、低剂量组(1.5 mg/kg)和高剂量组(37.5 mg/kg),每组10只。
1.2.3 雌鼠PM2.5气管滴注
采用吸入式大鼠气管滴注法[10]对雌鼠进行PM2.5吸入暴露。乙醚将大鼠麻醉后,称量大鼠体重,用棉线挂住上切牙垂直悬空,用镊子将大鼠舌头拉出,移液器吸取PM2.5悬液并注入舌根部,滴注量为75 μL/100 g体重,然后快速捏住大鼠的鼻腔,迫使其通过口腔呼吸从而使 PM2.5悬液吸入肺内,当听到湿罗音时,则表明滴注成功。滴注完成后,将大鼠放回鼠笼,自由饮水、进食。
1.2.4 子宫病理组织观察和氧化应激指标检测
大鼠连续滴注PM2.5悬液10 d后,处死大鼠。将取出的新鲜子宫组织用生理盐水充分冲洗,4%多聚甲醛固定24 h,逐步脱水法脱水,二甲苯透明,石蜡包埋,切片(5~6 μm),然后HE染色,镜下观察子宫组织变化。
取10 g新鲜子宫组织,按1∶9加入生理盐水,冰上剪碎组织,冰浴制备组织匀浆液,3000 r/min离心10 min,取组织上清液待用。严格按照试剂盒说明,检测子宫匀浆组织中SOD、MDA、GSH和LDH的含量。
1.3统计分析
应用SPSS 17.0分析软件进行统计学分析。氧化应激相关指标应用单因素方差分析法,组间比较时,方差齐时采用LSD法检验,方差不齐时采用Games-Howell法检验。以P<0.05为差异有统计学意义。
2 结果
2.1PM2.5对子宫组织病理学的影响
不同剂量PM2.5对子宫组织病理学影响结果见图1。对照组雌鼠子宫组织结果正常,内膜上皮为柱状上皮细胞,排列整齐且较厚;固有层含丰富的基质细胞和血管(图 1A)。PM2.5暴露组雌鼠子宫组织结构发现异常,内膜上皮细胞变薄,排列混乱;固有层基质细胞和血管减少。随着暴露浓度的增加大鼠子宫组织的病理变化越明显(图 1B和C)。
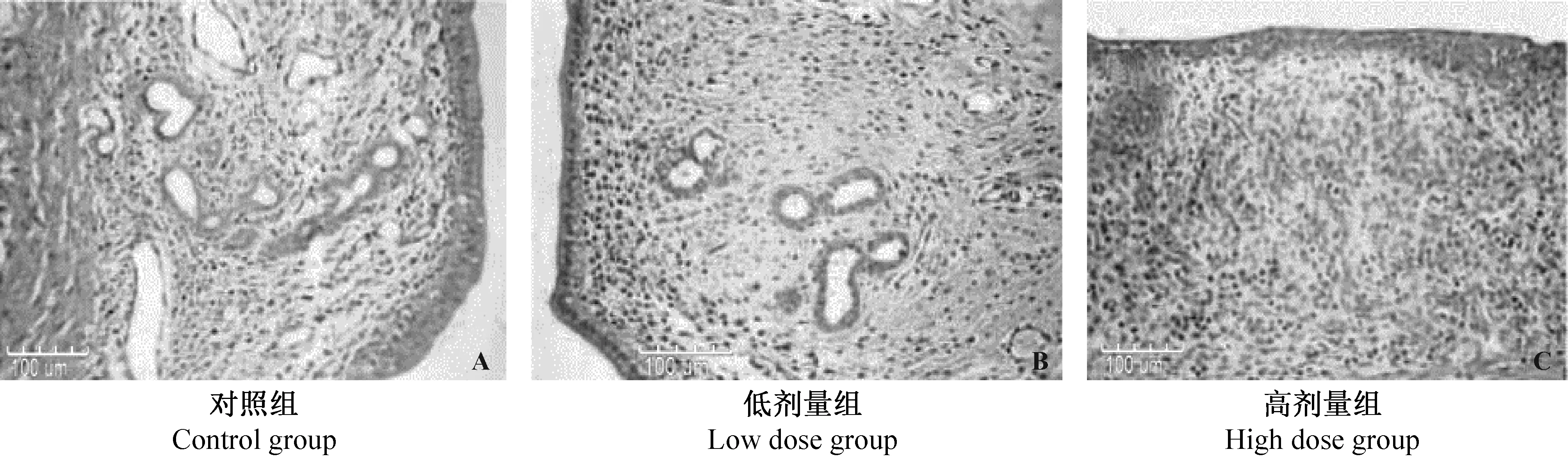
图1 PM2.5对子宫组织的影响(H&E×200)Fig.1 Effects of different doses of PM2.5 on histopathology of the rat uteri(H&E staining)
2.2PM2.5对子宫氧化损伤指标MDA和LDH含量的影响
不同剂量PM2.5对子宫组织中MDA、LDH、SOD和GSH含量影响的结果见表1。与对照组相比,低剂量和高剂量PM2.5暴露组子宫组织中MDA含量均不同程度的升高,高剂量组子宫MDA含量明显高于对照组,差异有显著性(P=0.008),低剂量组子宫MDA含量与对照相比,差异无显著性(P=0.755);另外高剂量组子宫MDA含量明显高于低剂量子宫组织MDA含量(P=0.013)。不同暴露组雌鼠子宫组织中LDH含量的变化趋势与MDA的变化趋势相似,但只有高剂量组雌鼠子宫组织中LDH含量明显高于对照组,差异有显著性(P=0.040)。
与对照组相比,低剂量和高剂量PM2.5暴露组子宫组织SOD活力明显降低(P=0.012和0.017),且随着暴露剂量的增加,SOD活力逐渐降低,但低剂量组和高剂量组宫组织SOD活力差异无显著性(P=0.826)。
不同暴露组子宫组织GSH含量明显低于对照组,差异均有显著性(P=0.041和0.001);随着暴露剂量的增加,子宫GSH含量逐渐降低,高剂量组中GSH含量明显低于低剂量组(P=0.037)。
表1 不同剂量PM2.5对子宫MDA和LDH含量的影响Tab.1 Effects of PM2.5 on the contents of MDA and LDH in the rat uteri
注:aP<0.05 vs对照组;bP<0.05 vs低剂量组。
Note. vs. the control group,aP<0.05; vs. the low dose group,bP<0.05.
3 讨论
近年来中国空气质量面临严峻挑战,尤其是大气细颗粒物(PM2.5)污染。国家环保部发布的最新环境公报显示,2014年我国161个检测城市中,90%以上的城市年空气质量未能达标,主要空气污染物是颗粒物[11]。2012年,世界卫生组织(WHO)发布的《全球疾病负担评估》(GBD)报告显示,在67种导致过早死亡的主要风险因子中,PM2.5位居第7位;在中国,PM2.5位居第4位,仅次于不良饮食习惯、高血压和吸烟[12]。潘小川等[13]的研究报告显示,2013年我国31座省会城市和直辖市平均因PM2.5,其造成的额外死亡率达到了0.89‰。
新生儿出生时的状态将直接决定婴幼儿出生后的身体状况,且会对其将来的健康产生长期的影响。目前已有大量关于PM2.5与妊娠结局相关性的流行病学调查。Kloog等[14]研究发现新生儿出生体重与孕期PM2.5暴露量呈负相关关系。孕期不同时间段暴露PM2.5,其对妊娠结局的影响不尽相同。Huynh等[15]的调查表明,怀孕首月暴露PM2.5,孕妇出现早产风险上升21%;而分娩前的2周暴露PM2.5,其出现早产风险上升17%。由之前的文献报道可知PM2.5对妊娠结局产生不良的影响,但当前的研究大多关注的是妊娠期暴露PM2.5对妊娠结局的影响,PM2.5暴露对生殖系统影响的相关研究非常少。本研究中,将雌鼠作为受试对象,暴露于不同浓度PM2.5,观察PM2.5对雌鼠子宫的损伤作用。本次实验病理学检查结果显示,PM2.5能够引起子宫组织结构异常,内膜上皮细胞变薄,排列混乱;固有层基质细胞和血管减少,且随着PM2.5暴露水平增加子宫组织的病理变化越明显,实验结果证明了PM2.5对子宫的组织结构损伤作用。
颗粒物毒性作用机制主要包含细胞的氧化损伤、促炎性反应、DNA损伤、促凝血作用[16]。子宫不仅是产生月经和孕育胎儿的器官,而且在引导血液流向骨盆、卵巢和外生殖器的过程中起重要作用。氧化应激是机体在内外有害因素影响下造成氧化与抗氧化作用的失衡,诱发细胞、组织发生脂质过氧化和DNA损伤等,其与多种疾病的发病有关。已有细胞实验表明,PM2.5能够诱导细胞中产生大量ROS,诱发细胞氧化应激反应[17]。Saenen等[18]研究发现,PM2.5能够诱发胎盘发生氧化应激反应,致使胎盘组织发生DNA甲基化。本次实验同样检测了子宫中氧化应激指标,实验结果显示,与对照组相比,PM2.5暴露组MDA和LDH含量明显升高,且随着暴露水平升高而增加,由此可见PM2.5暴露能够诱发子宫组织发生脂质过氧化反应。同时PM2.5暴露能明显降低子宫组织中的SOD活力和GSH含量,子宫组织的抗氧化能力降低。本次实验结果表明,妊娠前暴露PM2.5可造成子宫发生氧化应激反应,破坏子宫组织。
[1] Valavanidis A, Fiotakis K, Vlachogianni T. Airborne particulate matter and human health: toxicological assessment and importance of size and composition of particles for oxidative damage and carcinogenic mechanisms [J]. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev, 2008, 26(4): 339-362.
[2] Malmqvist E, Larsson HE, Jonsson I, et al. Maternal exposure to air pollution and type 1 diabetes-accounting for genetic factors [J]. Environ Res, 2015, 140: 268-274.
[3] Kowalska M, Kocot K. Short-term exposure to ambient fine particulate matter (PM2,5 and PM10) and the risk of heart rhythm abnormalities and stroke [J]. Postepy Hig Med Dosw (Online), 2016, 70(0): 1017-1025.
[4] Li R, Jiang N, Liu QC, et al. Impact of air pollutants on outpatient visits for acute respiratory outcomes [J]. Int J Environ Res Public Health, 2017, 14(1): 47.
[5] Shah AS, Langrish JP, Nair H, et al. Global association of air pollution and heart failure: a systematic review and meta-analysis [J]. Lancet, 2013, 382(9897): 1039-1048.
[6] Wu SW, Ni Y, Li HY, et al. Short-term exposure to high ambient air pollution increases airway inflammation and respiratory symptoms in chronic obstructive pulmonary disease patients in Beijing, China [J]. Environ Int, 2016, 94: 76-82.
[7] Malley CS, Kuylenstierna JC, Vallack HW, et al. Preterm birth associated with maternal fine particulate matter exposure: A global, regional and national assessment [J]. Environ Int, 2017, 101: 173-182.
[8] Schembari A, de Hoogh K, Pedersen M, et al. Ambient air pollution and newborn size and adiposity at birth: differences by maternal ethnicity (the Born in Bradford Study Cohort) [J]. Environ Health Perspect, 2015, 123(11):1208-1215.
[9] Ritz B, Wilhelm M. Ambient air pollution and adverse birth outcomes: methodologic issues in an emerging field [J]. Basic Clin Pharmacol Toxicol, 2008, 102(2): 182-190.
[10] 晋乐飞, 吴卫东, 张巧, 等. 吸入式气管滴注法的建立 [J]. 郑州大学学报 (医学版), 2015, 50(1): 75-78.
[11] 中华人民共和国环境保护部. 2014中国环境状况公报[EB/OL]. http://jcs.mep.gov.cn/hjzl/zkgb/2013zkgb, 2015-5-19.
[12] Lim SS, Vos T, Flaxman AD, et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010 [J]. Lancet, 2012, 380: 2224-2260.
[13] 潘小川, 刘利群, 张思齐, 等. 大气PM2.5对中国城市公众健康效应研究 [M]. 北京:科学出版社, 2016: 46.
[14] Wilhelm M, Ritz B. Local variations in CO and particulate air pollution and adverse birth outcomes in Los Angeles County, California, USA [J]. Environ Health Perspect, 2005, 113(9): 1212-1221.
[15] Huynh M, Woodruff TJ, Parker JD, et al. Relationships between air pollution and preterm birth in California [J]. Paediatr Perinat Epidemiol, 2006, 20(6): 454-461.
[16] Nel A, Xia T, Mädler L, et al. Toxic potential of materials at the nanolevel [J]. Science, 2006, 311(5761): 622-627.
[17] 何俊, 王以美, 赵增明, 等. PM2.5引起人胚胎干细胞来源的成纤维细胞氧化损伤的研究 [J]. 中华预防医学杂志, 2016, 50(8): 705-709.
[18] Saenen ND, Vrijens K, Janssen BG, Lower placental leptin promoter methylation in association with fine particulate matter air pollution during pregnancy and placental nitrosative stress at birth in the ENVIRONAGE Cohort [J]. Environ Health Perspect, 2017, 125(2): 262-268.
PM2.5inducesoxidativestressandhistopathologicalchangesintheuterusofrats
ZHANG Feng-quan1, DONG En-heng1*, WANG Jian-qiang2, CAO Jin-cheng1, GUO Xu-dong1, WU Wei-dong1
(1. Key Laboratory for Air Pollution Health Effects and Intervention of Xinxiang, School of Public Health, Xinxiang Medical University, Xinxiang 453000,China; 2. Department of Pathology, the Third Affiliated Hospital of Xinxiang Medical University, Xinxiang 453000)
ObjectiveThe aim of this work was to study whether PM2.5induces oxidative stress and histopathological changes in uterine tissue of rats.MethodsThirty 4-week-old female Sprague-Dawley rats were randomly divided into the control group (normal saline), the low dose of PM2.5group (1.5 mg/kg) and the high dose of PM2.5group (37.5 mg/kg). After exposed to PM2.5for 10 days, the rats were sacrificed to examine the histopathological changes in uterine tissues using H&E staining. The contents of SOD, GSH, MDA and LDH were also determined in the uterine tissues.ResultsCompared with the control group, PM2.5caused changes in the uterine structure, showing a thinner endometrial epithelium and reduction of stromal cells and blood vessels. The assessment of oxidative stress parameters showed that the levels of MDA and LDH in the high dose group were (6.53±1.24) nmol/mg prot and (265.62±24.65) U/g prot, significantly higher than those in the control group (P<0.05). Compared with the control group, the levels of SOD and GSH in the high dose and low dose groups were significantly decreased (P<0.05).ConclusionsPM2.5exposure can cause damages in the rat uterus by inducing oxidative stress.
PM2.5; Rat; Uterus; Oxidative stress; Histopathology
DONG En-heng. Email: dongphmu@163.com
Q95-33
A
1005-4847(2017) 05-0524-04
10.3969/j.issn.1005-4847.2017.05.010
2016-12-25
河南省高校科技创新团队支持计划(No.14IRTSTHN017)。
张丰泉(1985-),男,实验师,硕士,研究方向:颗粒物对健康的影响。Email: zhangfengquan29@126.com
董恩恒(1978-),男,博士,研究方向:空气污染物生物效应、机制及干预措施。Email: dongphmu@163.com
