新生小鼠缺氧缺血性脑损伤模型的建立
2017-11-01张丹周玉陶徐玉庭李志荣虎鑫王茜李虹椿李凡
张丹,周玉陶,徐玉庭,李志荣,虎鑫,王茜,李虹椿,李凡
(1. 昆明医科大学临床医学专业, 昆明 650500; 2. 昆明医科大学影像学专业, 昆明 650500; 3. 昆明医科大学基础医学院病理学与病理生理学系, 昆明 650500)
研究报告
新生小鼠缺氧缺血性脑损伤模型的建立
张丹1#,周玉陶2#,徐玉庭1,李志荣1,虎鑫1,王茜3*,李虹椿3,李凡3*
(1. 昆明医科大学临床医学专业, 昆明 650500; 2. 昆明医科大学影像学专业, 昆明 650500; 3. 昆明医科大学基础医学院病理学与病理生理学系, 昆明 650500)
目的对经典Vannucci法进行改进,建立一种简便、稳定的新生小鼠缺血缺氧脑损伤模型。方法将新生11 d的KM小鼠分为正常对照组(N组,n=20)和缺血缺氧组(HIBD组,n=160),对HIBD组行左侧颈总动脉结扎,分别按照C1-C8条件缺氧建模。建模后通过比较各条件下小鼠死亡率、建模成功率和TTC染色脑梗死体积,选取最稳定的建模条件。建模后利用体重生长曲线分析小鼠生长发育情况;Longa、Grip test、悬吊试验评估小鼠神经运动功能;HE染色观察脑组织病理改变。结果新生小鼠行左侧颈总动脉结扎,8% O2、35℃条件下缺氧45 min,死亡率低(8.3%)且成模率高(47.92%); HIBD组较N组小鼠体重增长缓慢并出现严重的神经运动功能障碍;结扎侧出现脑梗死区,约占全脑体积(17.76±0.70)%;结扎侧大脑皮层及海马区神经元出现变性坏死。结论本实验采用新生小鼠行左侧颈总动脉结扎,在8% O2、35℃条件下缺氧45 min复制HIBD动物模型,简便且稳定性好,是用于新生儿缺血缺氧性脑损伤研究较为理想的动物模型。
缺氧缺血;脑损伤;动物模型;新生小鼠
新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是由围生期窒息引起部分或完全缺氧,脑血流减少或暂停而导致新生儿脑损伤。该病可引起新生儿感觉运动功能障碍和认知功能缺陷,如意识障碍、注意力缺陷、记忆缺陷、智力发育迟缓,甚至可导致脑瘫、小儿脑卒中和癫痫等疾病[1]。现研究认为围生期窒息是导致该病的重要病因[2],其发生机理和有效的干预措施成为该病目前研究的焦点。为了深入研究该病的机制与治疗进展,建立稳定、简便的模拟动物模型显得尤为重要。Yager等[3]统计,在200多种有关新生儿HIBD的动物模型中,大鼠应用最为广泛(约占29%),其次是猪(约占25%)和羊(约占20%)。关于HIBD小鼠的模型有限,而转基因小鼠被逐步用于研究特定基因与HIBD发生发展的关系,但经典的Vannucci法并不适用小鼠,故本研究在借鉴经典Vannucci法的基础上,选用新生小鼠建立一种简便、稳定的新生小鼠缺血缺氧脑损伤模型,为进一步研究HIBD的发病机制打下良好的实验学基础。
1 材料与方法
1.1实验动物和分组
SPF级新生11日龄KM小鼠180只(与母鼠同笼饲养),雌雄不限,体重6.85~7.50 g。购自昆明医科大学实验动物中心【SCXK(滇)2015-0002】。随机将180只KM小鼠分为两组:① 正常组(N组,n=20);② HIBD组(分为C1-C8组,n=160)。各组在体重、数量上均无统计学差异。小鼠建模及组织取材于昆明医科大学实验动物科学部实验设施内进行【SYXK(滇)2015-0002】。
1.2主要仪器和试剂
一种改进的恒温缺氧模型实验装置[4];Ox-Plus氧浓度测试仪(键合电子有限公司);一种小型实验动物手术箱[5];电子天平(Mettle Toledo公司);5-0带线缝合针(上海浦东金环医疗用品公司);四唑红(2,3,5-triphenyltetrazolium chloride,TTC)(Sigma公司,货号93140);水合氯醛(Solarbio公司,货号T8590);异氟烷(山东科源制药有限公司,货号H19990157)。
1.3制备方法
N组:除不进行单侧颈总动脉结扎手术和缺氧,其余条件与HIBD组一致。
HIBD组:小鼠异氟烷(50 μL/只)吸入麻醉后,将其固定于无菌动物手术台上,行颈部正中切口(5~10 mm),切开皮肤后用眼科镊精细分离左侧颈前肌群,暴露颈动脉鞘,用玻璃分针轻轻将颈总动脉与迷走神经分离,以5-0缝合线单线结扎颈总动脉并确保无血流通过后缝合伤口,整个手术过程时间控制在10 min内。手术完成后置于笼外带有母鼠气味的垫料上休息30 min,转移至笼内母鼠旁休息1 h后进行缺氧实验。根据缺氧条件的不同分为C1-C8组,条件如表1所示。
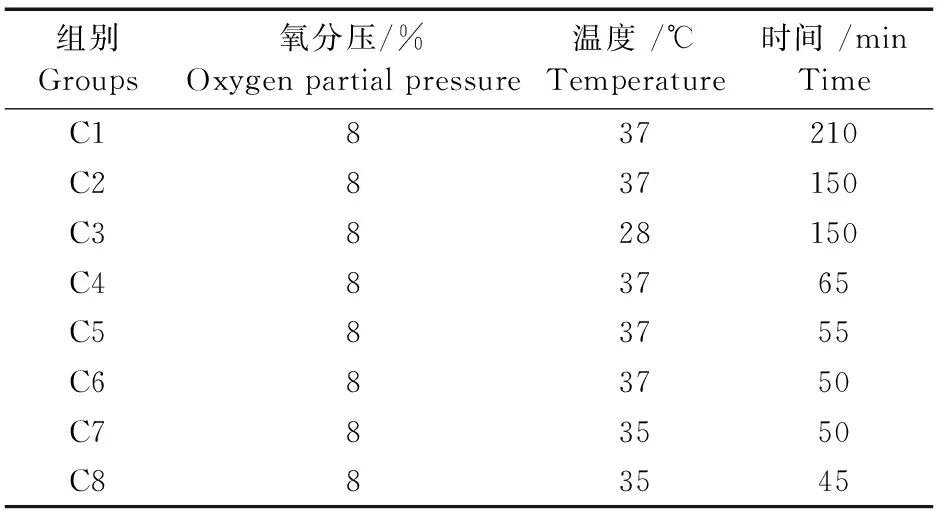
表1 出生后11 d各组小鼠缺氧条件设置(n=20)Tab.1 Hypoxic conditions in each group of the P11 mice
1.4体重动态监测
对各组小鼠于出生当天(P1)至造模后第5天(P16)称重(每天称重时间在17:00~18:00),记录小鼠体重数据,并绘制各组小鼠体重增长趋势图。
1.5行为学检测
在P12-P16采用双盲法对各组小鼠行Longa评分测试、Grip test评分测试、悬吊试验,评价小鼠的运动功能。
1.5.1 Longa评分法[6]
检查者按标准对小鼠进行神经功能评估。共分5个等级。0分:正常,无神经功能缺损;1分:左侧前爪不能完全伸展,轻度神经功能缺损;2分:行走时小鼠向左侧(瘫痪侧)转圈,中度神经功能缺损;3分:行走时,小鼠身体向左侧(瘫痪侧)倾倒,重度神经功能缺损;4分:不能自发行走,有意识丧失。
1.5.2 Grip test评分法[7]
将小鼠前爪搭置在铁丝上,评价小鼠运动功能协调性。评分标准:0分:跌落;1分:一只或两只前爪紧握铁丝;2分:试图爬上铁丝;3分:一只或两只前爪和一只或两只后爪紧握铁丝;4分:前爪和后爪紧握铁丝和尾巴缠绕铁丝;5分:逃跑。评分标准参考图1。
1.5.3 悬吊试验[8]
小鼠前爪抓住水平铁丝,铁丝离桌面45 cm,记录小鼠悬吊时间。评分标准:1分:≤10 s;2分:11 s-30 s;3分:31 s-2 min;4分:3 min-5 min;5分:>5 min。

注:a:小鼠跌落(0分);b:一只前爪紧握铁丝(1分);c:两只前爪紧握并试图爬上铁丝(2分);d:两只前爪和两只后爪紧握铁丝(3分);e:前爪和后爪紧握铁丝和尾巴缠绕铁丝(4分);f:小鼠紧握铁丝并沿着铁丝移动逃跑(5分)。图1 The Grip test评分Note. a: the mouse dropped (Score 0); b: a forelimb gripped the wire (Score 1); c: two forelimbs gripped and attempted to climb the wire (Score 2); d: two forelimbs and two hindlimbs gripped the wire (Score 3); e: two forelimbs and two hindlimbs gripped the wire, and tail twined around the wire (Score 4); f: the mouse gripped the wire and ran along the wire and escaped (Score 5).Fig.1 Scores of the grip test
1.6TTC染色
造模后第1天(P12),腹腔注射10%水合氯醛(0.10 mL/10 g)麻醉小鼠,快速取脑组织于-20℃冰箱里冰冻10 min,切片(厚度1 mm),将切好的脑片置于35℃、1% TTC溶液中染色15 min后,将脑片置于4%多聚甲醛溶液中固定24 h。Imagine-Pro Plus 6.0软件分析脑组织梗死体积[9]。
1.7HE染色
各组小鼠于造模后第1天(P12),10%水合氯醛腹腔麻醉小鼠,4%多聚甲醛灌流取脑组织,置于4%甲醛溶液中固定72 h后,制成石蜡切片。常规HE染色,光镜下观察脑组织形态学变化。
1.8统计学处理
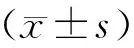
2 结果
2.1不同条件下HIBD模型成模率与稳定性的比较
2.1.1 不同条件下HIBD模型死亡率、成模率比较
实验中N组存活率为100%。HIBD组中因缺氧条件不同,存活率不同。C1、C2组死亡率为100.00%,其中C8组死亡率为8.30%,成模率为47.92%,C8组的缺氧条件(8%、35℃、45 min)是较适宜的。如表2所示。
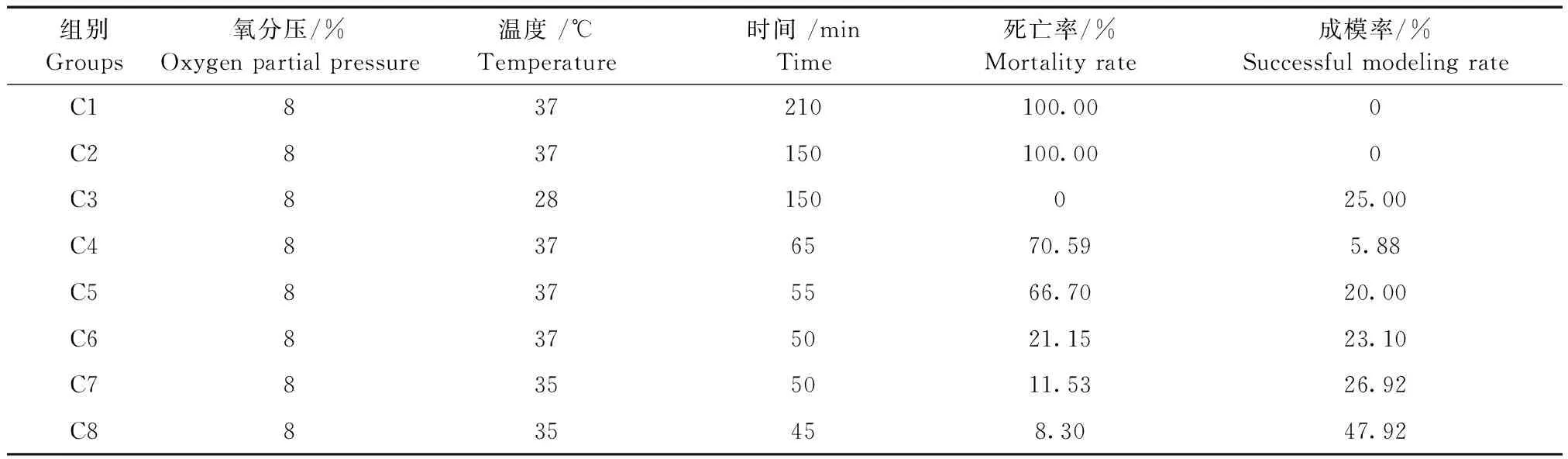
表2 各组HIBD模型死亡率、成模率比较(n=20)Tab.2 Comparison of the mortality and success rates in the HIBD groups
2.1.2 脑组织TTC染色
造模后第1天(P12),取小鼠脑组织切片进行TTC染色。结果显示:N组脑组织为均质红染,HIBD组脑组织结扎侧呈现苍白梗死灶(图2b黑色箭头所示),占脑组织的(17.76±0.70)%,与N组相比有差异有显著性,且梗死面积值符合正态分布,表明结扎左侧颈总动脉后于8% O2、35℃条件下缺氧45 min,可以得到较为稳定的模型。
2.2N组和HIBD组生长发育的比较
2.2.1 体重动态监测
观察P1至P16小鼠体重变化情况。P1 N组小鼠平均体重为(2.02±0.07)g,HIBD组平均体重为(1.96±0.02)g,两组体重差异无显著性(P>0.05)。P1至P11小鼠体重逐渐增长,两组在各时间点体重差异无显著性(P>0.05)。在造模后第2天(P13)N组体重仍明显增加,平均为(9.38±0.10)g,HIBD组体重较N组略低,平均为(8.85±0.10)g,两组比较差异具有显著性(P<0.05);造模后第3天(P14),N组平均体重为(10.39±0.20)g,HIBD组平均体重为(9.63±0.08)g,两组比较差异具有显著性(P<0.05);P15、P16两组平均体重差异无显著性(P>0.05)。如图3所示。
2.2.2 平均睁眼时间
N组小鼠约在出生后(13.71±0.22)d双眼完全睁开,HIBD组则明显延迟,双眼均睁平均时间为(16.92±0.26)d,两者相比差异有显著性(P<0.0001),如图4所示。出生后13 d,HIBD组小鼠非结扎侧眼已睁开,但结扎侧未睁眼,如图5b箭头所示。
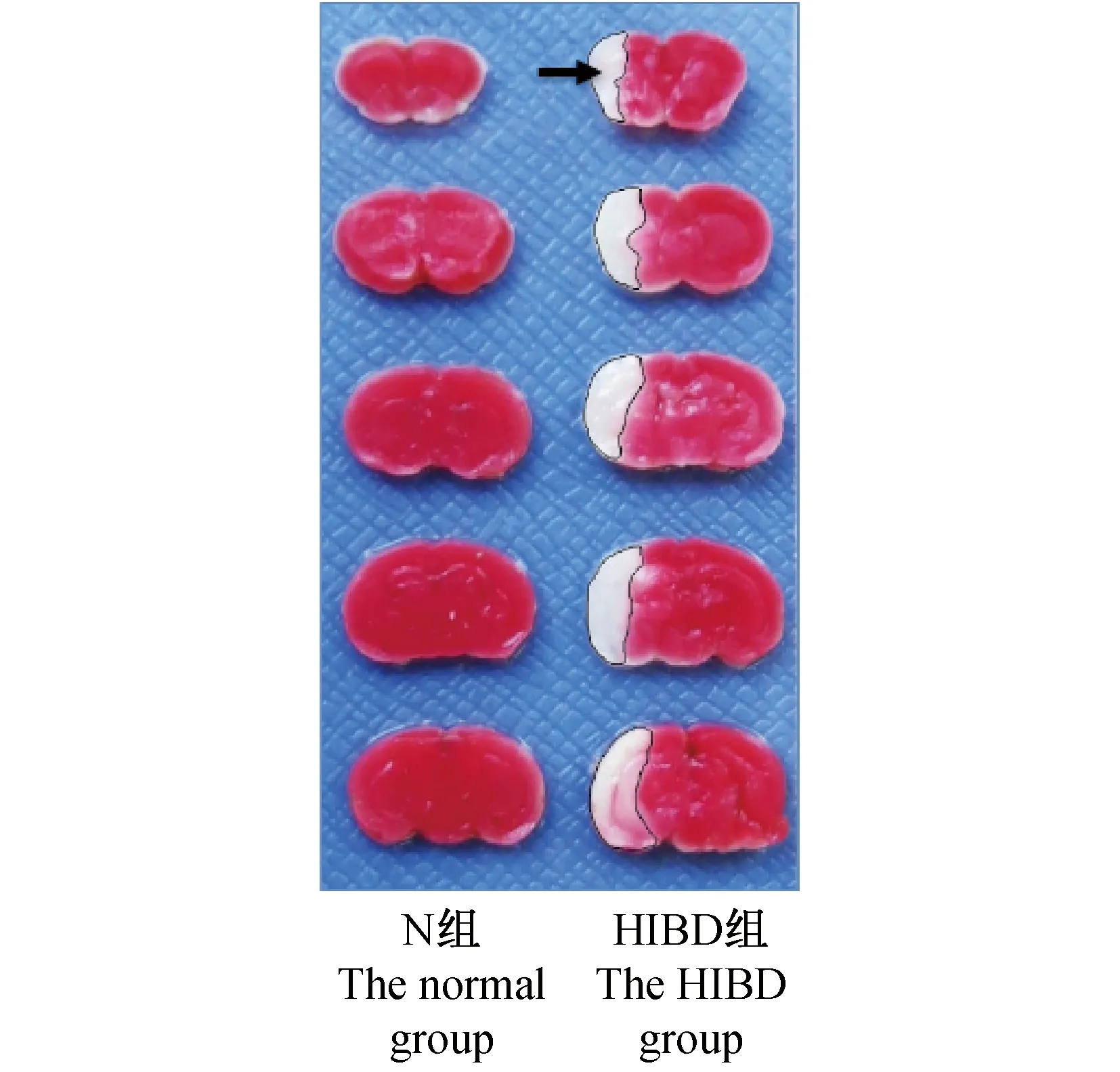
图2 TTC染色结果Fig.2 Infarction in the brain tissues(TTC staining)

注:出生后13 d和14 d, HIBD组与N组比较,*P<0.05。图3 N组和HIBD组体重变化趋势Note. Compared with the normal group at postnatal d13 and d14, *P<0.05.Fig.3 Trend of body weight changes in the normal and HIBD groups
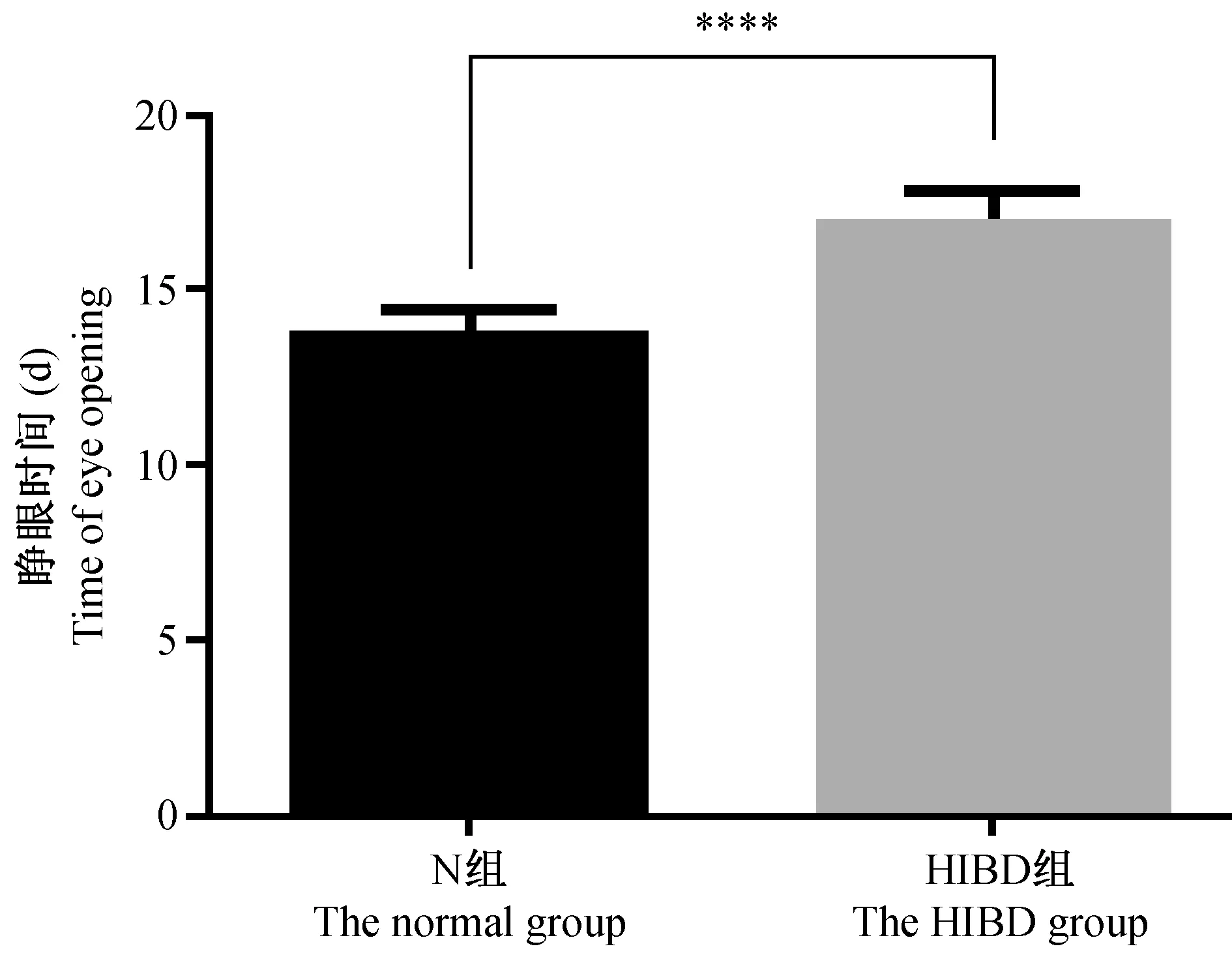
注:出生后,HIBD组与N组比较,****P<0.0001。图4 N组和HIBD组睁眼时间比较Note. Compared with the normal group after birth,****P<0.0001.Fig.4 Comparison of the time of eye opening between the control and HIBD groups
2.3N组和HIBD组运动功能的比较
造模后,P12-P16, HIBD组Longa评分均较N组高,并且在P12和P13差异有显著性(P<0.0001,P<0.01),如图6A所示; HIBD组握力测试评分均较N组低,且在P12两组比较差异有显著性(P<0.01),如图6B所示;HIBD组较N组悬吊试验评分低,并且P12-P16差异均有显著性(P<0.01,P<0.05),如图6C所示。
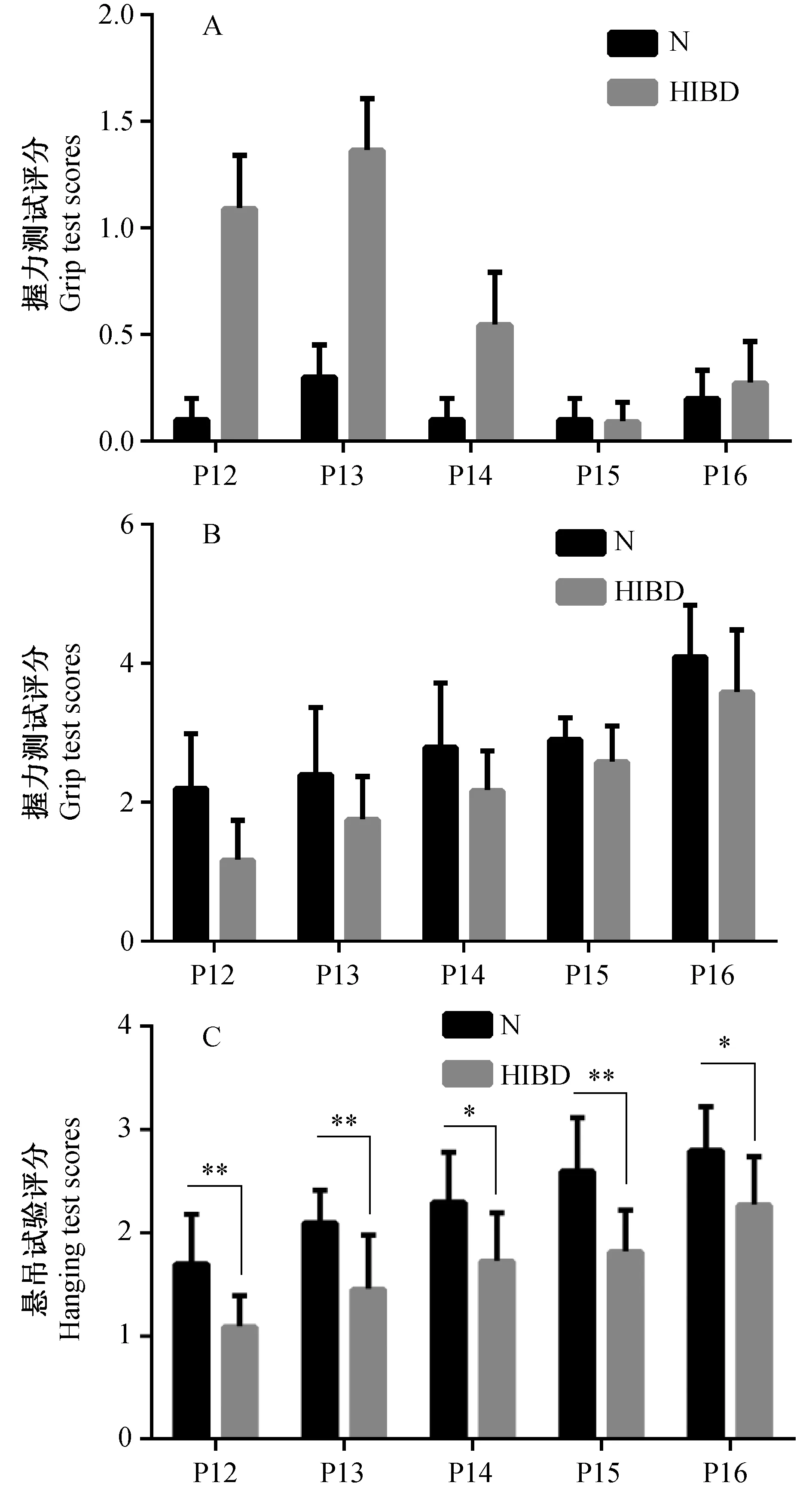
注:出生后12 ~16 d,HIBD组与N组比较,Longa评分****P<0.0001,**P<0.01。握力测试评分**P<0.01。悬吊试验评分**P<0.01,*P<0.05。图6 N组和HIBD组运动功能的比较Note. Compared with the normal group from postnatal d12 to postnatal d16,the Longa scores in the two groups ****P<0.0001,**P<0.01.Comparison of the grip test scores in the two groups **P<0.01. Comparison of hanging test scores in the two groups *P<0.01, *P<0.05.Fig.6 Comparison of motor function between group N and group HIBD
2.4N组和HIBD组脑组织HE染色比较
两组小鼠P12进行脑组织 HE染色,结果显示:N组小鼠脑组织齿状回(图7a)、海马CA2区(图7c)和大脑皮层(图7e)结构清楚,神经元密集且排列整齐;神经元胞质丰富,淡染;核仁清楚。

注:a: N组;b:HIBD组。图5 两组小鼠睁眼情况Note. a: the normal group; b: the HIBD group.Fig.5 The eye opening in the two groups
HIBD组小鼠齿状回(图7b)和海马CA2区(图7 d)神经细胞数量显著减少,且排列疏松杂乱,细胞间隙加宽,胞核固缩变性深染;大脑皮层(图7f)细胞数量减少,神经元变性坏死,胞体缩小,核固缩,整个细胞深染。
3 讨论
HIBD是导致新生儿死亡和远期行为异常的重要原因之一,其中足月儿发病率约为2%。25%的重度HIBD患儿可伴有终生残疾和神经发育迟滞,20%~50%的重度HIBD患儿在新生儿期死亡[10]。在近年的治疗进展中,对患有中度或重度HIE的足月或近足月儿进行亚低温治疗,并联合其他新的辅助治疗如使用抗炎药物、抗氧化剂,能降低HIBD患儿的死亡率与致残率[11],但治疗时间窗(6 h内)十分有限。调查显示,生育年龄大于35岁父母可导致产出缺陷婴儿的风险增加,高龄产妇可增加HIE的发病风险[12-14]。2015年10月,我国实施全面二胎政策,可预计高龄产妇与HIE患儿的数目将明显增加。因此,建立一种模拟临床HIBD患儿的实验动物模型进一步研究疾病的本质与发展显得极其重要。
HIBD是造成儿童脑瘫(CP)和残疾的重要原因[1]。目前国内研究的脑瘫模型大都分三种:第一种方法是神经毒素诱导的脑瘫动物模型[15];第二种方法是缺血缺氧脑瘫动物模型:① 宫内缺血缺氧法:将临产的实验动物双侧子宫动脉夹闭,维持一定时间后取出胎儿,致使新生动物在母体子宫内缺氧缺血制成脑瘫模型;② 颈总动脉结扎法:将新生动物单侧颈总动脉阻断、结扎或(和)切断,再将动物置于缺氧环境中一定时间制作脑瘫模型[16-19];③注射神经毒素联合缺血缺氧制成的脑瘫动物模型[20]。神经毒素诱导的脑瘫动物模型多用于研究外源性神经毒性物质或活性氧物质如胆红素等对神经系统的损失[21],其诱导的脑瘫与HIBD模型有较大的差异。虽然宫内缺氧缺血法能模拟新生儿在子宫内获得的全脑缺氧缺血性病理损伤,但其实验过程复杂,有较大的实验难度和不确定性。根据Vannucci法单侧颈总动脉结扎加缺氧建立大鼠HIBD模型,实验简便易行,且自该法发表以来已被国内外探究疾病的学者广泛采用。而随着科研技术的发展,转基因小鼠被逐步用于探究特定基因与HIBD发生发展的关系,但传统的Vannucci法并不适用于小鼠,故本研究旨在改良经典Vannucci法,建立一种稳定的模拟临床新生儿HIBD的小鼠模型。KM小鼠为最常见小鼠品种之一,相较BALB/c等小鼠大脑后动脉及椎基底动脉变异小,从而构成完整的Willis环,与人脑血液供应相似[22],并且11日龄小鼠脑的发育阶段与新生儿出生时相似[23]。因此,本研究选用P9-P11新生KM小鼠单侧颈总动脉结扎后系统性缺氧来建立新生儿HIBD模型。
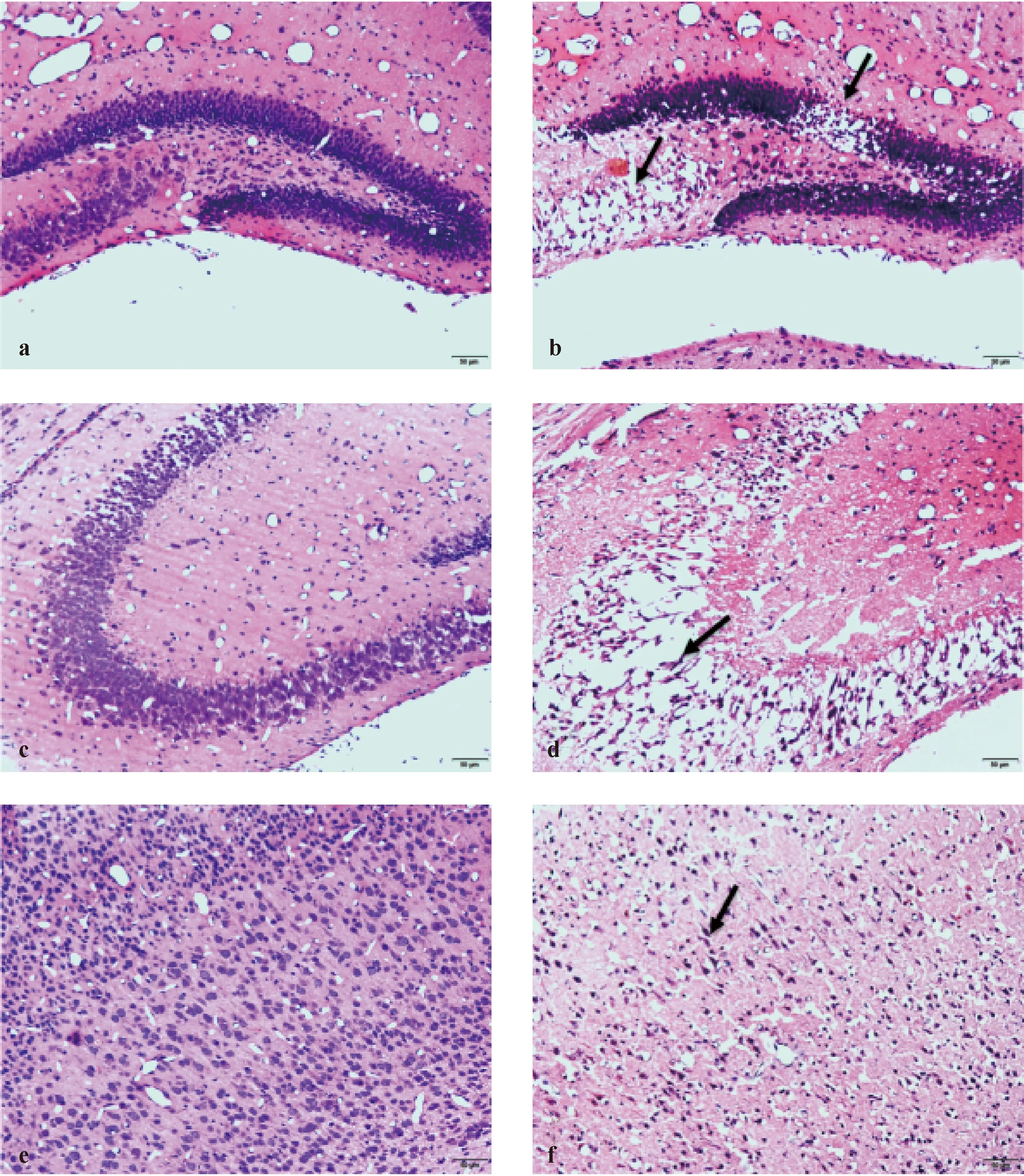
注:脑组织HE染色结果显示,与N组(7a、7c、7e)相比,HIBD组小鼠海马齿状回区域(7b)和海马CA2区域(7 d)损伤严重,神经细胞数量显著减少,且排列疏松杂乱,细胞间隙加宽;小鼠大脑皮层(7e) 大量神经元变性坏死,核固缩,整个细胞深染。(7a-7d:HE×200,7e-7f:HE×400)图7 两组小鼠脑组织HE染色Note. N group (7a, 7c, 7e) compared with the HIBD group, the dentate gyrus of the hippocampus (7b) and CA2 of the hippocampus (7 d) are damaged seriously, the number of neurons is significantly reduced, cyto-architecture is disordered and intercellular space widened; a great quantity of neurons in the cerebral cortex (7e) degenerated, nuclear pyknosis, whole cells are stained deeply.Fig.7 Pathological changes of brain tissues in te two groups(HE staining)
建立本模型的第一步就是单侧结扎小鼠颈总动脉,但小鼠脑的血液供应与人类相似,颈内动脉和椎动脉在大脑底部形成Willis环,单纯结扎一侧颈动脉不能造成理想缺氧缺血病变,只有同时给予缺氧才能在结扎侧大脑形成HIBD改变。而缺氧最关键的是温度和时间的控制,温度过高和时间过长会增加实验动物的死亡率,而温度过低和时间过短,造成的脑损伤在小鼠可代偿范围内,故使成模率降低。因此选取较为适宜的温度是造模成功过程中不可少的因素[24,25]。本实验通过比较不同温度下造模成模率及死亡率,最终确定35℃,45 min为较适宜的缺氧温度和时间。本实验在左侧颈总动脉结扎后8% O2、35℃、45 min条件下缺氧,造模死亡率较低,成模率较高,并在TTC染色中显示梗死面积占脑组织的(17.76±0.70)%,数据符合正态分布,表明模型稳定。
从动物体重增长情况发现,HIBD组较N组体重增长缓慢,在造模后第2、3天较明显,第4天起差异无显著性,这可能与小鼠自身修复有关。行为学检测显示,HIBD组较N组存在神经运动功能障碍,且在造模后前期有显著差异,应与缺氧缺血的易损部位大脑皮层和海马的损伤存在联系。后期差异逐渐减小,可能与小鼠自身恢复有关。我们发现HIBD组小鼠较N组小鼠患侧睁眼时间明显延迟,应与结扎颈总动脉,封闭其分支翼腭动脉有关。Huang等[27]的研究发现,早期睁眼有助于大脑海马区穿通纤维突触的延伸,视觉输入可促进大脑海马区的发育,并影响与大脑海马区相关的行为学表现,因此HIBD组患侧睁眼时间延迟进一步抑制了患侧脑组织神经系统的发育。
HIBD组TTC结果显示脑梗死灶累及同侧部分额叶、颞叶、顶叶及深部基底核团,很少累及同侧。这可能与大脑前动脉可通过前交叉动脉获得对侧大脑前动脉的血供,同侧大脑后动脉可通过后交通动脉获得同侧椎-基动脉的血供,而仅大脑中动脉供血区域发生局灶性缺血有关[23]。HE 染色发现小鼠齿状回和海马CA2区神经细胞数量显著减少,且排列疏松杂乱,细胞间隙加宽,胞核固缩变性深染;大脑皮层细胞数量减少,神经元变性坏死,胞体缩小,核固缩,整个细胞深染。这与文献报道相似[28]。
综上所述,我们所制作的新生儿缺血缺氧小鼠模型是成功的、稳定的,基本模拟了新生儿HIBD 后的神经行为学改变,可以应用于新生儿缺氧缺血性脑损伤的发生机制和防治措施的研究中。
[1] 王志坚,周晓光,刘仁红,等. 建立一种改良的新生兔缺氧缺血性脑损伤模型 [J]. 中国实验动物学报, 2007, 15(04): 296-299.
[2] Kurinczuk JJ, White-Koning M, Badawi N, et al. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy[J]. Early Human Dev, 2010, 86(6): 329-338.
[3] Yager JY. Animal model of hypoxic-ischemic brain damage in the newborn[J]. Semin Pediatr Neurol, 2004, 11: 31-46.
[4] 肖婕,王伟舟,徐开宇,等. 一种改进的恒温缺氧模型实验装置[P]. 中国,专利号:ZL201320101770.6,2013.
[5] 周慎,李虹椿,闵颖俊,等. 一种小型实验动物手术箱[P]. 中国,专利号:ZL201520214776.3,2015.
[6] 李丽华,屈艺,刘红卫,等. 足月新生儿缺氧缺血性脑损伤大鼠模型的制作与鉴定[J]. 中国实验动物学报, 2009, 17(04): 266-269.
[7] Kraft P, Gob E, Schuhmann MK, et al. FTY720 ameliorates acute ischemic stroke in mice by reducing thrombo-inflammation but not by direct neuroprotection[J].Stroke, 2013, 44(11): 3202-3210.
[8] Feng J, Lucchinetti E Fau-Ahuja P, Ahuja P Fau-Pasch T, et al. Isoflurane postconditioning prevents opening of the mitochondrial permeability transition pore through inhibition of glycogen synthase kinase 3beta [J]. Anesthesiology, 2005,103(5): 987-995.
[9] 包新杰,赵浩,赵英杰,等. 线栓法插线深度对大鼠脑梗死模型制备的影响 [J]. 中国实验动物学报, 2011, 19(03): 233-236.
[10] 陈楠,温晓红. 新生儿缺氧缺血性脑损伤生物标记物研究进展 [J]. 中华实用儿科临床杂志,2015,30(2): 156-158.
[11] Papile LA, Baley JE, Benitz W, et al. Hypothermia and neonatal encephalopathy [J]. Pediatrics, 2014,133(6):1146-1150.
[12] 张成云,李晓艳,杨建刚. 新生儿缺氧缺血性脑病危险因素分析 [J]. 实用儿科临床杂志,2009,24(11): 873-875.
[13] 曲红梅,于国伟. 出生缺陷环境影响因素研究进展 [J]. 中国公共卫生,2009, 25(6): 762-764.
[14] Wasden SW, Chasen ST, Jeffrey M, et al. Planned home birth and the association with neonatal hypoxic ischemic encephalopathy[J]. Perinat Med, 2016, 292(11): 1-6.
[15] 李晓捷,高晶,孙忠人. 宫内感染致早产鼠脑瘫动物模型制备及其鉴定的实验研究 [J]. 中国康复医学杂志, 2004, 19(12): 6-10.
[16] 陈刚, 李江, 刘伟, 等. 构建新生乳鼠脑性瘫痪模型及其稳定性[J].中国组织工程研究与临床康复, 2008, 12(37): 7326-7329.
[17] 郑宇, 张露芬, 任晓暄, 等. 石氏“醒脑开窍针法”对脑缺血再灌模型大鼠血浆AngⅡ、CGRP及ET含量的影响 [J]. 北京中医药大学学报, 2011, 34(02): 140-144.
[18] 王梧霖, 史小军, 侯天德, 等. 小鼠脑缺血再灌注模型的构建及条件优化 [J]. 现代生物医学进展, 2010, 10(01): 70-73.
[19] 王江涛, 毛英丽, 李洪华, 等. 新生大鼠痉挛型脑瘫动物模型构建及评价的实验研究 [J]. 中国妇幼保健, 2011, 26(19): 2992-2995.
[20] 高峰, 杨小朋, 陈刚. 应用孕鼠腹腔注射脂多糖合并缺氧方法制作脑瘫动物模型的实验研究 [J]. 临床和实验医学杂志, 2011, 10(07): 489-491.
[21] 曹冉,于亚东,田方涛,等. 脑瘫动物模型的制作及微观表现研究进展 [J]. 河北医药, 2013, 35(21): 3293-3295.
[22] 甄毅岚, 王亚男,李晟,等. 线栓法制备不同体重KM小鼠局灶性脑缺血再灌注模型的建立及评价 [J]. 中国实验动物学报, 2013, 23(02):39-44.
[23] Semple BD, Blomgren K, Gimlin K, et al. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species[J].Prog Neurobiol, 2013,106-107:1-16.
[24] Wagner CL, Eicher DJ,Katikaneni LD, et al. The use of hypothermia: a role in the treatment of neonatal asphyxia? [J]. Pediatr Neurol, 1999, 21(1): 429-443.
[25] Thoresen M. Cooling the asphyxiated brain — ready for clinical trials?[J].Eur J Pediatr, 1999, 158 (1):S5-S8.
[26] Huang Z, Liu J, Cheung PY, et al. Long-term cognitive impairment and myelination deficiency in a rat model of perinatal hypoxic-ischemic brain injury [J]. Brain Res, 2009, 1301:100-109.
[27] Waters CM, Moser W, Walkinshaw G, et al. Death of neurons in the neonatal rodent and primate globus pallidus occurs by a mechanism of apoptosis [J]. Neuroscience,1994, 63(3):881-894.
Establishmentofaneonatalmousemodelofhypoxic-ischemicbraindamage
ZHANG Dan1#, ZHOU Yu-tao2#, XU Yu-ting1, LI Zhi-rong1, HU Xin1, WANG Qian3*, LI Hong-chun3, LI Fan3*
(1. Specialty of Clinical Medicine, Kunming Medical University, Kunming 650500, China; 2. Specialty of Medical Imaging, Kunming Medical University, Kunming 650500; 3. Department of Pathology and Pathophysiology, School of Basic Medical Sciences, Kunming Medical University, Kunming 650500)
ObjectiveTo improve the classic Vannucci method for establishing a model of hypoxic-ischemic brain damage in the neonatal mice.MethodsPostnatal day 11 KM mice were randomly assigned into normal control group (N group,n=20) and hypoxic-ischemic brain damage group (HIBD group,n=160). For the HIBD group, the left common carotid artery of mice was ligated and exposed to hypoxia according to different conditions in the groups C1-C8, then compared the mortality and the success rates of all groups. TTC staining and relative infarct volume was measured to select the most stable conditions of modeling. In all groups, the growth and development of mice were evaluated by body weight growth curve at different time points after modeling. Longa test, grip test and hanging test were porformed to assess the neuromotor function. HE staining was used to detect cerebral neuronal pathological changes.ResultsNeonatal mouse models of hypoxic-ischemic brain damage were established by the left common carotid artery ligation and hypoxia for 45 min under conditions of 8% O2and 35℃, which resulted a low mortality rate (8.3%) and high success rate (47.92%). Compared with the normal group, mice of the HIBD group grew slowly in body weight and showed severe motor dysfunction. The ligation side of cerebral artery showed infarction area which accounted for 7.76±0.70% of the total brain. The cortex and hippocampus of ligated brain tissue showed neuron degeneration and necrosis.ConclusionsThe neonatal mouse model of hypoxic-ischemic brain damage is successfully established by our modified method , i.e. to ligate the left common carotid artery and to expose the mice to hypoxia at 8% O2and 35℃ for 45 min. This model provides a liable and stable experimental animal model for research of neonatal hypoxic-ischemic brain damage.
Hypoxia-ischemia; Brain damage; Animal model; Neonatal mice
LI Fang. E-mail: leefan623@sina.com. WANG Qian, Email: nancyqian9@163.com
Q95-33
A
1005-4847(2017) 05-0486-08
10.3969/j.issn.1005-4847.2017.05.004
2017-05-04
国家自然科学基金项目(No.81200939;No.31260242);云南省科技计划项目(No.2011FB060);2016年度昆明医科大学大学生创新性实验计划项目(No.201602)。
张丹(1994-),女,在读本科生。E-mail: 1871732033@qq.com;周玉陶(1995-),女,在读本科生。E-mail: 245010550@qq.com。# 并列第一作者
李凡(1974-),女,博士,研究方向:缺氧缺血性脑病。E-mail: leefan623@sina.com;王茜(1981-),女,博士,讲师,研究方向:缺血缺氧性脑病。Email: nancyqian9@163.com
