流式细胞术分析PMA诱导THP-1分化为巨噬细胞的表型特征
2017-11-01彭卓颖
彭卓颖,李 想,丛 喆,薛 婧
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
研究报告
流式细胞术分析PMA诱导THP-1分化为巨噬细胞的表型特征
彭卓颖,李 想,丛 喆*,薛 婧*
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,新发再发传染病动物模型研究北京市重点实验室,北京 100021)
目的用流式细胞术明确单独使用PMA诱导THP-1细胞分化而来的巨噬细胞的分化情况。方法首先用PMA刺激THP-1细胞分化为巨噬细胞,再分别使用LPS、IFN-γ和IL-6将细胞诱导为M1型巨噬细胞,用IL-4、IL-13和IL-6将细胞诱导为M2型巨噬细胞。显微镜下观察三种细胞的形态学改变,并用流式细胞术检测各细胞主要CD分子表达的差异。结果当THP-1分化为巨噬细胞后变为贴壁生长,细胞形态呈较规则的圆形或椭圆形;M1和M2细胞形态不规则,细胞突起较明显,细胞颗粒度较大。巨噬细胞表面与抗原提呈功能相关的CD分子的表达均较低,大部分呈阴性;而M1和M2细胞表面这些CD分子的表达均较高。结论单独使用PMA刺激THP-1细胞所分化而来的巨噬细胞抗原提呈能力较弱,基本处于静息状态。
THP-1;巨噬细胞;佛波酯;流式细胞术
巨噬细胞(macrophage,Mφ)是一类由血液中单核细胞分化而来的固有免疫细胞,在机体免疫反应中发挥重要作用[1]。但是由于细胞数量少,分离过程较繁琐[2,3],因此多用佛波酯(phorbol 12-myristate 13-acetate, PMA)诱导THP-1单核细胞系分化而成的THP-1-Mφ作为研究巨噬细胞功能的体外细胞模型[4]。虽然目前THP-1-Mφ细胞是比较通用的巨噬细胞模型,但是此细胞的分化特征尚不明确,这将影响对巨噬细胞相关功能实验的分析。本文主要利用流式细胞术对分化所得巨噬细胞的特征进行分析,首先用不同细胞因子组合对THP-1细胞进行刺激,分别诱导出Mφ、M1和M2三种细胞,比较以上细胞的形态学变化,并用流式检测各细胞主要CD分子表达的差异,以期明确THP-1-Mφ细胞的分化情况。
1 材料和方法
1.1细胞
THP-1细胞,外周血的人单核细胞系,购自中国医学科学院基础所细胞中心,用含10%胎牛血清的RPMI-1640完全培养基,置于37℃、5% CO2孵箱中进行培养。
1.2细胞因子
Recombinant Human IFN-γ(300-02)、Recombinant Human IL-13(200-13)和Recombinant Human IL-4(200-04)购自Peprotech公司,Recombinant Human IL-6 Protein(206-IL)购自R&D公司,PMA(P1585)和LPS(L4391)购自Sigma公司。
1.3流式抗体
流式抗体PE anti-human CD16 Antibody(3G8)、PE anti-human CD68 Antibody(Y1/82A)、FITC anti-human CD80 Antibody(2D10)、APC anti-human CD83 Antibody(HB15)、PE anti-human CD86 Antibody(IT2.2)、PE anti-human CD1a Antibody(HI149)、APC anti-human CD11c Antibody(3.9)均购自Biolegend公司;流式抗体PE Mouse Anti-Human CD14(M5E2)、PerCP-CyTM5.5 Mouse Anti-Human CD209(DCN46)、APC Mouse Anti-Human HLA-DR(G46-6)、FITC Mouse Anti-Human CD163(GHI/61)、PE Mouse Anti-Human CD206(19.2)均购自BD公司。
1.4实验方法
1.4.1 PMA和细胞因子诱导THP-1 细胞定向分化[4,5]
取9×106个正常THP-1于T25培养瓶内,加入终浓度为50 ng/mL的PMA。2 d后细胞进行换液处理,一部分细胞进行流式检测;一部分细胞中加入终浓度均为20 ng/mL的LPS、IFN-γ和IL-6,使细胞向THP-1-M1方向分化;另一部分细胞中加入终浓度均为20 ng/mL的IL-4、IL-13和IL-6,诱导细胞向THP-1-M2方向分化。THP-1-M1和THP-1-M2细胞于第5天进行流式检测。
1.4.2 胞外流式染色
用胰酶将培养瓶内的贴壁细胞消化下来,PBS缓冲液洗2次(4℃ 1500 r/min离心3 min),用PBS将细胞浓度调整为每毫升1×107个,混匀后在每个流式管中加入100 μL细胞悬液,向每管内加入相应流式抗体,轻轻混匀,4℃避光孵育30 min,2 mL PBS缓冲液洗2次,300 μL PBS重悬细胞,过滤后上机。
1.4.3 胞内流式染色[6]
同上将细胞加入流式管内,向每管中加入200 μL IC fixation buffer,4℃避光孵育20 min,随后用2 mL破膜液洗2次,100 μL破膜液重悬细胞,向每管中加入对应流式抗体,混匀后4℃避光孵育30 min,破膜液洗2次,PBS缓冲液洗1次,将细胞悬液过滤后上机。
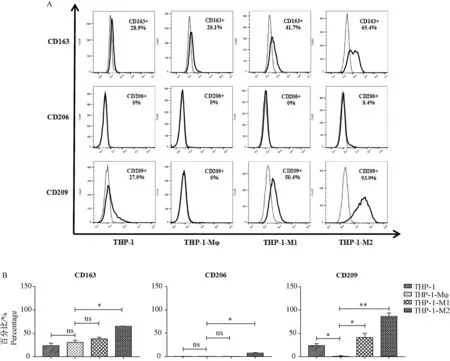
1.5统计学方法
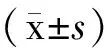
2 结果
2.1THP-1分化为不同细胞后的形态学改变
THP-1细胞形态饱满、大小均一、折光性较好,为悬浮生长单个细胞(图1A);PMA刺激2 d后,诱导分化的THP-1-Mφ细胞全部贴壁,大部分细胞仍呈圆形或椭圆形,聚团生长较明显(图1B);继续向其中加入细胞因子LPS、IFN-γ和IL-6,诱导细胞定向分化为THP-1-M1细胞后,形态更为多样,部分细胞呈长梭形,且细胞膜上的突起十分明显(图1C);而继续加入IL-4、IL-13和IL-6诱导分化出的THP-1-M2细胞,形态与THP-1-M1细胞较相似,但长梭形细胞相对较少(图1D)。
注:“……”同型对照;“-”CD14和CD68;A:使用流式细胞术检测CD分子的表达情况;B:利用统计图比较不同细胞上CD分子表达情况的差异。与THP-1-Mφ比较,* P< 0.05。图2 CD14和CD68分子在不同巨噬细胞上表达的差异Note: “……” Isotype control; “-”CD14 and CD68;A:The expression of CD molecules were detected by flow cytometry;B:The differences of CD molecules on different cells were analyzed by histogram.Compared with the THP-1-Mφ, * P< 0.05.Fig.2 Expression of CD14 and CD68 in different macrophage subsets
2.2单核巨噬细胞特异性分子CD14、CD68在各细胞中的表达
THP-1、THP-1-M1和THP-1-M2细胞表面均可高表达CD14分子,表达量分别为(85.8±6.93)%、(89.25±8.42)%和(82.20±8.62)%;而PMA刺激分化的THP-1-Mφ细胞表面CD14的表达仅为(43.1±2.95)%。与之相反,CD68分子在THP-1与THP-1-Mφ细胞内均高表达,当继续分化为THP-1-M1后CD68的表达也并未发生明显变化(P=0.7709);而THP-1-M2细胞内CD68的表达则出现了较明显的降低(P=0.0129),表达量为(53.45±1.62)%(图2)。
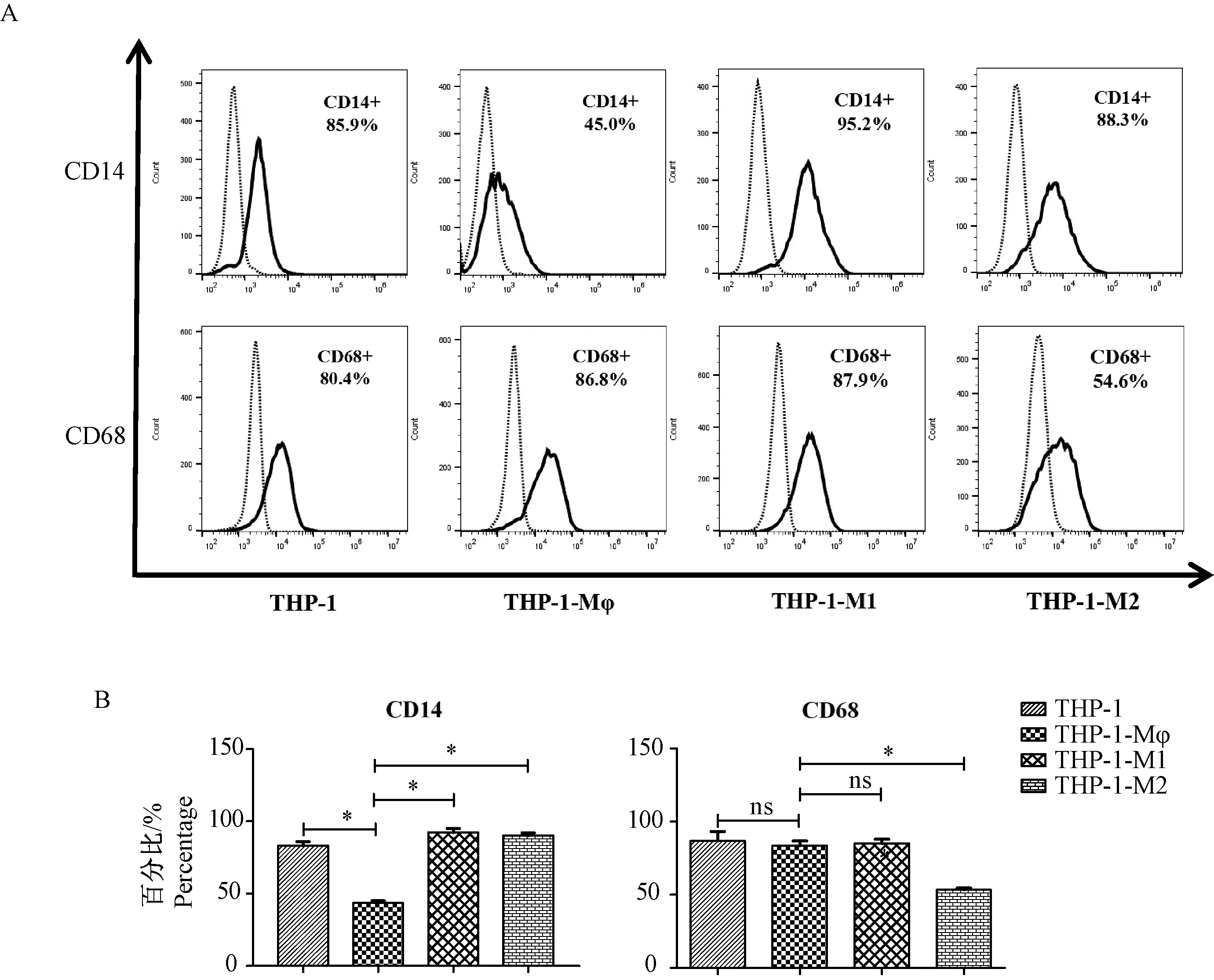
注:“……”同型对照;“-”CD16,CD80和CD86;A:使用流式细胞术检测CD分子的表达情况;B:利用统计图比较不同细胞上CD分子表达情况的差异。与THP-1-Mφ比较,* P< 0.05,** P< 0.01。图3 CD16,CD80和CD86分子在不同巨噬细胞表面表达的差异Note: “……” Isotype control;“-” CD16,CD80 and CD86;A:The expression of CD molecules were detected by flow cytometry;B:The differences of CD molecules on different cells were analyzed by histogram.Compared with the THP-1-Mφ,* P< 0.05,** P< 0.01.Fig.3 Differences in the expression of CD16,CD80 and CD86 in different macrophage subsets
2.3M1型巨噬细胞特异性分子CD16、CD80和CD86在各细胞中的表达
CD16、CD80和CD86等分子的表达是判断M1型巨噬细胞分化情况的指标。如图3所示,THP-1分化出的THP-1-Mφ细胞表面CD16和CD80的表达基本未发生变化,CD86分子的表达量增加到(14.59±2.98)%(P=0.0270);当THP-1-Mφ继续分化为THP-1-M1后,CD16分子的表达出现小幅度升高,而CD80和CD86的表达却出现了非常明显的上升(P值分别为0.0063和0.0082),表达量分别达到(75.85±8.41)%和(69.65±6.43)%;分化出的THP-1-M2细胞表面CD16分子的表达有所降低,但其变化并无显著性差异,CD80和CD86的表达情况与THP-1-M1细胞基本相同。
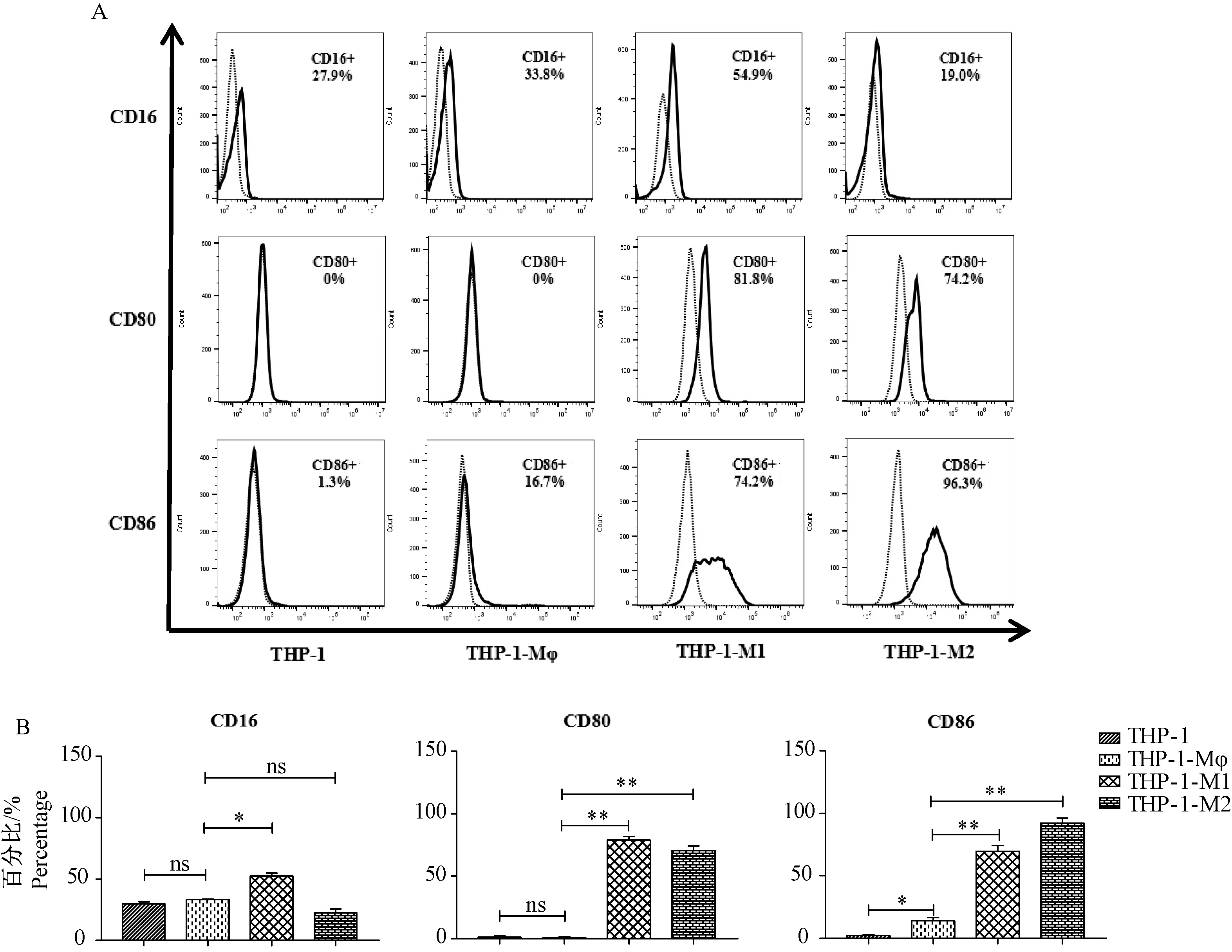
2.4M2型巨噬细胞特异性分子CD163、CD206和CD209在各细胞中的表达
较常用于鉴定THP-1-M2细胞分化情况的CD分子为CD163、CD206和CD209。正常THP-1、THP-1-Mφ和THP-1-M1细胞内CD163分子的表达量均较低;CD206分子在以上三种细胞表面的表达基本为阴性;CD209在THP-1和THP-1-M1细胞表面的表达量分别为(24.10±5.37)%和(44.75±7.99)%,而在THP-1-Mφ细胞表面的表达基本呈阴性;分化成的THP-1-M2细胞可低表达CD206分子,而且CD163和CD209分子的表达均出现了明显的增加,表达量分别为(64.90±0.71)%和(89.20±5.06)%(图4)。
注: “……”同型对照;“-”CD163,CD206和CD209;A:使用流式细胞术检测CD分子的表达情况;B:利用统计图比较不同细胞上CD分子表达情况的差异。与THP-1-Mφ比较,* P< 0.05,** P< 0.01。图4 CD163,CD206和CD209分子在不同巨噬细胞上表达的差异Note: “……” Isotype control;“-” CD163,CD206 and CD209;A:The expression of CD molecules were detected by flow cytometry;B:The differences of CD molecules on different cells were analyzed by histogram.Compared with the THP-1-Mφ,* P< 0.05,** P< 0.01.Fig.4 Differences in the expression of CD163,CD206 and CD209 in different macrophage subsets
2.5与抗原提呈功能相关的CD分子的表达情况
THP-1细胞表面CD83、CD11c和HLA-DR的表达均较高,表达量分别达到(54.75±7.84)%、(76.15±9.12)%和(94.25±2.89)%,CD1a分子的表达呈阴性。THP-1-M1和THP-1-M2细胞则高表达这几个分子。与之相反,THP-1-Mφ细胞CD1a的表达仍为阴性,CD83分子的表达明显降低(P=0.0498),CD11c和HLA-DR的表达更是显著下降,P值分别为0.0073和0.0027(图5)。
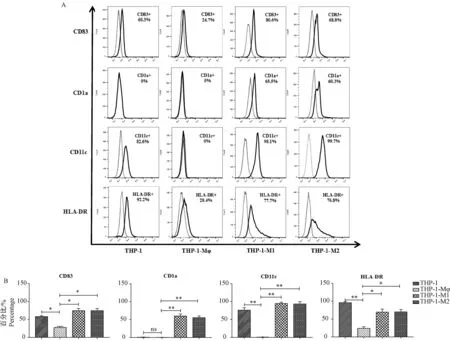
注:“……”同型对照;“-”CD83,CD1a,CD11c和HLA-DR;A:使用流式细胞术检测CD分子的表达情况;B:利用统计图比较不同细胞上CD分子表达情况的差异。与THP-1-Mφ比较,* P< 0.05,** P< 0.01。图5 CD83,CD1a,CD11c和HLA-DR分子在不同巨噬细胞表面表达的差异Note: “……” Isotype control;“-” CD83,CD1a,CD11c and HLA-DR;A:The expression of CD molecules were detected by flow cytometry;B:The differences of CD molecules on different cells were analyzed by histogram.Compared with the THP-1-Mφ,* P< 0.05,** P< 0.01.Fig.5 Differences in the expression of CD83,CD1a,CD11c and HLA-DR in different macrophage subsets
3 讨论
巨噬细胞是一种具有可塑性和多功能性的固有免疫细胞,当体内外微环境发生变化时,巨噬细胞可向不同亚型进行分化,其中研究较多的为M1和M2型巨噬细胞。M1细胞可分泌促炎因子,在炎症早期发挥作用;M2细胞可分泌抑制炎症因子,发挥组织修复作用[7,8]。而对巨噬细胞的功能性研究主要通过体外实验进行,PMA诱导THP-1细胞分化成的THP-1-Mφ是最常用的细胞模型,但到目前为止并没有明确其分化情况。THP-1-Mφ可能为单一亚型的巨噬细胞,也可能是M1和M2型巨噬细胞共存的细胞群,因此本研究对此科学问题进行了深入探究。首先利用PMA刺激THP-1单核细胞分化为THP-1-Mφ,然后在此基础上继续添加不同细胞因子,分别诱导出THP-1-M1和THP-1-M2细胞,最后用显微镜观察细胞形态的变化,并用流式细胞术检测细胞主要CD分子的表达情况。
当THP-1细胞被PMA刺激两天后,细胞由之前的悬浮生长变为贴壁生长,而且THP-1-Mφ细胞可高表达单核巨噬细胞特有的CD14分子和CD68分子,说明单核细胞已经成功分化为巨噬细胞。但是此时细胞大部分呈圆形或椭圆形,并没有形成明显的突触,不具备吞噬病原体的功能,故THP-1-Mφ细胞摄取抗原的能力较弱,当继续分化为THP-1-M1和THP-1-M2后,细胞表面出现非常明显的突起,此时的巨噬细胞可对病原体进行有效的吞噬。由于Mφ与M1和M2型巨噬细胞之间的形态学差异较大,而且THP-1-Mφ并不能高表达M1型巨噬细胞的特异性分子CD80和CD86,也不能高表达M2型巨噬细胞的特异性分子CD163和CD209,因此可以认为THP-1-Mφ细胞并非THP-1-M1和THP-1-M2两种细胞的混合群,而是不同于M1和M2的一种巨噬细胞。
除各细胞的特异性分子之外,本研究还对与抗原提呈功能相关的CD分子进行了检测,其中共刺激分子CD80、CD83和CD86可使细胞有效摄取并加工提呈抗原,为T细胞的活化提供所需的共刺激信号[9];CD209的高表达同样可促进巨噬细胞更好的识别抗原,激活T细胞的免疫应答[10];CD1a则主要负责脂类抗原的提呈[11];而HLA-DR的表达可促进巨噬细胞的激活,其表达程度也反映了细胞提呈抗原的能力[12]。统计结果发现,THP-1-Mφ细胞表面以上分子的表达量均较低,大部分呈阴性,与体内静息状态下的巨噬细胞较相似,此时细胞摄取并提呈抗原的能力较弱,无法有效的刺激T细胞活化[13];而当THP-1-Mφ被细胞因子诱导分化为THP-1-M1和THP-1-M2后,以上CD分子的表达均出现了明显的上升。因此可以认为THP-1-Mφ细胞为处于静息状态的巨噬细胞,而THP-1-M1和THP-1-M2则为被活化的具有功能性的巨噬细胞,但是以上结果并不能直接说明THP-1-Mφ即为M0细胞。
综上所述,静息状态的Mφ与活化状态的M1、M2在细胞形态和CD分子的表达方面差异较大,在实验过程中需要根据实验目的选择合适的细胞模型。本研究在体外诱导实验的基础上,采用了比较分析的方法,明确了PMA刺激THP-1细胞后所得THP-1-Mφ的类型,为巨噬细胞功能性实验的研究提供了理论依据,而且本实验重点研究了巨噬细胞CD分子的表达情况,也为巨噬细胞的表型鉴定方法提供了新思路。
[1] Van FR. The mononuclear phagocyte system [J]. Verh Dtsch Ges Pathol, 1980(64):1-11.
[2] 孙晓梅,曹春渝,高家红,等.血细胞分离机大量采集实验猕猴外周血单核细胞方法探讨[J].中国实验动物学报, 2008, 16(6):424-427.
[3] 桑明,代明,周立,等.恒河猴外周血单核巨噬细胞体外培养方法的建立[J].中国实验动物学报, 2015, 23(1):18-24.
[4] Xue J, Fu C, Cong Z, et al. Galectin-3 promotes caspase-independent cell death of HIV-1-infected macrophages [J]. FEBS J, 2016, 284 (1):97-113.
[5] 彭卓颖,丛喆,李想,等.不同方法诱导THP-1细胞分化效果比较[J].中国比较医学杂志, 2017, 27(9):1-7.
[6] 吴芳新,王卫,丛喆,等.艾滋病猴特异性细胞免疫的胞内细胞因子检测方法优化与应用[J].中国实验动物学报, 2012, 20(1):18-23.
[7] Martinez FO, Gordon S.The M1 and M2 paradigm of macrophage activation: time for reassessment [J]. F1000Prime Rep, 2014, 6:13.
[8] Mantovani A, Sica A, Sozzani S, et al.The chemokine system in diverse forms of macrophage activation and polarization[J]. Trends Immunol, 2004, 25(12):677-686.
[9] 张苗苗,梁雪,杨荣存.LPS刺激下miR-17和miR-20a对小鼠巨噬细胞CD80、CD86表达的影响[J].南开大学学报自然科学版, 2012(6):12-16.
[10] 任建敏,张彦洁,王俊青,等.DC-SIGN固有免疫调节及其表达调控机制研究进展[J]. 生命科学, 2012(10):9-15.
[11] De Libero G, Mori L. How the immune system detects lipid antigens [J]. Prog Lipid Res, 2010, 49(2):120-127.
[12] 徐魁,周云.HLA-DR、CD40和CD1a在桥本甲状腺炎甲状腺滤泡上皮中的表达[J].湖北科技学报(医学版), 2011, 25(6):480-482.
[13] Hornell TM1, Beresford GW, Bushey A,et al.Regulation of the class II MHC pathway in primary human monocytes by granulocyte-macrophage colony-stimulating factor [J]. J Immunol, 2003, 171(5):2374-2383.
PhenotypiccharacterizationofPMA-inducedTHP-1macrophagesanalyzedbyflowcytometry
PENG Zhuo-ying, LI Xiang, CONG Zhe*, XUE Jing*
(Comparative Medicine Center, Peking Union College(PUMC)& Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences (CAMS);Key Laboratory of Human Diseases Comparative Medicine, Ministry of Health;Key Laboratory of Human Diseases Animal Models, State Administration of Traditional Chinese Medicine, Beijing Key Laboratory for Animal Models of Emerging and Remerging Infectious Diseases, Beijing 100021, China)
ObjectiveTo identify the characteristics of the subtype of PMA-induced THP-1 macrophages by flow cytometry analysis.MethodsTHP-1 monocytic cells differentiate into macrophages promoted by PMA, then induced into M1 and M2 by adding different cytokines, such as LPS,IL-6 and IFN-γ for THP-1-M1, IL-4,IL-13 and IL-6 for THP-1-M2. Morphology of cells were observed under a microscope and the expression of CD14, CD68, CD16, CD80, CD86, CD163, CD206, CD209, CD83, CD1a, CD11c, HLA-DR were detected by flow cytometry.ResultsThe macrophages stimulated by PMA became adherent; THP-1-M1 and THP-1-M2 lost their spherical morphology, appeared more irregular with many obvious projections. The expression of CD83, CD1a, CD11c, HLA-DR which had the function of antigen presenting on the surface of THP-1-Mφ were very low, and most of them were negative, but those of THP-1-M1 and THP-1-M2 were very high.ConclusionsThe macrophages differentiated from THP-1 stimulated by PMA are weak in antigen presenting function.
THP-1; Macrophage; Phorbol 12-myristate 13-acetate, PMA; Flow cytometry
R-33
A
1671-7856(2017) 10-0010-06
10.3969.j.issn.1671-7856. 2017.10.003
2017-04-12
国家自然科学基金-青年科学基金项目(81301437);科技部重大专项(2014ZX10001001-001-004,2014ZX10001001-002-006)。
彭卓颖(1992-),女,硕士研究生,从事实验动物病毒学研究工作。E-mail: 18810963239@163.com
薛婧(1983-),女,副研究员,硕士生导师,研究方向:病原生物学和免疫学。E-mail: xuejing@cnilas.org。
丛喆(1972-),女,副主任技师,从事实验动物病毒分子生物学和模型研究工作。E-mail: congz@cnilas.org。*共同通讯
