HPLC法测定妇炎平阴道泡腾片中苦参碱的含量
2017-11-01辽宁中医药大学药学院辽宁大连116600
辽宁中医药大学药学院,辽宁 大连 116600
HPLC法测定妇炎平阴道泡腾片中苦参碱的含量
吴浩善冯宏玲韩丽张冬月虞小静张慧*
辽宁中医药大学药学院,辽宁 大连 116600
目的建立 HPLC法测定妇炎平阴道泡腾片中苦参碱含量的方法,并测定10批次泡腾片中苦参碱的含量。方法采用高效液相色谱法,Shim-pack VP-ODS色谱柱(4.6mm×250mm,5μm),流动相为乙腈-0.1%磷酸(20∶80)(三乙胺调pH至8.0),流速1.0 mL/min,柱温30 ℃,检测波长 220 nm。结果苦参碱与相邻组分分离度良好,且阴性液无干扰,方法的重复性、稳定性、精密度、准确度试验均符合有关规定,苦参碱的回归方程为y=803.66x+5.087,(r=0.9994),苦参碱进样量在0.752~3.006 μg范围内,线性关系良好。结论该法准确灵敏、稳定可靠,可用于妇炎平阴道泡腾片的质量控制。
妇炎平阴道泡腾片;苦参;苦参碱;高效液相色谱
妇炎平阴道泡腾片由苦参、苦木、蛇床子、枯矾、珍珠层粉、冰片、薄荷脑、盐酸小檗碱、硼酸9味中药经提取加工制成,具有清热解毒、燥湿止带、杀虫止痒的功效,用于肝经湿热、带下量多以及滴虫、真菌、细菌引起的阴道炎、外阴炎等症。妇炎平阴道泡腾片现已上市,但其质量标准中仅有蛇床子素和盐酸小檗碱的含量测定,而没有君药苦参相应的含量测定内容,不利于控制药品的质量。苦参中主要含有生物碱类、黄酮类成分,生物碱类成分主要为苦参碱,为指标性化学成分[1]。2015版《中国药典》苦参项下含量测定部分也将苦参碱作为含量测定项[2]。笔者经方法学考察,证实苦参碱与相邻组分分离度良好,且阴性液无干扰,方法的重复性、稳定性、精密度、准确度试验均符合有关规定,因此确立苦参碱为本制剂中苦参的含量测定指标,通过相关的方法学验证,建立了HPLC法测定妇炎平阴道泡腾片中苦参碱含量的方法,完善了本品的质量控制体系。
1 仪器与材料
1.1 仪器 Agilent 1260 高效液相色谱仪(美国 Agilent公司);KQ250DB 型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料 妇炎平阴道泡腾片(批号:150101、150403、150801、150802、160102、160103、160301、160302、160303、160304,江西南昌制药有限公司);苦参碱对照品(批号0805-200005,中国食品药品检定研究院);乙腈为色谱纯,水为重蒸馏水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱:Shim-pack VP-ODS;流动相:乙腈-0.1%磷酸(20∶80)(三乙胺调pH至8.0);检测波长:220 nm;流速:1.0 mL/min;进样量:10 μL,柱温:30℃。
2.2 溶液的制备
2.2.1 对照品溶液制备 取苦参碱对照品适量,精密称定,加流动相制成含苦参碱0.15 mg/mL的溶液,即得。
2.2.2 供试品溶液制备 取重量差异项下的本品,研细,取约1.9 g,精密称定,精密加水50 mL,微热使溶解,放冷,滤过,精密量取续滤液25 mL,加浓氨试液2 mL,三氯甲烷50 mL,超声30 min,分取三氯甲烷层,水层再用三氯甲烷15 mL分次洗涤,合并三氯甲烷液,蒸干,残渣加流动相定容至10 mL量瓶中,摇匀,即得。
2.2.3 阴性对照溶液制备 取除苦参以外的其它药材,按成品制备工艺制成阴性样品,按上述供试品溶液的制备方法制成缺苦参的阴性对照溶液。
2.3 方法学考察
2.3.1 专属性试验 精密吸取苦参碱对照品溶液、妇炎平阴性对照溶液、妇炎平供试品溶液各10 μL,依上法测定。结果妇炎平供试品溶液在与苦参碱对照品相同保留时间(19.9min)的位置有色谱峰,妇炎平阴性对照液色谱图中,在与苦参碱对照品相同保留时间(19.9min)的位置无色谱峰。结果表明,妇炎平阴性对照液无干扰,专属性良好。结果如图 1~3所示。

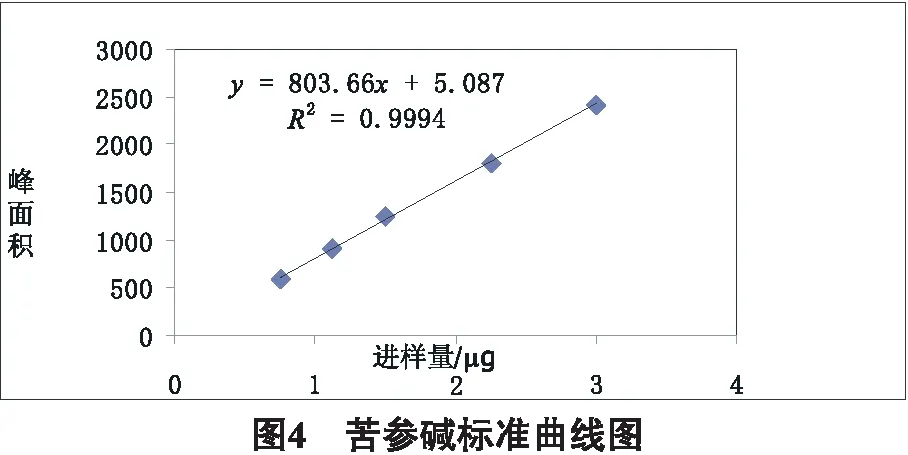
2.3.2 线性关系考察 分别精密量取苦参碱对照品溶液(浓度为1.503mg/mL) 0.5、0.75、1.0、1.5、2.0mL,分别置10mL量瓶中,加入流动相稀释至刻度,分别精密量取10 μL,注入液相色谱仪,测定峰面积。以峰面积为纵坐标(Y),进样量为横坐标(X),绘制标准曲线,苦参碱的回归方程为y=803.66x+5.087,r=0.9994,苦参碱进样量在0.752~3.006 μg范围内,线性关系良好。标准曲线如图4所示。
2.3.3 精密度试验
2.3.3.1 仪器精密度试验 取重量差异项下的本品(批号:160304),研细,混匀,取约1.9 g(相当于2片),精密称定,按供试液品溶液制备方法制备供试品溶液,分别精密吸取同一供试品溶液10 μL,连续进样6次,依法测定,记录苦参碱峰面积,供试品仪器精密度结果RSD(%)=0.58,符合相关规定。
2.3.3.2 中间精密度试验 取重量差异项下的本品(批号:160304),研细,混匀,分别取约1.9 g(相当于2片)6份,精密称定,由3个不同分析人员,按供试液品溶液制备方法分别制备供试品溶液,分别在3d,每人取样2次,依法测定,计算苦参碱含量,RSD(%)=0.92,符合相关规定。
2.3.4 重复性试验 取重量差异项下的本品(批号:160304),研细,混匀,取约1.9 g(相当于2片),共取6份,分别精密称定,按供试品溶液制备方法制备供试品溶液,依法测定,计算苦参碱含量,RSD(%)=0.65,结果表明方法重复性良好。
2.3.5 稳定性试验 取重量差异项下本品(批号:160304),研细,混匀,取约1.9 g(相当于2片),精密称定,按供试品溶液制备方法制备供试品溶液,精密吸取同一供试液,分别在0、2、4、6、8h时进样10 μL,记录峰面积,RSD(%)=1.28,结果表明,供试品溶液在8h内稳定,色谱峰面积无明显变化。
2.3.6 准确度试验 取已知含量的重量差异项下的本品(批号:160304,苦参碱含量为1.372mg/片),研细,混匀,取约0.95 g,共取6份,分别精密称定,置具塞锥形瓶中,分别精密加入苦参碱对照品溶液(浓度1.410mg/mL)1 mL,其余按供试品溶液制备方法制备供试品溶液,依法测定,计算苦参碱含量,并计算平均回收率及RSD。结果显示,苦参碱回收率在95%~105%之间,RSD为0.82%,符合相关规定。结果见表1。
2.4 样品含量测定 按供试品溶液制备方法制备,测定本品10批样品中苦参碱的含量。测定结果见表2。
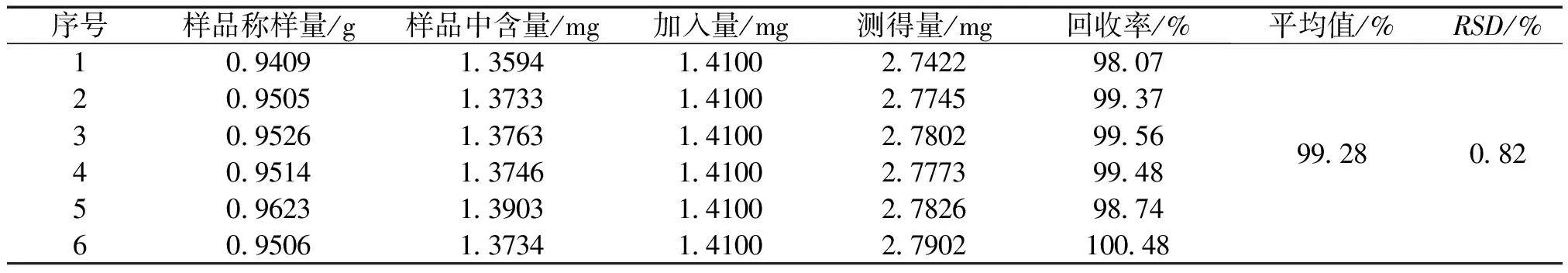
表1加样回收率试验测定结果

表2 10批样品含量测定结果
3 讨论
3.1 测定指标及流动相条件的确定 对2015版《中国药典》苦参项下苦参碱、氧化苦参碱含量测定所采用的氨基柱方法进行优化[2-7],苦参碱、氧化苦参碱分离度及拖尾因子均不能满足含量测定要求,且氧化苦参碱含量较低,作为质控指标成分,定量不准确,因此未采用药典方法。查阅文献,采用C18柱调整流动相比例[8-10],苦参碱分离度良好,方法稳定,可以满足含量测定要求;而氧化苦参碱含量过低,定量不准确,且多次试验摸索均难以与周围杂质峰分离,因此未测定氧化苦参碱含量。基于上述,确定含量测定指标为苦参碱,以乙腈-0.1%磷酸(20∶80)(三乙胺调pH至8.0)为流动相。结果显示,供试品色谱中待测组分分离度及方法重复性均良好,保留时间适宜。
3.2 检测波长的选择 取苦参碱对照品精密称定,加流动相制成每1mL中约含25μg溶液,以流动相为空白溶剂,在200~400nm范围内进行扫描。结果苦参碱在202nm处有最大吸收,因202nm为末端吸收,杂质峰过多干扰含量测定,为此参考2015版《中国药典》中苦参碱含量测定的检测波长[2],选择有紫外吸收的220nm为测定波长。
3.3 提取溶剂用量及超声处理时间的选择 鉴于本药品中苦参已经提取入药,选用三氯甲烷为提取溶剂,对提取溶剂用量(25 mL、50 mL、100 mL)时的苦参碱提取量进行了考察,结果表明,三氯甲烷提取用量为50 mL、100 mL时,已基本提取完全,考虑成本,确定三氯甲烷提取用量为50 mL。选用超声处理法制备供试液,对不同超声处理时间(15 min、30 min、45 min)进行了考察,结果显示,超声处理30 min,样品中苦参碱已基本提取完全,故确立超声处理的时间为30 min。
通过试验确定了用于测定苦参碱含量所采用的色谱柱类型、流动相条件、检测波长、提取溶剂、提取时间,并进行了方法学考察,最终确立了HPLC 测定妇炎平阴道泡腾片中苦参碱含量的方法,该方法准确、快速、可靠,结果稳定,苦参碱色谱峰形及分离度均较好,可用于妇炎平阴道泡腾片君药苦参中苦参碱的含量测定,完善了制剂的质量标准,从而能更加有效、全面地控制药品的质量。
[1]付起凤,曹琦,吕邵娃,等.正交法优化苦参中苦参生物碱的超声提取工艺[J].中医药信息,2015,32(1):11-13.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015.
[3]闵庆璐,王巍,鞠成国,等.HPLC测定丹黄祛瘀片中苦参碱和氧化苦参碱的含量[J].中国实验方剂学杂志,2012,18(1):60-62.
[4]梁亚丽,郭文敏,王莉芳,等.HPLC法测定妇宁阴道泡腾片中苦参碱和氧化苦参碱的总量[J].中国药师,2010,13(10):1411-1413.
[5]任永红,冯绍华.HPLC法测定康妇灵片中苦参碱和氧化苦参碱的含量[J].安徽医药,2009,13(2):154-155.
[6]骆莉莉,张亚洲,董立莎.HPLC法测定抗炎泡腾栓中苦参碱和氧化苦参碱的方法学研究[J].贵阳中医学院学报,2009,31(3):16-18.
[7]郝明虹,夏才付,王栋.HPLC法测定妇炎清泡腾片中苦参碱的含量[J].药物分析杂志,2007,27(12):1996-1997.
[8]张静,李玥瑛,张树杰,等.HPLC法测定康妇消炎胶囊中苦参碱的含量[J].中医药信息,2007,24(1): 59-60.
[9]麻风华,刘艳新,刘竹青.HPLC法测定康妇消炎栓中苦参碱的含量[J].中国药事,2006,20(5):293-295.
[10]毛丹,陈钶,王柯,等.HPLC法测定苦参软膏中苦参碱、槐定碱和氧化苦参碱[J].中成药,2011,(9):1531-1534.
DeterminationofMatrineinFuyanpingVaginalEffervescentTabletsbyHPLC
WU Haoshan FENG Hongling HAN Li ZHANG Dongyue YU Xiaojing ZHANG Hui*
College of Pharmacy,Liaoning University of Traditional Chinese Medicine,Liaoning 116600,China
ObjectiveTo establish an HPLC method for determination of Matrine in Fuyanping vaginal effervescent tablets and the determination of ten batches effervescent tablets Matrine content.MethodsMatrine was extracted by ultrasonic extraction and determined by high performance liquid chromatography.Shim-pack VP -ODS column ( 4.6mm × 250mm,5μm) was used.The mobile phase of acetonitrile-0.1%phosphoric acid water was 20∶80(Three ethylamine, pH ranging to 8).The flow rate was 1.0 mL/min.The column temperature was 30℃ and the detection wavelength was 220nm.ResultsMatrine had good separation with adjacent components and the negative was of no interference.The method's reproducibility,stability,precision and accuracy of the test were in line with relevant regulations.The regression equation wasy=803.66x+5.087(r=0.9994).The Matrine injection amount was within the range of 0.752~3.006 μg.It has a good linear relationship.ConclusionThe method is accurate and sensitive,stable and reliable and can be used for quality control in Fuyanping vaginal effervescent tablets.
Fuyanping Vaginal Effervescent Tablets;Sophora flavescens Ait;Matrine;High Performance Liquid Chromatography
R284
A
1007-8517(2017)17-0012-03
2017-05-31 编辑:陶希睿)
辽宁省高等学校优秀科技人才支持计划(LR2015042)。
吴浩善(1992-),男,汉族,硕士研究生在读,研究方向为中药品质评价与创新药物研究。E-mail:15641186420@163.com
张慧(1970-),女,教授,博士研究生,硕士研究生导师,研究方向为中药品质评价与创新药物研究。E-mail:syyycs@163.com
