小鼠念珠菌性阴道炎中维A酸相关孤儿受体、白细胞介素17表达
2017-11-01罗单张金娥陈嵘祎杨艳平周英樊翌明524001广东湛江广东医科大学附属医院皮肤科
罗单 张金娥 陈嵘祎 杨艳平 周英 樊翌明524001广东湛江,广东医科大学附属医院皮肤科
小鼠念珠菌性阴道炎中维A酸相关孤儿受体、白细胞介素17表达
罗单 张金娥 陈嵘祎 杨艳平 周英 樊翌明524001广东湛江,广东医科大学附属医院皮肤科
目的探讨Th17/白细胞介素(IL)17轴在小鼠念珠菌性阴道炎发病中作用。方法120只雌性BALB/c小鼠随机分为雌激素感染组(Ei)、雌激素非感染组(En)、对照感染组(Ci)和对照非感染组(Cn)。Ei、En组在阴道接种前3 d于后腿皮下注射雌二醇0.05 mg,而Ci、Cn组皮下注射灭菌大豆油0.1 ml,以后隔日注射1次直至实验结束;Ei、Ci组在接种日在阴道内接种白念珠菌悬液10 μl(5×104个孢子),而En、Cn组阴道内注入10 μl无菌磷酸盐缓冲液。接种后3、7、14 d,每组于各时间点分别随机取10只小鼠处死,完整切取阴道组织作液氮冷冻或石蜡包埋,实时荧光定量PCR(qRT⁃PCR)、Western印迹和免疫荧光染色分别检测阴道组织中维A酸相关孤儿受体(ROR)γt、RORα、IL⁃17 mRNA、蛋白表达及免疫荧光强度。结果激光共聚焦显微镜显示,En、Cn组中RORγt、RORα和IL⁃17主要表达于阴道固有膜及血管中炎症细胞,Ci组中主要表达于黏膜上皮及其表面附着的菌丝、固有膜及血管中炎症细胞,Ei组中则广泛分布于黏膜上皮、固有膜及血管中炎症细胞、阴道腔和黏膜上皮中内吞菌丝。qRT⁃PCR和免疫荧光检查显示,En、Ci和Ei组中RORγt、RORα、IL⁃17 mRNA表达及其免疫荧光强度在相同时间点均显著高于Cn组(均P<0.05),且Ei组显著高于En、Ci组(P< 0.05);除Cn组外,其余各组中RORγt、RORα、IL⁃17 mRNA表达及其免疫荧光强度均随时间延长有增加的趋势,其中RORγt、RORα mRNA和免疫荧光强度及IL⁃17 mRNA一般在14 d时最高,而IL⁃17免疫荧光强度在7 d时最高(P< 0.05)。Western印迹显示,Ci、Ei组中RORγt和IL⁃17蛋白表达在相同时间点均明显高于Cn、En组(RORγt:F组别=45.685,P< 0.001;IL⁃17:F组别=29.655,P< 0.01),其中Ei组表达水平最高(P< 0.05),而Cn、En组表达差异无统计学意义(P> 0.05);Ci、Ei组中二者表达均在感染后7 d明显上调,14 d无显著增加(RORγt:F时间=13.137,P< 0.001;IL⁃17:F时间=11.182,P< 0.001)。结论阴道念珠菌感染可上调RORγt、RORα、IL⁃17表达,提示Th17/IL⁃17轴可能参与BALB/c小鼠念珠菌性阴道炎发生。
念珠菌病,外阴阴道;白色念珠菌;雌激素类;核受体亚家族1,F组,成员3;白细胞介素17;小鼠;维A酸相关孤儿受体
初始CD4+T细胞可分化为Th1、Th2、Th17和Treg细胞。Th17细胞主要产生白细胞介素17(IL⁃17)、IL⁃17F、IL⁃21、IL⁃22等细胞因子[1]。维A酸相关孤儿受体(ROR)γt是调节Th17细胞分化的主要转录因子,而RORα起协同作用[2]。Th17免疫应答与念珠菌感染部位有关,其在念珠菌性阴道炎(VC)发病中作用存在较大争议。Th17/IL⁃17轴是抵御口咽、皮肤和系统性念珠菌感染的关键通路,但其在小鼠胃肠道念珠菌病中加重组织损伤[3]。在小鼠VC模型中,Yano等[4]认为炎症反应与Th17免疫应答无关,而Pietrella等[5]发现Th17细胞和IL⁃17具有保护作用。我们曾用不同剂量(每周0.15 mg或0.3 mg)雌激素皮下注射建立了小鼠VC模型,发现雌激素处理可增加阴道载菌量和感染、炎症反应程度[6]。本研究用实时荧光定量PCR(qRT⁃PCR)、Western印迹法和免疫荧光染色检测阴道组织中RORγt、RORα、IL⁃17表达,探讨Th17/IL⁃17轴在小鼠VC模型中的作用。
资料与方法
一、资料
1.动物、菌株及主要试剂、仪器:8~10周龄SPF级雌性BALB/c小鼠、白念珠菌标准株(CGMCC 2.2411)分别购于南方医科大学实验动物中心、中国科学院微生物研究所。羊抗小鼠IL⁃17(sc⁃6077)、羊抗小鼠 RORα(sc⁃26380)、兔抗小鼠RORγt(sc⁃28559)、FITC⁃驴抗兔 IgG(sc⁃2090)、RB200⁃鸡抗羊 IgG(sc⁃2860)抗体(美国Santa Cruz公司);大鼠抗小鼠RORγt(14⁃6981)抗体(美国eBioscience公司);兔抗小鼠IL⁃17(ab⁃79056)、兔抗小鼠β⁃actin(ab8227)、HRP标记羊抗兔(ab6721)抗体(美国Abcam公司);HRP标记山羊抗大鼠IgG(上海碧云天生物技术有限公司);Trizol(美国Invitrogen公司);SYBR Premix Ex TaqⅡ荧光定量试剂盒[宝生物工程(大连)有限公司];T⁃PER动物组织蛋白抽提试剂、BCA蛋白定量试剂盒、SuperSignal®化学发光底物(美国Thermo Scientific公司);TCS SP5Ⅱ激光共聚焦显微镜(德国Leica公司);LightCycler®480荧光定量PCR(瑞士Roche公司)。
2.小鼠分组及VC模型构建:参照文献[6],120只小鼠按照随机分配表随机分为雌激素感染组(Ei)、雌激素非感染组(En)、对照感染组(Ci)、对照非感染组(Cn),每组30只。Ei、En组在阴道接种前3 d于后腿皮下注射雌二醇0.05 mg,而Ci、Cn组皮下注射灭菌大豆油0.1 ml,以后隔日注射1次直至实验结束。Ei、Ci组在接种日取白念珠菌悬液10 μl(5×104个孢子)阴道内灌注并倒置5 min,而En、Cn组阴道内注入10 μl无菌磷酸盐缓冲液(PBS)。接种后3、7、14 d,每组于各时间点分别随机取10只小鼠断颈处死,完整切取阴道组织,其中4只用液氮冷冻作qRT⁃PCR,3只液氮冷冻作Western印迹,3只石蜡包埋作免疫荧光染色。
二、方法
1.qRT⁃PCR 检测阴道组织中RORγt、RORα、IL⁃17 mRNA的表达:小鼠阴道组织研磨成粉,用Trizol提取总RNA,用RT试剂盒反转录为cDNA。PCR引物由宝生物工程(大连)有限公司合成。RORα引物:正向5′⁃GCTTCTTCCCCTACTGTTCCTT⁃3′,反向 5′⁃TCACCTCTCTCTGCTTGTTCTG⁃3′,共87 bp;RORγt引物:正向5′⁃GAAAGCAGGAGCAATG GAAGT⁃3′,反向5′⁃GCTGAGGAAGTGGGAAAAGTC⁃3′,共166 bp;IL⁃17引物:正向5′⁃GTGTCAATGCGG AGGGAAAG⁃3′,反向 5′⁃GCATCTTCTCGACCCTGA AA⁃3′,共120 bp;β肌动蛋白引物:正向5′⁃TCCGTA AAGACCTCTATGCCAACA⁃3′,反向5′⁃GCTAGGAG CCAGAGCAGTAATCTC⁃3′,共104 bp。PCR反应条件:95℃预变性30 s;95℃变性5 s,60℃退火/延伸34 s,40个循环;每个循环结束时收集荧光信号。β肌动蛋白作为内参照,用2⁃ΔΔCt法计算目的基因相对表达量。
2.免疫荧光双标染色检测阴道组织中RORγt、RORα、IL⁃17免疫荧光强度:切片脱蜡至水,浸入枸橼酸盐缓冲液(pH 6.0)中微波修复抗原10 min;10%牛血清蛋白室温封闭抗原20 min,滴加预混匀一抗50 μl,即兔抗鼠RORγt+ 羊抗鼠RORα/羊抗鼠IL⁃17(工作浓度均为1∶100),4℃过夜后,37 ℃湿盒内孵育2 h,PBS洗3次;滴加预混匀FITC⁃驴抗兔IgG+RB200⁃鸡抗羊IgG(工作浓度均为1∶200)50 μl,37℃湿盒内避光孵育1 h,PBS洗3次;抗荧光淬灭封片液封片,激光共焦聚显微镜观察,FITC和RB200激发波长分别为495 nm、570 nm。每张切片随机选取3个视野拍摄照片,计算每个标本平均荧光值。
3.Western印迹检测阴道组织中RORγt、IL⁃17蛋白的表达:T⁃PER动物组织蛋白抽提试剂提取阴道组织蛋白质,BCA蛋白定量试剂盒检测总蛋白水平。SDS⁃PAGE电泳90 min,转膜2 h。5%牛血清蛋白室温封闭2 h,分别用RORγt(1∶500)、IL⁃17(1∶250)、β肌动蛋白(1∶1 000)4℃孵育过夜;0.5‰ TBST洗膜后加入HRP标记抗兔IgG(1∶2 000)或抗鼠IgG(1∶2 000)室温孵育1 h;0.5‰ TBST洗膜后用Super Signal®化学发光底物显色3~5 min,X线胶片曝光后作显影、定影处理。用Uniscan A686扫描胶片,Image J软件分析目的条带与β肌动蛋白吸光度A值。每个样本重复3次取均值。
三、统计学分析
用SPSS17.0统计软件分析,数据以±s表示。用Univariate方差分析,两两比较用SNK检验。
结 果
一、RORγt、RORα、IL⁃17免疫荧光染色
激光共聚焦显微镜显示(图1),FITC标记RORγt发出绿色荧光,RB200标记RORα或IL⁃17发红色荧光,RORγt+RORα或IL⁃17双标染色显示桔黄色荧光。En、Cn组中RORγt、RORα和IL⁃17主要表达于阴道固有膜及血管中炎症细胞,Ci组中主要表达于黏膜上皮及其表面附着的菌丝、固有膜及血管中炎症细胞,Ei组中则广泛分布于黏膜上皮、固有膜及血管中炎症细胞、阴道腔和黏膜上皮中内吞菌丝。各组小鼠在接种白念珠菌或PBS后3、7、14 d,RORγt、RORα、IL⁃17、RORγt+RORα 和 RORγt+IL⁃17免疫荧光强度均随感染时间延长而逐渐增强;而相同时间下,Cn、En、Ci和Ei组中RORγt、RORα、IL⁃17、RORγt+RORα和RORγt+IL⁃17免疫荧光强度也逐渐增强。
二、阴道组织中RORγt、RORα、IL⁃17 mRNA表达及其免疫荧光强度
qRT⁃PCR和免疫荧光检查显示(表1~ 3),En、Ci和Ei组中RORγt、RORα、IL⁃17 mRNA表达及其免疫荧光强度在相同时间点均明显高于Cn组(P<0.05),且Ei组一般显著高于En、Ci组(P< 0.05);除Cn组外,其余各组中RORγt、RORα、IL⁃17 mRNA表达及其免疫荧光强度均有随时间延长而增加的趋势,其中RORγt、RORα mRNA和免疫荧光强度及IL⁃17 mRNA一般在14 d时最高,而IL⁃17免疫荧光强度在7 d时最高(P<0.05)。
三、Western印迹检测阴道组织中RORγt、IL⁃17蛋白表达(图2)
Ci、Ei组中RORγt和IL⁃17蛋白表达在相同时间点均明显高于Cn、En组(RORγt:F组别=45.685,P< 0.001;IL⁃17:F组别=29.655,P< 0.01),其中Ei组表达水平最高(P<0.05),而Cn、En组表达差异无统计学意义(P> 0.05)。Ci、Ei组中RORγt和IL⁃17蛋白表达均在感染白念珠菌后7 d明显上调,14 d无增加(RORγt:F时间=13.137,P< 0.001;IL⁃17:F时间=11.182,P< 0.001)。
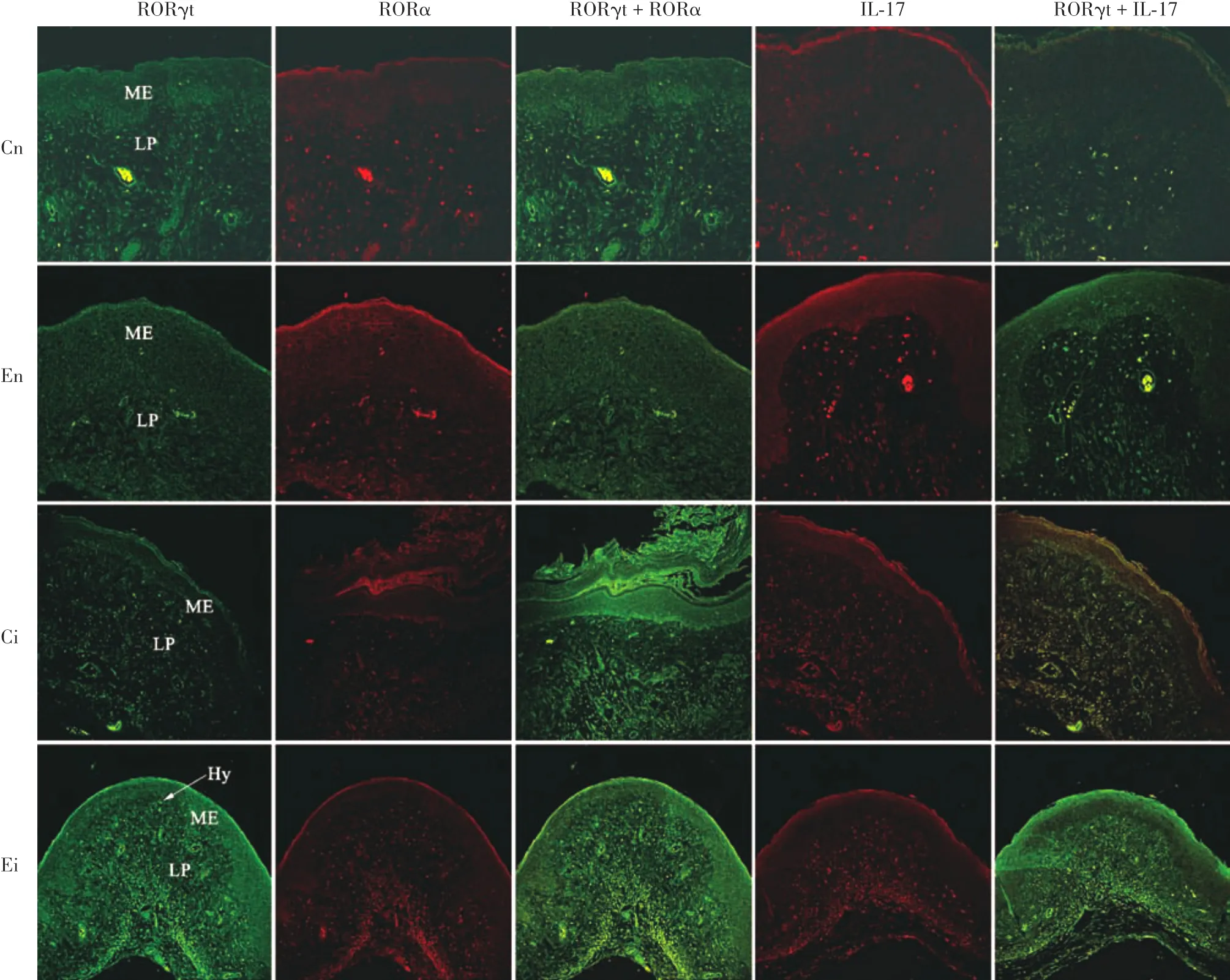
图1 各组小鼠接种白念珠菌或PBS 14 d RORγt、IL⁃17、RORα免疫荧光结果 绿色荧光表示FITC标记RORγt,红色荧光表示RB200标记IL⁃17或RORα,桔黄色荧光表示RORγt+IL⁃17或RORα双标染色;Hy:菌丝;ME:黏膜上皮,LP:固有膜;对照非感染组(Cn组,× 400):RORγt、RORα、IL⁃17表达及RORγt+RORα、RORγt+IL⁃17双标染色见于阴道固有膜和血管中炎症细胞;雌激素非感染组(En组,× 400):RORγt、RORα、IL⁃17表达及RORγt+RORα、RORγt+IL⁃17双标染色也见于阴道固有膜和血管中炎症细胞;对照感染组(Ci组,× 200):RORγt、IL⁃17和RORα表达在黏膜上皮、固有膜及血管中炎症细胞,而RORγt+IL⁃17和RORγt+RORα双标染色仅见于炎症细胞;雌激素感染组(Ei组,× 200):RORγt、RORα和IL⁃17广泛表达在黏膜上皮及内吞菌丝、固有膜及血管中炎症细胞,而RORγt+RORα和RORγt+IL⁃17双标染色仅见于炎症细胞;Cn、En、Ci、Ei组中RORγt、RORα、IL⁃17、RORγt+RORα、RORγt+IL⁃17免疫荧光强度均逐渐增强
表1 各组小鼠感染白念珠菌3、7、14 d后阴道组织中RORγt mRNA表达及其免疫荧光强度(±s)

表1 各组小鼠感染白念珠菌3、7、14 d后阴道组织中RORγt mRNA表达及其免疫荧光强度(±s)
注:n=3。Cn组:对照非感染组;En组:雌激素非感染组;Ci组:对照感染组;Ei组:雌激素感染组;F1:时间因素的效应大小;F2:分组因素的效应大小;SNK检验显示,a:与相同时间点Cn组相比,P<0.05;b:与相同时间点En组相比,P<0.05;c:与相同时间点Ci组相比,P<0.05;d:与同组别3d时相比,P<0.05;e:与同组别7d时相比,P<0.05
组别Cn组En组Ci组Ei组F1值P值mRNA表达(n=4)3 d 1.00 1.21±0.09a 1.36±0.15a 2.17±0.23abc 7 d 1.00 2.64±0.73ad 3.04±0.74ad 7.04±1.55abcd 128.062<0.001 14 d 1.00 3.49±0.47ade 3.74±0.47ade 33.40±5.41abcde F2值162.079 P值<0.001免疫荧光强度(n=3)3 d 2.09±0.29 3.69±0.56a 4.11±0.46ab 8.66±1.13abc 7 d 1.91±0.29 3.76±0.47a 5.32±0.56abd 11.63±0.53abcd 203.456<0.001 14 d 2.13±0.22 6.49±0.71ade 10.72±1.10abde 33.90±3.37abcde F2值338.63 P值<0.001
讨 论
小鼠VC模型的建立和维持需要每周皮下注射雌激素0.01 ~ 0.5 mg维持假发情状态[6⁃7]。我们早期研究[8]发现,感染组小鼠菌落计数在接种后3 d最高,7 d、14 d明显减少,21 d基本消失,而阴道黏膜炎症反应在7 d时明显,14 d、21 d加重。Fidel[7]的研究也指出,阴道接种白念珠菌后7~14 d可诱发明显T细胞应答。因此,我们后续研究选择接种后3 d、7 d、14 d进行观察。
表2 各组小鼠感染白念珠菌3、7、14 d后阴道组织中RORα mRNA表达及其免疫荧光强度(±s)

表2 各组小鼠感染白念珠菌3、7、14 d后阴道组织中RORα mRNA表达及其免疫荧光强度(±s)
注:n=3。Cn组:对照非感染组;En组:雌激素非感染组;Ci组:对照感染组;Ei组:雌激素感染组;F1:时间因素的效应大小;F2:分组因素的效应大小;SNK检验显示,a:与相同时间点Cn组相比,P<0.05;b:与相同时间点En组相比,P<0.05;c:与相同时间点Ci组相比,P<0.05;d:与同组别3 d时相比,P< 0.05;e:与同组别7 d时相比,P< 0.05
组别F2值P值F2值P值Cn组En组Ci组Ei组F1值P值mRNA表达(n=4)3 d 1.00 1.24±0.23a 1.54±0.23a 2.37±0.60abc 7 d 1.00 2.11±0.37ad 2.43±0.40ad 7.10±1.01abcd 147.875<0.001 14 d 1.00 3.24±0.25ade 3.92±0.49ade 16.06±2.17abcde238.418<0.001免疫荧光强度(n=3)3 d 1.67±0.46 2.85±0.58a 4.00±0.67ab 5.92±0.19abc 7 d 1.84±0.41 4.19±0.82ad 4.67±0.40a 9.09±0.83abcd 108.969<0.001 14 d 1.89±0.43 4.52±0.44ad 7.81±0.73abde 16.48±1.43abcde 262.036<0.001
表3 各组小鼠感染白念珠菌3、7、14 d后阴道组织中IL⁃17 mRNA表达及其免疫荧光强度(±s)

表3 各组小鼠感染白念珠菌3、7、14 d后阴道组织中IL⁃17 mRNA表达及其免疫荧光强度(±s)
注:n=3。Cn组:对照非感染组;En组:雌激素非感染组;Ci组:对照感染组;Ei组:雌激素感染组;F1:时间因素的效应大小;F2:分组因素的效应大小;SNK检验显示,a:与相同时间点Cn组相比,P<0.05;b:与相同时间点En组相比,P<0.05;c:与相同时间点Ci组相比,P<0.05;d:与同组别3 d时相比,P< 0.05;e:与同组别7 d时相比,P< 0.05
组别Cn组En组Ci组Ei组F1值P值mRNA表达(n=4)3 d 1.00 1.34±0.26a 1.50±0.27a 2.14±0.38abc P值<0.001 14 d 1.00 3.14±0.30ade 3.59±0.45ade 42.38±2.81abcde F2值877.902免疫荧光强度(n=3)3 d 1.72±0.54 3.48±0.68a 4.29±1.10a 10.48±1.68abc F2值77.137 7 d 1.93±0.43 4.78±0.56ad 5.08±0.96ad 13.02±1.05abcd 4.396<0.05 P值<0.001 14 d 2.18±0.17 6.50±1.24ad 8.53±0.98ad 8.09±2.81ab

图2 Western印迹检测各组RORγt和IL⁃17蛋白表达 1:对照非感染组;2:雌激素非感染组;3:对照感染组;4:雌激素感染组
小鼠VC模型中Th17免疫应答报道不一,可能与小鼠遗传背景、白念珠菌菌株、造模方法不同有关。Th17缺陷型及野生型C57BL/6小鼠VC模型阴道灌洗液中缺乏Th17相关细胞因子的表达[4]。CD1小鼠VC模型阴道灌洗液中IL⁃17含量在感染后2 d升高,14 d达高峰,5周恢复基线水平[5]。本研究结果显示,感染组中RORγt、RORα、IL⁃17表达明显高于非感染组,其表达趋势与炎症反应一致。鉴于IL⁃17通过募集中性粒细胞到达感染部位和上调黏膜表达β防御素、抗菌肽,介导宿主抗真菌免疫[3,9],提示Th17细胞和IL⁃17在BALB/c小鼠VC发生中起重要作用。
RORγt和RORα可协同诱导Th17细胞分化(以RORγt为主),还可分别促进3型、2型固有淋巴样细胞(ILC)发育,其中3型ILC产生IL⁃17A、IL⁃17F和IL⁃22,2型ILC分泌IL⁃5和IL⁃13[2]。我们发现各组中IL⁃17表达趋势与RORγt、RORα基本一致;Ei组中RORγt水平在感染后14 d明显高于RORα,而其他时间点二者表达相似。这些结果提示RORγt、RORα均可促进VC小鼠阴道组织中Th17细胞、ILC分化和IL⁃17产生。
除Th17细胞外,恒定型自然杀伤T细胞(iNKT)、3型ILC、γδ T细胞、自然Th17细胞也可产生IL⁃17[2⁃3]。健康妇女阴道上皮组织中 T 淋巴细胞密度估计为240个/mm2,局部抗原刺激诱导的炎症性细胞因子可能促使大多数T细胞迁移至阴道上皮。小鼠VC模型阴道灌洗液中IL⁃17主要由阴道CD4+T细胞产生,而早期表达IL⁃17可能来源于中性粒细胞和上皮细胞[5]。本研究显示,感染组中IL⁃17免疫荧光广泛分布于黏膜和炎症细胞,提示黏膜上皮细胞和炎症细胞均可产生IL⁃17。此外,我们发现阴道腔内菌丝和黏膜上皮中内吞菌丝均有IL⁃17、ROR免疫荧光,验证了IL⁃17A可与肠道或阴道分离的白念珠菌结合[10]。尽管白念珠菌中Crh11p蛋白可能是IL⁃17A结合部位[10],但ROR的结合部位尚待进一步研究。
本研究还发现,En组中RORγt、RORα、IL⁃17 mRNA表达和免疫荧光强度均在处理后3 d高于Cn组。尽管雌激素是诱导和维持小鼠VC的前提[6⁃7],为何En组中也有ROR和IL⁃17表达上调,其原因不明。一般而言,较低生理量雌激素促进I型干扰素(IFN)和促炎性细胞因子产生,而较高或超生理量雌激素上调抗炎性细胞因子表达[11]。雌激素对阴道黏膜免疫的作用包括抑制上皮细胞提呈抗原、降低分泌物中免疫球蛋白水平、减少上皮细胞介导抗念珠菌活性[12]。体内外实验显示,雌二醇下调白念珠菌诱导脾细胞产生IL⁃17A[13]。在小鼠脾细胞体外诱导分化模型中,我们发现雌二醇通过雌激素受体α募集雌激素受体活性阻遏物到RORγt启动子上雌激素反应元件,从而抑制RORγt表达和Th17细胞分化[1]。相反,Khan等[14]对性腺切除术后C57BL/6小鼠植入含有17β雌二醇硅胶囊缓释剂2个月,发现雌激素可上调脾细胞表达RORγt、IL⁃17。在小鼠VC模型中,单用雌激素处理1周引起小鼠阴道淋巴细胞逐渐增多,但与对照组比较差异无显著性,此后2周内淋巴细胞数基本不变[15];单用雌激素处理2周时炎症反应明显增加[6];单用雌激素可上调IL⁃1β、COX⁃2、NF⁃κB表达[16]。因此,鉴于非感染组中仅有炎症细胞出现RORγt、RORα、IL⁃17免疫荧光,我们推测非感染组中ROR和IL⁃17高表达可能与雌激素诱导炎症细胞浸润有关。
综上所述,本文结果显示阴道念珠菌感染可上调RORγt、RORα、IL⁃17表达,提示Th17/IL⁃17轴可能参与BALB/c小鼠VC发生,但需要应用标准造模方法、基因敲除小鼠等试验进一步证实。
志谢广东医科大学统计学教研室倪少凯副教授进行统计学指导
[1]Chen RY,Fan YM,Zhang Q,et al.Estradiol inhibits Th17 cell differentiation through inhibition of RORγT transcription by recruiting the ERα/REA complex to estrogen response elements of the RORγT promoter[J].J Immunol,2015,194(8):4019 ⁃4028.DOI:10.4049/jimmunol.1400806.
[2]Cook DN,Kang HS,Jetten AM.Retinoic acid⁃related orphan receptors(RORs):regulatory functions in immunity,development,circadian rhythm,and metabolism[J].Nucl Receptor Res,2015,2.pii:101185.DOI:10.11131/2015/101185.
[3]Conti HR,Gaffen SL.IL⁃17⁃mediated immunity to the opportu⁃nistic fungal pathogenCandida albicans[J].J Immunol,2015,195(3):780⁃788.DOI:10.4049/jimmunol.1500909.
[4]Yano J,Kolls JK,Happel KI,et al.The acute neutrophil response mediated by S100 alarmins during vaginalCandidainfections is independent of the Th17 ⁃pathway[J].PLoS One,2012,7(9):e46311.DOI:10.1371/journal.pone.0046311.
[5]Pietrella D,Rachini A,Pines M,et al.Th17 cells and IL⁃17 in protective immunity to vaginal candidiasis[J].PLoS One,2011,6(7):e22770.DOI:10.1371/journal.pone.0022770.
[6]Zhang JE,Luo D,Chen RY,et al.Feasibility of histological scoring and colony count for evaluating infective severity in mouse vaginal candidiasis[J].Exp Anim,2013,62(3):205⁃210.
[7]Fidel PL.The protective immune response against vaginal candidiasis:lessons learned from clinical studies and animal models[J].Int Rev Immunol,2002,21(6):515⁃548.
[8]高涛,陈嵘祎,李文,等.孕激素在小鼠外阴阴道念珠菌病模型中的作用[J].中国皮肤性病学杂志,2011,25(4):268⁃270,295.
[9]Hernández⁃Santos N,Gaffen SL.Th17 cells in immunity toCandida albicans[J].Cell Host Microbe,2012,11(5):425⁃435.DOI:10.1016/j.chom.2012.04.008.
[10]Zelante T,Iannitti RG,De Luca A,et al.Sensing of mammalian IL⁃17A regulates fungal adaptation and virulence[J].Nat Commun,2012,3:683.DOI:10.1038/ncomms1685.
[11]Kovats S.Estrogen receptors regulate innate immune cells and signaling pathways[J].Cell Immunol,2015,294(2):63⁃69.DOI:10.1016/j.cellimm.2015.01.018.
[12]Fidel PL,Cutright J,Steele C.Effects of reproductive hormones on experimental vaginal candidiasis[J].Infect Immun,2000,68(2):651⁃657.
[13]Relloso M,Aragoneses⁃Fenoll L,Lasarte S,et al.Estradiol impairs the Th17 immune response againstCandida albicans[J].J Leukoc Biol,2012,91(1):159⁃165.DOI:10.1189/jlb.1110645.
[14]Khan D,Dai R,Karpuzoglu E,et al.Estrogen increases,whereas IL⁃27 and IFN⁃gamma decrease,splenocyte IL⁃17 production in WT mice[J].Eur J Immunol,2010,40(9):2549 ⁃2556.DOI:10.1002/eji.201040303.
[15]Ghaleb M,Hamad M,Abu⁃Elteen KH.Vaginal T lymphocyte population kineticsduringexperimentalvaginalcandidosis:evidence for a possible role of CD8+T cells in protection against vaginal candidosis[J].Clin Exp Immunol,2003,131(1):26⁃33.
[16]Chen XR,Liu YL,Xiao DZ,et al.Expression and significance of NF⁃κB,IL⁃1β and COX⁃2 in the murine model of estrogen⁃dependent experimental vulvovaginal candidiasis[J].Journal of Reproduction and Contraception,2007,18(4):253⁃260.
Expression of retinoic acid⁃related orphan receptors and interleukin⁃17 in mice with vaginal candidiasis
Luo Dan,Zhang Jin′e,Chen Rongyi,Yang Yanping,Zhou Ying,Fan Yiming
Department of Dermatology,Affiliated Hospital of Guangdong Medical University,Zhanjiang 524001,Guangdong,China
Fan Yiming,Email:ymfan1963@163.com
ObjectiveTo investigate the role of T helper 17 cells/interleukin⁃17(Th17/IL⁃17)axis in the occurrence of vaginal candidiasis in mice.MethodsA total of 120 female BALB/c mice were randomly and equally divided into Ei,En,Ci and Cn groups.Three days before vaginal inoculation,estrogen(Ei and En)groups and control(Ci and Cn)groups
subcutaneous injection of 0.05 mg estradiol and 0.1 ml sterilized soybean oil at the hind legs,respectively,and then the hormone treatment continued every other day until the end of experiment.Infected(Ei and Ci)groups and noninfected(En and Cn)groups were inoculated intravaginally with 10 μl(5 × 104conidia)ofCandida albicanssuspension and 10 μl of sterilized phosphate⁃buffered saline,respectively.Ten mice were randomly selected from each group and sacrificed on day 3,7 and 14 after inoculation.The intact vagina tissues were resected and then frozen in liquid nitrogen or embedded in paraffin.Real⁃time fluorescence⁃based quantitative PCR(qRT⁃PCR)and immunofluorescent staining were performed to measure mRNA expression and immunofluorescence intensities of retinoic acid⁃related orphan receptorγt(RORγt),RORα and IL⁃17,respectively.Western blot analysis was conducted to determine protein expression of RORγt and IL⁃17.ResultsLaser scanning confocal microscopy showed that RORγt,RORα and IL⁃17 immunofluorescence was mainly located at inflammatory cells of the lamina propria and blood vessels in En and Cn groups,at mucosal epithelium,adherent hyphae,and inflammatory cells of the lamina propria and blood vessels in Ci group,and at mucosal epithelium,vaginal canal and endocytosed hyphae,and inflammatory cells of the lamina propria and blood vessels in Ei group.qRT⁃PCR and immunofluorescent staining uncovered that mRNA expression and immunofluorescence intensities of RORγt,RORα and IL⁃17 were significantly higher in En,Ci and Ei groups than in Cn group at the same time points(allP< 0.05),as well as in the Ei group than in En and Ci groups(bothP< 0.05),and were increased gradually over time in En,Ci and Ei groups,but not in the Cn group.Additionally,mRNA expression and immunofluorescence intensities of RORγt and RORα and IL⁃17 generally peaked on day 14 after inoculation,while the immunofluorescence intensity of IL⁃17 peaked on day 7(P< 0.05).Western blot analysis revealed that protein expression of RORγt and IL⁃17 was significantly higher in the infected(Ei and Ci)groups than in the noninfected(En and Cn)groups at the same time points(RORγt:F=45.685,P< 0.001;IL⁃17:F=29.655,P< 0.01),and was highest in the Ei group(P< 0.05);however,no significant differences were observed between Cn and En groups(bothP>0.05).Moreover,RORγt and IL⁃17 protein expression in Ci and Ei groups was obviously up⁃regulated on day 7 after inoculation(RORγt:F=13.137,P< 0.001;IL⁃17:F=11.182,P< 0.001),but was not increased further on day 14.ConclusionVaginal candida infection can up⁃regulate the expression of RORγt,RORα and IL⁃17,suggesting that Th17/IL⁃17 axis may be involved in the occurrence of vaginal candidiasis in BALB/c mice.
Candidiasis,vulvovaginal;Candida albicans;Estrogens;Nuclear receptor subfamily 1,group F,member 3;Interleukin⁃17;Mice;Retinoic acid⁃related orphan receptors
樊翌明,Email:ymfan1963@163.com
10.3760/cma.j.issn.0412⁃4030.2017.01.009
国家自然科学基金(81171512)
Fund program:National Natural Science Foundation of China(81171512)
2016⁃03⁃31)
(本文编辑:周良佳 颜艳)
