大黄蒙医酒焖炮制机理及有效性研究
2017-11-01苏布达那生桑
苏布达,阿 润,那生桑
(内蒙古医科大学蒙医药研究院,内蒙古 呼和浩特 010110)
大黄蒙医酒焖炮制机理及有效性研究
苏布达,阿 润,那生桑
(内蒙古医科大学蒙医药研究院,内蒙古 呼和浩特 010110)
目的探讨蒙医酒焖炮制大黄的原理,优化酒焖炮制工艺,并对其安全、有效性进行初步评价。方法采用高效液相色谱(HPLC)法分析大黄与酒焖大黄中总蒽醌与游离蒽醌的含量变化;对大黄酒焖炮制,以药材与酒的比例、焖润时间和加热时间为3个因素,每个因素选3个水平作正交试验,优选最佳工艺条件;通过酒焖大黄对小鼠泻下作用和急毒性试验初步评价大黄炮制饮片的安全、有效性。结果酒焖大黄结合型蒽醌的含量明显低于生大黄,泻下作用明显缓和,酒焖大黄组始排黑便时间长于生大黄组和模型组,排便次数少于这两组,酒焖大黄组稀便级和稀便率明显下降;急毒试验最大耐受量远超过临床剂量(0.06 g/kg)的100倍,无小鼠死亡及中毒现象,解剖观察试验鼠主要脏器无特殊改变;正交试验结果显示以大黄与酒质量体积比1∶7.5(kg/L)、焖润1 h、加热焖制4 h为效果最佳。结论大黄经蒙医理论的合理炮制,可明显缓和其下泻强度,消除疼痛等不良反应,降低毒性,从而增加大黄疗效,扩大用药范围。
蒙药;大黄;酒焖大黄;炮制工艺;药理;毒理
大黄为蓼科植物掌叶大黄 Rheum palmatum L.、唐古特大黄 Rheum tanguticum Maxim.ex Balf.或药用大黄 Rheum officinale Baill.的干燥根及根茎[1]。蒙药大黄味苦、酸,性凉,具稀、轻、动、糙诸效,有泄泻、清热、解毒、收敛疮疡、消食等功效[2-3]。现代药理学研究表明,大黄中的活性成分具有泻下、抗炎、抗菌、抗病毒、降压调脂、抗肿瘤等作用[4]。大黄含有游离型和结合型蒽醌类衍生物、蒽酮类、二苯乙烯类、苯丁酮类鞣质类、多糖类等成分。蒽醌类是大黄中研究最多的活性成分,分为游离型与结合型,其中游离型有大黄酸、大黄素、土大黄素、芦荟大黄素、大黄素甲醚、异大黄素、大黄酚、虫漆酸D等,结合型有大黄素甲醚葡萄糖苷、芦荟大黄素葡萄糖苷、大黄素葡萄糖苷和大黄酚葡萄糖苷,以及番泻苷 A,B,C,D,E,F 等[5]。结合型蒽醌以番泻苷为主,是致泻的主要活性成分。蒙医善用大黄,根据需要行特殊炮制,以降低泻下骏烈性。大黄炮制方法有酒焖法[6]、炒法。蒙医酒焖炮制大黄的方法有别于中医酒炙法和酒炖法[7],炮制目的是缓和其泻下作用,避免导泻中所致疼痛。本研究中探讨了蒙医酒焖炮制大黄的机理,旨在优化其炮制工艺。现报道如下。
1 仪器、试药与动物
1.1 仪器
SCL-10AVP型液相色谱仪(日本岛津公司);JA503型电子天平,AB135-S型电子分析天平,均为德国产;HH-S8型恒温水浴锅(北京格外永兴仪器有限公司);SKG-02500型烘干箱(广西恒丰医疗器械有限公司);KQ-250DE型超声波清洗器(昆山市超声波仪器有限公司);HX-100型高速粉碎机(浙江永康仪器有限公司);电子万用炉(天津市中环实验电炉有限公司)。
1.2 试药
大黄药材、大黄粉及其水煎液:大黄购自内蒙古天康蒙中医药有限责任公司,经内蒙古食品药品检验所主任药师康双龙鉴定为蓼科植物药用大黄 Rheum officinale Baill.的干燥根茎。先除去杂质,洗净,润透,切8~12 mm厚片,晾干;临用时粉碎,过4号筛,为大黄粉;取大黄粉25 g加 10倍量水浸0.5 h,煮沸 20 min,离心,取上清液,残渣再加5倍水,同法煎煮,取上清液,合并,加热浓缩成500 g/L质量浓度的水煎液,为大黄水煎液。
酒焖大黄粉及其水煎液:取酒焖大黄片(本实验室自行炮制品[8]),同上法粉碎,为酒焖大黄粉;同上法水煎制备,为酒焖大黄水煎液。
番泻叶:购自呼和浩特药材公司,批号为6928798310962。试验临时取番泻叶粉加水配制成8%浓度的混悬液,备用[9]。
对照品:芦荟大黄素(批号为110795-201007),大黄酸(批号为 110757-200206),大黄素(批号为110756-200110),大黄酚(批号为 110796-201017),大黄素甲醚(批号为110758-201013),均由中国食品药品检定研究院提供。
其他:印度墨汁购自呼和浩特药材公司;水为超纯水,甲醇为色谱纯,三氯甲烷、无水乙醇、乙醚等为分析纯,均为市售正品。白酒(草原白酒 60°,批号为6920685030083,内蒙古太仆寺旗草原酿酒有限责任公司)。
1.3 动物
昆明种小鼠,体质量(20 ±2)g,雌雄兼有,6 周龄,动物合格证编号为内实动管质<98>8号,洁净度为国家二级,SPF级环境饲养、试验,由内蒙古大学试验动物研究中心提供,实验结束后将存活小鼠在乙醚麻醉下,断头处死,冷冻处理,送医学废料处理厂处置。
2 方法与结果
2.1 总蒽醌含量测定[10]
2.1.1 色谱条件
色谱柱:Nuclesil ODS 柱(250 cm ×4 mm,5 μm);流动相:含 0.1%高氯酸的 80% 甲醇溶液;流速:0.5 mL /min;检测波长:254 nm。
2.1.2 溶液制备
对照品溶液:取芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚各2 mg,精密称定,分别置25 mL棕色容量瓶中,各加入甲醇5 mL,使溶解,加甲醇定容,得标准贮备液。分别依次吸取标准贮备液 0.1,1.0,1.0,0.5,0.5 mL,置 5 mL 棕色容量瓶中,加甲醇定容,混匀,作为混合对照品溶液。
供试品溶液:取大黄粉和酒焖大黄粉0.1 g,精密称定,置50 mL磨口具塞锥形瓶中,精密加入甲醇20 mL,室温浸15 h,经干燥滤纸滤过,弃初滤液,取续滤液备用。精密吸取上述续滤液5 mL,置20 mL具塞试管中,水浴上蒸干甲醇,加水2 mL,振摇使残渣溶解,置冰浴中放冷后精密加入乙醚10 mL及盐酸0.2 mL,立即密塞并剧烈振摇3 min,分层,精密量取乙醚液5 mL,置具塞试管中,在气流下挥尽乙醚,加入甲醇2 mL使残渣溶解,用滤膜滤过,得供试品溶液Ⅰ(游离蒽醌)。精密吸取上述续滤液2.5 mL,置20 mL具塞试管,水浴,蒸干甲醇,加水 2 mL、盐酸 0.2 mL,置沸水浴中水解30 min,移出,冰浴,放冷,精密加入乙醚10 mL,按上述方法“立即密塞并剧烈振摇3 min”起操作,得供试品溶液Ⅱ(总蒽醌苷元)。
2.1.3 线性关系考察
按拟订色谱条件,取混合对照品溶液 2,4,6,8,10 μL 进样,以进样量(X,μL)为横坐标、峰面积(Y)为纵坐标绘制标准曲线,得回归方程。见表1。
2.1.4 样品含量测定
在拟订色谱条件下,分别进样供试品溶液Ⅰ和供试品溶液Ⅱ各4 μL,按标准曲线方程计算各样品中总蒽醌与游离蒽醌的含量。结合型蒽醌总量=总蒽醌量-游离型蒽醌总量。结果见表2和图1。可见,大黄炮制前后结合型蒽醌的含量由0.384%降为0.056%,炮制后结合型蒽醌的含量显著降低;游离型蒽醌的含量从0.608%增加至0.716% 。说明炮制可促进蒽醌的转化,而总蒽醌的含量从0.992%降为0.772%。
2.2 大黄酒焖炮制工艺优化
蒙医对大黄药材的炮制有诸多方法,但利用缓和泻下功能时常采用酒焖法。本研究中选择酒焖法,以游离大黄素含量(同2.1项下方法测定,以大黄素为对照品)为评价指标,以大黄与酒质量体积比(因素A)、焖润时间(因素B)和加热焖制时间(因素C)为3个因素,每个因素选3个水平,选用 L9(34)正交表,完成正交试验[11]。结果见表3至表5。可见,影响因素次序为B>C>A,最佳工艺条件为 B1C3A2,即大黄与酒之比为 1 ∶7.5(kg /L),焖润1 h,加热焖制4 h为最佳工艺。其中焖润时间和加热时间对大黄素含量有显著性影响(P<0.05),而大黄
与酒的比例无显著性影响(P>0.05)。

表1 对照品溶液线性关系考察结果(n=5)

表2 大黄与酒焖大黄的蒽醌含量测定结果

图1 含量测定高效液相色谱图
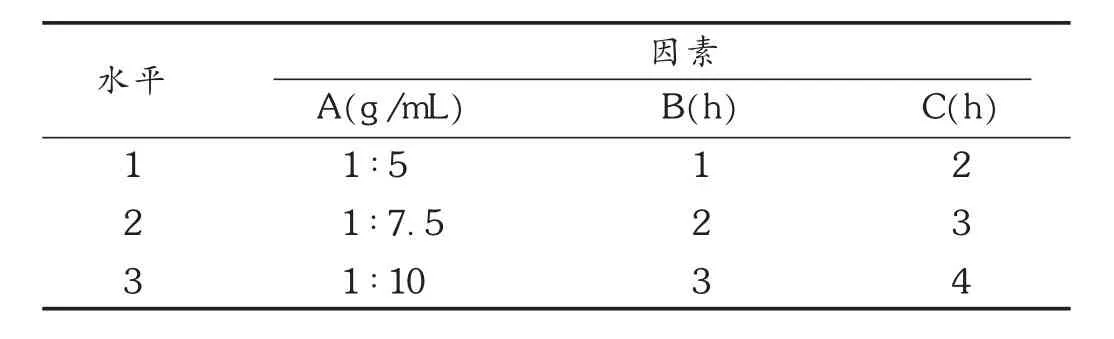
表3 炮制工艺优化因素水平表
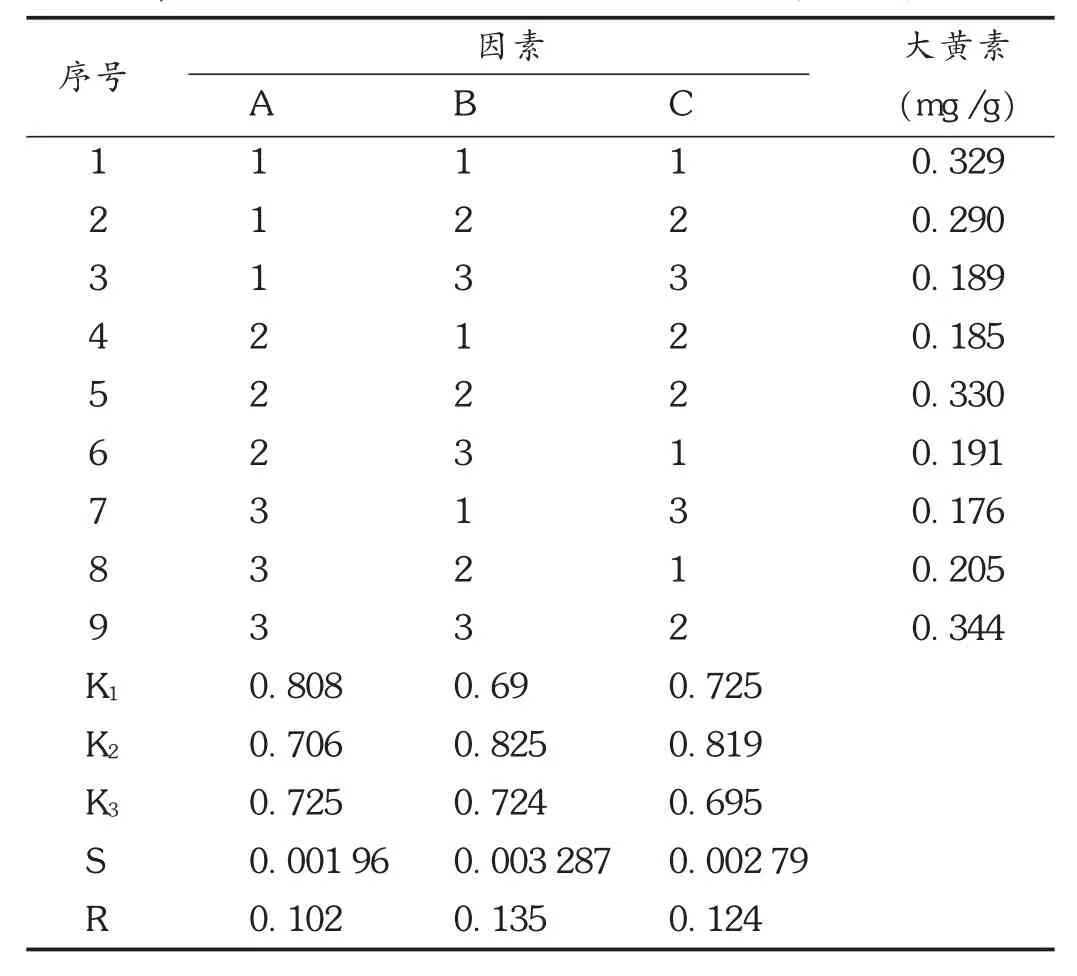
表4 炮制工艺优化 L9(34)正交试验方案及结果
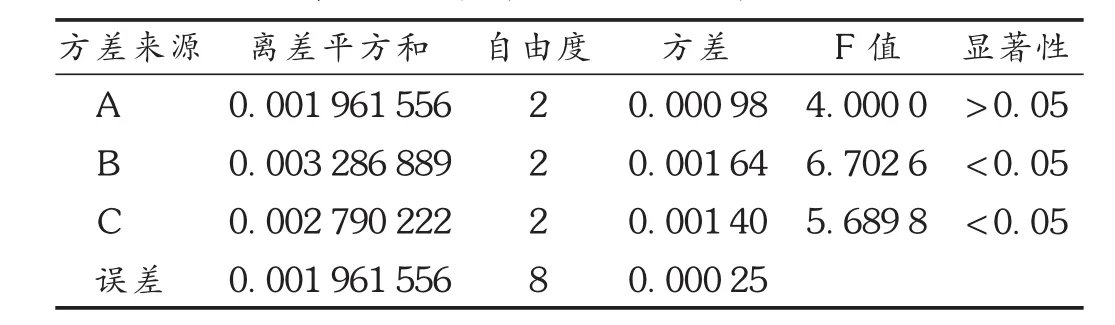
表5 大黄素含量方差分析结果
2.3 药理学试验[9]
2.3.1 急性毒性试验[12]
因受试药容量限制未测出半数致死量(LD50),仅测了最大给药量。取昆明系小鼠40只,雌雄各半,随机分为两组,每组20只。禁食12 h后给药组以1.2 g/mL质量浓度的酒焖大黄煎剂每20 g体质量0.8 mL,每24 h灌胃2次;对照组灌胃等量水。给药当天,与给药组相比,对照组小鼠活动减少、排便偏多,多呈稀便,其余未见显著异常;给药1~3 d小鼠体质量两组间无差异(P>0.05),第4~8日给药组小鼠体质量增长迟于对照组(P <0.05),第 8日后差异消失(P >0.05)。试验过程中无小鼠死亡,解剖观察试验小鼠主要脏器无异常改变。24 h内给予小鼠酒焖大黄煎剂2次,总量达96 g/kg,已超过蒙医临床常用剂量(0.06 g/kg)的 100 倍以上,说明酒焖大黄的毒性非常小。
2.3.2 泻下药效试验
取小鼠60只(无自然腹泻者),雌雄各半,随即分成4组,分别为空白组(10%墨汁蒸馏水)、模型组(含10%墨汁番泻叶粉混悬液)、大黄组(含10%墨汁大黄水煎液)、酒焖大黄组(含10%墨汁酒焖大黄水煎液),禁食12 h后,灌胃给药,当即将小鼠单个置铺有滤纸的钟罩内,观察排便情况,记录始排黑便时间、稀便级和稀便率等持续6 h。结果见表6。可见,酒焖大黄的泻下作用明显缓和,始见黑便时间酒焖大黄组>生大黄组>模型组;酒焖大黄组排便次数最少,有显著差异(P<0.01),其稀便级及稀便率明显下降,除生大黄组外,其他组小鼠均未出现腹痛反应。说明炮制后改变了生大黄较强的泻下作用,消除了不良反应。
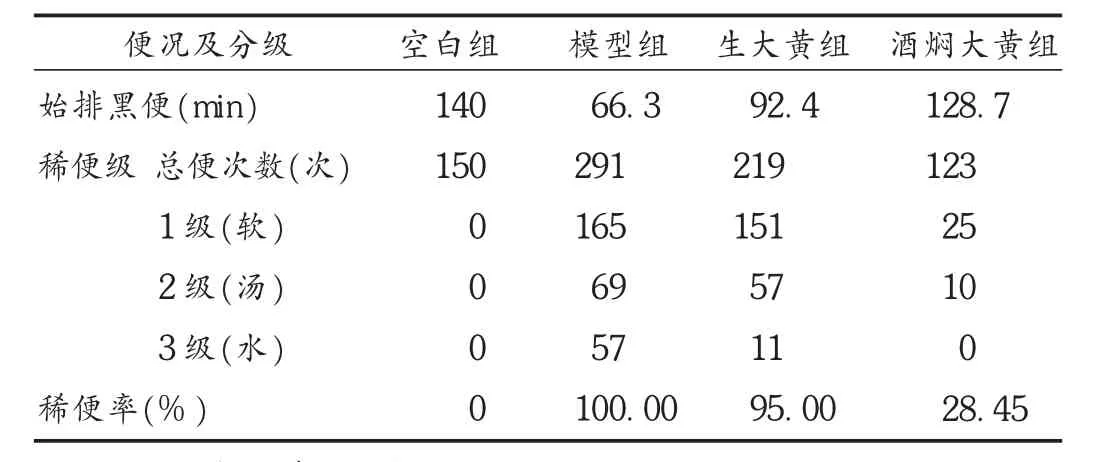
表6 酒焖大黄对小鼠泻下作用的影响
3 讨论
大黄为蒙医常用药材,用于“希日”热、便秘、食积不消、疮疡疖肿[6]。蒙药阿木日-6散中大黄为君药,主治腹胀便秘、消化性溃疡、肠梗阻、月经不调等[13]。而在治疗不需导泻性的疾病时常采用炮制,改变其功能及功效趋势。大黄有效成分中起到泻下作用的主要是结合型蒽醌,其作用部位主要在大肠,作用机制为刺激大肠黏膜及肠壁肌层的神经丛,显著促进横结肠和降结肠蠕动而致泻[14]。游离型蒽醌在提取过程中损失率高达64%,口服后上消化道吸收较完全,所以无泻下作用[15]。
本试验提示,经酒焖炮制使较多量的结合型蒽醌转化为游离型蒽醌(自 0.384%减至0.056%),游离型蒽醌反之增加(由0.608%增加至0.716%),保证了蒽醌总量损失甚少。药效试验显示,泻下作用明显缓和(P<0.01);始排黑便时间,酒焖大黄组长于模型组和生大黄组;排便次数亦少,酒焖大黄组稀便级和稀便率明显下降。毒理试验结果表明,酒焖大黄毒性很小,从而有效性发挥显著,避免了疼痛等不良反应,证明了蒙医炮制的有效性和科学性。本试验中只对药用大黄进行了系列研究,而对掌叶大黄和唐古特大黄的炮制,还尚未做相关性研究,应当对不同大黄品种炮制前后的药效变化及相互差异作比较,还需在今后的研究中加以补充,探索药物内在化学成分在炮制过程中的变化规律。
[1]那生桑.现代蒙药学[M].呼和浩特:内蒙古大学出版社,2011:410-411.
[2]伊希巴拉珠儿.甘露四部[M].呼和浩特:内蒙古人民出版社,1998:569-570.
[3]罗布桑.蒙药学[M].北京:民族出版社,1989:496-498.
[4]王 磊,张静泽,高文远.大黄活性成分药代动力学研究进展[J].中成药,2011,33(90):1571 - 1573.
[5]博兴圣,陈 菲,刘训红,等.大黄化学成分与药理作用研究新进展[J].中国新药杂志,2011,20(16):1534 - 1537.
[6]康双龙.蒙药材传统炮制方法[M].呼和浩特:远方出版社,2007:17-18.
[7]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:31-32.
[8]吴香杰.蒙药炮制学[M].呼和浩特:内蒙古人民出版社,2011:218-219.
[9]陈 奇.中药药理研究方法学[M].第3版.北京:人民卫生出版社,2011:109-119,379-385.
[10]周新蓓,欧阳荣.常用中药饮片质量检验[M].长沙:湖南科学技术出版社,2006:16-18.
[11]杨 波,陈淑映,蔡丽云,等.正交试验优选葛莲口服液的提取工艺[J].中国药业,2010,19(11):32 -34.
[12]宋祥玖,田维君,刘 骁,等.皮溃灵的药理学实验研究[J].药物研究,2004,3(4):38 -40.
[13]张双林,莫日根图,王文全,等.蒙药阿木日-6散临床应用[J].中国民族医药杂志,2014,4(4):65 - 66.
[14]唐大轩,谭正怀,梁媛媛,等.大黄蒽醌致泻作用及其机理的初步研究[J].时珍国医国药,2007,18(6):1312 -1314.
[15]金 兰.大黄的药理作用及临床应用进展[J].中国医药指南,2013,11(11):487 - 488.
Processing Mechanism and Effectiveness of Rheum Palmatum with Wine-Steaming According to Mongolian Medicine
Subuda,Arun,Nashengsang
(Institute of Mongolian Medicine Research,Inner Mongolia Medical University,Hohhot,Inner Mongolia,China 010110)
Objective To investigate the processing mechanism of Rheum palmatum with wine-steaming according to Mongolian medicine,and to optimize the wine-steaming processing technology and make an initial about safety and efficiency of processed Rheum palmatum.Methods HPLC method was used to analyze the content of total anthraquinone and free anthraquinone in Rheum palmatum and wine-steaming processed Rheum palmatum,the Rheum palmatum was processed by wine-steaming,with the ratio of herbs and wine,stewing time and heating time as 3 factors,each factor was selected at 3 levels for orthogonal test,and the optimum technological conditions were optimized.The safety and efficacy ofRheum palmatum Decoction were evaluated through the laxative effect and acute toxicity test of wine-steaming processed Rheum palmatum on mice.Results The content of anthraquinone of wine-steaming processed Rheum palmatum was significantly lower than the crude one.Meanwhile,the laxative effect was moderate obviously.Initial defecation time of processed group was longer than those of the crude group and model one,grade and rate of loose stools of the processed group was less than the crude group and model group.Maximum tolerance dose was far more than 100 times compared with clinical dose(0.06 g /kg)in acute toxicity test and no death or poisoning occurred in the mice.Pathological changes were not found in main organs.The best wine- steaming processing technology was as follows:the ratio of crude Rheum palmatum and wine was 1 ∶7.5(kg/L),the stewing time was 1 h,the stewing and heating time was 4 h.Conclusion Reasonable processing ofRheum palmatum based on Mongolian medicine theory can significantly ease laxative effect,eliminate pain and other adverse reactions,reduce toxicity,thereby increase the curative effect of Rheum palmatum,and expand the scope of medicine.
Mongolian medicine;Rheum palmatum;wine-steaming processed Rheum palmatum;processing technology;pharmacology;toxicology
R283.3;R282.71
A
1006-4931(2017)19-0019-05
10.3969 /j.issn.1006 - 4931.2017.19.005
内蒙古自治区自然科学基金项目[kj15sf22]。
苏布达(1995-),女,蒙古族,在读硕士研究生,研究方向为蒙药学,(电子信箱)923028362@qq.com。
那生桑(1956-),男,蒙古族,博士研究生导师,教授,主要研究方向为蒙药炮制规范化及蒙药现代化,(电话)0471-6653163(电子信箱)nasang56@ sina.com。
2017-02-08;
2017-07-06)
