基于渗透压释药原理的混合骨架控释片研究
2017-11-01于丽丽杨懿群刘禹宏赵丹阳李冰冰吴琼珠
于丽丽,杨懿群,刘禹宏,赵丹阳,李冰冰,吴琼珠
(中国药科大学,江苏 南京 210009)
研究
基于渗透压释药原理的混合骨架控释片研究
于丽丽,杨懿群,刘禹宏,赵丹阳,李冰冰,吴琼珠
(中国药科大学,江苏 南京 210009)
目的探讨以羟丙甲纤维素(HPMC)/乙基纤维素(EC)为混合骨架,制备基于渗透压释药原理的水溶性药物酒石酸美托洛尔(MT)控释片的可行性。方法以HPMC/EC为混合骨架,用粉末直接压片法制备;在单因素考察基础上,以控释片在1 h和12 h累积释放度、1~12 h内释药曲线线性拟合度 R2为评价指标,用星点设计-响应面优化处方工艺,探究其体外释药行为和机理。结果骨架材料用量、HPMC/EC比例、乳糖用量均对药物释放度有明显影响;其最优处方为骨架材料用量为74.66%,HPMC/EC比例为1∶2,乳糖用量为5.40%;制得的骨架控释片在12 h内释药恒定,其释药行为包含渗透压原理。结论所制成的混合骨架控释片可用于控制MT的释放,制备工艺简单,体外释药平稳,具有一定的应用前景。
混合骨架控释片;酒石酸美托洛尔;星点设计-响应面优化法;体外释放;渗透压原理
近年来,因控释制剂释药平稳、临床效果好,已成为国内外医药工业发展较重要的研究方向[1]。渗透泵控释制剂是典型代表,但因其生产成本较高、处方工艺复杂等因素而受到一定限制。骨架片因其开发周期短、工艺简便等特点,倍受医药界重视[2-3]。据报道,多层骨架片可达到药物的零级释放,但生产需特殊设备且难以控制。因此,单层骨架片仍是目前普遍采用的制剂技术,但以此技术达到水溶性药物的控释效果较难。如何采用不同特性的高分子材料混合制备理想的控释片备受关注。本研究中选择水溶性药物酒石酸美托洛尔(metoprolol tartrate,MT)为模型药物。作为第2代对心脏具有高度选择性的β1受体阻滞剂,MT是临床治疗高血压和心绞痛的重要药物之一[4]。目前,市售MT制剂主要有普通片、缓释片和控释片。其普通片血药浓度波动大,不良反应多,顺应性较差;缓释片血药浓度虽较平稳,但起效慢,易产生耐药性;渗透泵控释片虽能克服上述2种制剂的缺点,但其制备需包衣打孔,一旦包衣膜破裂即会导致毒副作用[5]。本研究中拟用乙基纤维素(EC)和不同黏度羟丙甲纤维素(HPMC)混合作为骨架材料,探讨其制成具有渗透压原理的单层骨架控释片的可行性。现报道如下。
1 仪器与试药
1.1 仪器
TDP型单冲式压片机(上海第一制药机械厂);ZRS-8G型智能溶出试验仪(天大天发);UV 752W型紫外可见分光光度计(上海元析仪器有限公司);电子天平(北京赛多利斯仪器系统有限公司);片剂硬度测定仪(上海黄海药检仪器厂)。
1.2 试药
酒石酸美托洛尔(MT,浙江普洛家园药业有限公司);羟丙甲纤维素(HPMC K4M,K15M,K100M),乙基纤维素(EC,批号为 PD394904)均由上海Colorcon包衣技术有限公司提供;微晶纤维素(MCC),硬脂酸镁和二氧化硅均由安徽山河药用辅料股份有限公司提供;乳糖(FlowLac 100,德国美剂乐集团上海代表处,批号为L1406A);其他试剂均为分析纯。
2 方法与结果
2.1 骨架控释片制备
按处方量称取已过筛的MT原料药与HPMC(K4M,K100M)、EC、MCC、乳糖,采用等量递增法混合均匀,加入适量微粉硅胶和硬脂酸镁,混匀。得每片质量为250 mg,其中含MT 25 mg,采用9 mm浅凸冲,粉末直接压片,硬度控制在 9~11 kg/mm2,制备骨架片[6]。
2.2 分析方法建立
2.2.1 标准曲线建立
取10.0 mg MT,精密称定,置100 mL容量瓶中,加蒸馏水定容,即得0.1 g/L MT对照品溶液。配制系列质量浓度的对照品溶液,于274 nm波长处测定吸光度(A),得标准曲线方程 C =0.003 7 A+0.002 5,R2=0.999 9。结果表明,MT 质量浓度在 5.0 ~ 60.0 μg/mL范围内与吸光度线性关系良好。
2.2.2 精密度试验
取 30 μg/mL 对照品溶液,室温放置 2,4,8,12,24 h,依法测定吸光度并计算,结果的 RSD小于2.0%(n=5),表明MT对照品溶液在24 h内稳定。另取30 μg/mL对照品溶液,1 d内连续测定5次,以及每天测定1次,连续测定5 d,结果日内和日间精密度的 RSD均小于2.0%(n = 5),表明该仪器精密度良好[7]。
2.2.3 体外释放度测定
参照2015年版《中国药典(四部)》通则中溶出度与释放度测定第一法[8],以脱气的蒸馏水900 mL为释放介质,转速为 50 r/min,温度为(37 ±0.5)℃,分别于1,2,4,6,8,10,12 h 时取样 10 mL,同时补加等量等温释放介质。照紫外-可见分光光度法,取续滤液于274 nm波长处测定吸光度,计算MT累积释放量。
2.3 处方单因素考察
2.3.1 骨架材料用量
固定 HPMC(K15M)/EC 比例为 1∶1,考察骨架材料用量对释放度的影响。结果骨架材料用量为50%时,药物突释严重;随着骨架材料用量的增加,药物释放呈减慢趋势;当增加到80%时,12 h时药物释放仍不完全。详见图1。
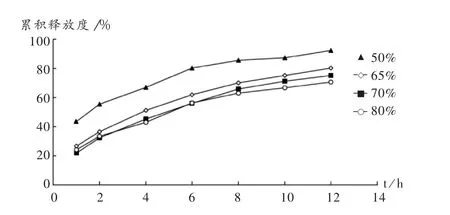
图1 骨架材料用量对骨架片药物释放度的影响
2.3.2 HPMC /EC 比例
固定骨架材料用量为65%,考察HPMC/EC比例对释放度的影响。结果HPMC/EC比例对MT的释放度影响较大,对药物的阻滞作用也随着EC比例的增加而减小。详见图2。
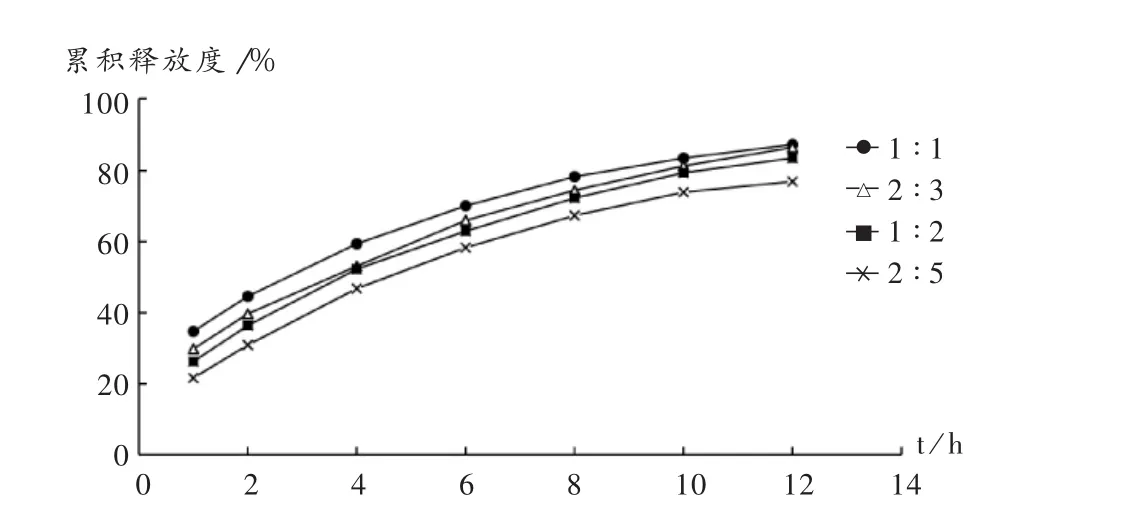
图2 HPMC/EC比例对骨架片药物释放度的影响
2.3.3 HPMC 黏度
固定骨架材料用量为65%,HPMC/EC比例为2∶3,考察HPMC黏度对释放度的影响。结果,随着HPMC黏度的加大,HPMC的水化速度减小,使得药物释放出现前期释放快而后期释放不完全的现象。详见图3。拟用混合黏度的HPMC为骨架材料,以制得较理想的骨架片。
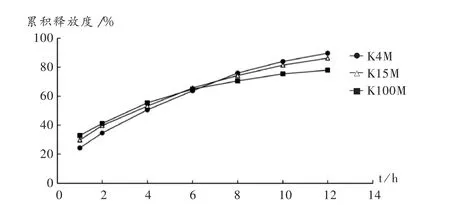
图3 HPMC黏度对骨架片药物释放度的影响
2.3.4 渗透压调节剂乳糖用量
固定骨架材料用量为65%,HPMC/EC比例为2∶3,考察渗透压调节剂乳糖用量对药物释放度的影响。结果,在一定范围内,随着乳糖用量的增加,药物的释放速率有上升趋势,但其零级释药的线性较差。详见图4。
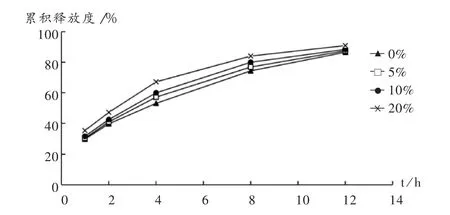
图4 乳糖用量对骨架片药物释放度的影响
2.4 处方优化
2.4.1 星点设计-响应面优化处方
根据单因素考察结果,选择骨架材料用量(X1)、HPMC /EC 比例(X2),乳糖的用量(X3)为考察因素[9],以药物 1 h 累积释放量(Y1)、12 h(Y2)累积释放量和 0 ~ 12 h释放曲线线性拟合相关度 R2(Y3)为评价指标,采用星点设计-响应面优化法进行设计[10-11]。详见表1和表2。
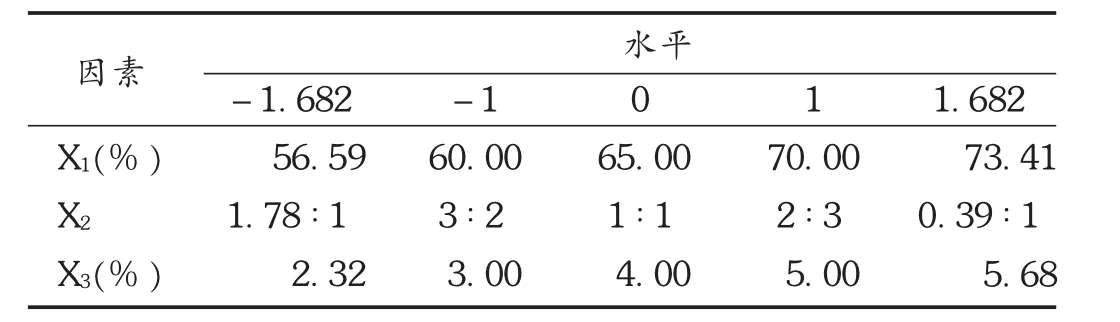
表1 星点设计各因素水平表
采用多元非线性回归对所测得试验数据进行处理,其二项式拟合方程分别为:
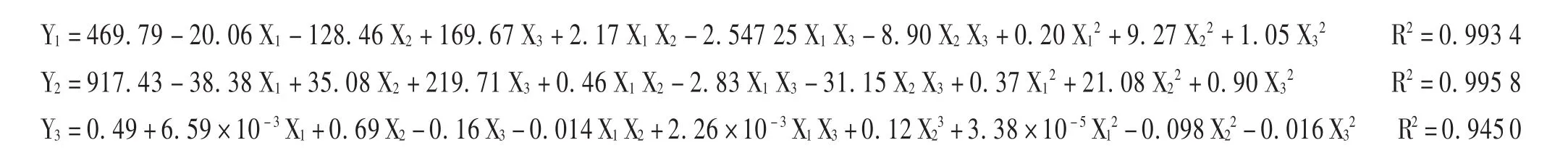
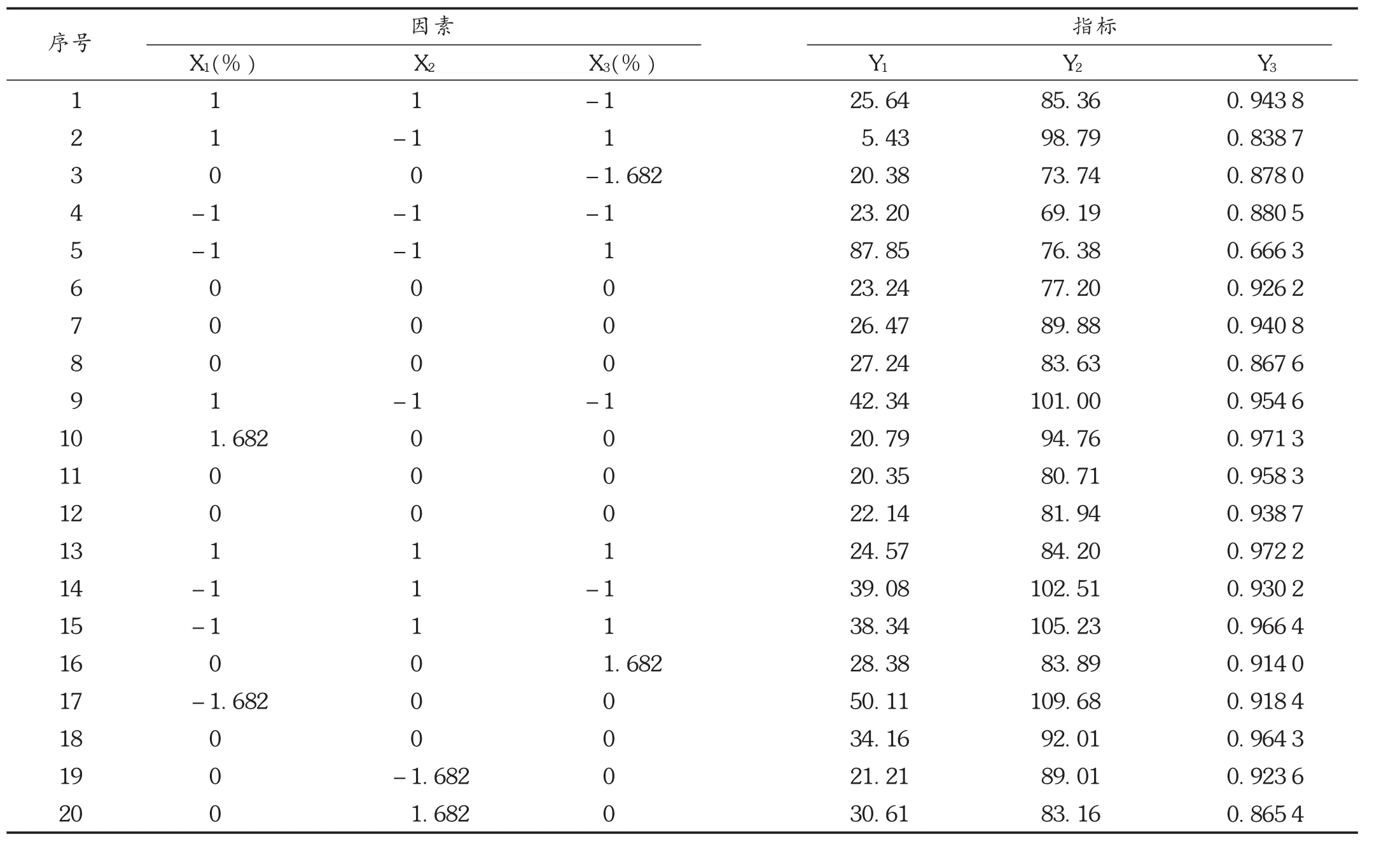
表2 星点试验处方设计及结果
2.4.2 响应面优化和预测
以 Design-Expert软件分别绘制 3个因素对 Y1,Y2,Y3的三维响应图,详见图5。结果 Y1随骨架材料用量的增加而减小,随HPMC/EC比例的增加而减小,随乳糖用量的增加而变大;Y2随骨架材料用量的增加而减小,随HPMC/EC比例的增加而减小,随乳糖用量的增加而提高,但不明显;Y3随骨架材料用量的增加而增加,随HPMC/EC比例的增加而增大,随乳糖用量的增加而明显减小。故在满足 Y1最小、Y2最大以及 Y3尽可能接近1的条件下,进行试验分析,得到最优处方为骨架材料用量为 74.66%,HPMC/EC 比例为 1∶2,乳糖用量为 5.40%。
2.4.3 优化处方验证
按最优处方工艺制备3批MT控释片,依法进行体外释放度测定,结果见表 3。可见,Y1,Y2,Y3的实际值与预测值的相对误差均低于6.0%,说明试验预测模型方程良好。
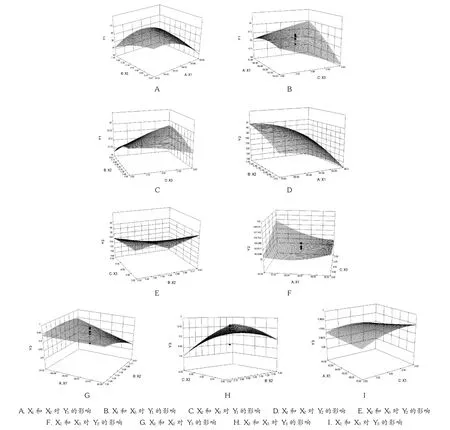
图5 三维响应曲面图
2.5 释药行为与释药机制
2.5.1 释放介质的pH对释药行为的影响
以最优化处方工艺制备骨架控释片,考察pH=1.2盐酸溶液、pH=4.5磷酸盐溶液、pH=6.8磷酸盐缓冲液和蒸馏水4种介质中的释药行为。结果,MT在不同pH的释放介质中的释放度差异不大,故骨架控释片在人体胃肠道内几乎不随pH的改变而改变。详见图6。

表3 3批自制片重复性试验结果
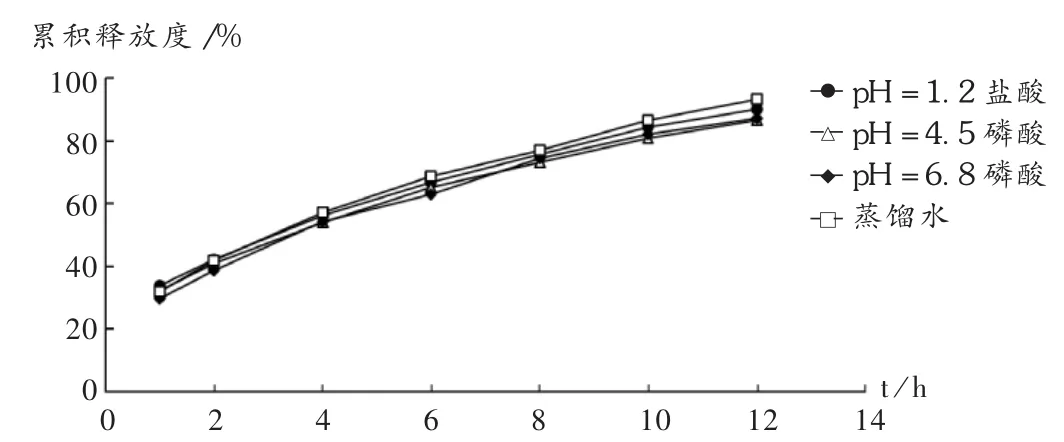
图6 不同pH溶出介质对骨架片的释放影响
2.5.2 释放介质的渗透压对释药行为的影响
以最优化处方工艺制备骨架控释片,考察不同浓度NaCl溶液(0,0.20% ,0.45% ,0.90% )为释放介质中的释放行为。结果,随着释放介质渗透压的增加,药物释放速度减慢,提示该骨架控释片的释药机制包含渗透压原理。详见图7。
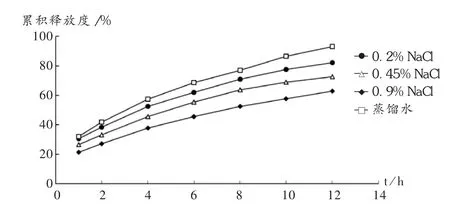
图7 不同渗透压的释放介质对骨架片释放度的影响
2.5.3 释药机制研究
根据2015年版《中国药典(四部)》附录缓控释制剂指导原则,借助Origin软件对骨架片的体外释药曲线进行模型拟合[8]。由表4可见,所制备的骨架控释片体外释放更符合零级释放特征,提示采用混合骨架可达到控制MT恒定释放的目的。

表4 骨架片体外释药模型拟合试验结果
3 讨论
3.1 骨架片的选择
EC常用于不溶性骨架片的制备,随着EC用量的加大,药物释放减缓,但不能水化,单用易造成水溶性药物的前期突释和后期释放不完全问题。HPMC为常用的亲水性凝胶骨架材料,研究发现,HPMC黏度越小,水化速度越快,有利于控制药物前期突释。本研究中采用EC和HPMC(K4M,K100M)混合作为骨架材料,达到控制水溶性药物MT恒定释放的目的。
3.2 乳糖用量的选择
乳糖作为片剂常用材料,可作稀释剂、渗透压促进剂和致孔剂等。试验发现,随着乳糖用量的增加,药物释放加快,但过量的乳糖会导致骨架孔道增多或变大,药物释放太快而难以达到恒定释放。故最终选择乳糖用量为 5.40% 。
3.3 星点设计-响应面法
本研究中采用星点设计-响应面法优化处方工艺,方法简单,试验次数较少,准确性高,预测性好。按最优处方工艺制备3批MT骨架控释片,并进行体外释放度研究,结果实测值和预测值一致,可达到预期效果。
3.4 验证方法的选择
应用数学模型拟合体外试验数据,对了解固体制剂体外释放特性,预测释药机制尤为重要[12]。本研究中通过比较其在不同pH及不同渗透压的释放介质中的释放曲线,发现所制得的MT骨架控释片的体外释药为非pH依赖型且具有渗透压释药原理,进一步采用不同数学模型进行拟合,结果发现其释药机制更符合零级释药特征,说明采用不同高分子材料制备混合骨架片控制水溶性药物的释放是可行的。
[1]齐晓丹,马志鹏,宋益民.口服缓控释制剂的研究概述[J].中国药房,2015,26(16):2281 -2284.
[2]褚 杰,刘秀萍,臧恒昌.口服缓控释制剂的研究概述[J].药物生物技术,2015,22(13):275 -278.
[3]胡雄伟,张 倩,宋洪涛.口服缓控释骨架片给药系统的研究进展[J].中国药房,2010,21(17):1619-1622.
[4]周钰滢,刘平平,朱春柳,等.酒石酸美托洛尔渗透泵片的研究[J].黑龙江医药,2015,28(1):49-53.
[5]郭彦亮,王卫国,朱春柳,等.酒石酸美托洛尔脉冲控释片的制备及其体内外评价[J].中国医药工业杂志,2010,41(6):425.
[6]徐 斌,浦雨伟,周 卫,等.星点设计-响应面法优化米拉贝隆缓释片处方[J].中国药房,2017,28(1):110-114.
[7]郑 欣,杨培洪,何 霖,等.丹皮酚-羟丙基- -环糊精包合物的制备及其处方工艺优化[J].中国药房,2017,28(4):530-533.
[8]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:121-124.
[9]田 霞,范云周,孙 媛,等.星点设计-效应面法优化蒿甲醚自微乳释药系统[J].国际药学研究杂志,2016,43(5):966-970.
[10]施 昶,沈诗偲,黄海飞,等.星点设计-效应面优化法在处方筛选和优化中的应用[J].机电信息,2014,32(422):41-46.
[11]夏美华,张 婧,李 翔,等.星点设计-效应面法优化波生坦渗透泵片处方[J].江西中医药大学学报,2016,28(5):83-87.
[12]陈 力,刘砚韬,黄 亮,等.缓控释系统药物释放的数学模型研究进展[J].中国药业,2008,17(11):1 -4.
Preparation of Hybrid-Matrix Controlled-Release Tablets Based on Osmotic Pressure Principle
Yu Lili,Yang Yiqun,Liu Yuhong,Zhao Danyang,Li Bingbing,Wu Qiongzhu
(China Pharmaceutical University,Nanjing,Jiangsu,China 210009)
Objective To investigate the feasibility of using hydroxypropyl methylcellulose(HPMC)/ethyl cellulose(EC)as the matrix skeleton materials to prepare water-soluble drug-metoprolol tartrate (MT)controlled-release tablets.M ethods The and HPMC /EC was used as the hybrid-matrix,the MT hybrid-matrix controlled-release tablets were prepared by the direct power compression method.According to the results of the single factor evaluation,the central composite design - response surface methodology was used to optimize the formulation.The accumulative release at 1,12 h and the correlation coefficientR2from 1 h to 12 h were chosen as the dependant variables and the release behaviorin vitro and drug release mechanism were investigated.Results The amount of hybrid -matrix material,the ratio of HPMC /EC and the amount of lactose had significant effects on the release of the drug.The optimum formulation containing 74.66% hybrid - matrix material,1 /2 HPMC /EC and 5.40% lactose exhibited a zero - order release and drugs were released steadily from the matrix within 12 h.Thedrugrelease wascontrolled by osmotic pressure.Conclusion Hybrid - matrix controlled-release tablets can be used to control the release of MT,the preparation process is simple and stable for the drug release in vitro,which has a certain application prospect.
hybrid-matrix controlled-release tablets;metoprolol tartrate;central composite design-response surface methodology;release in vitro;osmotic pressure principle
R944.4
A
1006-4931(2017)19-0009-05
10.3969 /j.issn.1006 - 4931.2017.19.003
中国药科大学药学基地科研训练及科研能力提高项目(国家基础科学人才培养基金)[J1310032];2016中国药科大学大学生创新创业训练计划项目[201610316209]。
于丽丽,在读大学本科,研究方向为药学,(电子信箱)yulilicpu@163.com。
吴琼珠,副教授,研究方向为药物新剂型,(电子信箱)wqz2008@sina.com。
2017-06-06)
