多指标正交试验优选丹参川芎复方的提取工艺
2017-11-01施天慧
施天慧,江 华
(1.江苏省南通卫生高等职业技术学校,江苏 南通 226010; 2.江苏省启东市人民医院,江苏 南通 226200)
多指标正交试验优选丹参川芎复方的提取工艺
施天慧1,江 华2
(1.江苏省南通卫生高等职业技术学校,江苏 南通 226010; 2.江苏省启东市人民医院,江苏 南通 226200)
目的优选丹参、川芎复方中药的最佳提取工艺。方法以丹参酮ⅡA、阿魏酸和干膏得率为醇提工艺评价指标,丹酚酸B和干膏得率为水提工艺评价指标,采用正交试验法筛选最佳提取工艺。结果丹参、川芎饮片,加8倍量的80%乙醇,提取3次,每次1.5 h。醇提后的药渣挥干乙醇,加8倍量的水,提取3次,每次1.5 h,滤过,合并水煎液,浓缩至相对密度为1.10(60℃热测),室温放置,加95%的乙醇使含醇量达65%,静置过夜,抽滤,回收乙醇至无醇味。结论通过正交试验优选的丹参川芎复方提取工艺稳定、可行,有效成分提取率高,可为工业化生产提供实验依据。
丹参;川芎;丹参酮ⅡA;丹酚酸B;阿魏酸;提取工艺;正交试验
丹参具有活血祛瘀、通经止痛、清心除烦的功效[1]。川芎有活血行气、祛风止痛的功效[1]。现代药理研究证实,丹参具有扩张血管、改善微循环、增加心肌供血量和供氧量、降低心肌耗氧量、抗肝纤维化的作用,其中以脂溶性丹参酮为代表的醌类化合物具有明显的抗炎作用,而以丹参酚酸类为主的水溶性成分是治疗心血管疾病的主要成分[2-3]。川芎也具有扩张冠状动脉、增加冠状动脉血流量、降低心肌耗氧量的作用,其中起主要作用的是生物碱和酚性成分[4-5]。丹参、川芎合用作为治疗冠状动脉粥样硬化性心脏病(简称冠心病)、心绞痛、脑梗死的重要活血化瘀药,配伍使用后能增加冠状动脉流量、提高缺血组织内氧分压、改善微循环、缩小梗死范围,是心脑血管成方制剂处方必不可少的药物[6-10]。本研究中以乙醇提取脂溶性成分,再取药渣以水提取水溶性成分,通过正交试验,以丹参酮ⅡA、阿魏酸的提取量及干膏得率为醇提工艺指标,以丹酚酸B的提取量和干膏得率为水提工艺指标进行优选,并进行验证试验,确定丹参与川芎的最佳提取工艺,以期为制剂开发、大生产工艺提供有益的实验室依据。现报道如下。
1 仪器与试药
1.1 仪器
Aglient 1200型高效液相色谱仪系统,DAD检测器(美国安捷伦公司);Sartorius BT125D型天平(精度为0.01 mg,北京赛多利斯科学仪器有限公司);HH-2型数显恒温水浴锅(常州国华电器有限公司);DW-2型调温电热器(南通市通州申通电热器厂);ZK-82B型真空干燥箱(上海实验仪器厂有限公司);SENCOR-301型旋转蒸发器(上海申顺生物科技有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);H66025T型超声波清洗器(无锡超声电子设备有限公司)。
1.2 试药
丹参(产地江苏,徐州彭祖中药饮片有限公司,批号为130725),川芎(产地四川,徐州彭祖中药饮片有限公司,批号为131016),经中国药科大学中药学院王强教授鉴定为唇形科植物丹参 Salvia miltiorrihiza Bge.的干燥根和根茎,伞形科植物川芎 Ligusticun chuanxiong Hort.干燥根茎;丹酚酸 B对照品(批号为 111562-201313),丹参酮ⅡA对照品(批号为 110766-200416),阿魏酸对照品(批号为110773-201313),均购自中国食品药品检定研究院;乙腈、甲醇为色谱纯,水为纯化水,其余试剂均为分析纯。
2 方法与结果
2.1 筛选指标确定
由于有效成分为脂溶性和水溶性,所以考虑先以乙醇提取脂溶部分,再取药渣以水提取水溶性部分。以丹参酮ⅡA、阿魏酸的提取量及干膏得率为醇提工艺指标;丹酚酸B的提取量和干膏得率为水提工艺指标。
2.2 醇提工艺优选
2.2.1 因素水平设计
根据文献及预试验,以丹参酮ⅡA、阿魏酸的提取量及浸膏得率[11-15]为考察指标,考察乙醇体积分数(A)、溶剂量(B)、提取时间(C)、提取次数(D)对提取效果的影响。因素水平见表1。

表1 丹参川芎醇提因素水平表
2.2.2 试验方法
根据以上因素水平,安排 L9(34)正交设计表。称取丹参川芎饮片9份各适量(丹参与川芎比为6∶5),按正交设计表的试验条件进行提取,过滤,药液回收乙醇减压浓缩至100 mL,备用。
2.2.3 干膏得率测定
精密量取2.2.2项下的浓缩液25 mL,置已干燥至恒重的蒸发皿中,在低温蒸干后,减压干燥至恒重,精密称定,计算干膏得率。
2.2.4 丹参酮ⅡA含量测定
色谱条件[16]:色谱柱为 Diamonsil-C18柱(250 mm ×4.6 mm,5 μm);流动相为甲醇 - 水(75 ∶25);检测波长为 270 nm;流速为 1 mL/min;柱温为 20℃;进样量为25 μL。理论板数按丹参酮ⅡA峰计算应不低于2 000。
对照品溶液制备:称取丹参酮ⅡA对照品2.50 mg,精密称定,置50 mL容量瓶中,加甲醇溶解,定容至刻度,摇匀,即得对照品贮备液。
供试品溶液制备:称取干燥的9份样品各适量,精密称定,置10 mL容量瓶中,加甲醇至刻度,超声溶解,用甲醇补足减失的质量,过滤,吸取续滤液1 mL置10 mL容量瓶中,加甲醇至刻度,摇匀,微孔滤膜滤过,即得。
线性关系考察:分别精密吸取对照品贮备液0.2,2.0,4.0,6.0,8.0 mL,置 100 mL 容量瓶中,定容至刻度,摇匀,分别进样 25 μL,以质量浓度(C,g/L)为横坐标,以峰面积(A)为纵坐标,绘制标准曲线,线性回归方程为 A=69 753.6+677 501 992.1C,r=0.999 9(n=5),质量浓度线性范围为 0.1 ~4.0 μg /mL。
精密度试验:精密吸取同一丹参酮ⅡA对照品溶液,按色谱条件重复进样6次。结果峰面积值的 RSD为0.10%(n=6),表明仪器精密度良好。
重复性试验:取同一批提取液干膏,依法制备供试品溶液,按色谱条件重复进样6次。结果丹参酮ⅡA峰面积的 RSD为0.85%(n=6),表明方法重复性良好。
稳定性试验:精密吸取同一供试品溶液,分别在0,2,4,6,8,12 h 时进样测定。结果丹参酮ⅡA峰面积的 RSD为0.55%(n=6),表明供试品溶液在12 h内稳定。
加样回收试验:取已知含量的同一批提取液干膏6份,精密称定,分别加入对照品适量,按供试品溶液制备方法制备溶液,按色谱条件进样,测定含量,计算回收率。结果丹参酮ⅡA的平均回收率为100.30%,RSD为0.44%(n=6)。
2.2.5 阿魏酸含量测定
色谱条件[1]:色谱柱为 Diamonsil-C18柱(250 mm ×4.6 mm,5 μm);流动相为甲醇 -1%醋酸水溶液(30∶70);检测波长为321 nm;流速为1 mL/min;柱温为25℃;进样量为25 μL。理论板数按阿魏酸峰计算应不低于4 000。
对照品溶液制备:称取阿魏酸对照品 1.00 mg,精密称定,置10 mL容量瓶中,加70%甲醇至刻度,摇匀,即得对照品贮备液。
供试品溶液制备:称取干燥的9份样品各适量,精密称定,置25 mL容量瓶中,加70%甲醇至刻度,超声溶解,摇匀,微孔滤膜滤过,即得。
线性关系考察:分别精密吸取 0.5,1.0,1.5,2.0,5.0 mL,置10 mL容量瓶中,加70%甲醇至刻度,摇匀,分别进样 25 μL,以质量浓度(C,g/L)为横坐标、峰面积(A)为纵坐标绘制标准曲线,线性回归方程为 A=58.378 6+95 285.630 4 C,r=0.999 9(n=5),质量浓度线性范围为 5 ~50 μg/mL。
精密度试验:精密吸取同一阿魏酸对照品溶液,按色谱条件重复进样6次。结果峰面积值的 RSD为0.48%(n=6),表明仪器精密度良好。
重复性试验:取同批提取液干膏,依法制备供试品溶液,按色谱条件重复进样6次。结果阿魏酸峰面积的RSD为0.10%(n=6),表明方法重复性良好。
稳定性试验:精密吸取同一供试品溶液,分别于0,2,4,6,8,12 h 时进样测定。结果阿魏酸峰面积的 RSD为0.22%(n=6),表明供试品溶液在12 h内稳定。
加样回收试验:取已知含量的同一批提取液干膏6份,精密称定,分别加入对照品适量,按供试品溶液制备方法制备溶液,按色谱条件进样,测定含量,计算回收率。结果阿魏酸的平均回收率为 102.40%,RSD为1.43%(n=6)。
2.2.6 正交试验结果及方差分析
按L9(3)4正交试验条件进行煎煮提取,共得到9份醇提液,测定丹参酮ⅡA、阿魏酸含量和干膏得率。结果见表2,方差分析见表3。由表 2可见,得膏率的极差数据 RD> RA> RC> RB,优先顺序为 D>A>C>B,A1B1C1D1较佳;从丹参酮ⅡA得率来看,优先顺序为A>C>B>D,A3B1C1D1较佳;从阿魏酸得率来看,A>C>D>B,A2B1C1D1较佳。由表3可见,因素B对得膏率和阿魏酸得率影响均不大,为节省加热、浓缩的时间及溶剂,选择B2。综合三者,选择 A2B2C1D1。即以 8倍量 80%的乙醇提取 3 次,每次 1.5 h。
2.3 水提工艺优选
2.3.1 因素水平设计
以丹酚酸B及干浸膏得率[11-16]为考察指标,考察加水量(A)、提取时间(B)、提取次数(C)、浸泡时间(D)对提取的影响。因素水平见表4。
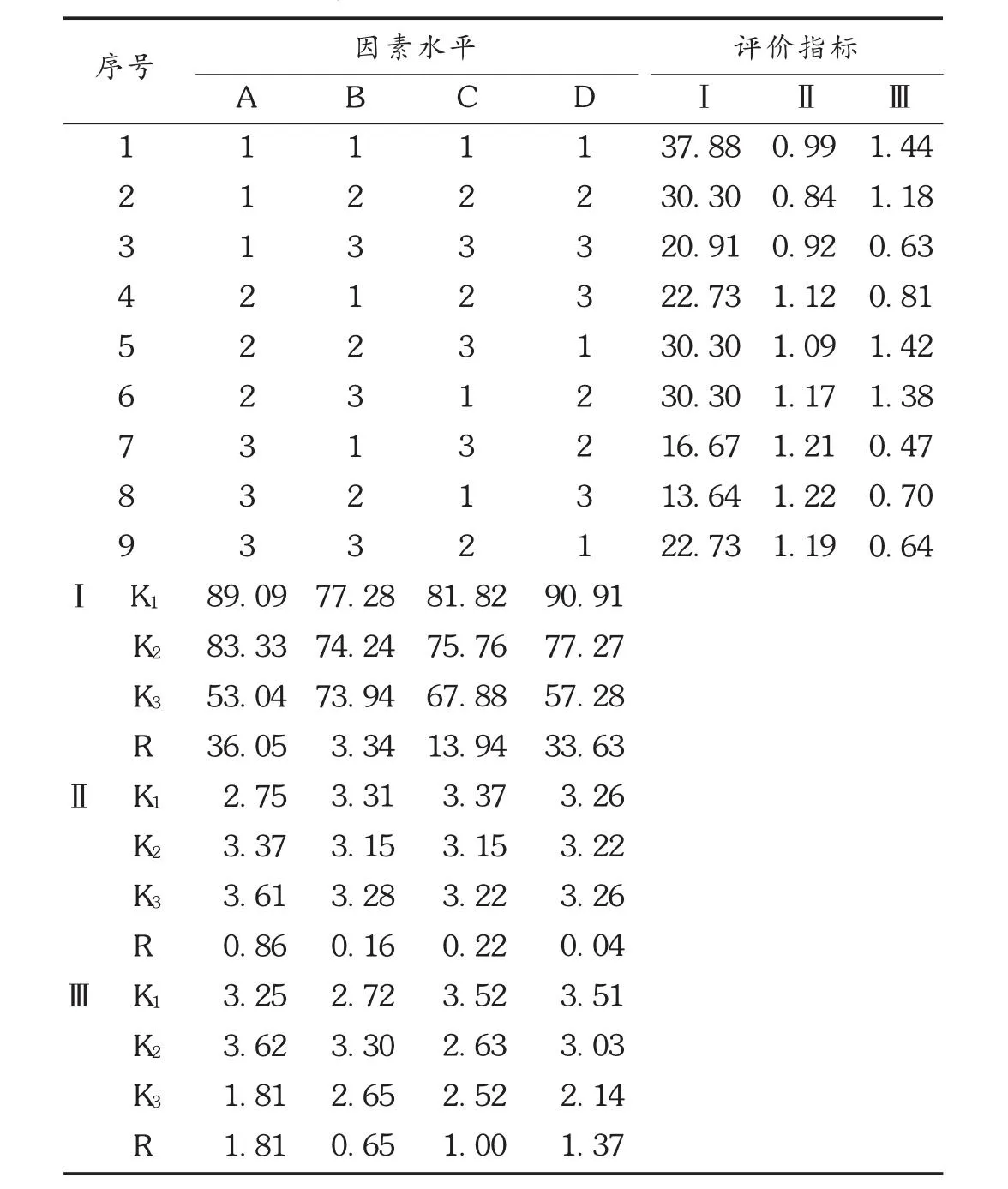
表2 丹参川芎醇提工艺优选正交试验结果

表3 丹参川芎醇提工艺优选方差分析表
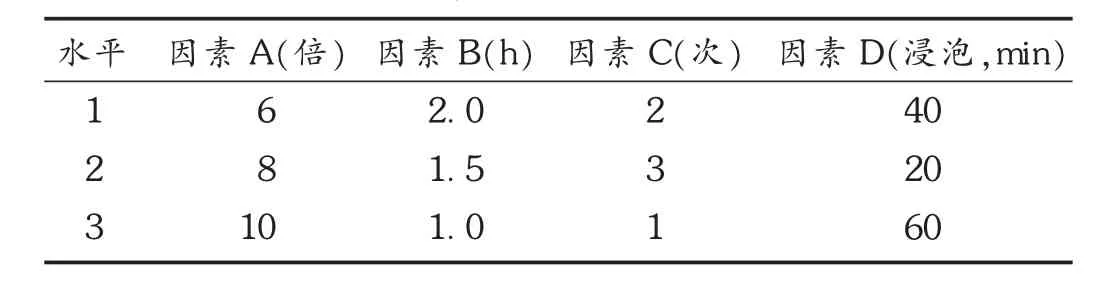
表4 丹参川芎水提因素水平表
2.3.2 试验方法
根据以上因素水平,安排 L9(34)正交设计表。将前一步醇提后的药渣按正交表的条件进行煎煮,合并水提液,过滤,减压浓缩至100 mL,备用。
2.3.3 干膏得率测定
精密量取2.3.2项下的浓缩液25 mL,置已干燥至恒重的蒸发皿中,水浴蒸干后,减压干燥至恒重,精密称定,计算干膏得率。
2.3.4 含量测定
色谱条件[1]:色谱柱为 Diamonsil-C18柱(250 mm ×4.6 mm,5 μm);流动相为乙腈 - 0.1% 磷酸(22 ∶78);流速为 1.2 mL/min;检测波长为 286 nm;柱温为 20℃;进样量为25 μL。理论板数按丹酚酸B峰计算应不低于6 000。
对照品溶液配制:称取丹酚酸B对照品5.00 mg,精密称定,置10 mL容量瓶中,加甲醇 -水(8∶2)混合溶液,超声溶解,放置至室温后,再加甲醇稀释至刻度,摇匀,即得。
供试品溶液配制:取9份样品各适量,置25 mL容量瓶中,加甲醇-水(8∶2)混合溶液至刻度,超声溶解,摇匀,过滤,取续滤液1 mL于10 mL容量瓶中,加甲醇-水(8∶2)混合溶液至刻度,摇匀,微孔滤膜滤过,即得。
线性关系考察:精密吸取对照品溶液 0.05,0.10,0.20,0.40,0.60,0.80 mL 置 1 mL 容量瓶中,加甲醇 -水(8 ∶2)稀释至刻度,进样 25 μL,按上述色谱条件测定,以质量浓度(g/L)为横坐标、峰面积为纵坐标绘制标准曲线,线性回归方程为 A=16 412.771 2 C-58.209 3, r=0.999 8(n=6),质量浓度线性范围为25 ~ 400 μg /mL。
精密度试验:精密吸取同一丹酚酸B对照品溶液,按色谱条件重复进样6次。结果峰面积值的 RSD为0.10%(n=6),表明仪器精密度良好。
重复性试验:取同一批提取液干膏,依法制备供试品溶液,按色谱条件重复进样6次。结果丹酚酸B峰面积的 RSD为0.33%(n=6),表明方法重复性良好。
稳定性试验:精密吸取同一供试品溶液,分别在0,2,4,6,8,12 h时进样测定。结果丹酚酸 B峰面积的RSD为0.70%(n=6),表明供试品溶液在12 h内稳定。
加样回收试验:取已知含量的同一批提取液干膏6份,精密称定,分别加入对照品溶液适量,按供试品溶液制备方法制备溶液,按色谱条件进样,测定含量,计算回收率。结果丹酚酸B的平均回收率为97.83%,RSD为0.45%(n=6)。
2.3.5 正交试验结果及方差分析
按 L9(3)4正交试验条件进行煎煮提取,共得到9份水提液,测定丹酚酸B和干膏得率。结果见表5,方差分析见表6。由表5可见,得膏率的极差数据RB>RC>RD>RA,优先顺序为 B>C>D>A,A3B1C2D3最佳;从丹酚酸B的得率来看,优先顺序为 C>B>D>A,A2B2C2D3最佳;由表6可见,因素A对得膏率和丹酚酸B得率影响不大。为节省浓缩时间选择 A2,综合两者选择A2B2C2D3。即加8倍量水,浸泡60 min,提取3次,每次1.5 h。

表5 丹参川芎水提工艺优选正交试验结果

表6 丹参川芎水提工艺优选方差分析表
2.4 醇沉工艺考察
2.4.1 醇沉含量选择
取110 g药材,按最佳提取工艺先醇提后水提,精密吸取水浴浓缩至相对密度为1.10(60℃热测)的样品溶液3份各适量,加入95%乙醇使含醇量分别为55%,65%和75%,静置过夜,滤过,滤液减压回收乙醇,真空干燥至恒重,得干膏,计算得膏率。干膏用甲醇-水(8∶2)混合溶液溶解,置25 mL容量瓶中,加甲醇-水(8∶2)混合溶液至刻度,摇匀,吸取 1 mL,置 10 mL容量瓶中,稀释至刻度,作为供试品溶液,测定丹酚酸B含量。结果见表7。综合考虑,选择65%醇沉浓度最宜。

表7 醇沉工艺含醇量优选试验结果
2.4.2 浓缩液密度选择
取相对密度分别为 1.05,1.10 和 1.15(60 ℃热测)的样品溶液各适量,置三角瓶中,加入95%乙醇使含醇量为65%,静置过夜,滤过,滤液减压回收乙醇,真空干燥至恒重,得干膏,计算得膏率。干膏用甲醇-水(8∶2)混合溶液溶解,于25 mL容量瓶中,加甲醇-水(8∶2)混合溶液至刻度,摇匀,吸取1 mL,置10 mL容量瓶中,稀释至刻度,作为供试品溶液,测定丹酚酸B含量。结果见表8。综合考虑,选择加工溶液浓缩到相对密度为1.1(60 ℃热测)。

表8 醇沉工艺浓缩液密度优选试验结果
2.5 最佳工艺确定
取丹参川芎饮片,加8倍量的80%乙醇,提取3次,每次1.5 h。醇提后的药渣挥干乙醇,加8倍量的水,提3次,每次 1.5 h,滤过,合并水煎液,浓缩至相对密度 1.10(60℃热测),放置室温,加 95%的乙醇使含醇量达65%,静置过夜,抽滤,回收乙醇至无醇味,即得。
2.6 验证试验
为确定优选工艺的优劣和稳定性,平行称取3份饮片,根据最佳提取工艺进行验证试验。试验结果见表9,表明该工艺合理可行、稳定可靠。

表9 最佳工艺验证试验结果
3 讨论
丹参是本复方中的君药,其中含量较多且具显著药效的成分分别为水溶性丹酚酸B和脂溶性丹参酮ⅡA。川芎中含挥发油、生物碱、酚酸等多种成分,其中酚酸类成分阿魏酸具有清除氧自由基、抗血小板聚集、改善微循环等作用;生物碱类成分川芎嗪含量很少,且易升华;挥发油类 本内酯在提取过程中又易挥发。本研究中发现,将丹参川芎配伍使用,可促进丹酚酸B分布更广泛、消除减缓、体内作用时间延长,能促使阿魏酸的血药浓度提高、体内清除加快[6]。因此,选择丹酚酸B、阿魏酸和丹参酮ⅡA作为提取工艺评价指标性成分。
药材采用先醇提后水提的方法,醇提干浸膏得率在30%左右。水提后浸膏得率较高,由于水提部分成分复杂,制得的干膏引湿性强,故将水提液浓缩为浸膏后再采用醇沉法去除大量水溶性杂质,干膏得率降低,在14%左右。水提醇沉后对丹酚酸B含量影响不大,还可减少用药量,便于制剂后减少用药剂量提高患者用药依从性。提取过程中应注意,有效成分丹参酮ⅡA、丹酚酸B在湿热条件下易降解变质,故提取后的浸膏宜真空干燥,且温度不宜过高。药材水提液浓缩后加入乙醇沉淀杂质时,乙醇应边搅拌边缓缓加入,否则会导致局部乙醇浓度过高,形成絮状沉淀,不利于过滤并会影响醇沉效果。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:76 -77,40 -41.
[2]梁文仪,陈文静,杨光辉,等.丹参酚酸类成分研究进展[J].中国中药杂志,2016,41(5):806 -812.
[3]刘慧颖,姜长涛,冯 娟.丹参酮类化合物研究进展[J].中国药理学通报,2016,32(12):1643 -1647.
[4]杜旌畅,谢晓芳,熊 亮,等.川芎挥发油的化学成分与药理活性研究进展 [J].中国中药杂志,2016,41(23):4328 -4333.
[5]朱 尧,刘微微,顾 宁.川芎的活性成分及其心血管系统保护作用研究进展[J].时珍国医国药,2016,27(7):1701 -1704.
[6]张翠英,章 洪,董 宇,等.基于药效成分丹酚酸B和阿魏酸在大鼠血浆的药代动力学研究丹参与川芎配伍[J].中国中药杂志,2015,40(8):1589 -1593.
[7]金玉青,洪远林,李建蕊,等.川芎的化学成分及药理作用研究进展[J].中药与临床,2013(3):44 -48.
[8]李树学,韩宇博,田 苗,等.参芎注射液对家兔离体心肌缺血再灌注心功能的影响[J].中国临床保健杂志,2014,17(6):613 - 615.
[9]王亚玲,崔张新,李方江.丹参与川芎联合用药对冠心病患者脂代谢及血流流变性的影响[J].时珍国医国药,2009,20(9):2169-2170.
[10]管敏国,张宇燕,万海同,等.丹参川芎有效成分配伍对缺氧损伤大鼠脑内皮细胞的影响[J].安徽中医药大学学报,2014,33(2):74 - 78.
[11]任伟光,王 阶,张翠英,等.多指标正交试验优选丹参黄连的提取工艺[J].中国医院药学杂志,2016,36(10):814 -818.
[12]甘方良,李 丽.正交试验法优化丹参乙醇回流提取工艺[J].中国医院药学杂志,2011,31(8):646 - 649.
[13]王 虎,李文兵,胡昌江,等.不同产地川芎主要有效成分含量比较[J].中国药业,2015,24(21):37 -39.
[14]武亚晓,李 希,冯建安,等.正交试验设计优化川芎阿魏酸的提取工艺[J].中药与临床,2015,6(3):22 -25.
[15]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:70-71.
[16]张锦林,季屹红,卫小瑾,等.正交试验法优选理气颗粒提取工艺的研究[J].现代中药研究与实践,2016,30(3):53 - 57.
Optimization of Extraction Process forRadix Salviae Miltiorrhizae and Ligusticum Chuanxiong by Multi-Index Orthogonal Test
Shi Tianhui1,Jiang Hua2
(1.Nantong Health Vocational School of Jiangsu Province,Nantong,Jiangsu,China 226010; 2.Qidong People′s Hospital,Nantong,Jiangsu,China 226200)
Objective To optimize the best extraction process forRadix Salviae miltiorrhizae and Ligusticum chuanxiong.Methods The tanshinoneⅡA,ferulic acid and dry extract yield were taken as the evaluation indexes of ethanol extraction process,the salvianolic acid B and dry extract yield were taken as the evaluation indexes of water extraction process,the optimum extraction process was screened by orthogonal test.Results The optimum extraction process of Radix Salviae Miltiorrhizae and Ligusticum Chuanxiong was adding 8 times amount of 80% alcohol,refluxing and extracting for 3 times,1.5 h each time.The residue was adding 8 times amount of water,refluxing and extracting for 3 times,1.5 h each time,then concentrating the water extraction to ρ = 1.10(determined at 60 ℃ ),letting it at room temperature and adding 95% alcohol to 65% ,standing overnight,filtration,recycling ethanol to no alcohol flavor.Conclusion The optimized extraction process of Radix Salviae miltiorrhizae and Ligusticum chuanxiong by orthogonal test is stable and feasible,and the extraction rate of effective ingredients is high,which can provide experimental basis for industrial production.
Salvia miltiorrihiza; Ligusticun chuanxiong;tanshinoneⅡA;salvianolic acid B;phenolic acid;extraction process;orthogonal test
TQ460.6;R284.2
A
1006-4931(2017)20-0029-05
10.3969 /j.issn.1006 - 4931.2017.20.008
施天慧(1980-),女,江苏南通人,硕士研究生,讲师,执业药师,主要从事药学专业教学工作,(电话)0513-51083102(电子信箱)55348482@ qq.com。
2017-06-06)
