牛结合珠蛋白α链单克隆抗体制备及辣根过氧化物酶标记
2017-10-31郑晓燕赵达户长春王彩宏王虹范长友代亚楠赵喜文孙东波
郑晓燕,赵达,户长春,王彩宏,王虹,范长友,代亚楠,赵喜文,孙东波
牛结合珠蛋白α链单克隆抗体制备及辣根过氧化物酶标记
郑晓燕,赵达,户长春,王彩宏,王虹,范长友,代亚楠,赵喜文,孙东波
(黑龙江八一农垦大学,大庆 163319)
为了制备牛结合珠蛋白主要抗原区重组蛋白(pirBoHp)单克隆抗体及对其进行辣根过氧化物标记。试验利用纯化的pirBoHp作为免疫原,免疫雌性BALB/c小鼠,然后利用淋巴细胞杂交瘤技术,制备BoHp单克隆抗体。通过Western blot试验分析制备的BoHp单克隆抗体的免疫反应性;利用抗体亚型鉴定试剂盒,分析鉴定BoHp单克隆抗体的亚型和轻链型。利用改良过碘酸钠标记法,对制备的BoHp单克隆抗体进行辣根过氧化物酶(HRP)标记。结果显示,试验成功制备了4株BoHp单克隆抗体,分别命名为1B3、6D6、6D3和6B7。Western blot结果显示,制备的4株BoHp单克隆抗体1B3、6D6、6D3和6B7能识别牛血浆中天然BoHp的α链。进一步抗体亚型鉴定结果表明,1B3、6D6、6D3和6B7抗体亚型均为IgG1,轻链型为kappa链。利用改良过碘酸钠标记法,对纯化的BoHp单克隆抗体1B3、6D6、6D3和6B7成功进行了HRP标记。BoHp α链单克隆抗体的制备及其HRP标记为BoHp特异性诊断方法的建立奠定了基础。
牛结合珠蛋白;单克隆抗体;辣根过氧化物酶
奶牛炎性疾病已经严重影响了奶牛的生产性能,造成了巨大经济损失,其中影响较严重的炎性疾病包括奶牛乳房炎、炎性蹄病、子宫内膜炎。尽管已有奶牛炎性疾病相关诊断方法的报道,但是目前仍然未见针对奶牛炎性疾病通用的高通量及应用便利的快速诊断方法[1]。当动物机体受到外伤、炎症或感染早期时,免疫系统首先做出的免疫应答表现在机体局部的炎症反应上,当损伤超出局部防御能力时,机体便会引发更加广泛的全身反应,引起这一非特异性免疫防御反应的过程称为急相反应。参与急性期反应的蛋白质,称为急相蛋白(acute phase proteins,APPs)[2]。 目前,急相蛋白在临床疾病诊断中被广泛作为生物标记物[3]。结合珠蛋白(Haptoglobin,Hp)是一种急相蛋白,由两条20 kDa的多肽(α链)和两条30 kDa的多肽(β链)组成的四聚体,分子质量约为1 000~2 000 kDa。Hp在血液中游离的结合珠蛋白很少,主要与血液中的血红蛋白(Hb)聚合成Hp-Hb复合物[4]。大量研究发现,牛结合珠蛋白(bovine haptoglobin,BoHp)在奶牛蹄叶炎、奶牛腐蹄病等炎性疾病中浓度显著升高[5]。因此,BoHp能够作为奶牛炎性疾病的生物学标记物,在奶牛炎性疾病中有重要的应用价值和潜在的应用前景[6-7]。试验利用BoHp主要抗原区重组蛋白(pirBoHp)作为免疫原,制备能识别BoHp α链的单克隆抗体,并对获得的BoHp单克隆抗体进行HRP标记,为BoHp生物传感器、定量ELISA和免疫胶体金等特异性诊断方法的建立提供基础。
1 材料与方法
1.1 实验动物
6~8周龄的雌性BALB/c小鼠购自中国农业科学院哈尔滨兽医研究所实验动物中心。
1.2 主要材料与试剂
pirBoHp重组蛋白保存于黑龙江八一农垦大学生物技术中心502实验室;HT、HAT混合盐,弗氏完全佐剂(FCA)、弗氏不完全佐剂(FICA)、PEG-1450、HRP-山羊抗鼠IgG均购自Sigma公司;DMEM培养基、胎牛血清(FBS)均购自 Gibco公司;3,3',5,5'-四甲基联苯胺(TMB)购自AMRESCO;IgG抗体亚类鉴定试剂盒购自 Thermo Pierce(Rockford,IL);彩色预染蛋白Marker购自碧云天生物技术公司。
1.3 BoHp单克隆抗体的制备
1.3.1 免疫小鼠
利用BoHp主要抗原区重组蛋白(pirBoHp)作为免疫原,对6~8周龄的BALB/c小鼠进行腹腔及背部皮下多点注射免疫,免疫剂量为60 μg·mL-1,共进行3次免疫,免疫间隔时间为14 d。首次免疫用弗氏完全佐剂,第二和第三次免疫用弗氏不完全佐剂。第三次免疫后7 d进行采血,分离血清,用间接ELISA方法对血清中抗体效价进行检测。然后腹腔注射100 μg的重组蛋白进行加强免疫,3 d后进行细胞融合实验。
1.3.2 细胞融合与单克隆抗体筛选
无菌摘取免疫鼠脾脏,制备脾细胞悬液,然后与鼠骨髓瘤细胞SP2/0细胞进行融合。细胞融合操作如下:将备用的SP2/0细胞与小鼠脾细胞混匀加到50 mL 离心管(细胞混合的比例为 1∶5~1∶10);室温,1 000×g,离心6 min,并弃尽上清;将离心管底部放于EP管板上轻轻用力来回摩擦震荡,促使两种细胞充分混匀,将离心管放于37℃水浴,维持恒温;均匀摇晃水浴中的离心管,并匀速加入1 mL PEG1450,45 s内加完,再静止45 s;1 min内匀速加入1 mL DMEM溶液,再1 min内匀速加入1 mL DMEM溶液;再以5 mL·min-1的速度加DMEM溶液至离心管30 mL处;室温,1 000×g,离心6 min,弃上清;用10 mL HAT选择培养液轻吹细胞,加到新的无菌瓶中,再补加HAT培养液至100 mL,轻轻混匀,以100 μL·孔-1铺于96孔细胞培养板,并置于37℃、5%二氧化碳细胞培养箱中培养。采用HAT、HT选择培养液对融合细胞进行筛选培养,当细胞集落长到1/5孔底面积时,取细胞上清,利用ELISA方法进行阳性杂交瘤细胞的筛选,同时用His标签蛋白包被酶标板作为标签对照。利用有限稀释法,对阳性细胞孔进行克隆,将获得的阳性细胞株保存于液氮中。
1.3.3 单克隆抗体亚型鉴定
根据IgG抗体亚类鉴定试剂盒说明书,鉴定制备的单克隆抗体的亚型。其操作步骤:将试剂盒置于室温30 min,平衡温度;用TBS稀释杂交瘤细胞上清,稀释度为 1∶50(可稀释范围为 1∶10~1∶100);各取50 μL稀释好的杂交瘤细胞上清于ELISA板竖列八个孔中;每孔各加入50 μL山羊抗鼠IgG+IgA+IgM HRP,轻混;盖上盖子室温孵育1 h;弃去孔中液体,用Wash Buffer洗涤 ELISA板4次,每孔 300 μL,每次 3~5 min,拍干;每孔各加入 75 μL TMB 显色液,显色10 min后,每孔各加入75 μL终止液;酶标仪读取OD450的值,吸光值≥0.2判为阳性。
1.3.4 单克隆抗体免疫活性的鉴定
通过Western blot实验,对BoHp单克隆抗体免疫反应性进行鉴定。具体操作如下:将患腐蹄病奶牛血浆、健康奶牛血浆、pirBoHp重组蛋白和His标签蛋白进行SDS-PAGE电泳,然后将其转移至硝酸纤维素膜(NC) 上。4株BoHp单克隆抗体1B3、6D6、6D3和6B7作为一抗,HRP-Goat Anti-Mouse IgG(H+L)作为二抗,用ECL超敏发光显色液作为显色液,化学发光荧光成像系统(Bio-Rad)分析捕获得到的图像信号。
1.3.5 单克隆抗体HRP标记
1.3.5.1 单克隆抗体腹水的纯化
单克隆抗体腹水预处理:10 000×g,4℃离心15 min,去除上层油脂;溶于一定体积预冷的Bingding buffer溶液中;用0.22 μm滤膜过滤,4℃冰箱放置备用。亲和层析法纯化腹水:使用10倍柱体积的Binding buffer溶液,以1 mL·min-1的流速洗涤柱子两次;将上述处理好的腹水溶液以1 mL·min-1的流速过柱子4~6次;用5~10倍柱体积Bingding buffer溶液洗柱子一次;用2~5倍柱体积的Elution buffer洗脱柱子,将洗脱下来的溶液溶于一定比例的1 M Tris-HCl即为所要的抗体。用蛋白质定量试剂盒(BCA)测定其浓度,用SDS-PAGE电泳鉴定其纯度。
1.3.5.2 纯化单克隆抗体的HRP标记
利用改良过碘酸钠标记法制备BoHp单克隆抗体的HRP酶标抗体。具体操作如下:取5 mg HRP溶于1~5 mL pH5.6的0.06 M HAc-NaAc缓冲液中;加入0.5 mL新配置的0.06 M NaIO4,溶液由棕色变为草绿色,于4℃冰箱放置25 min;25 min后加入1 mL 0.16 M乙二醇,室温避光放置30 min,终止氧化反应,此时溶液由草绿色变为棕黄色;加入待标记的纯化抗体10 mg,混匀,调其pH值调为9.0左右,装入透析袋内,用pH9.5浓度为0.05 M的碳酸盐缓冲溶液4℃透析过夜(注意2 h/4 h换液),使之充分结合;透析结束后加入 200 μL,5 mg·mL-1的 NaBH4溶液,混匀,4℃放置 2 h,每隔 30 min混匀一次,用pH7.4,0.02 M PBS溶液,4℃透析18 h;向透析后的溶液中缓缓加入等体积的饱和硫酸铵,混匀,4℃放置30 min,12 000×g离心20 min, 弃上清;用1 mL pH7.4,0.02 M PBS溶液将沉淀悬起,装入处理好的透析袋中,于pH7.4,0.02 M PBS 4℃透析过夜(注意2 h/4 h换液);4℃ 2 000×g离心20 min,弃去不溶沉淀,即得酶标记物。采用棋盘滴定法,通过直接ELISA方法,确定BoHp单克隆抗体HRP酶标记的最佳条件。BoHp单克隆抗体HRP酶标记物小量分装后,保存于-70℃冰箱。
2 结果
2.1 BoHp单克隆抗体制备与鉴定
利用纯化的BoHp主要抗原区重组蛋白(pir-BoHp)作为免疫原,通过淋巴细胞杂交瘤技术,获得了4株针对BoHp的单克隆抗体细胞株,分别命名为1B3、6D6、6D3 和 6B7。 BoHp 单克隆抗体 1B3、6D6、6D3 和 6B7 小鼠腹水的效价分别为 1∶9.6×108、1∶4.4×105、1∶1.0×106和 1∶1.0×106。抗体亚类鉴定结果显示,1B3、6D6、6D3和6B7单克隆抗体的亚型均为IgG1,轻链类型为kappa(图1)。Western blot结果显示,1B3、6D6、6D3和 6B7均能与重组 pirBoHp蛋白反应,同时均能识别天然的BoHp蛋白(患腐蹄病奶牛血浆),且具有良好的免疫反应性(图2)。

图1 单克隆抗体的亚类鉴定Fig.1 Identification of subtypes of monoclonal antibodies
2.2 BoHp单克隆抗体HRP标记
利用亲和层析柱,对单克隆抗体腹水1B3、6D3、6B7、6D6 的腹水进行了纯化,SDS-PAGE 电泳结果表明4株腹水均获得了较高的纯度,其中1B3 为 13.5 μg·mL-1,6D3 为 10.0 μg·mL-1,6B7 为12.3 μg·mL-1,6D6 为 6.8 μg·mL-1。 利用改良过碘酸钠标记法,对纯化的BoHp单克隆抗体1B3、6D6、6D3和6B7进行了HRP标记。酶标单克隆抗体测定结果显示,HRP标记的1B3、6D3、6B7和6D6能特异性的与pirBoHp重组蛋白结合,其中1B3-HRP的效果最佳,当其稀释度为1∶12 800,OD450值依然在1.0以上(图 3)。
3 讨论
奶业已成为我国畜牧业的主要支柱产业之一。随着饲养规模扩大和泌乳量增高,奶牛疾病发生率也日益增高,已影响奶业健康发展。在奶牛疾病中,亚临床的炎性疾病因其临床症状不明显,早期不易发现,给奶牛养殖造成的危害性最大,带来严重的经济损失,已经成为影响奶牛养殖效益和奶产品质量的瓶颈问题[8]。因此,奶牛亚临床炎性疾病早期预警方法的研究具有重要科学意义及应用价值。单克隆抗体是由免疫小鼠的脾细胞与骨髓瘤细胞形成的具有双亲特征的杂交瘤细胞产生的只针对一种抗原决定簇的单一抗体。单克隆抗体以其特异性强、纯度高、均一性好等优点,广泛应用于各种特异性诊断方法的建立[9]。因此,试验选择通过制备BoHp单克隆抗体,并对制备的单克隆抗体进行标记,为后续奶牛亚临床炎性疾病的诊断方法建立奠定基础。
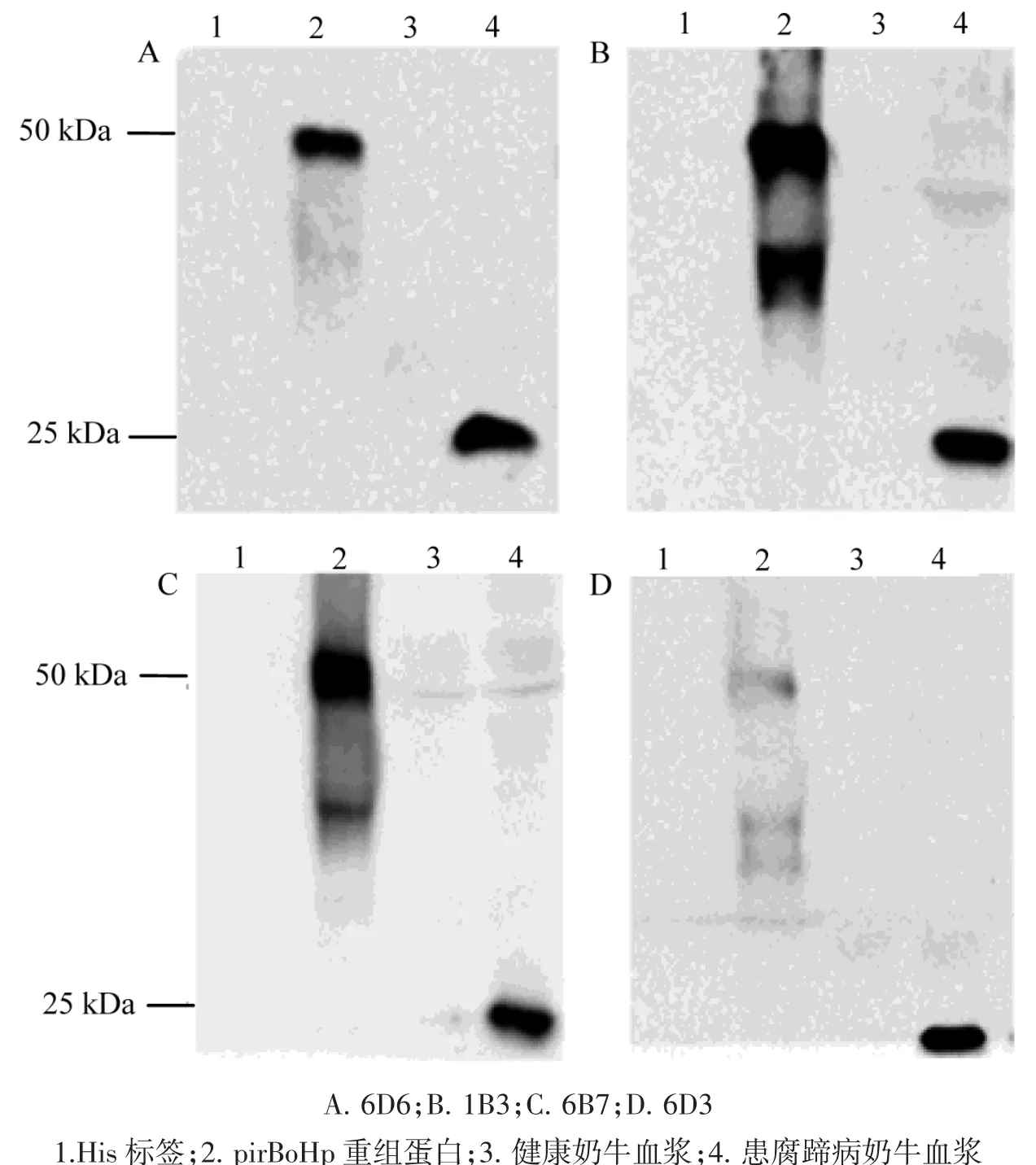
图2 单克隆抗体的Western blot分析Fig.2 Analysis of monoclonal antibodies by Western blot
在单克隆抗体制备过程中,免疫抗原纯度是决定单克隆抗体能否成功获得的关键因素之一。虽然用于免疫的抗原,从纯度上要求不高,但是高纯度的抗原可提高小鼠的免疫应答机制,提高融合机率。但是抗原中混杂物较多,且混杂物中含有免疫原性较强的物质,就必须对抗原进行纯化。试验采用的是原核表达系统大肠杆菌系统表达的pirBoHp重组蛋白,蛋白纯度高,能够保障免疫效果。影响免疫的因素很多,例如佐剂的选择,抗原的纯度及用量,免疫的次数,免疫的时间等都会影响到免疫的效果。免疫的途径通常采用皮下及腹腔多点注射,为提高小鼠对抗原的免疫反应性,也有采用静脉注射及脾内注射。免疫时间的选择,在小鼠免疫早期,获得的杂交瘤细胞主要分泌IgM抗体,在免疫中后期获得的杂交瘤细胞主要分泌IgG抗体,因此试验采取三次免疫,一次腹腔加强免疫后,进行骨髓瘤细胞与杂交瘤细胞的融合。单克隆抗体的免疫活性是决定其应用的关键特性。在试验中,选择天然的BoHp作为检测抗原评价抗体的免疫反应性,为了BoHp单克隆抗体后续的应用提供保障。
目前,用于标记抗体的方法主要有酶标记、荧光素标记、同位素标记、生物素标记、化学发光标记以及金标记等。试验采用酶标记法,常用做标记抗体的酶有辣根过氧化物酶(HRP)、碱性磷酸酶、葡萄糖氧化物酶和β-半乳糖苷酶等,其中HRP性质稳定、活性较强、较容易提纯,且价格便宜。因此试验选用HRP作为抗体的标记物。现在常用的酶标记单克隆抗体的方法是改良过碘酸钠法,试验过程中需要注意的事项包括:在溶解HRP时,以pH5.6醋酸盐缓冲液溶解酶为宜;氧化HRP时间不能超过30 min,25 min为宜;一般认为氧化5 mg HRP,使用NaIO4量以 0.06 mol·L-10.5 mL 为宜,不能低于 0.015 mol·L-10.5 mL;整个试验过程中试剂要现用现配。
4 结论
试验成功制备了4株BoHp单克隆抗体,分别命名为 1B3、6D6、6D3 和 6B7, 抗体亚型均为 IgG1,轻链类型为kappa链,其腹水效价均在105以上,且均能识别牛血浆中天然BoHp的α链。利用改良过碘酸钠标记法,对纯化的BoHp单克隆抗体1B3、6D6、6D3和6B7成功进行了HRP标记,其中1B3-HRP的效果最佳,当其稀释度为1∶12 800,OD450值依然在1.0以上,能用于后续基于HRP的特异性诊断方法建立。
[1] Asai T,Mori M,Okada M,et al.Elevated serum haptoglobin in pigs infected with porcine reproductive and respiratory syndromevirus [J].Veterinary Immunology& Immunopathology,1999,70(1-2):143-148.
[2] Morimatsu M,Sarikaputi M,Syuto B,et al.Bovine haptoglobin:single radial immunodiffusion assay of its polymeric forms and dramatic rise in acute-phase sera[J].Veterinary Immunology&Immunopathology,1992,33(4):365-372.
[3] Zhang MZ,Sun ZC,Fu XR,et al.Analysis of serum proteome profiles of non-Hodgkin lymphoma for biomarker identification[J].J Proteomics,2009,72(6):952-959.
[4] 刘健华,梁礼成,金久善.急性期蛋白及其在兽医临床上的诊断价值[J].中国兽医杂志,2001,37(7):41-43.
[5] Murata H,Miyamoto T.Bovine haptoglobin as a possible immunomodulator in the sera of transported calves[J].British Veterinary Journal,1993,149(3):277-283.
[6] Kujala M,Orro T,Soveri T.Serum acute phase proteins as a marker of inflammation in dairy cattle with hoof diseases[J].Veterinary Record,2010,166(8):240-241.
[7] Sun D,Zhang H,Guo D,et al.Shotgun Proteomic Analysis of Plasma from Dairy Cattle Suffering from Footrot:Characterization of Potential Disease-Associated Factors[J].Plos One,2013(2):55973.
[8] 郑家三,鲁明福,徐闯,等.奶牛主要群发性生产疾病早期预警系统的设计与实现[J].黑龙江八一农垦大学学报,2016,28(6):34-38.
[9] Guo D,Zhang H,Li C,et al.A polyclonal antibody against recombinant bovine haptoglobin expressed in Escherichia coli.[J].Monoclonal Antibodies in Immunodiagnosis&Immunotherapy,2013,32(6):419-424.
Preparation of Monoclonal Antibodies against α Chains of Bovine Haptoglobin and Labeling of Horseradish Peroxidase Conjugates
Zheng Xiaoyan,Zhao Da,Hu Changchun,Wang Caihong,Wang Hong,Fan Changyou,Dai Yanan,Zhao Xiwen,Sun Dongbo
(Heilongjiang Bayi Agricultural University,Daqing 163319)
In order to prepare the monoclonal antibodies (McAbs)against major antigen region recombinant protein of bovine conjugated globin(pirBoHp)and marker horseradish peroxidation,the study that bovine haptoglobin were prepared in BALB/c mice using recombinant protein of the predicted immunodominant region of bovine haptoglobin (pirBoHp)as immunized antigens by lymphocyte hybridoma technique.The immuno-response activity of the prepared monoclonal antibodies was evaluated by Western blot.The subtype of the McAbs was identified by using the Rapid ELISA Mouse mAb Isotyping Kit.Labeling of McAbs-horseradish peroxidase(HRP)was carried out by the modified sodium periodate labeling method.Results indicated that a total of four McAbs,named 1B3,6D6,6D3 and 6B7,were prepared by conventional B lymphocyte hybridoma technique.In Western blot,the McAbs 1B3,6D6,6D3 and 6B7 could recognize α -chain of the native BoHp from plasma of dairy cows.The subtype of the McAbs 1B3,6D6,6D3 and 6B7 was IgG1κ.The McAbs 1B3,6D6,6D3 and 6B7 were successfully labeled with HRP.Preparation and labeling of the McAbs against BoHp would have a potential use for developing diagnostic reagents of BoHp.
bovine haptoglobin;monoclonal antibodies;horseradish peroxidase
S815.4
A
1002-2090(2017)05-0044-05
10.3969/j.issn.1002-2090.2017.05.012
2016-12-20
黑龙江省大学生创新创业训练计划项目(201610223030)。
郑晓燕(1994-),女,黑龙江八一农垦大学动物科技学院2014级本科生。
赵达,男,副教授,E-mail:hljzd@163.com;孙东波,男,教授,博士研究生导师,E-mail:dongbosun@126.com。
