DC-CTL细胞对卵巢癌小鼠不同输注途径的治疗效果比较
2017-10-30BHATTISADAF周飞凌AHMADMEESAQGHULAMQADIRSAQUIBBINISH李劼
●BHATTI SADAF,周飞凌,AHMAD MEESAQ, GHULAM QADIR,SAQUIB BINISH,李劼
DC-CTL细胞对卵巢癌小鼠不同输注途径的治疗效果比较
●BHATTI SADAF,周飞凌,AHMAD MEESAQ, GHULAM QADIR,SAQUIB BINISH,李劼
目的:探讨DC-CTL细胞采用两种不同的输注方式对卵巢癌小鼠的治疗效果的比较。方法:取健康人的外周血制备DC-CTL细胞,分为抗原负载DC既A1组,未进行抗原负载为A2组,采用酶标法检测A1和A2对卵巢癌细胞的杀伤作用。同时6周龄的雌性SPF小鼠60只,在超净工作台内将SKOV3细胞液接种于裸鼠颈背部皮下建立移植瘤模型,第15天模型建立,选择移植瘤模型建立成功的小鼠48只,随机分为四组,分别为皮下注射组及其对照组,尾静脉注射组及其对照组。两组实验组第21天分别采用皮下注射和尾静脉注射法注入5*103的DC-CTL细胞,对照组注射相同剂量的生理盐水作为安慰剂。第35天处死小鼠,分离瘤组织称重并统计数据。结果:抗原负载的DC-CTL细胞对卵巢癌细胞有更好的杀伤效果。小鼠经颈背部皮肤下注射SKOV3细胞在15天左右成瘤,两组实验组瘤重都明显低于相应的对照组(P<0.05),而两组实验组之间,尾静脉皮下注射组小鼠的瘤重量明显低于皮下注射组(P<0.05)。结论:DC-CTL细胞能有效的抑制小鼠卵巢癌的发展,DC-CTL细胞经尾静脉注入卵巢癌小鼠体内比皮下注射对小鼠有更好的治疗效果, 本实验结果为临床使用DC-CTL细胞治疗卵巢癌输注方式的选择提供了一定的依据。
DC-CTL细胞;移植瘤模型;输注方式
卵巢癌为女性生殖系统三大恶性肿瘤之一,如今仍然杀死80%的患者死亡率居妇科恶性肿瘤之首[1]。卵巢癌的主要问题是它可以在腹部内扩散引起症状。由于卵巢癌的发生发展具有非常隐匿的特点,超过70%的患者在卵巢癌发现时已经属于晚期,其五年生存率不足40%[2]。作为一个沉默的杀手,卵巢癌预后不良。很明显,新的治疗是卵巢癌所必需的.因此,新的治疗方法必须不同.现在临床治疗晚期卵巢癌的治疗主要采用手术联合化疗的方案,但是这种方案对身体的副作用较大,而且复发率较高。肿瘤免疫治疗作为肿瘤治疗的新型辅助疗法,具有副作用较小,有效祛除体内微小病灶,降低复发率等优点,明显改善了卵巢癌患者的生活质量和降低了复发率[3]。CTL细胞对卵巢癌细胞的杀伤作用已经被很多的研究证实[4],但是并没有研究探讨过注射途径对其治疗效果的影响。本文采用DC-CTL细胞对卵巢癌模型的小鼠行皮下及尾静脉注射,旨在验证DC-CTL细胞对卵巢癌小鼠的治疗作用的基础上,来分析不同的输注途径对其治疗效果的影响,为卵巢癌的免疫细胞治疗采用更有效的输注途径提供了一定的依据。
1 材料与方法
1.1 主要试剂及实验动物
雌性SPF小鼠购自湖南实验动物有限公司;SKOV3细胞珠购自上海素尔生物技术有限公司;rhGM-CSF 由上海江莱有限公司提供;CD3、rhIL-2、TNF-α 、IL-4由上海普欣生物技术有限公司提供;RPMI1640培养液由美国Hyclone公司提供;胎牛血清由美国Gibco公司提供;Ficoll细胞分离液由美国GE公司提供。
1.2 实验方法
1.2.1 裸鼠卵巢癌模型构建
人卵巢癌SKOV3细胞株接种于RPMI1640培养基中常规培养传代,与37℃,5%CO2温度和湿度的培养箱中培养,卵巢癌SKOV3细胞为贴壁生长的细胞,每隔一天换液,取对数生长期细胞制备单细胞悬液,调整密度至2×106/ml备用。取60只6周龄左右的裸鼠在超净工作台内将SKOV3细胞液接种于裸鼠颈背部皮下而建立移植瘤模型,15天左右成瘤,共51只产生移植瘤,直至体积约100-250mm3成荷瘤鼠。
1.2.2 卵巢癌细胞肿瘤抗原的制备
取对数生长期的人卵巢癌SKOV3细胞株制备单细胞悬液,洗涤后调整细胞密度至2⋆106/ml,通过反复三次的冻融,冻融操作为液氮5min,100℃水浴复苏。600g离心25min,收集上清液,13000g离心45min,4摄氏度保存备用。
1.2.3 抗原负载的DC-CTL细胞对人卵巢癌SKOV3细胞的杀伤作用
采健康志愿者的外周血50ml,采用Ficoll分离液分离外周血单个核细胞,加入含有胎牛血清的RPMI1640培养液,置于37℃,5%CO2培养箱中培养2h,吸出未贴壁的细胞悬液备用,重新加入含有rhGM-CSF和IL-4的RPMI1640培养液,隔天换液,第6天加入TNF-α诱导DC成熟,成熟的DC细胞分成两组培养,第一组第8天加入卵巢瘤抗原进行负载,设为A1组;第二组第8天不加入肿瘤抗原进行负载,设为A2组,共培养2天;未贴壁的细胞悬液通过免疫磁珠分选法,分选CD3+的细胞,冻存3d后加入含有胎牛血清的RPMI1640培养液悬浮培养。第10天等量分别与A1组和A2组的DC共同加入到包被有CD3单抗的培养瓶中培养4d,离心分离冻存备用,两组DC-CTL细胞制备完毕。取对数生长期的卵巢癌SKOV3细胞,消化后调节密度为5×104个/ml。按96孔板每孔100ul的量接种于培养箱中培养12h使其贴壁,作为靶细胞。12h后去掉上清,分别加入A1和A2组效应细胞按效应细胞和靶细胞的比值为 5∶1、10∶1、20∶1、40∶1,不加效应细胞的作为对照组。培养箱中共培养48h后,每孔加入MTT30ul,培养箱中再培养2h。终止培养,倒掉上清,每孔加入200ul DMSO,充分混匀后用酶标仪检测吸收值,波长492nm,计算杀伤率。杀伤率=[(对照组A492-效应细胞组A492)/对照组A492]×100%。
1.2.4 动物分组及治疗
选择移植瘤模型建立成功的小鼠48只,随机分为四组,分别为皮下注射组及其对照组,尾静脉注射组及其对照组,皮下注射组和尾静脉注射组两组实验组第21天起每隔两天分别采用皮下注射和尾静脉注射法注入5×103的抗原负载DC-CTL细胞,对照组在相同时间注射0.2ml的生理盐水作为安慰剂。第35天处死小鼠,分离瘤组织称重并统计数据。
1.3 统计学方法
采用SPSS21.0统计软件行统计分析。各组数据均以计量资料以均数±标准差(x±s)表示:2组间均数比较采用成组t检验,检验水准α=0.05。
2 结果
(1)将肿瘤负载DC-CTL(A1)组,未肿瘤负载DC-CTL(A2组)细胞分别与靶细胞按照不同比例混合后,共培养48h后观察 DC-CTL 对人卵巢癌细胞 SKOV-3 的杀伤作用。实验结果显示,在相同的效靶比中:与对照组相比,A1组A2组效应细胞对卵巢癌大鼠SKOV-3细胞都有明显 的杀伤作用(P<0.05),A1组对比A2组对卵巢癌大鼠SKOV-3细胞的杀伤性也有显著性(P<0.05)。在不同的效价比中发现40∶1、20∶1、10∶1效靶比细胞对比5∶1效靶比的细胞有明显的杀伤作用(P<0.05);40∶1、20∶1效靶比 DC-CTL 细胞比 10∶1 杀伤作用有显著性(P<0.05),而40∶1效靶比DC-CTL细胞对比20∶1效靶比DC-CTL细胞没有明显的杀伤作用(P>0.05)。结果说明DC-CTL细胞对卵巢癌细胞有明显的杀伤作用,并且有抗原负载的DC-CTL细胞有更好的杀伤作用,效靶比在20∶1之前越高杀伤效果越好。结果见表1。
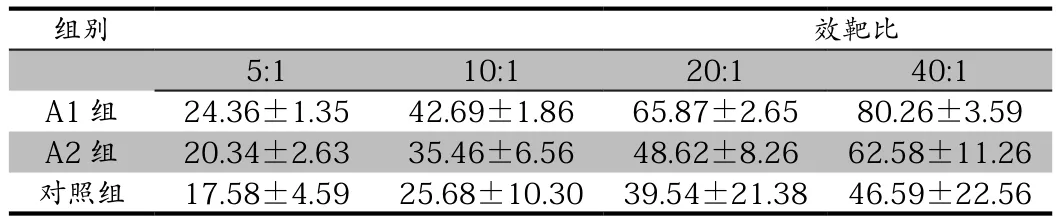
表1 不同效靶比对SKOV-3细胞的杀伤作用
(2)经过称重统计,皮下注射组瘤重为1.64±0.26g,皮下注射对照组瘤重2.36±0.37g;尾静脉注射组瘤重1.32±0.31g,尾静脉注射组瘤重2.41±0.53g(见表1)。皮下注射组、尾静脉注射组瘤重均明显低于其对照组(P<0.05);尾静脉注射组瘤重明显低于皮下注射组(P<0.05);而两组对照组之间并无显著差异(P>0.05)。结果见表2。
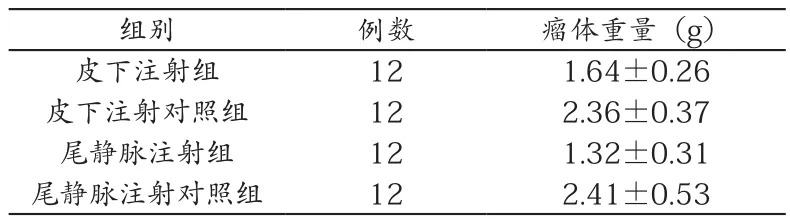
表2 各组小鼠肿瘤质量
3 讨论
卵巢癌在女性生殖系统肿瘤中死亡率最高,很多患者发现即为晚期。目前,卵巢癌的治疗是外科手术结合化疗的治疗策略,虽然患者的生存率得到了提高,但化疗严重的毒副作用、卵巢癌细胞的耐药性产生以及不能清除微小病灶,很多患者2年以内发生了复发以及耐药性[5]。因此迫切需要寻找其他的治疗策略
人体正常情况下,免疫系统是处在一个稳态的状态,肿瘤发生发展及疾病的产生都与免疫力降低有密切的关系。肿瘤免疫细胞治疗作为一种新兴的肿瘤辅助治疗方法,具有重建免疫耐受,提高机体免疫细胞对肿瘤杀伤作用,杀瘤靶向性强,无明显毒副作用,杀伤手术无法清除的微小病灶,提高病人生活质量,延长带瘤生存期等优点,成为肿瘤治疗研究的热点[6][7][8]。其中DC细胞和CTL细胞是目前研究较多的肿瘤免疫细胞治疗的重要部分。DC细胞又称树突状细胞,是体内已知的抗原呈递能力最强的细胞,也是唯一能激活原始型T细胞的抗原城底细胞,很多研究证实[9][10],抗原致敏的DC细胞能刺激T细胞产生特异性的肿瘤杀伤作用,在肿瘤应答中起到至关重要的作用。CTL 是最早识别肿瘤抗原的细胞,也能最有效的杀伤肿瘤细胞,它能够消灭微小残留病灶,甚至能使晚期肿瘤获得完全缓解,在免疫细胞抗肿瘤中起重要作用,所以在肿瘤免疫治疗中有着重要的地位[11]。研究发现,卵巢癌患者体内免疫功能处于严重的抑制状态,体内DC与CTL细胞数量出现显著的减少,导致肿瘤的识别及呈递出现障碍,卵巢癌患者的恶化程度与体内DC细胞的数量密切相关[12]。实验证明[13],免疫细胞治疗能有效地杀伤卵巢癌细胞,减少卵巢癌的复发,降低患者的毒副反应。最新研究发现,不成熟的DC细胞可以导致卵巢癌细胞的凋亡,且DC与卵巢癌细胞共同培养后可促进CTLs细胞的增值[14]。本研究一是通过体外杀伤实验的方法,采用MTT法[15]检测抗原致敏的DC-CTL对卵巢癌SKOV-3细胞的杀伤作用,来验证抗原致敏的DC-CTL对卵巢癌细胞的杀伤作用及无抗原致敏的DC-CTL细胞对卵巢癌细胞杀伤效果的比较,实验结果显示DC-CTL细胞相对对照组对卵巢癌细胞有明显的杀伤作用,而抗原负载的DC-CTL细胞对卵巢癌细胞相对没有抗原负载的DC-CTL细胞的杀伤作用更显著;二是通过实验一验证杀伤作用后,通过皮下注射组、尾静脉注射组与其各自对照组注射DC-CTL细胞的对比发现,使用抗原负载DC-CTL细胞治疗卵巢癌小鼠能有效降低卵巢癌的瘤重,说明抗原负载的DC-CTL细胞能有效的杀伤卵巢癌肿瘤细胞,而两个对照组之间瘤重的差异没有显著性,也排除了注射途径对肿瘤形成的影响,为DC-CTL对卵巢癌治疗的临床应用提供了一定的依据。
免疫细胞治疗主要有静脉注射,皮下灌注,动脉注射等途径。目前临床来讲以静脉注射为主,动脉注射,皮下注射及其它注射方式为辅。有报道证明[16],CIK细胞采用不同的输注方式输入裸鼠体内后,细胞到达各器官的时间及其在各个器官中的分布量都有一定的不同,然而并没有研究探讨在卵巢癌的治疗中何种输注方式为更有效输注途径。关于过继性免疫细胞治疗的免疫细胞输注到体内后存活时间,有研究发现在免疫细胞输注到模型小鼠中,第90d通过检测标记物检测免疫细胞的存活率,其存活率仅为输注量的(2.3±1.0)%[17],同时有研究报道异体免疫细胞输入到患者外周血中可存活7.0±0.93周[18]。因而为肿瘤患者选择一种合适的输注途径,将有效地提高治疗药物或者免疫细胞对肿瘤的杀伤作用,及时的让药物发挥其作用,减少药物或者杀伤细胞在输注到体内的过程中的损耗。本文采用DC-CTL皮下注射和尾静脉注射两种途径,来探讨对于卵巢癌患者何种输注方式更有效,这也是本文一个大的创新点。本文采用反复冻融人卵巢癌SKOV3细胞株来制作致敏抗原,而不是采用人体卵巢癌组织标本进行致敏抗原的制作,考虑手术后肿瘤组织的采集很难,尤其是肿瘤晚期转移的患者,更难取得患者本人的肿瘤组织,本实验通过选择反复冻融SKOV3细胞株来制作致敏抗原,而SKOV3细胞株与卵巢癌细胞具有相同抗原也是我们选择这种方法的一个原因。通过本实验结果发现,抗原负载的DC-CTL细胞对卵巢癌细胞有明显的杀伤作用, 也说明人卵巢癌SKOV3细胞株来制作致敏抗原起到了明显的作用,用尾静脉输注DC-CTL比皮下注射DC-CTL能更好的减少卵巢癌模型小鼠的瘤重,说明对卵巢癌模型小鼠采用尾静脉注射法能得到更有效的改善,能够更有效地到达肿瘤病灶部位。因此通过本实验结果一是再次验证了在体外,肿瘤抗原致敏的DC-CTL细胞对卵巢癌细胞有很好的杀伤作用,二是发现尾静脉注射DC-CTL细胞比静脉注射能更好的降低卵巢癌小鼠的瘤重,为临床卵巢癌患者采取免疫细胞治疗时,采用更有效的输注方式达到更好的卵巢癌治疗效果提供了一定的依据。
(作者单位:湖南人民医院妇科系)
[1] Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011∶the impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4)∶212-236.
[2] Burges A, Schmalfeldt B.Ovarian cancer diagnosis and treatment[J].Deutsches Ärzteblatt International | Dtsch Arztebl Int,2011; 108(38)∶635-641.
[3] Jiang J, Wu C, Lu B.Cytokine-induced killer cells promote antitumor immunity[J].J Transl Med, 2013, 11∶83.
[4]Peethambaram PP,Melisko ME,Rinn KJ,et al.A phase I trial of immunotherapy with lapuleucel-T(APC8024) in patients with refractory metastatic tumors that ecpress HER-2/neu[J].Clin Cancer Res,2009,15(8)∶5937-5944.
[5]Armstrong DK, White AJ, Weil SC, et al.Farletuzumab (a monoclonalantibody against folate receptor alpha) in relapsed platinum-sensitiveovarian cancer.Gynecol Oncol, 2013, 129(3)∶452-458.
[6]Marcus A, Gowen BG, Thompson TW, et al.Recognition of tumors by the innate immune system and natural killer cells[J].Adv Immunol, 2014,122,91-128.
[7] Coulie PG, Vandeneynde BG, Vanderbruggen P, et al.Tumour antigens recognized by T lymphocytes∶ at the core of cancer immunotherapy[J].Nat Rev Cancer, 2014,14(2),135-146.
[8] Glienke W, Esser R, Ftiesener C, et al.Advantages and applications of CAR-expressing natural killer cells[J].Front Phamacol,2015,6∶21.
[9] Janikashvili N, Larmonier N, Katsanis E, et al.Pesonalized dendritic cell-based tumor immunotherapy[J].Immunotherapy,2010,2∶57-68.
[10] Palucka K, Banchereau J.Cancer immunotherapy via dendritic cells[J].Nat Rev Cancer ,2012,12∶265-277.
[11] Santin AD, BeLLone S, Ravaggi A, PecoreLLi S, Cannon MJ, Parham GP.Induction of ovarian tumor-specific CD8+ cytotoxic T Lymphocytes by acid-eLuted peptide-puLsed autoLogous dendritic ceLLs.Obstet GynecoL 2000;96∶422–430.
[12] Iwamoto M , Shinohara H, Miyamoto A , et al .Prognostic value of tumor-infi lt rating dendritic cells expressing CD83 in human breast carcinomas .Int J Cancer, 2003, 104 ∶92-97.
[13]陈芸,刘晓健,胡素英.卵巢癌腹水自体抗原致敏DC-CIK过继转移治疗的应用研究[J].实用临床医药杂志,2011,15(7):51-54.
[14] Krempski J, Karyampudi L, Behrens MD, et al.Tumor infiltrating programmed death receptor-1+dendritic cells mediate immune suppression inovarian cancer [J].J Immunol,2011,186(12)∶6905.
[15]Emesto M,Dihadenys L, MjgueL E et aL.Comparative evaLuation of the nitrate reduction assay,the MTI-test,and the resazurin Microtitre assay for drug susceptibiLity testing of cLinicaL isoLates of MycobaCt6riumtubereuLosjs[J] Antimjerob.Chemother,2005,55∶500-505.
[16]李慧,岳欣,安秀梅等。不同输注途径对CIK细胞体内分布和抑瘤作用的影响。2007,23(4):416-420.
[17]Rosenberg SA, Restifo NP, Yang JC,et al.Adoptive cell transfer∶ a clinical path to effective cancer immunotherapy.Nat Rev Cancer,2008,8∶299-308.
[18]李壮,王爱民。自体及健康人CIK细胞对比治疗恶性肿瘤的初步评估研究[C].2014,4∶36-47.
Comparison of the therapeutic effects of DC-CTL cells by different routes of delivery in ovarian cancer mice
BHATTI SADAF , ZHOU LING FEI , AHMAD MEESAQ , GHULAM QADIR , SAQUIB BINISH ,LI JIE
(Department of Gynecology, Hunan People’s Hospital, Hunan Changsha 410005, China)
OBJECTIVE To investigate the different effect of two infusion ways of DC-CTL treatment on mice with ovarian cancer.METHODS ∶To prepare DC-CTL cells from normal human peripheral blood,antigen-loaded DC group (group A1) and no antigen-loaded group (group A2).The cell killing effect of A1 and A2 on ovarian cancer cells was detected by enzyme-linked immunosorbent assay.To get 60 6-week-old female SPF mice in a clean bench,SKOV3 cells were inoculated subcutaneously into nude mice to establish cervical xenograft model.The model were established about 15 days.48 xenograft model mice were randomly divided into four groups, named subcutaneous injection group and the control group,tail- intravenous injection group and the control group.Two experimental groups mice were respectively injected by tail-subcutaneous injection and tail vein injection of 5 ⋆ 103 DC-CTL cell on day 21 and in the control group injected with the same volume of saline as a placebo.Mice were executed on day 35.The tumor tissue was weighed and separated statistically.RESULTS ∶Antigen-loaded DC-CTL cells had better killing effect on ovarian cancer cells .SKOV3 cells can make tumors about 15 days through injecting under the mice dorsal and neck skin.The tumor weight with the experimental group were significantly lower than those of the control group (P <0.05) and the tumor weigh of tailintravenous injection group was significantly lower than in mice by subcutaneous injection group (P <0.05).CONCLUSION ∶DC-CTL cells can effectively inhibit the development of mouse ovaries tumor.DC-CTL cells were injected into the tail vein of mice with ovarian cancer can have a significantly better therapeutic effect than subcutaneous injection in mice.The present results provide a certain basis for the clinical use of DC-CTL cells in ovarian cancer treatment options infusion.
DC-CTL Cell, Xenograft Model, Infusion
