青蒿琥酯对小鼠气道阻力及气道平滑肌牵张力的效应研究*
2017-10-29张艺凡王悦刘磊李晶晶邓林红
张艺凡,王悦△,刘磊,李晶晶,邓林红△
(1.常州大学生物医学工程与健康科学研究院暨常州市呼吸医学工程重点实验室,常州213164;2.常州大学 制药与生命科学学院/护理学院,常州213164)
1 引 言
哮喘主要病理特征表现为气道炎症、气道重构及气道高反应性,气道平滑肌细胞(ASMC)是参与气道高反应(AHR)的主要细胞类型[1],舒张气道平滑肌,减轻气道狭窄是目前治疗哮喘的主要方法。但治疗哮喘的药物存在心动过速,骨质疏松等诸多不良反应,价格也相对昂贵,因此有必要寻找既经济又有效的治疗哮喘药物,如中草药。近年来研究发现,在气道平滑肌上存在苦味受体(Bitter taste receptors,TAS2Rs),当苦味物质如糖精和氯喹等与TAS2Rs结合后能舒张 ASMC,改善 AHR症状[2],其支气管舒张效果甚至强于已用于临床的β2受体激动剂[3-4]。青蒿琥酯是著名的抗疟药青蒿素的衍生物,也是广为人知的苦味物质,可抑制小鼠哮喘模型的气道炎症[5],但其是否对气道阻力及平滑肌的牵张力有影响未见报道。本研究建立了小鼠哮喘动物模型,在体内和体外实验检测了青蒿琥酯对小鼠气道阻力和气道平滑肌牵张力的效应,并初步探讨了效应机制。
2 材料和方法
2.1 试剂与动物
2.1.1 实验动物 6~8周龄雌性Balb/c小鼠,由常州卡文斯实验动物有限公司提供,许可证号SCXK(苏)-2016-0010。
2.1.2 实验试剂及材料 青蒿琥酯,Ι型胶原(Sigma-Aldrich);DMEM培养基,胎牛血清,双抗(Gibco);其余试剂从Fisher Scientific获得;倒置显微镜(NIKON);LSM710激光共聚焦扫描显微镜(Carl Zeiss);FV-FX1.3小动物肺功能检测仪(SCIREQ)。
2.2 OVA诱导BALB/c小鼠急性哮喘模型
BALB/c小鼠在第1、8 d腹腔注射200μL含氢氧化铝干粉(2%)和OVA(0.02%)致敏剂,每天用50 mg/ml的OVA激发20 min,持续2周;对照组以生理盐水代替致敏剂[6]。所有实验组均在末次激发结束24 h之后,进行肺功能及相关指标检测。
2.3 哮喘模型小鼠肺组织病理学检测
将哮喘模型小鼠右肺取出,4%福尔马林浸泡过夜,并在分级系列乙醇溶液中脱水。经包埋,切片,展片,HE染色后光学显微镜下进行形态分析。收集小鼠支气管肺泡灌洗液(BALF)进行炎症细胞分类及总细胞的计数。
2.4 小鼠气道阻力的测定
小鼠麻醉状态下进行气管插管手术,用侵入式的FlexiVent小动物肺功能检测仪检测正常组和OVA组小鼠在乙酰甲胆碱(Mch)激发下气道阻力的变化。小鼠雾化吸入 0、2、8、32、64、128 mg/ml的Mch,当气道阻力达到基线4~5倍时,再分别雾化吸入青蒿琥酯(30,60,120μg),沙丁胺醇(3μg)和盐酸奎宁(150μg),通过肺功能检测仪每30 s测量一次气道阻力,持续 5 min[7]。
2.5 小鼠原代气道平滑肌细胞的分离培养
解剖BALB/c小鼠取出肺叶组织,用无菌器械从外膜表面分离结缔组织,上皮层,纤维层及粘膜层组织,纵向剖开支气管,去除内膜后剪成1 mm2组织块,移至培养瓶中倒置6~8 h后加入适量培养基,待细胞爬出后生长约至90%时进行传代,纯化,鉴定[8]。
2.6 小鼠气道平滑肌细胞牵张力的测定
使用傅里叶变换牵引力显微术(fourier transform tractionmicroscopy,FTTC)来量化ASMC的牵张力。将ASMC(2000个/皿)接种到涂有 I型胶原(0.1 mg/m l)的聚丙烯酰胺凝胶培养皿上培养24 h后,更换无血清培养基继续培养12 h后进行实验。通过相差显微镜和荧光显微镜分别记录单个细胞和荧光微珠标记物的对照图像,且每隔30 s采集一次微珠位置的荧光图像[9]。
2.7 小鼠气道平滑肌细胞的胞内钙离子浓度测定
将小鼠ASMC接种到共聚焦玻璃皿底中(10000个/皿),贴壁后加入5μM膜渗透性[Ca2+]i敏感荧光染料Fluo-4乙酰氧基甲基酯(Fluo-4AM)Ca2+指示剂,孵育60 min。用 Tyrode溶液洗涤细胞3次后再孵育20 min使细胞质基质完全脱脂。将激发波长设定为488 nm,发射波长设定为>505 nm进行荧光测量[10]。以刺激前细胞内[Ca2+]i为基线,测定时间为20 s,再在共聚焦专用皿中分别加入各种不同浓度(0,0.375,0.75 mM)青蒿琥酯,观察并记录加入药物后荧光强度瞬间动态变化。
2.8 统计分析
实验数据采用平均数±标准差(±SD)表示,采用Origin 7.5进行统计学分析,各组组间组内的差异比较均用单因素方差分析,以P<0.05作为显著性差异的标准。
3 结果
3.1 OVA诱导BALB/c小鼠哮喘模型的鉴定
正常组小鼠的肺组织中可以清楚看到开放的气道腔,少量炎症细胞浸润(见图1A);OVA组小鼠的肺切片出现明显的组织重构,包括平滑肌明显增厚,支气管(Br)和血管周围的嗜酸性细胞聚集(见图1B)。OVA组小鼠肺泡灌洗液(BALF)中炎症细胞总数及嗜酸性细胞均显著增加,呈过敏性哮喘典型的嗜酸性气道炎症(见图1C,Eos:嗜酸性细胞;Neu:中性粒细胞;Lym:淋巴细胞;Mac:巨噬细胞)。

图1 正常组和OVA组Balb/c小鼠的肺组织病理学鉴定(A-B.bar=100μm;n=4,**P<0.01;*P<0.05)Fig 1 Characterization of lung histopathology of normal and OVA-treated Balb/c mice
3.2 OVA致敏小鼠气道阻力的测定
如图2所示,Mch诱导的小鼠气道阻力增加呈现剂量依赖性,OVA组小鼠的响应程度大于正常组,在OVA组和正常组小鼠中最大支气管收缩达到基线的4~5倍时Mch剂量分别为64,128 mg/mL。这些结果同样证实OVA组小鼠显示过敏性哮喘表型的标志,因此适合于评价青蒿琥酯的支气管扩张功效的研究。
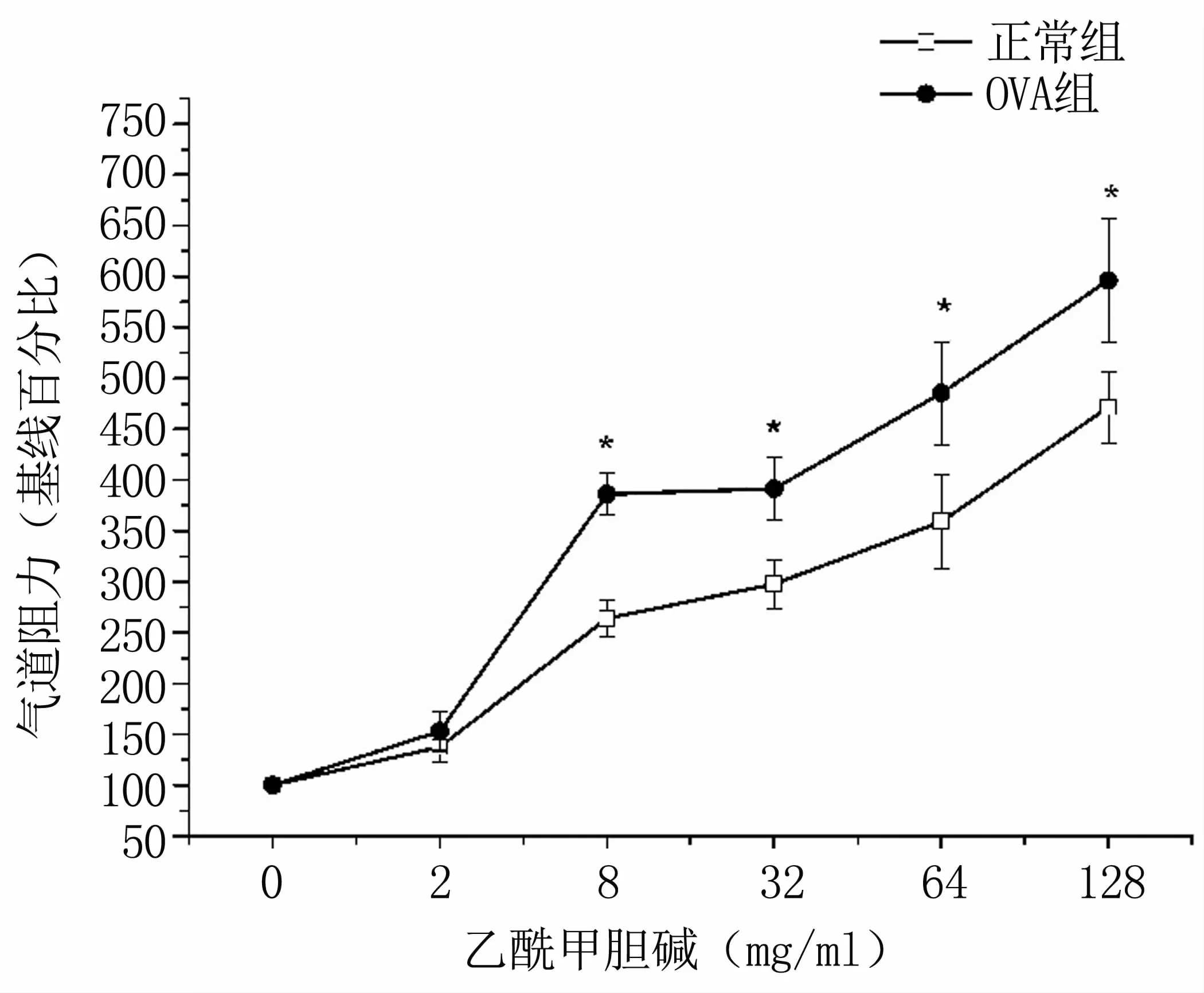
图2 正常组和OVA组小鼠气道阻力的比较 (n=4,*P<0.05)Fig 2 Com parison of airway resistance of normal and OVA-treated Balb/c mice
3.3 青蒿琥酯对小鼠气道阻力的影响
支气管扩张剂沙丁胺醇,苦味受体激动剂奎宁盐酸盐能有效地将气道阻力减少约50%,青蒿琥酯剂量从30μg增加到120μg时,正常组和OVA组小鼠气道阻力逐渐降低。120μg青蒿琥酯使正常组小鼠气道阻力从431.43±85.67%降至242.34±11.1%,OVA组小鼠气道阻力从506.84±40.33%降至273.964±17.98%。青蒿琥酯(120μg)的支气管扩张的功效与沙丁胺醇(3μg)相当。


图3 青蒿琥酯对正常组和OVA组小鼠气道阻力的影响(n=5;**P<0.01)Fig 3 Effect of artesunate on airway resistance of normal or OVA-treated mice
3.4 气道平滑肌细胞的鉴定
如图4所示,形态学上单个细胞呈梭形状,细胞群呈现典型的“峰-谷”形态(图4A),细胞骨架相对连续且具有一定的方向性(图4B),α-actin免疫细胞免疫荧光鉴定结果显示细胞的应力纤维呈丝状,90%以上的细胞为平滑肌细胞(图4C,D)。
3.5 青蒿琥酯对气道平滑肌细胞牵张力的效应
图5A-C分别是粘附在涂覆有I型胶原的聚丙烯酰胺凝胶表面的单细胞相差图,荧光微珠图,以及使用傅立叶变换牵引技术(FTTC)从位移场中计算出的牵引场和相应的牵引力分布图。从表1可知,ASMC牵张力随着青蒿琥酯浓度增加而逐渐降低。
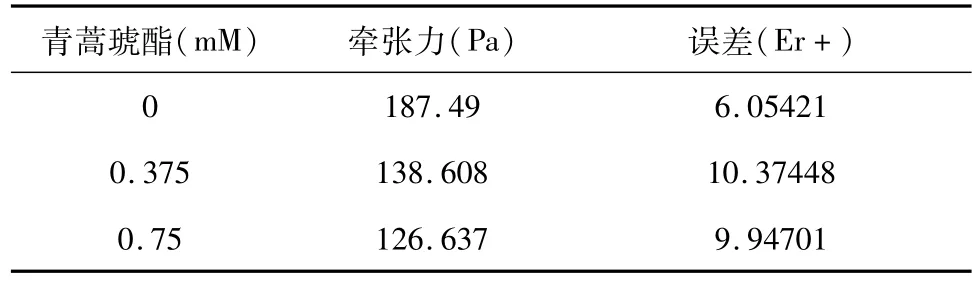
表1 青蒿琥酯浓度对ASMC牵张力的影响(n=4)Table 1 Effect of concentration of artesunate on traction force generated by the cultured ASM cells

图4 体外培养Balb/c小鼠平滑肌细胞的鉴定A.原代培养(×20);B.F-actin骨架染色(×63,油镜);C-D.α-actin免疫细胞免疫荧光(C:×20;D:×63,油镜)Fig 4 Characterization of the culture ASM cells from Balb/c mice

图5 青蒿琥酯对ASMC牵张力的效应(n=4)Fig 5 Effect of artesunate on traction force generated by the cultured ASM cells
3.6 青蒿琥酯对气道平滑肌细胞胞内钙离子浓度的影响
图6A表示在0.75 mM盐酸奎宁处理前后的代表性细胞荧光图像,胞内钙荧光强度在0~75 s内先增强后减弱。但0.75 mM青蒿琥酯处理后,在0~120 s内荧光强度逐渐增强,并且到150 s时一直维持在较高的水平。ASMC瞬态胞内[Ca2+]i以及峰值均以剂量依赖性方式响应青蒿琥酯(见图6C-D)。
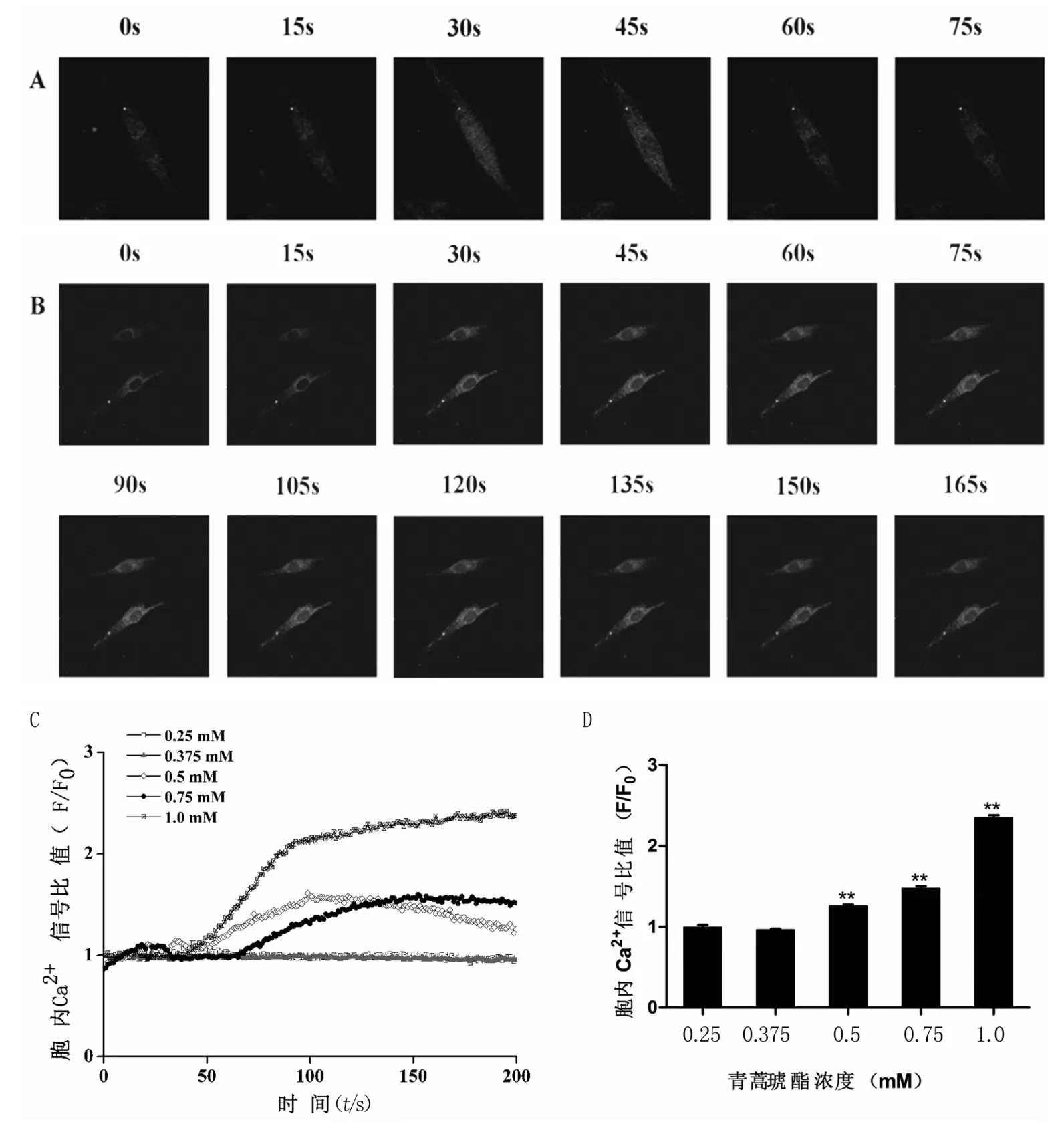
图6 青蒿琥酯激发Balb/c小鼠气道平滑肌细胞胞内[Ca2+]i变化A.加入0.75 mM奎宁后胞内[Ca2+]i随时间变化的图像;B.加入0.75 mM青蒿琥酯后胞内[Ca2+]i随时间变化的图像;C.不同浓度青蒿琥酯作用于ASMC胞内[Ca2+]i瞬态变化;D.不同浓度青蒿琥酯在150 s时的[Ca2+]i值.F0.胞内[Ca2+]i的基底值;F.给药后胞内[Ca2+]i的实时值.n=4,**p<0.01)Fig 6 Artesunate evoked[Ca2+]i flux in ASM cells from Balb/c mice
4 讨论
气道高反应性是指因炎症气道出现过度敏感及过强的气道平滑肌收缩反应,引起气道狭窄和气道阻力增加,从而引发咳嗽、呼吸困难、喘息等症状。气道平滑肌的生物力学性质在哮喘气道高反应和气道狭窄中起了决定性的作用[11],因此有效舒张气道平滑肌,降低气道阻力是治疗哮喘的关键环节。本实验选用众所周知的苦味物质青蒿琥酯进行体内和体外实验,发现其能使哮喘模型小鼠ASMC牵张力下降,从而舒张气道,降低气道阻力。
本研究表明,青蒿琥酯对小鼠气道阻力和ASMC的舒张程度呈现剂量依赖性。小鼠正常组和OVA哮喘模型组雾化吸入青蒿琥酯均可使Mch诱导的气道阻力得到有效缓解,且呈剂量依赖性。当青蒿琥酯剂量达到120μg,降低哮喘组小鼠气道阻力的程度相当于3μg沙丁胺醇(常规哮喘治疗)的效果。我们还使用傅里叶变换牵张力显微术(FTTC)来量化ASMC产生牵张力的能力。FTTC是近来被广泛用于测定ASMC在受到收缩剂(组胺)或舒张剂(异丙肾上腺素)刺激时收缩/舒张效应的技术方法[9]。FTTC研究结果显示,体外培养的ASMC牵张力随着青蒿琥酯浓度(0,0.375,0.75 mM)的增加而逐渐降低。有研究报道苦味物质盐酸奎宁作为苦味受体激动剂能以剂量依赖方式降低ASMC产生的细胞牵张力,这可能是与 ASMC中表达的TAS2R靶向结合产生的舒张效应[3,12]。据调查,用于实验检测的苦味受体激动剂的化学结构式是相似的,都有氧,羰基和羟基官能团,且含有多个环,比如糖精和盐酸奎宁都能在不同程度降低小鼠的气道阻力,减小 ASMC牵引力,增加 ASMC的[Ca2+]i应答。据此,苦味物质青蒿琥酯很可能也是靶向结合苦味受体产生了对气道平滑肌的舒张作用。本研究中所用青蒿琥酯的剂量达到120μg,可能与目前采用的青蒿琥酯生物活性较低、苦味受体对青蒿琥酯的敏感性差等原因有关,将来需采用改进剂型、药物分子修饰等方法增强青蒿琥酯的活性、以及增强其与苦味受体的相互作用等进一步改善青蒿琥酯对哮喘的治疗作用。
本研究通过激光共聚焦扫描显微镜观察到青蒿琥酯浓度从0.25 mM增加到1.0 mM时诱导ASMC中[Ca2+]i增加,青蒿琥酯的[Ca2+]i响应趋势与已知苦味受体激动剂盐酸奎宁,糖精和柚皮苷的一致[3,13]。TAS2R激动剂如盐酸奎宁是通过细胞膜介导的局部[Ca2+]i响应,激活大电导钙离子依赖的K+(BKCa)通道,从而导致膜超极化和ASMC的舒张[3,14-17]。基于这些苦味物质之间的相似性,青蒿琥酯诱导的ASMC舒张效应也可能同样是由于细胞膜超极化使得局部[Ca2+]i反应而导致的,这种潜在机制还有待进一步的研究证明。
